β-紫罗兰酮温敏脂质体的制备工艺及配方优化
王一涵,徐迎波,宁 敏,周志磊,梁 蓉,陈 羚,徐菲菲,钟 芳*
(1.江南大学 食品学院,江苏 无锡214122;2.安徽中烟工业有限责任公司 烟草化学安徽省重点实验室,安徽合肥 230088;3.江南大学 合成与生物胶体教育部重点实验室,江苏 无锡 214122)
β-紫罗兰酮温敏脂质体的制备工艺及配方优化
王一涵1,徐迎波2,宁 敏2,周志磊1,梁 蓉3,陈 羚1,徐菲菲1,钟 芳*1
(1.江南大学 食品学院,江苏 无锡214122;2.安徽中烟工业有限责任公司 烟草化学安徽省重点实验室,安徽合肥 230088;3.江南大学 合成与生物胶体教育部重点实验室,江苏 无锡 214122)
以合成磷脂DPPC和氢化大豆卵磷脂HSPC为膜材,采用薄膜超声法和乙醇注入法制备β-紫罗兰酮脂质体,并对其超声条件及配方进行优化。优化得到的较佳工艺参数为:超声功率240 W,超声时间4 min。通过单因素实验优化得到的β-紫罗兰酮脂质体的较佳配方为:DPPC与HSPC摩尔比为8∶2,磷脂质量浓度10 mg/mL,β-紫罗兰酮与Tween80、磷脂的质量比为1∶1∶20。该条件下制备的脂质体包封率为(60.62±3.48)%,平均粒径在200 nm左右,在原子力显微镜的观察下为球状或近似球状的小囊泡。
β-紫罗兰酮;脂质体;二棕榈酰磷脂酰胆碱DPPC;氢化大豆卵磷脂HSPC
近年来,各种综合降焦技术的使用,致使卷烟香味物质大量损失,卷烟香味平淡。如何在降焦减害的同时保持卷烟的香味风格已经成为烟草行业研究的热点。卷烟加香加料是弥补卷烟香味物质损失的一个重要手段,但许多烟用香料易挥发、氧化或遇到光热易分解,影响了香料的使用效果。因此研究有效的加香方式,防止香料的散失,减少香料在卷烟燃吸时的可变性(如热解)就显得尤为重要[1]。
脂质体(liposomes)是一种结构和组成均类似于生物膜双分子层的微型囊泡,具有靶向、缓释、生物相容性等特点,可以同时包埋亲水性成分和疏水性成分。而新型脂质体——温度敏感型脂质体(thermo-sensitive liposomes,TSL), 不仅能在常温下保持稳定,在达到相变温度时还能快速释放包埋物。因此其能有效改善香料对光、热及环境的稳定性。
卷烟在燃烧时滤嘴的温度一般在40℃左右,所以,将脂质体的相变温度设定在40℃。由于天然卵磷脂为一种混合物,其组成复杂、相对分子质量分布较广,通常不表现出明显的相变温度[2];而合成卵磷脂成分单一、纯度高,具有良好的温度敏感性,但是价格较昂贵,限制了其应用范围。因此,作者采用复合磷脂技术,将天然卵磷脂和合成卵磷脂进行复配[3],对经典温敏脂质体的配方进行优化,以期在保证良好的温敏释放性能前提下,尽量降低成本。β-紫罗兰酮 (4-( 2,6,6-三甲基-1-环己烯基)-3-丁烯-2-酮)是卷烟中一种重要的香味化合物,其挥发性较强,采用脂质体作为载体可以显著地提高其储藏稳定性,因此作者选择β-紫罗兰酮为模型物质,探讨制备β-紫罗兰酮TSL的可行性,并系统地研究了影响脂质体相变温度Tm和β-紫罗兰酮包埋效果的因素。
1 材料与方法
1.1 试剂
二棕榈酰磷脂酰胆碱(DPPC):上海艾韦特医药科技有限公司产品;氢化大豆卵磷脂(HSPC):上海艾韦特医药科技有限公司产品;TritonX100:分析纯,国药集团化学试剂有限公司产品;β-紫罗兰酮:分析纯,上海安谱实验科技股份有限公司产品;乙腈:色谱纯,上海沃凯化成工业有限公司产品。
1.2 仪器
旋转蒸发器(R-205):上海申顺生物科技有限公司产品;超声波细胞粉碎机:南京菲奇工贸产品;AL204电子天平:梅特勒-托利多仪器上海有限公司产品;透析袋(截留相对分子质量3 500):美国Viskase产品;磁力加热搅拌器(C-MAG HS4):德国IKA产品;Waters高效液相色谱仪 (waters1525):美国waters公司产品;Zeta电位及纳米粒度分析仪(ZetaPALS):美国布鲁克海文仪器公司产品;差示扫描量热仪(204 F1):德国耐驰仪器公司产品;原子力显微镜(Multimode8):德国布鲁克科技有限公司产品。
1.3 方法
1.3.1 薄膜超声法制备β-紫罗兰酮脂质体 称取一定比例的DPPC、HSPC、吐温80和β-紫罗兰酮于250 mL圆底烧瓶中,加入20 mL的无水乙醇,50℃水浴至溶,减压旋转蒸发除去乙醇,形成薄膜.再加入一定量PBS(pH 6.8)缓冲溶液,旋转蒸发水化30 min(50℃),迅速冷却,于探头式超声仪上碎冰浴超声处理(脉冲)。50℃水溶2 h后于4℃静置过夜,冷冻离心(4 500 g)20 min,置于冰箱中保存[4-5]。
1.3.2 乙醇注入法制备β-紫罗兰酮脂质体 称取一定比例的DPPC、HSPC、吐温80和β-紫罗兰酮于10 mL试管中,再加入4 mL无水乙醇,50℃水浴至溶。用移液枪抽吸打匀上述脂质溶液后(50℃),快速将其注入50℃ PBS缓冲液中(pH 6.8),搅拌水化30 min,旋转蒸发除去乙醇(50℃),冷却后在4℃下静置过夜[4]。
空白脂质体的制备:称取等量脂质和吐温80溶于乙醇,不添加被包埋物质,其余步骤与上述脂质体的制备相同。
1.3.3 β-紫罗兰酮脂质体包埋率的测定 总β-紫罗兰酮浓度:取一定量的脂质体混悬液到10 mL容量瓶中,加入等量TritonX-100溶液,漩涡振荡使脂质体解体,用超纯水定容后过0.22 μm微孔滤膜,HPLC测定溶液里β-紫罗兰酮的总浓度Ctol。
游离β-紫罗兰酮浓度:精密量取脂质体混悬液5 mL置于 250 mL烧杯中,用 w(CH3CH2OH)=20%的乙醇水溶液稀释至200 mL。再量取w(CH3CH2OH)=20%的乙醇水溶液5 mL于已处理的透析袋内,把透析袋浸入上述经稀释的脂质体混悬液中,同时以磁力搅拌器搅拌,达到平衡时间(12 h)后,取透析袋内透析液20 μL进样,HPLC测定计算游离β紫罗兰酮的浓度。

式中,Ctol为脂质体溶液中β-紫罗兰酮的总浓度;CFree为脂质体溶液中游离β-紫罗兰酮的浓度。
1.3.4 原子力显微镜(AFM)观察 取适量β-紫罗兰酮脂质体用超纯水稀释500倍。吸取2 μL样品滴在新解离的云母表面并铺展,室温下干燥24 h。待充分干燥后,将样品置于原子力显微镜的扫描探头 (Si探针)下,以ScanAsyst模式扫描 (频率70 kHz,弹簧系数0.4 N/m),在室温和大气环境下进行观测[6]。
1.3.5 粒径和Zeta电位的测定 采用激光光散射法测定脂质体的粒径。采用Zeta PALS粒度分析仪,散射角为90°。将准备好的待测样品装入聚苯乙烯比色皿中 (折光指数 1.33),(25±0.1)℃下保温 3 min,进样测定,记录平均粒径(Dz)和粒径分布情况(多分散指数 PDI)。
平均粒径的变化率按照下式计算:
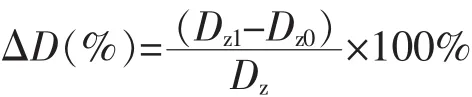
式中,Dz1为低温贮存一个月的平均粒径;Dz0为制备初期的平均粒径。
1.3.6 相变温度的测量 将制得的脂质体混悬液4 800 r/min离心20 min移去上层清液,收集下层脂质体。称取5~10 mg脂质体铺于密闭铝坩埚底部,在加热范围为20~60℃的条件下扫描样品,设定升温速率为5℃/min,重复两次,测定其DSC图谱,以空白坩埚作为对照。
2 结果与分析
2.1 β-紫罗兰酮脂质体制备方法的选择
脂质体的制备方法较多,方法不同,制得产品的粒径、包封率等亦不同。结合芯材β-紫罗兰酮不溶于水的特点以及实验室的具体条件,作者选择薄膜-超声和乙醇注入-超声这两种制备方法进行比较。根据所用的壁材(DPPC、HSPC和Tween80)和芯材β-紫罗兰酮的溶解性以及安全性,选择乙醇作为溶解壁材和芯材的溶剂。

表1 薄膜超声法和乙醇注入法制备的β-紫罗兰酮脂质体的性质比较Table1 Comparison ofpropertiesofbeta-ionone liposomes prepared by thin-film evaporation and ethanol injection
采用乙醇注入-超声法制得的样品较粘稠,且粒径明显大于采用薄膜-超声法制得的样品,包封率也相对较低(表1)。试验过程中还发现薄膜-超声法制得的样品长时间放置比较稳定。因此,选择薄膜-超声法制备β-紫罗兰酮脂质体以进一步研究。
2.2 探头超声工艺研究
分别考察了脂质体制备时的探头超声功率和时间对包封率的影响[7]。图1、2结果显示探头超声工艺对结果影响不大。但超声时间过长,超声探头会释放更多钛颗粒杂质造成污染[8]。结合粒径及其变化情况,最终选择240 W、4 min用于后续的试验。
2.3 β-紫罗兰酮脂质体配方的确定
在确定薄膜-超声法工艺参数的基础上,以相变温度Tm、包封率、平均粒径以及平均粒径的变化程度为指标,研究了磷脂的类型及组成、磷脂浓度、β-紫罗兰酮浓度、Tween80用量等因素对脂质体相变温度Tm和β-紫罗兰酮包埋效果的影响。


图1 探头超声功率对脂质体包埋效果的影响Fig.1 Effect of different sonication power on encapsulation qualities of beta-ionone liposomes

图2 探头超声时间对脂质体包埋效果的影响Fig.2 Effect of different sonication time on encapsulation qualities of beta-ionone liposomes
2.3.1 配方对脂质体相变温度的影响
1)磷脂组成对脂质体相变温度的影响 作者选用的主要磷脂 DPPC、HSPC的相变温度分别为41.3℃和52.7℃,采用这两种磷脂分别制备不同摩尔分数DPPC组成的空白脂质体,进行相变温度的测定[9],考察不同磷脂组成对脂质体相变温度的影响,结果见表2。

表2 二棕榈酰磷脂酰胆碱 (DPPC)和氢化大豆卵磷脂(HSPC)复配比例对空白脂质体相变温度的影响Table 2 Effect of DPPC to HSPC ratio on the phasetransition temperature of blank liposomes
随着HSPC加入量的增加,脂质体相变温度Tm逐渐升高,半峰宽也逐渐增大,转变的协同性下降。初步选定BL-d8h2这一配方的PC组成进行下一步的实验。
2)β-紫罗兰酮加入量对脂质体相变温度Tm的影响 包埋物对脂质体Tm的影响分为两种情况:无影响,即不改变脂质体的相变温度Tm;有影响,即当包埋物结合进入脂质双分子层时,Tm会明显下降。例如9%(摩尔分数)替莫卟吩加入到DPPC和DPPG脂质体 (Tm41℃)后,其起始相变温度降到34~35℃[10]。
以配方BL-d8h2为例,考察了不同β-紫罗兰酮加入量对脂质体相变温度的影响(表3),结果发现包埋β-紫罗兰酮后,脂质体的相变温度Tm相较于空白脂质体有所降低,同时半峰宽明显增大。且随着β-紫罗兰酮添加量的增加,脂质体的相变温度Tm逐渐降低,半峰宽也逐渐增大。当加入量增大到100 mg时,开始出现相分离。
综上所述,考虑到卷烟抽吸时滤嘴的温度大概在40℃左右,结合表2初步选择BL-d8h2(载量10 mg)此种基础配方,可以在得到合适的相变温度Tm和半峰宽的同时,尽量降低成本。
3)Tween80加入量对脂质体相变温度的影响通常吐温80的加入可以改变脂质体的包埋率,并调节脂质体膜的通透性,同时,吐温80的加入也可能会对脂质体的相变温度产生影响[11]。考察了吐温80的对脂质体相变温度的影响,结果见表4。随着Tween80浓度的增加,脂质体的相变温度Tm略微下降,半峰宽增大,转变的协同性下降,表明不止一种物质发生转变[11]。

表3 β-紫罗兰酮的加入量对温敏脂质体相变温度的影响Table 3 Effect of beta-ionone on the phase-transition temperature of beta-ionone liposomes

表4 吐温80的加入对温敏脂质体相变温度的影响Table 4 Effect of Tween80 on the phase-transition temperature of liposomes with different PC composition
2.3.2 配方对脂质体包埋效果的影响
1)磷脂组成对包埋效果的影响 为了考察磷脂组成对包埋率的影响,制备了不同DPPC组成的β-紫罗兰酮温敏脂质体,具体组成及性质见图3。结合PC组成对相变温度的影响,最终选用BL-d8h2(质量分数80%DPPC+20%HSPC)这一配比的磷脂组成。
2)磷脂质量浓度对脂质体包埋效果的影响磷脂浓度可影响水化及超声过程中脂质体悬液的粘度及流动性,选用不同质量浓度的磷脂分别制备β-紫罗兰酮脂质体,考察磷脂浓度对脂质体包埋效果的影响,结果见图4。随着磷脂质量浓度的增加,包埋率增大。继续增加磷脂质量浓度到20 mg/mL,包埋率基本不变,但粒径显著增大到1 000 nm以上。因为提高磷脂质量浓度后,溶液的粘度变大,易导致旋蒸时形成的薄膜不均匀,水化形成颗粒很大的多层脂质,超声处理时不易破碎成均匀的脂质体[12]。最终选用的磷脂质量浓度为10 mg/mL,在该质量浓度下,脂质体溶液的流动性良好。

图3 PC组成对脂质体包埋效果的影响Fig.3 Effect of PC composition on encapsulation qualities of beta-ionone liposomes
3)β-紫罗兰酮添加量对脂质体包埋效果的影响 脂质体是通过将脂溶性芯材镶嵌在磷脂双分子层中来实现对药物的包载,芯材和磷脂的相容性及芯材和磷脂的比例显著的影响脂质体的包封率,因此进一步考察了β-紫罗兰酮添加量对脂质体包埋率的影响。由图5可知,随着β-紫罗兰酮添加量的增加,脂质体的包埋率升高,但当β-紫罗兰酮添加量大于10 mg后,包埋率开始下降。故选定β-紫罗兰酮添加量为10 mg。


图4 磷脂质量浓度对脂质体包埋效果的影响Fig.4 Effectofconcentration ofphospholipidson encapsulation qualities of beta-ionone liposomes

图5 β-紫罗兰酮添加量对脂质体包埋效果的影响Fig.5 Effect of beta-ionone on encapsulation qualities of Beta-ionone liposomes
4)Tween含量对脂质体包埋效果的影响 选用不同比例的Tween80与磷脂用于制备β-紫罗兰酮脂质体,以确定辅助壁材Tween80的合适添加量。由图6可知,在一定范围内提高Tween80含量能够有效地降低脂质体的粒径大小。这是因为Tween 80具有一条较长的疏水链和3条比较短的亲水链,在脂质体双分子层中掺入的Tween 80物理吸附于双分子层表面,其聚氧乙烯基从双分子层中伸出,形成有一定厚度的亲水相,具有空间位阻效应。当两个立体稳定的脂质体接近时,由于存在水溶性链,脂质体间的化学位能降低,脂质体之间进入大量的水而分离[13]。研究也表明,吸附于脂质体双分子层外表面的Tween 80增加了脂质体的曲率,而吸附于双分子层内表面的Tween 80的作用与之相反[14]。由于有较多的Tween 80吸附于双分子层的外表面,因此,在脂质体双分子层中掺入Tween 80有助于减少脂质体的初始粒径大小。但Tween 80的添加量并非越高越好,表面活性剂浓度达到一定值时,磷脂将被逐渐增溶成混合胶束,脂质体的双分子层结构将遭到破坏,因此导致包埋率降低[15]。综上,结合包埋率,确定Tween80的添加量为10 mg。
2.4 纳米脂质体表面形貌的观察
在原子力显微镜下观察脂质体的表面形貌(见图7),呈球状或近似球状的小囊泡,分布均匀且颗粒间彼此分散。

图6 Tween80添加量对脂质体包埋效果的影响Fig.6 Effect of Tween 80 on encapsulation qualities of Beta-ionone liposomes

图7 β-紫罗兰酮脂质体的的原子力显微镜图像Fig.7 Atomic force microscopy(AFM) imagines of betaionone liposome composed of beta-ionone/Tween
3 结语
薄膜-超声法比较适合制备β-紫罗兰酮脂质体,优化得到的较佳制备工艺参数为:超声功率240 W,超声时间4 min。通过单因素试验优化得到的β-紫罗兰酮脂质体的较佳配方为:DPPC与HSPC物质的摩尔比为 8∶2,磷脂质量浓度 10 mg/mL,β-紫罗兰酮与Tween80、磷脂的质量比为 1∶1∶20。 该条件下制备的脂质体包封率为(60.62±3.48)%,粒径分布在200 nm左右,在AFM原子力显微镜的观察下为球状或近似球状的小囊泡。
[1]苏长涛.紫罗兰酮的合成及其卷烟加香应用研究[D].郑州:河南农业大学,2008.
[2]CHELVI T P,RALHAN R.Designing of thermosensitive liposomes from natural lipids for multimodality cancer therapy[J].Int J Hyperthermia,1995,11(5):685-695.(in Chinese)
[3]HE Chaoqin,HU Mengya,ZHANG Hui,et al.Study on preparation and thermosensitive release property of composite phospholipid liposomes containing total alkaloids from Strychnos nux-vomica[J].China Journal of Chinese Materia Medica,2013,38(9):1366-1370.(in Chinese)
[4]夏书芹.辅酶Q10纳米脂质体的研究[D].无锡:江南大学,2007.
[5]BANGHAM A D,STANDISH M M,WATKINS J C.Diffusion of univalent ions across the lamellae of swollen phospholipids[J].J Mol Biol,1965,13:238-252.
[6]谭晨.类胡萝卜素脂质体的研究[D].无锡:江南大学,2014.
[7]ZHU Bin,XU Shiying,XIA Shuqin.The preparation of liposome-based air-filling micro-bubbles[J].Journal of Food Sdence and Biotechnology,2007,26(3):41-45.(in Chinese)
[8]ZENG Dan,ZHANG Yangde,ZHAO Dongwei,et al.Study of ultrasound parameters in liposome preparation[J].China Journal of Modern Medicine,2012,22(19):25-28.(in Chinese)
[9]JUN C,DONG C,JUN L,et al.Influence of lipid composition on the phase transition temperature of liposomes composed of both DPPC and HSPC[J].Drug Development and Industrial Pharmacy,2013,39(2):197-204.
[10]KUNTSCHE J,FREISLEBEN I,STEINIGER F,et al.Temoporfin-loaded liposomes:physicochemical characterization[J].Eur J Pharm Sci,2010,40(4):305.
[11]G.M.M.El Maghraby,WILLIAMS A C,BARRY B W.Interactions of surfactants (edge activators) and skin penetration enhancers with liposomes[J].International Journal of Pharmaceutics,2004,276:143-161.
[12]陆潇筠.盐酸米托蒽醌长循环热敏脂质体的研究[D].武汉:武汉工程大学,2013.
[13]梁伟.蟾毒灵脂质体的研究[D].上海:上海医药工业研究所,2000.
[14]TASI L M,LIU D Z,CHEN W Y.Microcalorimetric investigation of the interaction of polysorbate surfactants with unilamellar phosphatidylcholines liposomes[J].Colloids Surf A,2003,213(1):7-14.
[15]XIA S,XU S.Ferrous sulfate liposomes:preparation,stability and application in fluid milk[J].Food Res Int,2005,38(3):289-296.
Optimization of Preparation and Formula for Beta-Ionone Liposome
WANG Yihan1,XU Yingbo2,NING Min2,ZHOU Zhilei1,LIANG Rong3, CHEN Ling1,XU Feifei1, ZHONG Fang*1
(1.School of Food Science and Technology,Jiangnan University,Wuxi 214122,China;2.Key Laboratory of Tobacco Chemistry,China Tobacco Anhui Industrial Co.,LTD,Hefei 230088,China ;3.Key Laboratory of Synthetic and Biological Colloids,Ministry of Education,Jiangnan University,Wuxi 214122,China)
To prepare beta-ionone liposomes bythin-film evaporation and ethanol injection using DPPC (1,2-dipalmitoyl-sn-glycero-3-phosphocholine) and HSPC (hydrogenated soy phosphatidylcholine) as membrane materials,as well as optimize its preparation formula.The results showed that the optimal preparation condition and formula of beta-ionone liposomes was as follows:the molar ratio of DPPC to HSPCwas 8∶2,the concentration of phosphatidylcholine (PC)was 10 mg/mL,the mass ratio of beta ionone toPCs was 1∶20,the ratio of Tween80 to PCs was 1∶20,the ultrasonic power was 240 W,the time was 4 min.Under these conditions,entrapment efficiency of beta-ionone liposomes was 60.62%±3.48%.The diameters of beta-ionone liposomes were about 200nm,the appearances ofbeta-ionone liposomes were completely or approximately globular vesicles underatomic force microscope(AFM).
beta-ionone,liposomes,DPPC(1,2-dipalmitoyl-sn-glycero-3-phosphocholine),HSPC(hydrogenated soy phosphatidylcholin)
TQ 914.1
A
1673—1689(2017)10—1022—07
2015-10-27
国家自然科学基金项目(31171686);烟草化学安徽省重点实验室2013年开放课题资助项目(0920140109010)。
*通信作者:钟 芳(1972—),女,河南新乡人,工学博士,教授,博士研究生导师,主要从事食品物性、食品胶体研究。
E-mail:fzhong@jiangnan.edu.cn
王一涵,徐迎波,宁敏,等.β-紫罗兰酮温敏脂质体的制备工艺及配方优化[J].食品与生物技术学报,2017,36(10):1022-1028.

