黄酒多糖的分离纯化及理化性质研究
孟祥勇 ,沈 赤 ,毛 健 *,姬中伟
(1.粮食发酵工艺与技术国家工程实验室,江南大学,江苏 无锡 214122;2.江南大学 食品学院,江苏 无锡214122;3.江南大学 食品安全与营养协同创新中心,江苏 无锡214122;4.国家黄酒工程技术研究中心,浙江 绍兴 312000;5.绍兴文理学院,浙江 绍兴 312000)
黄酒多糖的分离纯化及理化性质研究
孟祥勇1,2,3,4,沈 赤1,2,5,毛 健*1,2,3,4,姬中伟1,2,3,4
(1.粮食发酵工艺与技术国家工程实验室,江南大学,江苏 无锡 214122;2.江南大学 食品学院,江苏 无锡214122;3.江南大学 食品安全与营养协同创新中心,江苏 无锡214122;4.国家黄酒工程技术研究中心,浙江 绍兴 312000;5.绍兴文理学院,浙江 绍兴 312000)
以绍兴黄酒为原料,采用乙醇沉淀、Sevag法脱蛋白得到黄酒粗多糖,经DEAE-Sepharose FF色谱柱和葡聚糖凝胶G75色谱柱对黄酒粗多糖进行分离纯化,并采用高效凝胶渗透色谱法(HPGPC)对黄酒多糖的相对分子质量和纯度进行检测,进一步采用紫外光谱、红外光谱以及核磁共振波谱对黄酒多糖组分CRWP1的结构特征进行初步解析。结果表明:所得多糖组分为纯度较高的中性多糖组分,其重均相对分子质量为7 850;主要由主阿拉伯糖、葡萄糖和木糖组成,并含有少量岩藻糖、半乳糖和甘露糖;所得多糖组分CRWP1为在1,3糖苷键主链上连接有1,4糖苷键支链的杂多糖,含有α糖苷键构型,并且其单糖残基为吡喃型。
绍兴黄酒;大分子;相对分子质量;单糖;结构特征
黄酒是以谷物为酿造原料,利用酒药、麦曲中的多种微生物共同酿造而成的一种营养丰富的发酵酒,具体酿造过程包括浸米、蒸煮、前酵、后酵、过滤、煎酒、贮存等步骤[1-2],具有以下显著特点:敞口式、双边发酵、多菌种参与[3-4],目前对黄酒中生物活性成分的研究主要集中在氨基酸[5]、功能性低聚糖、多酚类物质[6]和生物活性多肽[7]等功能性物质。作者在前期研究过程中发现黄酒中含有一定含量的多糖,并且多糖含量因黄酒发酵工艺的不同而表现出一定的差异性。在前期研究中,黄酒原液经浓缩、醇沉、Sevag试剂去蛋白质、透析以及冷冻干燥等得到粗多糖。虽然醇沉物经初步分离,已去掉部分杂质,但粗多糖中仍有未脱除干净的色素、蛋白质、单糖等物质,并且其所含多糖在分子大小和极性上也存在差异,因此需要在进一步对黄酒粗多糖进一步分离,以为黄酒多糖生物活性的研究提供基础。
与小分子化合物相比,多糖具有相对分子质量大、结构复杂及极性大等特点,因而多糖分离纯化的方法不同于普通化合物的分离纯化。粗多糖的分离纯化一般需要经过除杂、脱色、除蛋白质等步骤,将一些非糖去掉后,然后进一步通过乙醇分级沉淀法、透析法、超滤和膜分离等进一步纯化,其中纤维素离子交换柱层析和葡萄糖凝胶色谱柱层析分别是依据多糖的极性和相对分子质量进行分离。
因此,作者首先将粗多糖中的酸性多糖和中性多糖用DEAE Sepharose FF离子交换柱进行分离,然后按相对分子质量大小将多糖用葡聚糖凝胶柱G75进行分离,同时采用高效凝胶过滤色谱法(HPGFC)测定绍兴黄酒多糖的相对分子质量及纯度、高效阴离子交换色谱-脉冲安培检测法(HPAEC-PAD)测单糖组成、红外光谱和紫外光谱以及核磁共振分析绍兴黄酒多糖的结构,并通过刚果红实验对绍兴黄酒多糖的三维螺旋结构进行测定,以期初步推断其结构,为解释黄酒多糖的对黄酒的风味品质和健康作用的影响提供依据。
1 材料与方法
1.1 材料与试剂
绍兴黄酒粗多糖:实验室自制,乙醇沉淀黄酒多糖,并采用Sevage法去除沉淀中的蛋白质,其含有的无机盐、低聚糖等杂质经透析袋透析72 h去除,随后进行减压浓缩,冷冻干燥得到黄酒粗多糖。
DEAE琼脂糖凝胶、葡聚糖凝胶G75、KBr、单糖标准样:美国Sigma-Aldrich公司产品。
1.2 仪器与设备
SY500旋转蒸发仪:上海亚荣生化仪器厂产品;Avanti J-26 XP高速冷冻离心机:美国贝克曼库尔特产品;FreeZone®冷冻干燥机:美国Labconco公司产品;MD99-3自动液相色谱分离层析仪:上海青浦沪西仪器厂产品;UV2600紫外可见分光光度计:天美(中国)科学仪器有限公司产品;NEXU S670智能型傅里叶红外光谱仪:美国尼高利公司产品;ICS-5000离子色谱仪:美国Dionex公司产品;Waters 600高效液相色谱仪:美国Waters公司产品;AVANCEⅢHD 400 MHz核磁共振:美国布鲁克公司产品。
1.3 方法
1.3.1 黄酒多糖DEAE离子交换柱纯化 参照Guo等人[8]的方法,称取DEAE Sepharose FF琼脂凝胶填料100 g,用体积分数70%的乙醇反复漂洗,抽干后于2 mol/L氯化钠溶液中浸泡3 h,抽干,然后用去离子水洗涤至中性,超声波脱气;将预处理过的DEAE Seph-arose FF填料用去离子水悬浮均匀,沿柱壁缓慢加入内径 2.6 cm、柱高30 cm的层析柱内,静置使胶体充分沉淀,以5柱体积的去离子水洗涤平衡柱子;取0.1 g黄酒粗多糖样品,用超纯水溶解,配成质量浓度为10 mg/mL的溶液,过0.45 μm滤膜后上DEAE-Sepharose Fast Flow柱,上样量为10 mL,调节恒流泵的转动速度至洗脱流量为1.5 mL/min,用部分收集器收集洗脱液,洗脱每4 min接收1管多糖洗脱液。首先用300 mL超纯水洗脱(接收50管),再用0~1 mol/L NaCl(用梯度混合器发生,左边放150 mL 1 mol/L NaCl溶液,右边盛放150 mL超纯水)洗脱,洗脱至没有多糖检出为止。每隔一管取0.2 mL洗脱液检测多糖含量,然后以管数为横坐标,吸光度为纵坐标,绘制洗脱曲线,根据洗脱峰对分离效果进行判断。洗脱液分别收集,单一峰收集液合并,然后对收集液进行减压浓缩,透析,冻干得黄酒多糖的DEAE-Sepharose FF组分。
1.3.2 黄酒多糖葡聚糖G75凝胶柱分离 取一定量的葡聚糖凝胶G75,用约20倍凝胶量的去离子水,置于室温下24 h进行溶胀,间隙搅拌,以保证凝胶的溶胀完全,以免上柱后流速变慢和凝胶断裂,然后将表面悬浮的小颗粒取出;将层析柱垂直固定于铁架台上,接着将溶胀完全并脱气的葡聚糖凝胶搅拌均匀,沿柱壁缓慢加入内径2.6 cm、柱高30 cm的玻璃柱内,然后静置使填料成分沉淀均匀、致密。装柱后,用去离子水洗涤平衡柱子24 h;将经过DEAE柱分离得到的黄酒多糖组分配制成5 mg/mL的水溶液10 mL,然后将多糖溶液沿柱壁缓慢加G75葡聚糖凝胶柱,上样量为5 mL;用去离子水洗脱,调节恒流泵的转速至洗脱流量为0.5 mL/min,用部分收集器收集洗脱液,每10 min接收1管洗脱液。每隔一管取0.2 mL洗脱液检测多糖含量,然后以管数为横坐标,吸光度为纵坐标,绘制洗脱曲线,根据洗脱峰对分离效果进行判断。洗脱液分别收集,单一峰收集液合并,然后对收集液进行减压浓缩,透析,冻干。
1.3.3 多糖纯度和相对分子质量测定 黄酒多糖的相对分子质量和纯度采用高效凝胶过滤色谱法(HPGFC)测定,具体方法参照Hsu等人[9],样品溶液经0.5 μm微孔膜过滤后,取15 μL上高效液相色谱仪。高效凝胶过滤色谱仪的条件为:Waters 600高效液相色谱仪,410示差折光检测器,雾化温度55 ℃,雾化压力 3.06 bar,UltrahydrogelTMLinear(300 mm×7.8mm)凝胶柱,色谱柱温度为45℃,流动相为0.1 mol/L NaNO3,流速为 0.96 mL/min。
1.3.4 单糖组成分析 取2 mg多糖样品放入薄壁长试管中,加入4 mL 2 mol/L三氟乙酸(TFA)溶液,混匀后于110℃下水解2 h;然后低于40℃温度下将试管内溶液减压蒸干,接着加入3 mL甲醇再次蒸干,重复以上操作4~5次,以完全除去TFA。用超纯水溶解定容至100 mL容量瓶,稀释10倍后上样测定。色谱条件为:Dionex CarboPac PA20阴离子交换柱,包括250 mm×4 mm分析柱、50 mm×4 mm保护住;色谱柱温度为30℃;流动相由A(超纯水)和B(0.25 mol/L NaOH)组成,其中流动相B的比例分别 为 体 积 分 数 2.0% (0~22.0 min)、2.0%~80.0%(22.0~23.0 min)、80.0% (23.0~30.0 min)、80.0%~2.0%(30.0~31.0 min)、2.0%(31.0~40.0 min);流量为0.5 mL/min;进样体积为 20 μL。
1.3.5 黄酒多糖三股螺旋结构的测定 黄酒多糖三股螺旋结构的测定参照You等人[10],并略作改动。称取5 mg黄酒多糖样品,分别加入蒸馏水2.0 mL和80 μmol/L的刚果红试剂2.0 mL,然后加入1.0 mol/LNaOH溶液,使溶液中NaOH浓度分别达到0、0.05、0.1、0.15、0.2、0.25、0.3、0.35、0.4、0.45、0.5 mol/L,混匀后于200~800 nm波长范围内进行紫外可见光谱扫描,并记录最大吸收波长;以蒸馏水替代黄酒多糖溶液,重复以上操作作为对照。以NaOH浓度为横坐标,最大吸收波长为纵坐标作图,分析多糖溶液的最大吸收波长与NaOH浓度之间的关系。
1.3.6 黄酒多糖紫外-可见光光谱 (UV)分析 取50 mg纯化后的黄酒多糖置于25 mL容量瓶中,用去离子水配制2.0 mg/mL黄酒多糖溶液,于200~400 nm范围内进行紫外-可见光扫描,判断260 nm和280 nm处是否存在吸收峰。
1.3.7 黄酒多糖红外光谱分析 将光谱纯KBr预先用红外干燥箱干燥,取100~200 mg,用压片机压成薄片作为空白对照;另取经红外干燥的黄酒多糖样品,与100~200 mg光谱纯KBr混合,并在玛瑙研钵中轻轻研磨均匀,压成薄片,于4 000~400 cm-1处采集红外光谱信息,扫描参数为:32次扫描、2 cm-1的分辨率。
1.3.8 黄酒多糖核磁共振分析 黄酒多糖结构分析采用核磁共振法,具体方法参考Ruthes等人[11]研究,并略作修改。取多糖样品60 mg,溶于1 mL D2O以置换H2O、冻干,反复置换3次,装入核磁管,溶于D2O 中(1~0.5 mL),DDS(二甲基硅戊烷磺酸钠)作内标。在室温下用BRUKERA-V400型核磁共振仪上进行1H-NMR,13C-NMR,1H-1H 相关谱 (1H-1HCOSY)、异核单量子关系(HSQC)、异核多键相关谱(HMBC)。
2 结果与分析
2.1 黄酒粗多糖的分离纯化
2.1.1 黄酒粗多糖DEAE-Sepharose FF色谱柱纯化 由于不同多糖组分所带电荷的不同,其和DEAE-Sepharose FF色谱柱固定相中离子交换子的集合能力有所差异,样品溶液流经色谱柱时,不同电荷的多糖被选择性地吸附在固定相上,因而当洗脱液流经色谱柱时,不同电荷量的多糖就被先后洗脱下来,从而实现黄酒多糖的分离纯化。
由图1可知,采用醇沉多糖工艺所得粗多糖经DEAE-Sepharose FF色谱柱洗脱后可得3种黄酒多糖组分:CRWP1、CRWP2和 CRWP3;由图中洗脱曲线可判断出,最先被去离子水洗脱下来的黄酒多糖组分CRWP1为不带电荷的中性多糖,而当洗脱液换为用0~1 mol/L NaCl溶液梯度洗脱时,此时被分离下来的黄酒多糖为酸性多糖。比较洗脱下来的3个洗脱峰,其中组分CRWP1所占比例达到91.5%,CRWP2和CRWP3所占比例分别为5.67%和2.83%。从以上分析结果看,CRWP1为含量最高的黄酒多糖组分,且其活性经初步验证高于其它两个组分,因此以CRWP1为目标组分继续进行纯化。

图1 黄酒多糖DEAE-Sepharose FF色谱柱的梯度洗脱曲线Fig.1 Stepwise elution curve of crude polysaccharides from Chinese rice wine on DEAE-Sepharose FF chromatography column
2.1.2 黄酒粗多糖葡聚糖凝胶G75色谱柱纯化
图2为DEAE-Sepharose FF色谱柱初步分离得到的黄酒多糖组分CRWP1经葡聚糖凝胶G75色谱柱的洗脱结果。如图2所示,用葡聚糖凝胶G75色谱柱对多糖组分CRWP1进行洗脱,硫酸苯酚法检测后得到单一对称吸收峰,表明该组分纯度较高。收集合并吸收峰位置洗脱液,将洗脱液透析和冷冻干燥后,得到白色的多糖样品,说明多糖中混有的色素得到了很好的去除。
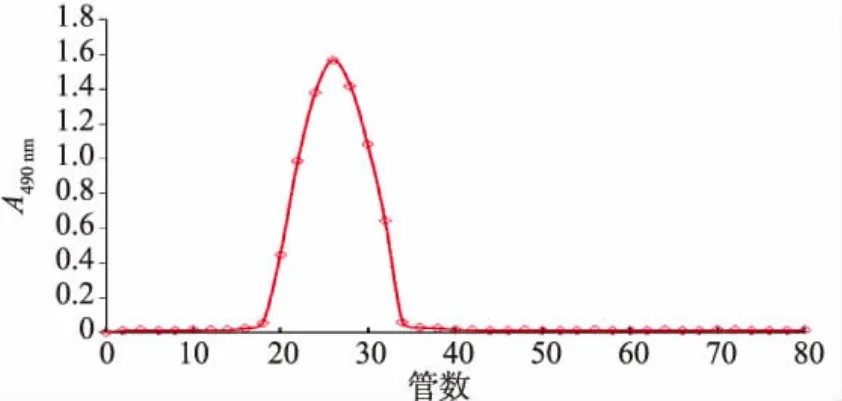
图2 黄酒多糖组分CRWP1的葡聚糖凝胶G7色谱柱的洗脱曲线Fig.2 Elution curve of CRWP1 on Sephadex G75 chromatography column
2.2 黄酒多糖CRWP1的纯度和相对分子质量
图3为黄酒多糖的高效凝胶过滤色谱图,通过对图形分析可知,经DEAE-Sepharose FF色谱柱和葡聚糖凝胶G7色谱柱分离纯化可得到纯度较高的黄酒多糖组分。根据标准分子量葡聚糖绘制的标准曲线,得到黄酒多糖的重均相对分子质量为7 850。

图3 黄酒多糖组分CRWP1的HPGPC色谱图Fig.3 HPGPC chromatography of CRWP1
2.3 黄酒多糖CRWP1的单糖组成
图4、5分别给出了混合标样和CRWP1的离子色谱图。出峰时间和代表的化合物如表1和表2所示。

图4 混合标样的离子色谱图Fig.4 HPAEC separation with pulsed-amperometric detection of sugar standard solution
由表1和表2可知,黄酒多糖组分CRWP1各峰保留时间与阿拉伯糖、葡萄糖、木糖、岩藻糖、半乳糖和甘露糖标准品的保留时间一致,通过进一步分析可知阿拉伯糖、葡萄糖和木糖为CRWP1的主要组分,并含有少量岩藻糖、半乳糖和甘露糖。
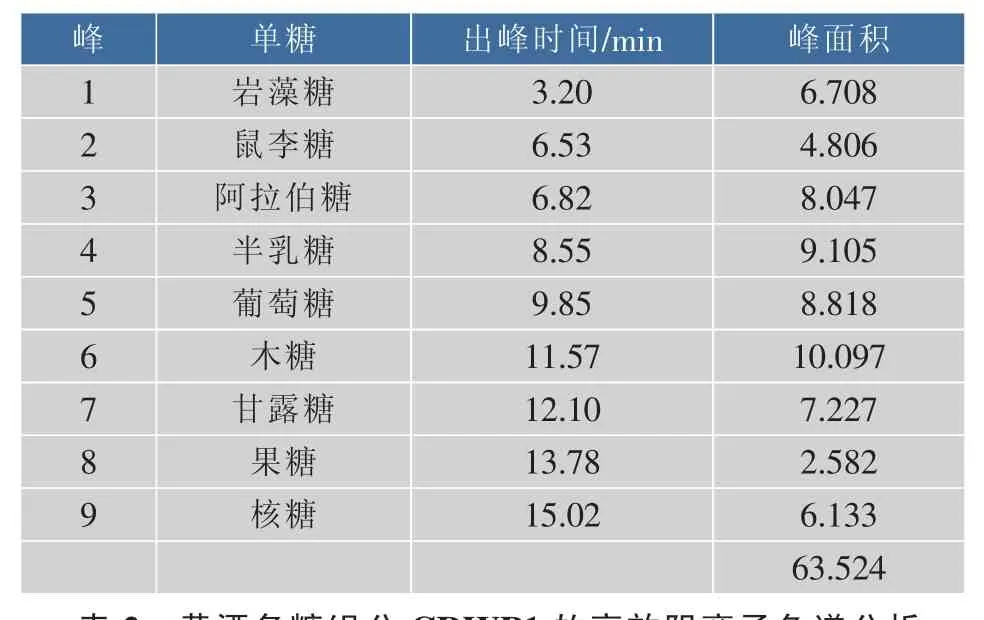
表1 单糖标准品的高效阴离子色谱分析Table 1 Analysis for the spectrum of HPAEC for monosaccharide standards

表2 黄酒多糖组分CRWP1的高效阴离子色谱分析Table2 Analysisforthespectrum ofHPAEC formonosaccharide standards
2.4 黄酒多糖组分CRWP1紫外光谱分析
黄酒多糖组分CRWP1的紫外光谱扫描信息如图6所示,根据CRWP1在200~600 nm波长范围内的扫描结果,在260 nm和280 nm两个位置均为出现明显吸收,说明经DEAE-Sepharose FF色谱柱和葡聚糖凝胶G75色谱柱分离后得到的黄酒多糖组分CRWP1不含核酸和蛋白质。
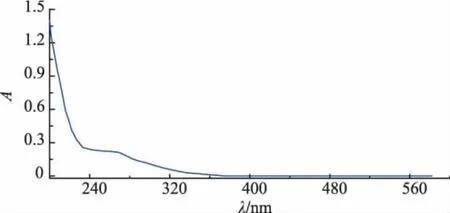
图6 黄酒多糖组分CRWP1的紫外光谱图Fig.6 UV spectra of CRWP1
2.5 黄酒多糖组分CRWP1红外光谱分析
取干燥后的黄酒多糖CRWP1经溴化钾压片后制样,进行红外扫描,其傅里叶变换红外光谱吸收信息如图7所示。

图7 黄酒多糖组分CRWP1的傅里叶变换红外光谱图Fig.7 FT-IR spectra of CRWP1
从图7可以看出,多糖组分CRWP1在3 380.41 cm-1的吸收峰宽而强,表明分子间或分子内存在O-H伸缩振动;2 925.99 cm-1处的吸收峰,说明存在糖类物质的C-H键伸缩振动[12];1 653 cm-1处的强吸收峰,为-CHO中的C=O伸缩振动特征吸收;1 419 cm-1、1 365.69 cm-1处存在弱吸收峰,说明存在 C-H 变角振动;1 152.20 cm-1、1 087.07 cm-1、1 027.40 cm-1有吸收峰,说明存在β-吡喃糖基CO-H和C-O-C中C-O引起的振动吸收;843.27 cm-1存在吸收峰,即为α-D-Glc吡喃构型和β-糖苷键引起的特征吸收;760.95 cm-1有吸收,说明存在α-D-木吡喃环的对称伸缩振动。
2.6 黄酒多糖组分CRWP1三股螺旋结构
由图8可知,当NaOH的浓度在0~0.05 mol/L范围内变化时,黄酒多糖组分CRWP1与刚果红形成的络合物的λmax随浓度的增加而增加;当NaOH浓度在0.05~0.5 mol/L范围内变化时,黄酒多糖组分CRWP1与刚果红形成的络合物的λmax随浓度的增加而逐渐减小,而为添加黄酒多糖组分CRWP1的刚果红溶液的λmax随NaOH浓度的增加 (0~0.5 mol/L)而不断下降。由此说明,在黄酒多糖组分CRWP1存在三股螺旋结构,该结构在弱碱性条件下与刚果红形成络合物,使λmax增大;但该结构在强碱性溶液中不稳定,当NaOH溶液浓度大于0.05 mo/L时,三股螺旋结构中的氢键被破坏,从而表现为λmax的降低。
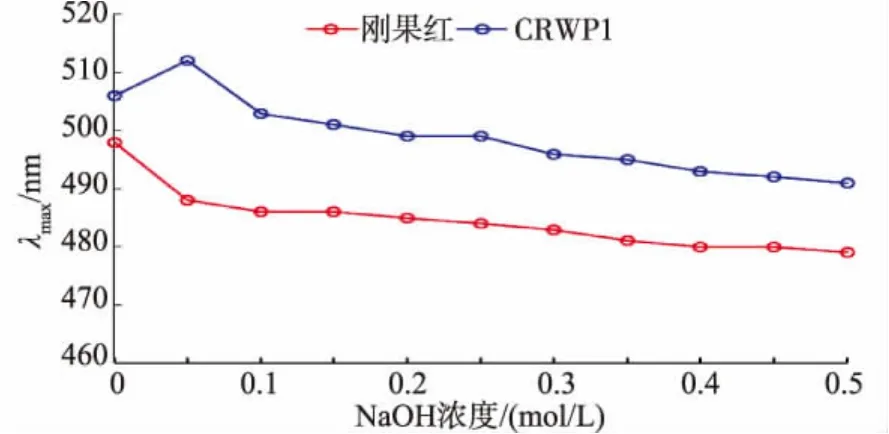
图8 黄酒多糖组分CRWP1在NaOH溶液中的λmaxFig.8 Maximum absorption wavelength of mixture ofCRWP1 in various concentration of NaOH
2.7 黄酒多糖组分CRWP1核磁共振分析
黄酒多糖组分CRWP1核磁共振波谱分析如图9、10所示。从黄酒多糖组分CRWP1的1H-NMR图谱(图9)分析可知,δ 4.790处的信号为水分子的信号;在异头氢区的共振区域δ 5.00~5.40范围内共有5个异头氢的共振峰,分别是 δ 5.181、5.302、5.312、5.333、5.354,其化学位移均大于4.9,并且在5.40处未出现质子信号,说明黄酒多糖组分CRWP1为含有α型糖残基的吡喃糖[13]。
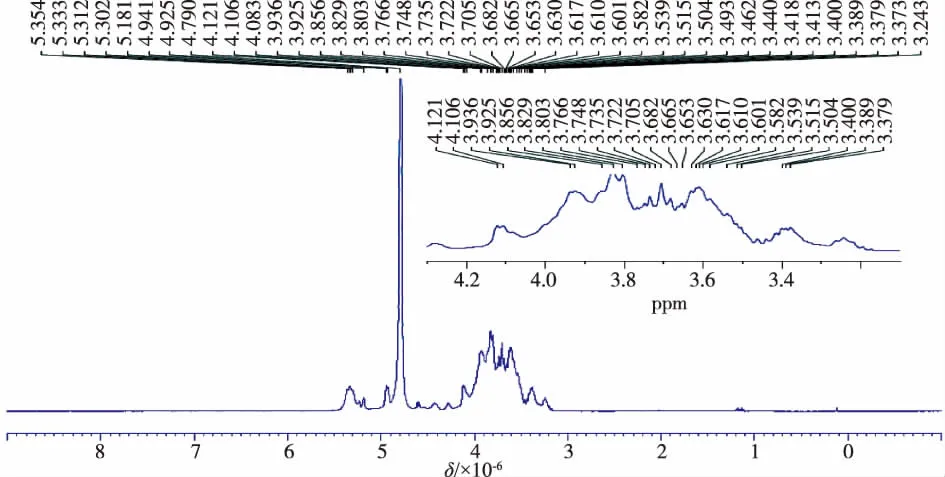
图9 黄酒多糖组分CRWP1的1H-NMRFig.9 1H-NMR spectrum of CRWP1
由图10可知,异头碳的共振峰出现在δ 95.873~99.927,共有5个共振峰,说明黄酒多糖组分CRWP1是由5种单糖残基组成的杂多糖。多糖中同一单糖的位置不同,异头碳的化学位移也会不同;取代基的空间排列对异头碳的化学位移影响较大,与异头碳上垂直键的化学位移相比,平伏键的化学位移处于较高场例如α-型糖苷异头碳和多数β-型糖苷异头碳的化学位移分别处于95~101和101~105[14]。
由据图10发现,在δ 95~101范围内出现共振信号,说明黄酒多糖组分CRWP1含有α糖苷键构型。一般情况下,可根据13C-NMR检测到的信号将多糖分为呋喃糖、吡喃糖,其中呋喃糖的三位碳和五位碳在δ 82~84范围内无信号,而吡喃糖的三位碳和五位碳的化学位移小于80。同时根据图10发现,δ 82~84范围内未有信号出现,说明黄酒多糖组分CRWP1不存在呋喃型结构,因此可以初步确定黄酒多组分CRWP1的单糖残基构型为吡喃型[14-15]。未被取代时吡喃糖残基的C2、C3、C4化学位移为70~76,一旦发生取代,其相应位移将移向76~85;对于C6(δ60~65)位发生取代后,其位移将移至67~76。结合图3~9可知,黄酒多糖组分CRWP1在76~85范围内出现信号,即为C3位糖苷键取代后的共振峰,说明黄酒多糖组分CRWP1存在1,3连接糖苷键[16];在δ 75.911处出现的信号为被取代的C4糖残基信号,说明黄酒多糖组分CRWP1中含有少量1,4连接糖苷键。
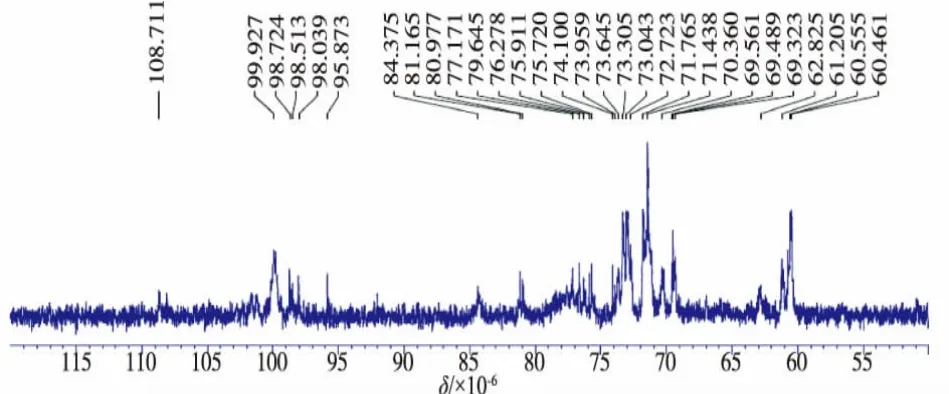
图10 黄酒多糖组分CRWP1的13C-NMRFig.10 13C-NMR spectrum of CRWP1
3 结语
采用DEAE-Sepharose FF色谱柱和葡聚糖凝胶G75色谱柱对黄酒粗多糖进行分离纯化,得到一种白色的黄酒多糖组分CRWP1。并且使用HPGPC对该组分的纯度和相对分子质量进行测定,其洗脱峰呈单一、对称正态分布,说明经DEAE-Sepharose FF色谱柱和葡聚糖凝胶G7色谱柱分离纯化得到的黄酒多糖组分CRWP1为纯度较高的单一组分,相对分子质量为7 850;并且经高效阴离子色谱检测证明,CRWP1主要由阿拉伯糖、葡萄糖和木糖组成,并含有少量岩藻糖、半乳糖和甘露糖;此外,采用紫外光谱、红外光谱以及核磁共振波谱对黄酒多糖组分CRWP1的结构进行分析,结果表明所得多糖组分CRWP1为在1,3糖苷键主链上连接有1,4糖苷键支链的杂多糖,含有α糖苷键构型,并且其单糖残基为吡喃型。
[1]FENG Hao,MAO Jian,HUANG Guidong,et al.Study on isolation,identification and biological properties of lactic acid bacteria from the fermentation of Chinese rice wine[J].Science and Technology of Food Industry,2013,34 (16):224-2278.(in Chinese)
[2]HAN Xiao,MAO Jian,HUANG Guidong.Effect of trace ventilation on flavoring substances and free amino acids in chinese rice wine during storage[J].Food Science,2013,34(3):123-127.(in Chinese)
[3]LUAN Tongqing,LI Zhijun,ZHONG Qiding,et al.Preliminary study of changes of the bacterial community structures during the rice wine fermentation[J].Science and Technology of Food Industry,2013,12(34):177-180.(in Chinese)
[4]ZHANG Fengjie,XUE Jie,WANG Yijing,et al.Study on biogenic amines formation and influencing factors in Chinese rice wine[J].Food and Fermentation Industries,2013,39(2):62-68.(in Chinese)
[5]HE S,MAO X,LIU P,et al.Research into the functional components and antioxidant activities of North China rice wine (Ji Mo Lao Jiu)[J].Food Science&Nutrition,2013,4(1):307-314.
[6]QUE F,MAO L C,PAN X.Antioxidant activities of five Chinese rice wines and the involvement of phenolic compounds[J].Food Research International,2006,39(5):581-587.
[7]HAN F L,XU Y.Identification of low molecular weight peptides in Chinese Rice Wine (Huang Jiu) by UPLC-ESI-MS/MS[J].Journal of the Institute of Brewing,2011,117(2):238-250.
[8]GUO S,MAO W,HAN Y,et al.Structural characteristics and antioxidant activities of the extracellular polysaccharides produced by marine bacterium Edwardsiella tarda[J].Bioresource Technology,2010,101(12):4729-4732.
[9]HSU W,HSU T,LIN F,et al.Separation,purification,and α-glucosidase inhibition of polysaccharides from Coriolus versicolor LH1 mycelia[J].Carbohydrate Polymers,2013,92(1):297-306.
[10]YOU L,GAO Q,FENG M,et al.Structural characterisation of polysaccharides from Tricholoma matsutake and their antioxidant and antitumour activities[J].Food Chemistry,2013,138(4):2242-2249.
[11]RUTHES A C,RATTMANN Y D,CARBONERO E R,et al.Structural characterization and protective effect against murine sepsis of fucogalactans from Agaricus bisporus and Lactarius rufus[J].Carbohydrate Polymers,2012,87(2):1620-1627.
[12]LI Qingyu,YANG Ying,JIA Linfei,et al.Purification,Structural analysis and antifatigue assay of polysaccharide from Castanea mollissima Blume[J].Journal of Food Science and Biotechnology,2013,32(7):767-772.(in Chinese)
[13]AGUIRRE M J,ISAACS M,MATSUHIRO B,et al.Characterization of a neutral polysaccharide with antioxidant capacity from red wine[J].Carbohydrate Research,2009,344(9):1095-1101.
[14]CHEN Y,MAO W,YANG Y,et al.Structure and antioxidant activity of an extracellular polysaccharide from coral-associated fungus,Aspergillus versicolor LCJ-5-4[J].Carbohydrate Polymers,2012,87(1):218-226.
[15]LIM J M,JOO J H,KIM H O,et al.Structural analysis and molecular characterization of exopolysaccharides produced by submerged mycelial culture of Collybia maculata TG-1[J].Carbohydrate Polymers,2005,61(3):296-303.
[16]YANG Yanchao,XU Deping.Hypoglycemic effect and structural determination of polysaccharides from barley malt[J].Journal of Food Science and Biotechnology,2012,31(10):1087-1092.(in Chinese)
Isolation,Purification and Physicochemical Properties of Polysaccharides from Chinese Rice Wine
MENG Xiangyong1,2,3,4,SHEN Chi1,2,5,MAO Jian*1,2,3,4,JI Zhongwei1,2,3,4
(1.National Engineering Laboratory for Cereal Fermentation Technology,Jiangnan University,Wuxi 214122,
China;2.School of Food Science and Technology,Jiangnan University,Wuxi 214122,China;3.Synergetic Innovation CenterofFood Safety and Nutrition,Jiangnan University,Wuxi214122,China;4.National Engineering Research Center of Chinese Rice Wine,Shaoxing 31200,China;5.Shaoxing University,Shaoxing 31200,China)
In this study,Chinesericewinefrom Shaoxing region was used to extract polysaccharides,and the protein of crude polysaccharides sample was precipitated by sevag.The isolation,purification of polysaccharides was performed by DEAE-Sepharose Fast Flow and Sephadex G75.Furthermore,the purity and molecular weight were determined by high performance gel permeation chromatography (HPGPC).Ultraviolet spectrum (UV),fourier transform infrared spectrometry (FTIR)and NMR were for determining the structure of CRWP1.It was showed as a single symmetrical peak on high-performance gel-permeation chromatography (HPGPC)and theaverage molecular weight was 7 850 Da.The results showed that CRWP1 was a heteroglycan,which was composed mainly of glucose,arabinose,xylose,and a small quantity of fucose,galactose and mannose.There was one glycosidic configuration (α)in structure of polysaccharides from Shaoxing rice wine,and the glycosidic bond was galactopyranose type.It was also revealed that the structure of polysaccharides from Shaoxing rice wine contained 1,3 glycosidic bonds as the main chain and 1,4 glycosidic bonds as branched chain.
Shaoxing rice wine,macromolecule,molecularweight,monosaccharide,structure characteristics
TS 262
A
1673—1689(2017)10—1029—07
2015-09-02
国家863计划项目(2013AA102203-06);中央高校基本科研业务费(JUSRP11411)。
孟祥勇(1982—),男,安徽砀山人,工学博士,副教授,主要从食品生物技术研究。E-mail:nelmeng@163.com
*通信作者:毛 健(1970—),男,安徽宿州人,工学博士,教授,博士研究生导师,主要从事食品生物技术研究。E-mail:biomao@263.net
孟祥勇,沈赤,毛健,等.黄酒多糖的分离纯化及理化性质研究[J].食品与生物技术学报,2017,36(10):1029-1035.

