乌鸡低聚肽铁的分离纯化及结构鉴定
刘文颖,谷瑞增,蔡木易,鲁 军
(中国食品发酵工业研究院 北京市蛋白功能肽工程技术研究中心,北京100015)
乌鸡低聚肽铁的分离纯化及结构鉴定
刘文颖,谷瑞增,蔡木易,鲁 军*
(中国食品发酵工业研究院 北京市蛋白功能肽工程技术研究中心,北京100015)
为了考察乌鸡低聚肽铁中肽段的结构,以乌鸡为原料,以氯化亚铁为铁源制备乌鸡低聚肽铁,对其总蛋白质质量分数、螯合率、得率进行测定,结果表明乌鸡低聚肽铁总蛋白质质量分数为(56.79±0.18)%,螯合率为(83.53±0.15)%,得率为(40.86±0.14)%。 然后利用反相高效液相色谱(RP-HPLC)对其进行分离纯化,收集4个组分峰,利用四极杆飞行时间串联质谱仪(QTOF质谱仪)测定肽序列,分析出1个肽段,氨基酸序列为Thr-Ser-Gly-Met-Pro,相对分子质量为491.56。
乌鸡低聚肽;肽铁螯合物;分离纯化;结构鉴定
乌鸡俗称乌骨鸡,是我国特有的食药两用鸡种,含有丰富的营养成分,是优质的蛋白质来源[1-4]。
铁是人体所必需的微量元素之一,缺铁会导致多种疾病的发生[5-7]。目前,主要通过服用补铁剂来防治缺铁性贫血,补铁剂主要有无机铁、有机铁、氨基酸铁和生物铁等。多肽铁螯合物是一种新型的生物铁,可直接被肠黏膜细胞吸收,吸收率远较无机铁和有机铁高,并且无消化道刺激,是理想的补铁剂[8-11]。此外,通过制备乌鸡低聚肽铁还可以协同乌鸡肽的免疫调节、抗氧化和促进矿物质吸收等功能,多方面强化乌鸡补铁的功效。
目前,国内外对乌鸡低聚肽铁的研究主要集中在制备和优化水解条件等方面,有关乌鸡低聚肽铁的分离纯化、结构鉴定的文章并不多见。作者通过工艺优化制备出乌鸡低聚肽铁,并对其稳定性进行了研究[12-13]。在对其总蛋白质、螯合率、得率进行分析的基础上,采用反相高效液相色谱(RP-HPLC)对其进行分离纯化,利用四极杆飞行时间串联质谱仪(Q-TOF质谱仪)鉴定肽段结构,以期为利用乌鸡开发生物补铁剂提供科学依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料 乌鸡:市售;Alcalase 2.4L、木瓜蛋白酶:诺维信(中国)生物技术有限公司产品;乙腈:色谱纯,美国Fisher公司产品;三氟乙酸:分析纯,英国Alfa Aesar公司产品。
1.1.2 仪器 FE20K型pH计:瑞士METTLER TOLEDO公司产品;YG30喷雾干燥机:无锡市阳光干燥设备有限公司产品;FD-1A-50冷冻干燥机:北京华圣科仪实验设备有限公司产品;LC-20AD型高效液相色谱仪:日本岛津公司产品;Q-TOF2正交加速电喷雾串联质谱仪:英国Micromass公司产品。
1.2 方法
1.2.1 乌鸡低聚肽铁的制备 将乌鸡除去内脏后切块,用绞肉机绞碎→加适量水用匀浆机匀浆→调节pH值为8.5,温度为60℃,以3 000 U/g蛋白质的酶量加入Alcalase 2.4L,酶解2 h→调节pH值为7.0,温度保持60℃,以2 500 U/g蛋白质的酶量加入木瓜蛋白酶,酶解2 h→升温至100℃,灭酶10 min→6 000 g离心15 min,取上清液→用截留相对分子质量为2×106的陶瓷膜过滤,取中间清液→用截留相对分子质量为1 000的超滤膜超滤,得到相对分子质量小于1 000的滤过液→喷雾干燥,得到乌鸡低聚肽干粉→将8 g乌鸡低聚肽干粉,溶解于200 mL蒸馏水中,加入2.0 g抗坏血酸防止亚铁离子被氧化→调节pH值为5。加入2.0 g FeCl2·4H2O,50℃下水浴反应60 min,冷却至室温→加入4倍体积的无水乙醇,室温放置1 h→抽滤收集沉淀,干燥后得到乌鸡低聚肽铁干粉→干燥器中保存备用[13-15]。
1.2.2 乌鸡低聚肽铁指标测定 总蛋白质质量分数测定采用凯氏定氮法[16]。螯合率和得率的测定参照文献[12]。采用邻菲罗啉比色法测定铁的含量。称取0.05 g乌鸡低聚肽铁,加入1 mL盐酸溶解,配制成质量分数0.1%乌鸡低聚肽铁溶液。称取1 mL溶液于50 mL容量瓶中,按照标准曲线操作步骤测定其吸光度。
1.2.3 RP-HPLC分离乌鸡低聚肽铁 利用RPHPLC对乌鸡低聚肽铁进行分离纯化。色谱条件为:流动相 A:V(水)∶V(三氟乙酸)=100∶0.1;流动相 B:V(乙腈)∶V(水)∶V(三氟乙酸)=80∶20∶0.1;样品质量浓度:10 mg/mL; 进样体积:100 μL; 流量:0.6 mL/min;检测波长:UV220 nm;柱温:32℃。梯度洗脱程序:0~20 min,流动相 B:0%~5%;20~30 min,流动相B:5%~5%;30~80min, 流动相 B:5%~25%;80~90 min,流动相B:25%~80%;90~100 min,流动相B:80%~80%。选择主要的组分峰进行收集,然后用氮吹仪将组分峰中的三氟乙酸、乙腈等有机溶剂除去,利用冻干机进行冷冻干燥,-20℃保存备用[17-18]。
1.2.4 Q-TOF MS测定相对分子质量及肽序列 利用Q-TOF2正交加速电喷雾串联质谱仪对乌鸡低聚肽铁的结构进行鉴定。首先进行一级质谱扫描,得到ESI-MS图。从ESI-MS图中选出待测离子,然后进行ESI-MS/MS分析。质谱图经Micromass的MaxEnt 3转换后,由Peptide Sequencing推导出肽段序列。质谱条件为:离子化方式:纳升电喷雾正离子;雾化气体:N2;碰撞气体:Ar;锥孔电压:50 V;TOF加速电压:9.1 kV;MCP检测器电压:2 150 V;毛细管电压:800 V;源温:80℃;MS和MS/MS的质量准确度:0.1[19-20]。
2 结果与讨论
2.1 乌鸡低聚肽铁的总蛋白质量分数、螯合率和得率
结果表明,乌鸡低聚肽铁的总蛋白质量分数为(56.79±0.18)%,螯合率为(83.53±0.15)%,得率为(40.86±0.14)%。表明乌鸡低聚肽铁中蛋白质质量分数较高,并且具有较高的螯合率和得率。
2.2 乌鸡低聚肽铁的分离纯化
分离纯化方法主要有超滤、聚丙烯酰胺凝胶电泳、高效液相色谱、离子交换层析、凝胶过滤色谱等手段。其中,反相高效液相色谱(RP-HPLC)法是多肽分离纯化时最常用,也是最有效的方法。RPHPLC法是根据多肽的极性强弱进行分离的,具有很好的分离效果。与其它色谱方法相比,RP-HPLC法具有色谱过程稳定、重复性好、分辨率高、操作简便等优势[21,22]。乌鸡低聚肽铁的RP-HPLC分离色谱图如图1所示。乌鸡低聚肽铁经RP-HPLC分离后,得到4个主要的组分峰,集中在色谱图的前10 min。RP-HPLC能够使得相邻或相近极性的多肽富集在一起,亲水性组分先被洗脱出来,而疏水性组分后被洗脱出来,因此这4个组分峰都是亲水性强的组分。将其分别命名为组分1~4,分管收集、冷冻干燥后进行质谱分析。
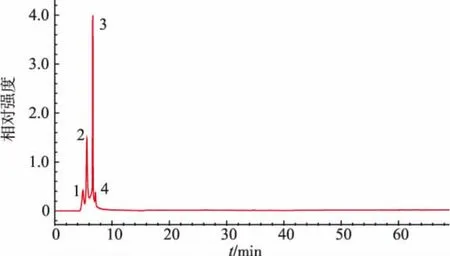
图1 乌鸡低聚肽铁的RP-HPLC分离色谱图Fig.1 RP-HPLC separation chromatogram of BSFP-Fe
2.3 乌鸡低聚肽铁的肽序列测定
利用Q-TOF质谱仪对收集得到的4个组分峰进行分析。该质谱仪采用电喷雾电离源(ESI)和飞行时间检测器(TOF),通过对各个组分二级质谱的碎片离子的质谱图进行解谱得到肽段的结构[23,24]。
组分3的一级质谱图如图2所示,利用Q-TOF质谱仪从乌鸡低聚肽铁的组分3中分析出1个肽段序列,这说明组分3含有的是单一性成分,肽段的氨基酸序列为Thr-Ser-Gly-Met-Pro(图3),相对分子质量为491.56。组分3是乌鸡低聚肽铁最大的组分峰,其余3个组分中未检测出肽段结构,可能是盐类等物质。Fe2+与多肽是以离子键和配位键形式结合的,也有一部分是以物理吸附形式沉积在多肽铁表面,从质谱中未发现Fe2+峰,这表明Fe2+与小肽结合得较弱,在电离过程中脱落下来,因此未检测出来。五肽Thr-Ser-Gly-Met-Pro不同的部位均可与Fe2+发生螯合作用,与Fe2+发生螯合的位置可能是-NH-、NH2、-COOH和-OH这几个基团,从而形成不同的螯合物[25]。
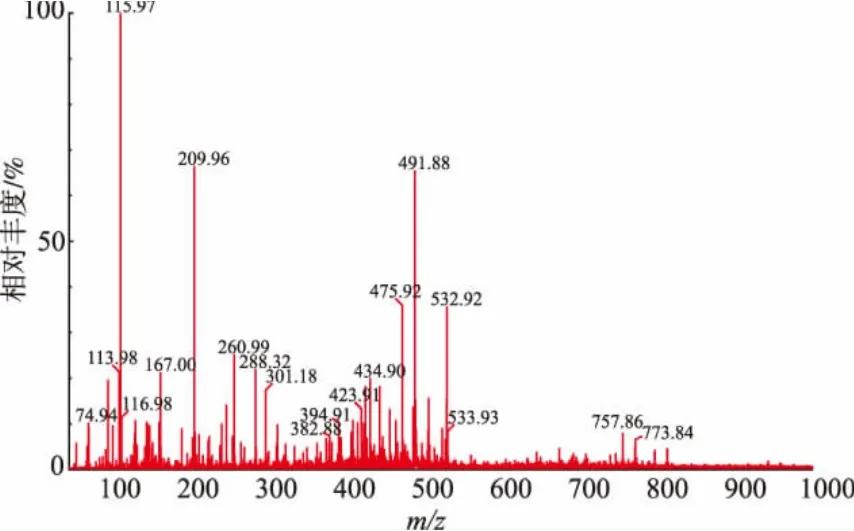
图2 组分3的一级质谱图Fig.2 MS spectrum of fraction 3
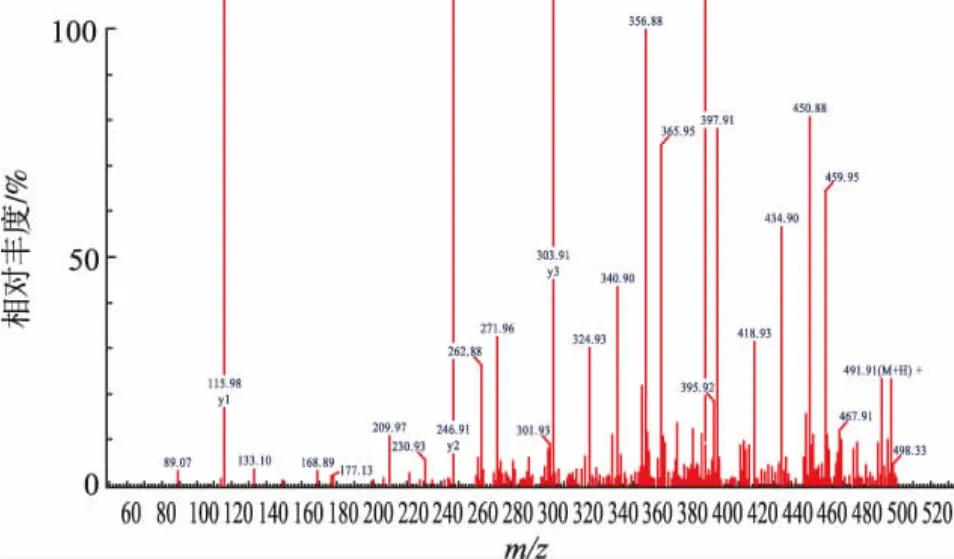
图3 肽段的二级质谱图Fig.3 MS spectrum of amino acid sequence of peptide
3 结语
作者以乌鸡为原料,以氯化亚铁为铁源制备出乌鸡低聚肽铁,其总蛋白质质量分数为 (56.79±0.18)%,螯合率为(83.53±0.15)%,得率为(40.86±0.14)%。利用RP-HPLC对其进行分离纯化,收集4个主要的组分峰,利用Q-TOF质谱仪进行结构测定,从组分3中鉴定出一个肽段,氨基酸序列为Thr-Ser-Gly-Met-Pro,相对分子质量为491.56。作者究明确了乌鸡低聚肽铁的肽段结构,为生物补铁制剂的开发利用提供了一定的理论支持,同时拓宽了乌鸡的应用领域。
[1]LIU J H,TIAN Y G,WANG Y ,et al.Characterization and in vitro antioxidant of papain hydrolysate from black-bone silky fowl(Gallus gallusdomesticusBrisson) muscle and its fractions[J].Food Res Int,2011,44:133-138.
[2]TIAN Y G,XIE M Y,WANG W Y,et al.Determination ofcarnosine in Black-Bone Silky Fowl (Gallus gallusdomesticus Brisson) and commonchicken by HPLC[J].Eur Food Res Technol,2007,226:311-314.
[3]LIN Lin,TIAN Yinggang,XIE Mingyong,et al.Research on antioxidant activity in vitro and molecular weight distribution of Black-bone silky fowl bioactive peptides[J].Food Science,2007,28(10):41-45.(in Chinese)
[4]TIAN Yinggang,XIE Mingyong,WU Hongjing,et al.Effects of hexane extract from Black-bone silky fowl on hematopoiesis[J].Pharmacology and Clinics of Chinese Materia Medica,2007,23(1):48-50.(in Chinese)
[5]SUN Ning,WANG Zhigeng,MEI Lin,et al.Experiment on the effects of hydrolysedcasein bound iron in ironsupplementation on rats[J].Journal of Food Science and Biotechnology,2013,32(3):330-335.(in Chinese)
[6]LIU Yong,YE Xian,WEI Shoulian.Optimization of the preparation process for iron chelate of Tilapia scale collagen peptide[J].Fine Chemicals,2013,30(7):761-765.(in Chinese)
[7]ZHENG Jiong,WANG Xuerong,KAN Jianquan.Studyon preparation ofhaemoglobin polypeptide-ironanditsanti-anaemiafunction[J].Science and Technology of Food Industry,2009,30(10):312-314.(in Chinese)
[8]LV Y,LIU Q,BAO X,et al.Identification and characteristics of ironchelatingpeptides from soybean protein hydrolysates using IMAC-Fe3+[J].J Agr Food Chem,2009,57(11):4593-4597.
[9]TORRES-FUENTES C,ALAIZ M,VIOQUE J. Iron-chelating activity ofchickpea protein hydrolysate peptides[J].Food Chem,2012,134(3):1585-1588.
[10]HUANG G,REN Z,JIANG J.Separation of iron-binding peptides fromshrimp processing by-products hydrolysates[J].Food Bioprocess Tech,2011,4(8):1527-1532.
[11]SUN Ning,WANG Zhigeng,MEI Lin,et al.Experiment on the effects of hydrol Ysed casein bound iron in iron supplementation on rats[J].Journal of Food Science and Biotechnology,2013,32(3):330-335.(in Chinese)
[12]LIU Wenying,LU Jun,GU Ruizeng,et al.Stability of iron-chelating Bback-bone silky fowl oligopeptides[J].Food and Fermentation Industries,2014,40(10):124-128.(in Chinese)
[13]SONG Shasha,GAO Fei,REN Difeng,et al.Preparation and infrared spectrum identification of black-bonesilky fowl oligopeptide-iron (Ⅱ) chelates[J].Food and Fermentation Industries,2013,39(6):13-17.(in Chinese)
[14]LIU Wenying,GU Ruizeng,LU Jun,et al.Preparation and stability of black-bone silky fowl oligopeptides[J].Food Science and Technology,2014,39(12):157-160.(in Chinese)
[15]LIU Wenying,MA Rongqing,JIN Zhentao,et al.Antioxidant activities in vitro of black-bone silky fowl oligopeptides[J].Food and Fermentation Industries,2010,36(10):19-23.(in Chinese)
[16]国家卫生部.食品中蛋白质的测定:GB/T5009.5-2003[S].北京:中国标准出版社,2003.
[17]LIU Wenying,GU Ruizeng,LIN Feng,et al.Study on separation and purification of marine collagen oligopeptidesand their antioxidant properties[J].Science and Technology of Food Industry,2012,33(18):131-134.(in Chinese)
[18]GU R Z,LIU W Y,LIN F,et al.Antioxidant and angiotensin I-converting enzyme inhibitory properties of oligopeptides derived from black-bone silky fowl(Gallus gallusdomesticusBrisson)muscle[J].Food Res Int,2012,49(1):326-333.
[19]GU R Z,LI C Y,LIU W Y,et al.Angiotensin I-converting enzyme inhibitory activity of low-molecular-weight peptides from Atlantic salmon (Salmo salar L.) skin[J].Food Res Int,2011,44(5):1536-1540.
[20]LIU W Y,LU J,GAO F,et al.Preparation,characterization and identification of calcium-chelating Atlantic salmon (Salmo salar L.) ossein oligopeptides[J].EurFood Res Technol,2015,DOI:10.1007/s00217-015-2510-2
[21]慕现敏.鱼鳞钙离子结合活性肽的分离纯化及其生理活性研究[D].青岛:中国海洋大学,2013.
[22]NIU Rui,YU Jiansheng.Antioxidant activity and purification of pollockpeptides[J].Journal of Food Science and Biotechnology,2010,29(4):562-566.(in Chinese)
[23]ZHANG Q X,WU H,LING Y F.Isolation and identification of antioxidant peptides derived from whey protein enzymatic hydrolysate by consecutive chromatography and Q-TOF MS[J].J Dairy Res,2013,80(3):367-373.
[24]CHALKLEY R J,BURLINGAME A L.Identification of GlcNAcylation sites of peptides and alpha-crystallin using Q-TOF mass spectrometry[J].J Am Soc Mass Spectrom,2001,12(10):1106-1113.
[25]林慧敏.带鱼下脚料酶解小肽亚铁螯合物结构鉴定及其生物活性研究[D].福州:福建农林大学,2012.
[26]TORRES-FUENTES C,ALAIZ M,VIOQUE J.Iron-chelating activity of chickpea protein hydrolysate peptides[J].Food Chem,2012,134:1585-1588.
Separation,Purification and Structural Identification of Iron-Chelating Black-Bone Silky Fowl Oligopeptides
LIU Wenying,GU Ruizeng,CAI Muyi,LU Jun*
(Beijing Engineering Research Center of Protein and Functional Peptides,China National Research Institute of Food and Fermentation Industries,Beijing 100015,China)
In order to investigate the structure of peptides fromiron-chelating black-bone silky fowloligopeptides(BSFP-Fe),BSFP-Fe wasprepared by using black-bone silky fowl as raw material andiron chloride as iron resource.The total protein content,chelating rate and yield were determined.Results showed that the total protein content,chelating rate and yield were 56.79±0.18%,83.53±0.15%and 40.86±0.14%,respectively.Then,BSFP-Fe was separated and purified by reversed phase high performance liquid chromatography (RP-HPLC).A total of4 fractions were collected and subjected to Q-TOF mass spectrometer to identify peptide sequences.One peptide,Thr-Ser-Gly-Met-Pro,was identified and its molecular weight was 491.56 u.This studyconfirmed the structure of peptides from BSFP-Feand provided certain theoretical support for the development of BSFP-Fe as iron supplement food.
black-bone silky fowloligopeptides,iron-chelating peptides,separation and purification,structural identification
TS 201.4
A
1673—1689(2017)10—1036—04
2015-09-15
国家863计划项目 (2013AA102205-02);国家 “十二五”科技支撑项目 (2012BAD33B04-02);北京市科技计划项目(Z131100003113010);科技北京百名领军人才培养工程项目(Z131110000513026)。
刘文颖(1984—),女,河北保定人,工学硕士,工程师,主要从事食源性低聚肽研究。E-mail:wenyingliu888@126.com
*通信作者:鲁 军(1973—),男,安徽六安人,理学博士,高级工程师,主要从事食品营养与生物技术研究。E-mail:johnljsmith@163.com
刘文颖,谷瑞增,蔡木易,等.乌鸡低聚肽铁的分离纯化及结构鉴定[J].食品与生物技术学报,2017,36(10):1036-1039.

