花生种质资源耐低温表型鉴定方法研究
刘海龙,陈小姝,杨富军,白冬梅,孙晓苹, 吕永超,任小平,姜慧芳*,高华援*
(1.吉林省农业科学院花生研究所,吉林 公主岭 136100; 2.山西省农业科学院经济作物研究所,山西 汾阳 032200; 3.中国农业科学院油料作物研究所,湖北 武汉 430062)
花生种质资源耐低温表型鉴定方法研究
刘海龙1,3,陈小姝1,杨富军1,白冬梅2,孙晓苹1, 吕永超1,任小平3,姜慧芳3*,高华援1*
(1.吉林省农业科学院花生研究所,吉林 公主岭 136100; 2.山西省农业科学院经济作物研究所,山西 汾阳 032200; 3.中国农业科学院油料作物研究所,湖北 武汉 430062)
本研究目的是构建既可鉴定花生种质资源耐低温属性,又可进行耐低温性数量性状分析的表型鉴定方法。本方法构建公式相对发芽率=xi/yi×100%,花生耐低温性属性分级标准鉴定花生耐低温属性,及利用相对发芽率数据进行耐低温数量性状分析。利用此方法对94份花生种质资源进行鉴定,鉴定出相对发芽率≥85% 耐低温型(R)6个,约占检测资源的6.38%,分别为山花8(A1)、豫花1(A38)、开农30(A10)、白沙1016(A37)、油4(A32)和泉花646(A42),从94份花生资源中选取20份材料进行田间耐低温验证,其结果与本研究构建的方法结果一致,证明花生种质资源耐低温表型方法可以鉴定花生种质资源耐低温属性;利用此方法鉴定出徐花13×中花6重组自交系群体(RIL)各家系及亲本,分析耐低温性主基因+多基因遗传模型,符合模型G-1,主基因的遗传率为91.21%,多基因的遗传率为8.34%,证明此方法可应用在耐低温性数量性状分析上。
花生;耐低温;表型;相对发芽率
花生(ArachishypogaeaL.)起源于南美洲的热带亚热带地区,栽培花生是豆科(Leguminosae)花生属(Arachis)花生区组(Arachissection)的一种,是世界范围内重要的油料和经济作物之一[1]。
花生在我国南北方都有种植,近年在东北等高纬度地区花生种植面积发展迅速,同时低温对我国高纬度花生单产影响非常严重,开花期遇到低于22℃的低温,花生不授粉,有壳无仁,造成大面积减产,开花期低温在吉林省每隔3~4年就会发生1次,减产幅度一般为30%~40%;播种期遇寒流即发生大面积低温烂种,出苗不齐或不出苗,导致严重减产;收获期遭遇低温(4℃),会使种子死亡,脱水困难,霉果率高,严重影响花生销售价格,还会给来年的花生生产造成潜在的危害。
低温是我国高纬度花生产区主要非生物胁迫之一,选育耐低温品种是理想途径。而花生耐低温种质表型鉴定是选育耐低温花生品种的前提,现阶段我国对花生耐低温表型鉴定的研究报道较少[2-3],为了加快我国花生耐低温品种的选育,有必要构建一个行之有效的花生耐低温表型鉴定方法。
1 材料与方法
1.1 试验方法
1.1.1 种子的准备
参试材料94份(由中国农业科学院油料作物研究所提供,见表1),选择饱满活力正常的种子,每个品种各180粒,平均分为6份,每份30粒,将试验所用的种子取出置于室温下。
1.1.2 种子发芽
种子处理方法主要利用冷浸处理的方法,进行低温吸胀发芽试验。冷浸温度为2℃,每份(30粒)种子做3次重复,浸种48h后,放置25℃下发芽。同时正常发芽每份(30粒)种子做3次重复,作为矫正参数。分别在72、96、120h采集发芽数。
准备的种子,酒精消毒,放置在小烧杯中,蒸馏水冲洗掉酒精,置于预冷2℃灭菌的蒸馏水浸泡48h。灭菌的培养皿底部放置滤纸,加2℃灭菌的蒸馏水,将浸泡48h种子无菌的状态下放置在直径为9cm 的干净灭菌的培养皿中,25℃电脑恒温层析柜中发芽。
1.2 相对发芽率计算
相对发芽率公式:RGRi=xi/yi×100%
RGRi为第i个试验材料相对发芽率,xi为第i个试验材料在2℃浸泡48h后置于层析柜中25℃发芽得到的发芽率,yi为第i个试验材料按照常规发芽方法的发芽率(矫正参数)。
xi=mi/ai×100%yi=si/bi×100%
mi为第i个试验材料在2℃浸泡48h后置于层析柜中25℃发芽数,ai为第i个试验材料花生仁数;yi为第i个试验材料按照常规发芽方法的发芽数(矫正参数),bi为第i个按照常规发芽方法试验材料花生仁数。 约束条件:ai=bi
1.3 花生耐低温性属性分级标准
相对发芽率≥85%,耐低温型(R);50%≤相对发芽率<85%,中间型(M);相对发芽率<50%,敏感型(S)。
1.4 田间验证方法
采用王晶珊等[3]田间鉴定花生耐低温性方法,略有改动。2014-05-05(3d地温稳定在9℃时),选取室内鉴定的20份试验材料,分别为白沙1016(A37)、中花5(54)、开农30(A10)、山花8(A1)、鄂花4(A11)、油4(A42)、泉花646(A32)、豫花1(A38)、黔花生2号(A24)、福花3(A43)、山花9(A2)、油7(A31)、桂花17(A20)、CS16(A70)、H4145(A77)、粤油92(A13)、桂花66(A19)、冀油6(A9)、冀花6(A29)、09测S8(A93),采用随机区组试验,3次重复,行长5.0m,垄宽0.6m,4行区,每穴单粒播种,播种后5d,调查花生出苗数。
公式: EA(出苗能力)=出苗率×100/从播种到第i天出苗的相应天数
1.5 遗传模型分析
试验材料为徐花13(敏感型,三次重复平均相对发芽率=38.20%)×中花6(中间型,三次重复平均相对发芽率=74.50%),包含188个家系的RIL群体(F7),亲本及群体材料采用花生耐低温表型鉴定方法,三次重复。遗传模型分析采用盖钧镒等提出的植物数量性状遗传模型主基因+多基因多世代联合分析方法[4-6],对亲本徐花13(P1)、中花6(P2)和RIL群体的耐低温性状进行遗传分析。通过迭代ECM算法估计各世代、各成分分布参数,然后通过模型的极大对数似然函数值MLV和AIC值,利用AIC准则选择备选的相对最佳模型,即AIC值最小的模型作为最优模型。同时进行适合性检验,选择统计量达到显著水平个数最少的模型为最优 遗传模型,并由此估计出相应的主基因与多基因效应值、方差及有关遗传参数。
2 结果与分析
2.1 花生耐低温性属性鉴定结果与分析
从表1可以看出,根据花生耐低温性属性分级标准,相对发芽率<50% 敏感型(S)共有75个资源,约占检测资源的78.72%;50%≤相对发芽率<85% 中间型(M)有14个资源,分别为山花10(A3)、鄂花4(A11)、桂花66(A19)、黔花生2号(A24)、黔花生4号(A25)、油7(A31)、泉花10(A41)、福花3(A43)、福花4(A46)、福花8(A47)、中花8(A55) 、H4145(A77)、09测S8(A93)、中花5(A54),约占检测资源的15.56%;相对发芽率≥85% 耐低温型(R)有6个资源,约占检测资源的6.38%,分别为:山花8(A1)、豫花1(A38)、开农30(A10)、白沙1016(A37)、油4(A32)、泉花646(A42)。花生耐低温资源在花生种质资源比例约为6.38%,占整个资源的比例较小,但耐低温性资源确实存在,同时说明利用花生耐低温表型鉴定方法可以明确划分花生耐低温资源。
2.2 耐低温属性鉴定结果田间验证
表2可见,田间鉴定的耐低温型种质资源有8个种质属于耐低温型,分别为白沙1016、中花5、开农30、山花8、鄂花4、油4、泉花646、豫花1。利用相对发芽率指标鉴定的耐低温型种质资源有6个,分别为山花8、豫花1、开农30、白沙1016、油4、泉花646。田间鉴定的耐低温型比利用相对发芽率指标鉴定出的耐低温型多出2个种质资源,分别为中花5和鄂花4,其他田间检测与利用相对发芽率检测结果一致,说明花生种质资源耐低温表型方法可以鉴定花生种质资源耐低温属性。
但田间鉴定的耐低温种质资源与利用相对发芽率鉴定出的耐低温种质资源排序并非完全一致,田间鉴定排位第一的耐低温型种质资源白沙1016在利用相对发芽率指标鉴定的排序中为第四位,田间鉴定出的中花5为耐低温型,且排在第二位,在利用相对发芽指标中并没鉴定出中花5为耐低温型,而是中间型,说明田间鉴定花生的耐低温性受环境影响较大,有不确定的因素影响花生耐低温表型鉴定。田间鉴定中间型有10个,而利用相对发芽率指标鉴定中间型为6个,田间鉴定的结果明显过于宽松,利用相对发芽率数据确定花生耐低温性更为严谨(表2)。
2.3 花生耐低温表型鉴定方法在耐低温数量性状分析上的应用
花生耐低温性是数量性状,仅仅对于耐低温属性描述不能满足花生育种需要,因此构建花生耐低温表型鉴定方法时,需充分考虑其不同用途。下面用此方法鉴定RIL群体各家系,分析花生耐低温性遗传模型。
选取AIC值最小及与之较接近的模型F-1、G-1、G-3作为备选最适模型,AIC值分比为1763.14、1754.27、1795.87。针对耐低温性的3个备选遗传模型进行3个基本世代的适合性检验,选择统计量达到显著水平个数最少的遗传模型作为最优模型开展分析,最终确定模型G-1即3对主基因的多基因加性上位性遗传模型为花生耐低温性遗传模型[7-14]。
一阶参数与一阶参数的关系通过最小二乘法进行估计;二阶参数利用文献[15]的方法估计σmg2,主基因遗传率:hmg2(%)=σmg2/σp2,多基因遗传率:hpg2(%)=σpg2/σp2。其中σp2为群体表型方差,σmg2为主基因遗传方差,σpg2为多基因遗传方差,σe2为多环境遗传方差。各遗传方差间的关系可表示为σp2=σmg2+σpg2+σe2。
表3可知,花生耐低温遗传表现为主基因与多基因加性效应。主基因的遗传率达到了91.21%,多基因的遗传表达率为8.34%。通过花生耐低温鉴定方法对徐花13×中花6重组自交系群体及亲本耐低温鉴定,利用相对发芽率数据,进行花生耐低温性遗传模型分析,得到花生耐低温性遗传模型为G-1,即3对主基因的多基因加性上位性遗传模型为花生耐低温性遗传模型,主基因的遗传率达到了91.21%,多基因的遗传率为8.34%,说明花生耐低温表型鉴定方法可以在花生耐低温遗传模型分析中应用。
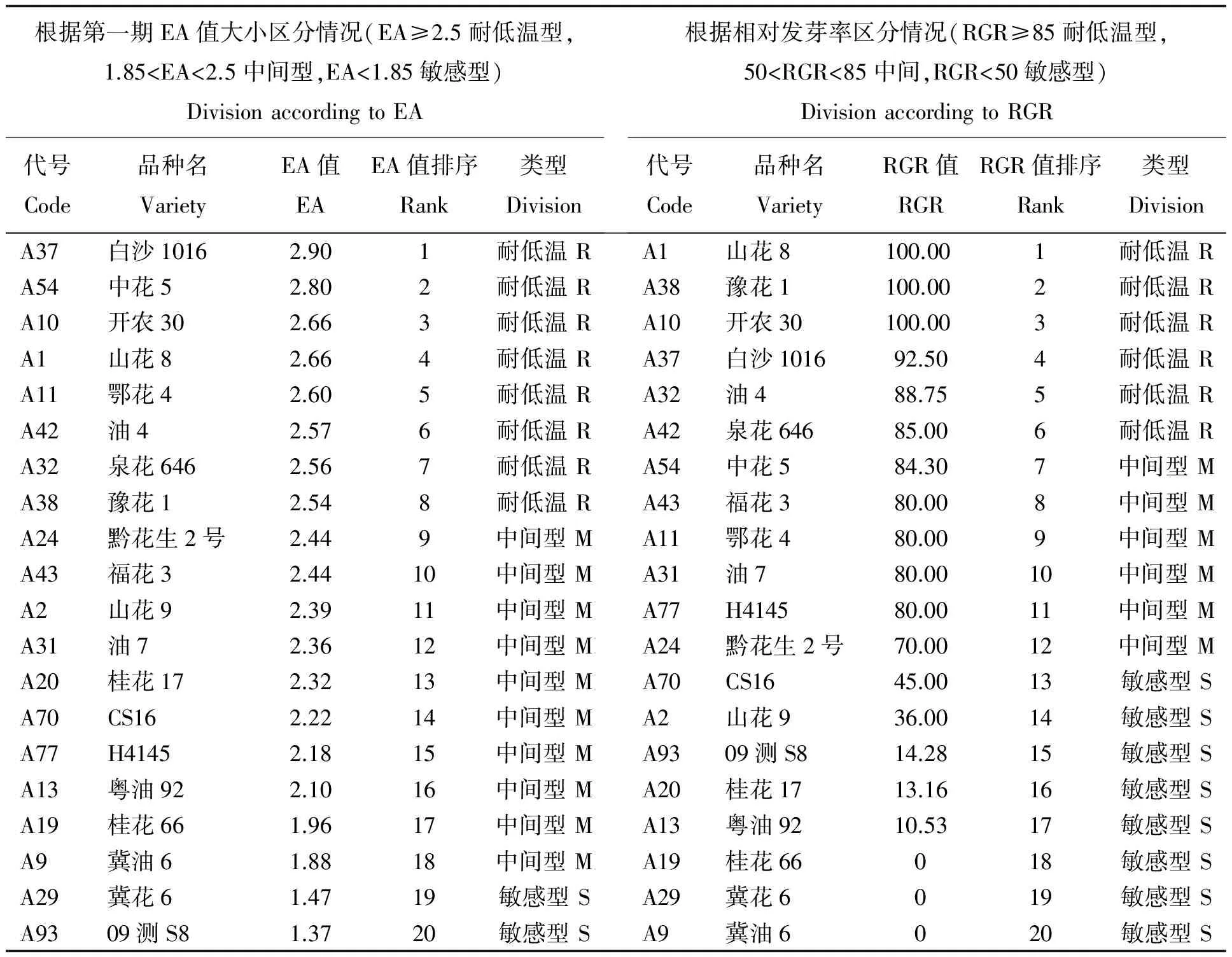
表2 根据EA、RGR值入选情况
注:EA,出苗能力;RGR:相对发芽率。
Note: EA: emergence ability; RGR: relative germination rate.
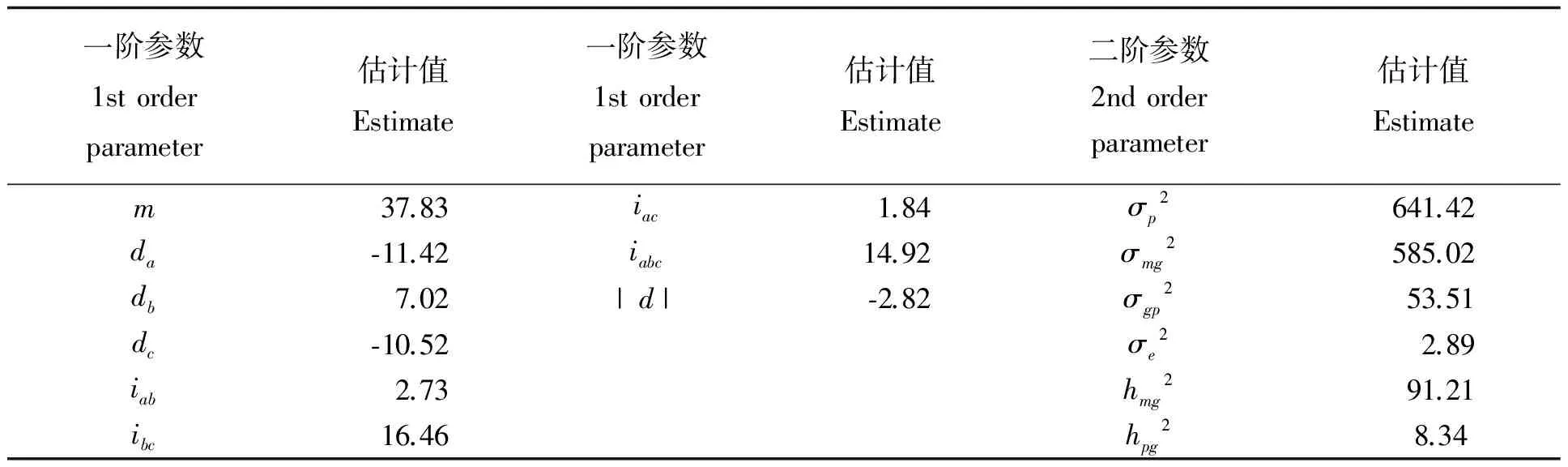
表3 遗传参数估算
3 讨 论
花生耐低温性表型鉴定方法的构建,主要考虑以下两方面:① 试验仪器对试验材料的影响,本试验采用电脑层析柜,此实验仪器温度变动幅度为±0.5℃,试验环境对于本试验的影响可以忽略,因此重复性好;② 参试材料种子发芽率情况,必须矫正低温胁迫下的发芽率,因此在建立相对发芽率公式时,引进yi这个矫正参数。
花生耐低温表型鉴定方法是对封海胜(1991)表型鉴定方法的改进,此方法相较少了6℃冷水浸泡胁迫处理,仅利用2℃胁迫,可以减少耐低温表型鉴定的工作量。封海胜报道冷浸时间对发芽率的影响很明显。2℃冷浸24h,在适温下发芽72h,伏花生发芽种子中有10.6%刚刚“露白”,83.0%胚根伸长不到1cm,6.4%胚根伸长1~2cm;冷浸48h,发芽种子刚刚“露白”的增至64.7%,伸长不到1cm的占35.3%,1cm以上的一粒没有。本方法在冷水浸泡的时间设置为48h,主要从两方面考虑:第一,水在温度较低的情况下,被种子吸收速度是下降的;第二,过长的冷水浸泡不仅仅温度对花生种子有胁迫作用,同时水中含氧量低,长时间浸泡会造成种子缺氧,降低发芽率。
王晶珊等[3]利用田间鉴定,使用播种到出苗积温多少,鉴定花生耐低温性,此方法过于繁琐,本文对从播种到出苗积温多少改为出苗能力(EA)指标,与王晶珊田间鉴定方法意义相同。通过本文的田间验证结果表明,田间鉴定环境影响大,同时花生耐低温性的鉴定有向于宽松的方向指引。所以,本文构建的花生耐低温表型鉴定方法未采用田间鉴定法。
花生耐低温表型鉴定方法,通过构建相对发芽率公式RGRi=xi/yi×100%,及花生耐低温性属性分级标准,能够鉴定花生耐低温属性;利用相对发芽率数据,能够进行耐低温数量性状分析。
[1] 廖伯寿. 我国花生科研与产业发展现状及对策[J]. 中国农业信息, 2008(5):18-20.
[2] 封海胜. 花生种子吸胀期间对低温性鉴定[J]. 中国油料,1991(1):67-70.
[3] 王晶珊,封海胜,案文玻. 低温对花生出苗的影响及耐低温种质的筛选[J]. 中国油料,1985(3):27-32.
[4] 盖钧镒. 植物数量性状遗传体系的分离分析方法研究[J]. 遗传,2005,27(1):130-136.
[5] 盖钧镒,章元明,王建康. 植物数量性状遗传体系[M]. 北京:科学出版社,2003.
[6] 盖钧镒,章元明,王建康. QTL混合模型扩展至两对主基因+多基因时的多世代联合分析[J]. 作物学报,2000,26(4):385-391.
[7] 王金社,李海旺,赵团结,等. 重组自交系群体4对主基因加多基因混合遗传模型分离分析方法的建立[J]. 作物学报,2010,36(2):191-201.
[8] 朱军. 遗传学[M]. 3版. 北京:中国农业出版社,2004.
[9] 陈四龙,李玉荣,程增书,等. 花生含油量杂种优势表现及主基因+多基因遗传效应分析[J]. 中国农业科学,2009,42(9):3048-3057.
[10] 章元明、盖钧镒、王永军. 利用P1P2和DH或RIL群体联合分离分析的拓展[J]. 遗传,2001,23(5):467-470.
[11] 刘华,秦利,张新友,等. 基于花生种间杂交遗传群体的脂肪及脂肪酸含量的遗传模型分析[J]. 中国油料作物学报,2016,38(2):172-178.
[12] 闫世江,司龙亭,马志国,等. 黄瓜苗期低温弱光下生长速度主基因—多基因联合遗传分析[J]. 中国农业科学,2010,43(24):5073-5078.
[13] 胡国玉,赵晋铭,周斌,等. 大豆耐低温出苗的遗传分析与分子标记[J]. 大豆科学,2008, 27(6):905-910.
[14] 申时全,普晓英,杜娟,等. 粳稻孕穗期耐冷性的主基因加多基因遗传分析[J]. 西南农业学报,2006,19(s1):17-21.
[15] 章元明,盖钧镒. 利用DH或RIL群体检测QTL体系并估计其遗传效应[J]. 遗传学报,2000,24(7):634-640.
ResearchofIdentificationMethodonLowTemperatureResistanceofPeanutGermplasmResourcesPhenotype
LIU Hai-long1,3, CHEN Xiao-shu1, YANG Fu-jun1, BAI Dong-mei2, SUN Xiao-ping1, LÜ Yong-chao1, REN Xiao-ping3, JIANG Hui-fang3*, GAO Hua-yuan1*
(1.PeanutResearchInstitute,JilinAcademyofAgriculturalSciences,Gongzhuling136100,China; 2.EconomicPlantResearchInstitute,ShanxiAcademyofAgriculturalSciences,Fenyang032200,China; 3.KeyLab.ofBiologyandGeneticImprovementofOilCrops,MinistryofAgriculture,Wuhan430062,China)
This study was to construct an identification method which can simultaneously identify low temperature tolerance characteristic of peanut germplasm resources and analyze low temperature resistance quantitative traits. The formula adopted as RGRi (relative germination rate) =xi/yi×100%. 94 peanut germplasm resources were identified with RGB as: 6 germplasm resources, Shanhua8 (A1), Yuhua1 (A38), Kainong30 (A10), Baisha1016 (A37), You4 (A32) and Quanhua646 (A42), were low temperature resistance based on the RGB ≥85%. 20 germplasm resources selected from 94 were verified in field, which showed that the results were consistent with the result through the identification method. RIL and parents were identified with this method. Through analysis of low temperature resistant major gene and polygene genetic model, the results showed that the peanut low temperature resistance characteristic was accordant with model G-1, and the major gene heritability was 91.21%, polygene heritability was 8.34%. This method could be applied to analyze the low temperature resistance quantitative characteristic of peanut.
peanut; low temperature resistance; phenotype; relative germination rate
10.14001/j.issn.1002-4093.2017.03.004
S565.2024; S332.1
A
2017-03-31
农业部油料作物生物学与遗传育种重点实验室开放课题基金(2014001);国家花生产业技术体系(CARS-14);吉林省农业科学院创新工程—花生创新团队(CXGC2017TD013);吉林省农业科技创新工程杰出青年项目(CXGC2017JQ005);中国农业科技东北创新中心/博士后研究项目;农业部948项目(2015-Z55)
刘海龙(1976-),男,吉林公主岭人,吉林省农业科学院花生研究所副研究员,硕士,主要从事花生遗传育种方面研究。
*通讯作者:姜慧芳,研究员,主要从事花生种质资源研究。Tel: 027-86711550;E-mail: peanut@oilcrops.com 髙华援,研究员,主要从事花生遗传育种研究。Tel: 0434-6283378;E-mail:ghy64143@163.com

