花生AhGPAT9与AhLPAAT4基因的原核表达及Western Blot分析
杨 珍,郝翠翠,2,李昊远,3,焦 坤,王 通,王 冕,陈 娜, 陈明娜,潘丽娟,姜焕焕,4,禹山林*,迟晓元*
(1.山东省花生研究所,山东 青岛 266100;2.青岛科技大学海洋科学与生物工程学院,山东 青岛 266042;3.哈尔滨工业大学(威海)海洋科学与技术学院,山东 威海 264209;4.哈尔滨工业大学市政环境工程学院,黑龙江 哈尔滨 150001)
花生AhGPAT9与AhLPAAT4基因的原核表达及Western Blot分析
杨 珍1,郝翠翠1,2,李昊远1,3,焦 坤1,王 通1,王 冕1,陈 娜1, 陈明娜1,潘丽娟1,姜焕焕1,4,禹山林1*,迟晓元1*
(1.山东省花生研究所,山东 青岛 266100;2.青岛科技大学海洋科学与生物工程学院,山东 青岛 266042;3.哈尔滨工业大学(威海)海洋科学与技术学院,山东 威海 264209;4.哈尔滨工业大学市政环境工程学院,黑龙江 哈尔滨 150001)
酰基转移酶基因家族是甘油三酯合成的关键基因。本研究以前期克隆的AhGPAT9与AhLPAAT4基因部分序列设计引物,构建原核表达载体,转化进大肠杆菌BL21,经IPTG诱导表达,利用SDS-PAGE检测表明,重组蛋白在37℃,5h诱导条件下获得高效表达。重组蛋白经纯化和富集,对新西兰兔进行4次免疫,纯化获得的多克隆抗血清,通过间接ELISA检测,表明获得了效价比较高的多克隆抗体。通过对重组蛋白纯化后样品进行Western Blot分析,结果显示在纯化样品相应位置有明显信号,表明所制备的抗体具有很高灵敏度和特异性。并采用制备的抗体对AhGPAT9与AhLPAAT4蛋白在花生不同组织及种子不同发育时期的表达进行了Western Blot分析。为深入研究AhGPAT9与AhLPAAT4基因的功能提供了科学数据。
花生;AhGPAT9;AhLPAAT4;原核表达;多克隆抗体;蛋白质免疫印记法
植物油脂作为植物细胞内的关键组分,对植物的生长、发育和繁衍过程具有重要意义,同时作为一种可再生的生物能源产品,得到了广泛的关注和应用[1-2]。植物油主要来源于植物种子中储存的的油脂,而油脂主要以三酰甘油(Triacylglycerol,TAG)的形式储存。植物体内TAG的生物合成(或装配)主要通过Kennedy Pathway途径(KP)实现[1]。TAG合成的主要过程是:由甘油-3-磷酸(G-3-P)生成溶血性磷脂酸(LPA),再生成磷脂酸(PA),然后生成二酰甘油(DAG),最后生成TAG。该生物合成过程中的三次酯化反应分别由甘油-3-磷酸酰基转移酶(Glycerol-3-phosphate acyltransferase,GPAT)、溶血磷脂酸酰基转移酶[3](Lysophosphatidic acid acyltransferase,LPAAT)和二酰甘油酰基转移酶(Diacylglycerol acyltransferase,DGAT)催化完成[4]。
在本实验室前期研究中,已经克隆得到了AhGPAT9[5]与AhLPAAT4[6-7]基因并进行了初步功能分析。本研究分别构建了这2个基因的原核表达载体,并诱导重组蛋白表达,获得了理想浓度的蛋白。制备了多克隆抗体,采用蛋白质免疫印迹(Western Blot)方法定量确定了目标蛋白在花生不同组织和种子发育不同时期的表达情况。为AhGPAT9与AhLPAAT4基因在蛋白质水平上的研究提供了新的科学数据,为进一步了解AhGPAT9与AhLPAAT4蛋白功能奠定了理论基础。
1 材料与方法
1.1 材 料
选用花生材料为花育33,由山东省花生研究所提供。种子萌发后,移入实验室专用土壤中,置于光照培养箱中培养。待花生生长至三叶期时,取其根、茎、叶、子叶和下胚轴,-80℃冻存备用。在花生开花下针后,分别采集其下针后12、24、36、48和60d的种子,-80℃冻存备用。
载体pET-28b购自Novagen公司,T4 DNA连接酶、NdeI和XhoI内切酶购自宝生物有限公司(大连),E.coliDH5a和E.coliBL21感受态购自天根生化科技有限公司,质粒提取试剂盒与胶回收试剂盒购自OMEGA有限公司,弗氏完全佐剂与弗氏不完全佐剂均购自Sigma,辣根酶标记山羊抗兔IgG(H+L)和蛋白提取试剂盒购自生工生物工程(上海)股份有限公司。其他试剂均为国产分析纯。
1.2 AhGPAT9与AhLPAAT4基因原核表达载体的构建
根据本实验室已克隆报道过的AhGPAT9基因(登录号:KC160499)和AhLPAAT4基因(登录号:JX843441)部分序列,设计特异性引物,在5'端引物加入NdeI酶切位点,在3'端加入XhoI酶切位点。分别将获得的AhGPAT9基因和AhLPAAT4基因目的片段PCR产物纯化后用NdeI和XhoI双酶切,同时也将大肠杆菌pET-28b质粒用Nde I和Xho I双酶切,酶切产物用T4 DNA连接酶16℃连接过夜,后将连接产物转入大肠杆菌E.coliDH5a感受态细胞,在LB平板(含卡那霉素)上挑取阳性克隆单菌落,提取质粒,通过PCR、双酶切筛选阳性克隆,并对阳性克隆测序验证,将成功的重组质粒分别命名为pET-28b-AhGPAT9和pET-28b-AhLPAAT4。
1.3 转 化
取1L重组的pET-28b质粒转化E.coliBL21(DE3)感受态细胞,42℃热击90s,冰上静置2min后涂平板(LB,含卡那霉素),37℃过夜培养。
1.4 AhGPAT9和AhLPAAT4重组蛋白的诱导表达及SDS-PAGE分析
挑取表达菌株的单菌落于含卡那霉素的4mL LB液体培养基中,37℃,220r/min过夜培养。将培养的菌液按1:100比例分别接种于含卡那霉素的4mL LB液体培养基中,37℃,220r/min培养。当OD值达到0.6左右时,添加终浓度为0.5mmol/L的IPTG诱导剂。为探索蛋白最佳诱导条件,设对比试验,分为三组:一组220r/min,20℃诱导过夜;二组220r/min,37℃诱导5h;三组为阴性对照,不加IPTG诱导剂。诱导全部结束后,离心收集菌体后用1×PBS缓冲液悬浮。使用5%浓缩胶、12%分离胶进行SDS-PAGE电泳检测,分析蛋白表达情况,选择最佳的蛋白表达诱导条件。然后在最佳诱导条件下,按照上述方法大量诱导表达重组蛋白,并离心收集细胞菌体。
1.5 AhGPAT9和AhLPAAT4重组蛋白的纯化及SDS-PAGE分析
1.5.1 超声破碎菌体
将收集的菌体用破碎Buffer溶解,在冰浴中超声破碎菌体20min(超声2s,暂停6s,依次循环),功率400W。超声完毕后,4℃,12000r/min,离心20min,取上清做下一步纯化。
1.5.2 镍琼脂糖亲和层析
(1)取5mL Ni-NTA,用10倍柱床体积的Binding buffer清洗平衡柱子,流速为5mL/min。将平衡好的柱料与上清混匀,4℃孵育0.5h。(2)上柱,流速为2mL/min,收集穿透液。(3)10倍柱床体积的Binding buffer清洗柱子,流速为10mL/min。(4)Wash Buffer洗杂,流速为5mL/min,收集洗脱液。(5)Elution Buffer洗脱,流速为2mL/min,收集洗脱液。(6)纯化后的蛋白置于透析buffer中,4℃透析过夜,过滤分装,-80℃保存。将透析后的样品进行SDS-PAGE分析,电泳条件同1.4。
纯化试验用的Buffer配制如下:破碎Buffer:7mol/L盐酸胍,50mmol/L Tris,300mmol/L NaCl,0.1%Triton X-100,1mmol/L DTT,pH=8.0。Binding buffer:8mol/L尿素,50mmol/L Tris,300mmol/L NaCl,0.1%Triton X-100,1mmol/L DTT,pH=8.0。Wash Buffer:8mol/L尿素,50mmol/L Tris,300mmol/L NaCl,10/20/50mmol/L咪唑,pH=8.0。 Elution Buffer:8mol/L尿素,50mmol/L Tris,300mmol/L NaCl,500mmol/L 咪唑,pH=8.0。透析buffer:1×PBS,1mmol/L DTT,0.1%SKL,pH=7.4。
1.6 重组蛋白浓度测定与Western Blot分析
采用SK3071非干扰型蛋白浓度测定试剂盒测定蛋白浓度,按照Western Blot步骤用TMB显色试剂盒显色,将纯化后的蛋白进行Western Blot分析。
1.7 蛋白抗原制备多克隆抗体
选用4月龄2.1kg的健康雌性新西兰大白兔,分别在1d、21d、35d和49d进行初免、二免、三免和四免。初免抗原为蛋白抗原与等体积弗氏完全佐剂混匀乳化,二免、三免、四免抗原为蛋白抗原与等体积弗氏不完全佐剂混匀乳化。初免所用剂量为0.3mg/只,二免、三免、四免剂量为0.15mg/只。并在三免和四免结束后的第7天进行耳静脉采血,酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)检测抗血清效价;57d时,ELISA检测抗血清效价达到要求,然后颈动脉采全血。终放后纯化抗体,再进行ELISA检测纯化抗体效价。间接ELISA检测过程中用到的一抗是将兔子的血清分别按照1:1000稀释,37℃ 孵育1h;二抗是辣根酶标记山羊抗兔IgG(H+L),按照 1:8000稀释,37℃孵育45min。
1.8 基因在花生不同组织和种子不同发育时期的Western Blot分析
采用蛋白提取试剂盒,提取花育33的根、茎、叶、子叶、下胚轴和5个不同发育时期的种子蛋白并进行SDS-PAGE分析,经电泳转膜、免疫反应完成Western Blot分析。
2 结果与分析
2.1 AhGPAT9和AhLPAAT4基因原核表达载体的构建
采用TMHMM 2.0 Server分析蛋白跨膜结构(图1),根据结果截取AhGPAT9蛋白N端的236个氨基酸(图2)和AhGPAT9蛋白中间的260个氨基酸(图3)进行原核表达研究。阳性克隆测序结果比对正确,表明原核表达载体pET-28b-AhGPAT9和pET-28b-AhLPAAT4构建成功。
2.2 重组蛋白的诱导表达
如图4(a)(b)所示,SDS-PAGE检测分析结果表明,在分子量25kD和35kD之间出现特异性目的条带,与生物信息学预测出的蛋白分子量基本一致。另外,在37℃ 5h诱导条件下的蛋白表达量高于20℃过夜的诱导条件。
2.3 重组蛋白的纯化
AhGPAT9和AhLPAAT4重组蛋白经过镍琼脂糖亲和层析法纯化后,在25kD和35kD之间位置出现明显单一条带(图5),表明AhGPAT9和AhLPAAT4重组蛋白均成功得到了纯化,为蛋白功能的进一步研究奠定了基础。
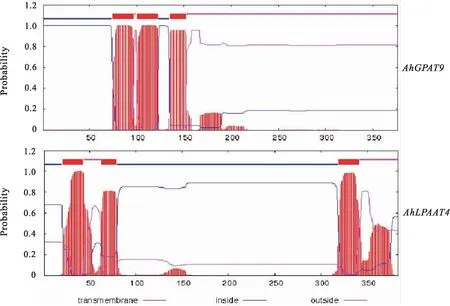
图1 AhGPAT9和AhLPAAT4基因的跨膜结构预测 Fig.1 Predicted transmembrane domain for AhGPAT9 and AhLPAAT4

图2 AhGPAT9原核表达蛋白序列的选择 Fig.2 The AhGPAT9 protein sequence used for prokaryotic expression注:划线的蛋白序列用于原核表达研究。下同。Note: The underlined protein sequences were used for prokaryotic expression. The same as below.

图3 AhLPAAT4原核表达蛋白序列的选择 Fig.3 The AhLPAAT4 protein sequence used for prokaryotic expression

图4 AhGPAT9(a)和AhLPAAT4(b)重组蛋白小试SDS-PAGE分析图 Fig.4 SDS-PAGE analysis of the recombinant AhGPAT9 (a) and AhLPAAT4(b) 注:M:蛋白Marker;1:诱导前全菌;2:20℃诱导全菌;3:37℃诱导全菌。Note: M: protein marker; 1: total proteins before induction; 2: induced total proteins at 20℃; 3: induced total proteins at 37℃.

图5 AhGPAT9(a)和AhLPAAT4(b)重组蛋白纯化的SDS-PAGE分析图 Fig.5 SDS-PAGE analysis of the purified recombinant AhGPAT9 (a) and AhLPAAT4 (b) 注:M:蛋白Marker;1:纯化的目的蛋白。Note: M: protein marker; 1: the purified target protein.
AhGPAT9重组蛋白浓度1.190393μg/μL,AhLPAAT4重组蛋白浓度1.1313945μg/μL。
2.4 多克隆抗体制备
AhGPAT9多克隆抗体制备结果如图6所示,三免后抗血清效价:A≥64k,B≥512k;四免后抗血清效价:A≥512k,B≥512k;终放后抗血清效价:A≥512k,B≥512k;终放后抗血清纯化抗体效价:A≥512k,B≥512k。
AhLPAAT4多克隆抗体制备结果如图7所示,三免后抗血清效价:A≥512k,B≥512k;四免后抗血清效价:A≥512k,B≥512k;终放后抗血清效价:A≥512k,B≥512k;终放后抗血清纯化抗体效价:A≥512k,B≥512k。证明血清里抗体浓度高,特异性强,可以用于后续的蛋白印迹实验。
2.5 AhGPAT9和AhLPAAT4重组蛋白Western Blot分析
对诱导纯化后的重组蛋白进行Western blot分析,结果显示纯化后样品在相应位置有明显信号,所获免疫血清与诱导表达后的目的蛋白专一结合显色(图8)。证明所获抗体确实是含AhGPAT9和AhLPAAT4基因的抗体。

图6 AhGPAT9多克隆抗体制备结果 Fig.6 Polyclonal antibody preparation of AhGPAT9 注:(a)三免后抗血清效价检测结果及酶标仪测出的数据,(b)四免后抗血清效价检测结果及酶标仪测出的数据,(c)终放后抗血清效价检测结果及酶标仪测出的数据,(d)终放后抗体效价检测结果及酶标仪测出的数据。Note: (a) The titer of the antiserum after the third immunization and the data measured by microplate reader. (b) The titer of the antiserum after the fourth immunization and the data measured by microplate reader. (c) The titer of the antiserum after the final blood letting and the data measured by microplate reader. (d) The result of antibody titer test and the data measured by microplate reader.

图7 AhLPAAT4多克隆抗体制备结果 Fig.7 Polyclonal antibody preparation of AhLPAAT4注:(a)三免后抗血清效价检测结果图及酶标仪测出的数据,(b)四免后抗血清效价检测结果图及酶标仪测出的数据,(c)终放后抗血清效价检测结果图及酶标仪测出的数据,(d)终放后抗体效价检测结果及酶标仪测出的数据。Note: (a) The titer of the antiserum after third immunization and the data measured by microplate reader. (b) The titer of the antiserum after fourth immunization and the data measured by microplate reader. (c) The titer of the antiserum after final blood letting and the data measured by microplate reader. (d) The result of antibody titer test and the data measured by microplate reader.
2.6 花生不同组织及种子不同发育时期的Western Blot分析
对花育33的组织蛋白进行提取,然后进行蛋白质印迹实验。结果如图9所示,AhGPAT9与 AhLPAAT4蛋白在花生叶中均表达,在根、茎、子叶、下胚轴中均未见表达。AhGPAT9蛋白在种子发育至12d、24d、36d时的表达量逐渐上调,但不明显,发育到48d时表达量略有下降,随后在60d时表达量有所上升。AhLPAAT4蛋白在种子发育至12d时的表达量处于很低水平,到24d时,表达量明显上调,随后逐渐缓慢下降,到60d时又有所上升。

图8 AhGPAT9重组蛋白(a)和AhLPAAT4重组蛋白(b)Western Blot分析图 Fig.8 Western Blot analysis of recombination AhGPAT9 (a) and AhLPAAT4 (b) protein 注:M: 蛋白Marker;1:目的蛋白. Note: M: protein marker; 1: target protein.
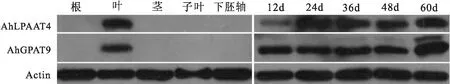
图9 AhGPAT9和AhLPAAT4在不同组织和种子不同发育时期的Western Blot分析Fig.9 Western Blot analysis of AhGPAT9 and AhLPAAT4 at different tissues and different seed development stages
3 讨 论
原核表达系统具有目的基因表达水平高,培养周期短,抗污染能力强,成本相对低等优点。本试验构建了原核表达载体,进行了重组蛋白的体外诱导表达,成功获得了AhGPAT9 和AhLPAAT4重组蛋白。这比利用生物信息学软件预测出的分子量(AhGPAT9,43.5kD;AhLPAAT4,43.9kD)小,这是因为生物信息学软件预测的蛋白分子大小是以完整的氨基酸序列进行,而实验中通过设计引物已经把基因跨膜区序列切除,所以表达蛋白的分子量要比预测值小。
本实验室在前期通过实时荧光定量PCR(qRT-PCR)技术分别检测了AhGPAT9[5]与AhLPAAT4[7]基因在花生不同组织器官、6个种子发育不同时期的表达特性。将荧光定量PCR结果与Western Blot结果进行对比分析。荧光定量PCR结果显示,AhGPAT9基因在花生不同组织中均有表达,茎中的表达量最高,其次是花;AhLPAAT4基因在叶中的表达量明显高于其他组织。这与Western Blot分析结果不同,这可能与选用的花生品种不同有关,荧光定量试验选用的是花育19号,而本实验选用的是花育33号,基因的表达与蛋白的表达可能存在差异。另外,荧光定量PCR结果显示,AhLPAAT4基因在种子不同发育时期的表达规律为:前30d表达量逐渐上调,在40d时略微下降,至50d时表达量下降明显,60d时又略微上调。这与Western Blot分析结果一致。AhGPAT9基因的荧光定量结果显示在前50d,表达量逐渐上调,60d时略微下调,基本保持平稳,这与Western Blot分析结果相比,只在60d时表达存在差异,整体上基本一致。
大肠杆菌表达重组蛋白的影响因素有很多,包括诱导温度、诱导时间、诱导剂浓度等,为了能高效表达重组蛋白,本试验通过对比试验摸索条件,SDS-PAGE电泳结果显示,37℃ 5h的诱导条件为最佳,能够获得较纯、较大量的重组蛋白。高质量重组蛋白的获得与多克隆抗体的成功制备为进一步研究AhGPAT9和AhLPAAT4蛋白的结构解析、生物学功能、及与其他蛋白质的相互作用奠定了基础,同时为家族内其他成员的表达和纯化提供借鉴。
[1] Ohlrogge J, Browse J. Lipid Biosynthesis[J]. Plant Cell, 1995, 7(7):957-970.
[2] Broun P, Gettner S S C. Genetic engineering of plant lipids[J]. Annual Review of Nutrition, 1999, 19(1):197-216.
[3] Arroyo-Caro J M, Chileh T, Kazachkov M, et al. The multigene family of lysophosphatidate acyltransferase (LPAT)-related enzymes inRicinuscommunis. Cloning and molecular characterization of two LPAT genes that are expressed in castor seeds[J]. Plant Science, 2013, 199-200: 29-40.
[4] Maisonneuve S, Bessoule J J, Lessire R, et al. Expression ofBrassicanapusmicrosomal lysophosphatidic acid acyltransferase isozymes enhances seed oil content inArabidopsisthaliana[J]. Plant Physiol, 2010, 152:670-684.
[5] Chi X, Yang Q, Pan L, et al. Isolation and expression analysis of glycerol-3-phosphate acyltransferase genes from peanuts (ArachishypogaeaL.) [J]. Grasas Y Aceites, 2015, 66(3): e09.
[6] 董芳,迟晓元,杨庆利,等. 三个花生溶血磷脂酸酰基转移酶基因的克隆与序列分析[J]. 花生学报,2013,42(1):1-11.
[7] Chi X, Dong F, Yang Q, et al. Expression and characterization of Lysophosphatidyl acyltransferase genes from peanut[J]. Research on Crops, 2014, 15(1):141.
ProkaryoticExpressionandWesternBlotofAhGPAT9andAhLPAAT4ofPeanut
YANG Zhen1, HAO Cui-cui1,2, LI Hao-yuan1,3, JIAO Kun1, WANG Tong1, WANG Mian1, CHEN Na1, CHEN Ming-na1, PAN Li-juan1, JIANG Huan-huan1,4, YU Shan-lin1*, CHI Xiao-yuan1*
(1.ShandongPeanutResearchInstitute,Qingdao266100,China; 2.CollegeofMarineScienceandBiologicalEngineering,QingdaoUniversityofScience&Technology,Qingdao266042,China; 3.CollegeofMarineandTechnology,HarbinInstituteofTechnology,Weihai264209,China; 4.SchoolofMunicipalandEnvironmentalEngineering,HarbinInstituteofTechnology,Harbin150001,China)
Acyltransferase family genes play important roles in triacylglycerol synthesis. The prokaryotic expression vectors ofAhGPAT9 andAhLPAAT4 genes were constructed, and the fusion proteins were super-expressed inE.coliBL21 under induction of IPTG. SDS-PAGE analysis showed that the fusion proteins were highly expressed after induction for 5h at 37℃. Then the fusion proteins were purified and used as antigens to inject rabbits for four times. The prepared polyclonal antiserums were obtained and purified. The indirect ELISA analysis showed that the polyclonal antibodies have a high titer of 1:512000. The polyclonal antibodies were used to test the expression of fusion proteins inE.coliBL21 through Western Blot, and detected the specific bands. It suggested that the polyclonal antibodies have high specificity and sensitivity. Furthermore, the expressions of AhGPAT9 and AhLPAAT4 proteins at different tissues and different seed developmental stages were determined by Western Blot. This study provided scientific data for the further study ofAhGPAT9 andAhLPAAT4 genes.
peanut; AhGPAT9; AhLPAAT4; prokaryotic expression; polyclonal antibody; Western Blot
10.14001/j.issn.1002-4093.2017.03.002
S565.2; Q786
A
2017-07-19
2014年国家“万人计划”青年拔尖人才;国家花生产业技术体系项目(CARS-14);山东省自然科学基金项目(ZR2014YL011;ZR2014YL012);国家自然科学基金项目(31000728;31200211);山东省农业科学院青年科研基金项目(2016YQN14);青岛市应用基础研究项目(17-1-1-51-jch);青岛市民生计划项目(14-2-3-34-nsh);山东农业科学院农业科技创新项目(CXGC2016B02);山东省农业科学院青年英才培养计划
杨珍(1979-),女,山东胶南人,山东省花生研究所助理研究员,硕士,研究方向为花生遗传育种。
*通讯作者:禹山林(1956-),研究员,主要从事花生遗传育种研究。E-mail: yshanlin1956@163.com 迟晓元(1979-),副研究员,主要从事花生遗传育种研究。E-mail: chi000@126.com

