暖地泥炭藓在不同水位及光照条件下的光谱特征分析
王林凤,盛 威,徐俊锋,吴玉环
(1.杭州师范大学生命与环境科学学院, 浙江 杭州 310036;2.杭州师范大学遥感与地球科学研究院,浙江 杭州 310036)
暖地泥炭藓在不同水位及光照条件下的光谱特征分析
王林凤1,盛 威1,徐俊锋2,吴玉环1
(1.杭州师范大学生命与环境科学学院, 浙江 杭州 310036;2.杭州师范大学遥感与地球科学研究院,浙江 杭州 310036)
在实验室内模拟不同水位条件下,对暖地泥炭藓的高光谱反射数据进行分析.结果表明,在不同的水位条件和光照条件下,暖地泥炭藓光谱曲线表现出很大差异,随着水位的降低其在可见光和近红外的反射率均有升高,且在近红外的几个水吸收波段的吸收谷深度随着水位的增加不断加深.对暖地泥炭藓光谱的一阶导数分析,结果表明过高和过低的水位对于植物本身都造成了胁迫,其体内叶绿素含量下降,导致其红边位置向短波方向移动.在过强的光照强度下,暖地泥炭藓叶片发生不同程度光合色素含量的下降,从而导致在绿波段反射率的增加.本研究将为野外实地光谱测量的验证以及高分辨率卫星遥感监测泥炭藓湿地水分状况提供地面光谱反射依据.
泥炭藓;反射光谱; 水分状况;光照强度
苔藓植物(bryophytes)和地衣(lichens)是北方泥炭地和北方湿地植物群落的重要组成部分,它们在植被年生产力、固碳、改变地表径流和能量平衡方面有着重要的贡献[1].苔藓植物是从水生到陆生过渡的最低等的高等植物,体型微小,孢子体结构相对简单,不能独立生活,寄生在配子体上,生活史具有明显的世代交替[2].泥炭藓属 (Sphagnum) 植物是苔藓植物中孤立的、原始的一个类群,形态结构和生态习性特殊,在藓纲中做为独立的一个泥炭藓亚纲 (Sphagnopsida)存在,泥炭藓亚纲仅有1科(泥炭藓科Sphagnaceae)1属(泥炭藓属Sphagnum),全世界大概有280多种[3],分布于全世界,集中于北半球寒温带,是寒温带湿地的主要植被.泥炭藓属中国有40种左右,主要分布在东北、西北和西南高寒地区[4].泥炭藓属是一类沼泽地区、森林洼地或滴水石壁下丛生的藓类植物,植物体柔软,灰白色或灰黄色,有时紫红色,丛生成垫状.植物体上部可以无限制地继续生长,长者可达1~2 m,下部逐渐腐解,在沼泽中由于缺氧,腐解缓慢,形成泥炭[5].泥炭沼泽通过长期的积累,储存了地球上约1/3的碳源[6],据初步统计,作为泥炭藓沼泽特有的分类群,泥炭藓属植物是积累泥炭的最重要植物,泥炭藓(包括活体及其残体)所固定的碳比全球所有的陆生植被一年所固定的碳还多[7],因此其在全球碳循环中发挥着重要作用,在自然界具有不可替代的生态功能.
遥感探测的目标地物特征的原理是地物电磁辐射差异在遥感反射光谱特征或者成像上的反映,而植物反射光谱特征主要是由叶绿素含量与含水量所决定的,同类植物吸收谷和反射峰的波长位置都是相同的,而不同植物反射光谱特征具有明显差异性,吸收谷和反射峰的位置绝大多数是不同的,因此可以根据这些特征进行植被群落的遥感光谱识别研究.高光谱遥感是以纳米尺度对目标进行连续光谱成像的新技术,它使本来在宽波段遥感中不可探测的物质,在高光谱遥感中能被探测[8].
高光谱遥感技术的出现使利用遥感数据提取生物化学参数成为可能,从而能在区域以及全球尺度上提取生物化学信息来研究和评价光合作用、碳、氮养分循环、气体交换、植物生产力、凋落物分解速率等生态系统过程[9-12].对于植被含水量的监测,林川等[13]认为应用高光谱遥感手段不仅可以很好地满足植被含水量监测在空间广泛性和时间连续性上的要求,而且能够实现对植被水分状况实时快速准确的监测.运用遥感技术和光谱反射数据进行泥炭藓属植物水分状况变化的监测在一些文献中已有了广泛的描述[14-21].
对于普通绿色植被来说,其光谱反射特征在可见光(0.38~0.76 μm)波段、近红外波段(0.76~3 μm)、中红外波段(3~6 μm)表现出不同的光谱反射特征:在可见光波段主要是受到各种色素的影响,在近红外波段主要受植物叶片内部构造的控制,中红外波段绿色植物的光谱响应主要被1.4、1.9、2.7 μm附近水的强吸收带所支配[22].但泥炭藓属植物不同于普通绿色植物,其常生于酸性沼泽地及湿原中,具有很强的持水能力,吸水后可达自身干重的10~15倍左右,这主要与泥炭藓属植物的结构特征紧密相关,泥炭藓属植物有3种不同类型的分枝在密集的藓丛中彼此交错生长形成孔隙,通过毛细现象可大量吸收和存储水分.其茎具有大型无色的表皮细胞,其叶片除了小型绿色细胞外,主要是大型无色细胞,细胞壁上还有很多水孔,更有利于水分的吸收和储存[23].泥炭藓属植物这些独特的形态结构特征,决定了它与普通绿色植物在光谱特性方面的不同,需要通过地面实测的光谱数据来找到其不同于普通绿色植物的光谱特性差异所在,从而为湿地植被分类研究奠定基础.
测量不同水分条件下各类湿地植被群落的光谱数据并进行光谱分析,找出不同水分条件下不同植被群落以及同一植被群落的光谱特性和变化规律,有助于建立地面光谱数据与高光谱遥感图像光谱数据之间的联系,为进一步研究湿地植被水分状况,进行参数反演,以及湿地植被分类等遥感应用具有重要意义.本研究拟在实验室内模拟不同水位条件下,对暖地泥炭藓的高光谱反射数据进行观察及分析.
1 研究材料和实验方法
1.1 样品采集
本次实验材料暖地泥炭藓(Sphagnumjunghuhnianum)采自浙江安吉小鲵国家级自然保护区.保护区位于浙江安吉县、临安县和安徽宁国县的交界处,海拔1330 m处的千亩田,因局部环境较特殊,有以禾本科植物为主的山地草甸和以暖地泥炭藓为主的高位泥炭沼泽,是目前浙北地区保存较好的高位湿生植被[24-25].此泥炭藓湿地中的泥炭藓植物仅有暖地泥炭藓1种,为该湿地的优势种类.采集方法是在泥炭藓湿地开阔处,选择盖度大于90%暖地泥炭藓生境,采集一定量健康生长的暖地泥炭藓,并装在塑料自封袋内,以防止水分散发.迅速运回实验室后,选取比较均匀的植株,截取上部3cm,放在顶部直径9 cm、底部直径5.6 cm的聚乙烯杯中培养,每杯50株,放入人工气候箱中,气候箱模拟暖地泥炭藓生长的野外条件,光周期设置为为16 h/8 h, 温周期为27 ℃/20 ℃,湿度为80%.参照国内外已有实验培养苔藓植物的做法,采用与沼泽水体的养分最为接近的Rudolph培养液[26].
1.2 实验设计
试验共分为2个试验组,分别为水位变化组、光照变化组.
1)水位变化组:分别设置5个不同的水位来研究对泥炭藓生长状态和光谱特征的影响.实验设置1、2、3、4和5五个水位条件(即自杯底至水位线分别为1、2、3、4、5 cm),每个水位5个重复.依据龙王山的年降水量1650 mm, 每天用降雨模拟器对泥炭藓样品施浇10 mL蒸馏水,每隔2~3 d喷撒8~10 mL pH值为5.8的 Rudolph营养液,并通过施加蒸馏水保持水位.每隔一周将杯内水体重新换一遍.
2)光照强度变化组:调控两个不同光照强度,分别为一般光照强度和高光照强度.一般光照强度的光强约为3000 Lux,高光照强度的光强约为6000 Lux.
1.3 研究方法
实验开始前记录暖地泥炭藓株高,每隔10 d记录其叶绿素含量,整个实验期间共测量2次,仪器采用美国OPTI-sciences CCM-300叶绿素含量测量仪.每隔10 d进行一次光谱测量,整个实验期间共测量2次,测量仪器为美国Analytical Spectral Device(ASD)公司生产的FieldSpec3便捷式地物光谱仪,波段值350~2500 nm,其中350~1050 nm光谱采样间隔1.4 nm,光谱分辨率为3 nm;1000~2500 nm光谱采样间隔为2 nm,光谱分辨率为10 nm.
测量在暗室进行,光谱仪探头全视场角为8°,测定时光谱探头垂直向下,距样本冠层高度为10 cm.测量一次样本仪器自动生成10条光谱曲线,为了保证测量的均一性,一个样本测量4次,每测量一次,样本旋转45°,即每个样本共有40条光谱曲线,一个水平有5个重复即200条光谱曲线,取200条光谱曲线的平均值作为该水平的光谱曲线,测量过程中每10 min进行一次白板的优化,以保证数据测量的精确性.
1.4 数据分析
用ASD便捷式光谱分析仪所自带的光谱分析软件ViewSpec Pro6.0对采集的光谱数据进行处理,导出ASCII码文件在Excel和 Origin8.5中进行相关反射曲线平滑去噪等分析,最终生成曲线图,由于小于450 nm和大于2400 nm处的波谱反射率噪声太大,故只选取了450~2400 nm处的光谱反射率进行分析和显示.
2 结果分析
2.1 不同水位条件下光谱反射曲线分析

a.不同水位处理10 d后 b. 不同水位处理20 d后图1 暖地泥炭藓在不同水位条件下光谱反射特征Fig.1 Spectral reflectance characteristics of Sphagnumjunghuhnianum under different water levels
在水位实验开始的10 d后获得的光谱反射率数据(图1a)表明,在可见光波段暖地泥炭藓的光谱反射特征与普通绿色植物的很相似,也有一个“绿峰”,大致位于550 nm处,不同水位的实验样本的反射曲线在可见光波段范围内几乎一致,在700 nm处泥炭藓有一个与普通植物相比非常陡的红边(REP),红边是绿色植物叶子光谱曲线在680~740 nm之间变化率最快的点,也是一阶导数光谱在该区间内的拐点.红边在普通绿色植被中受叶绿素含量的影响,红边漂移部分原因是由叶绿素控制的[27].当植物受到胁迫时,叶绿素含量的减少会导致大约位于680 nm处的叶绿素吸收谷向短波方向移动,也就是“蓝移”[28].从实验结果中观测到在700~920 nm处暖地泥炭藓的反射率达最高,呈现出一个反射高原区.不同水位的反射率介于30%~45%之间,水位越低的样本其反射率越高,水位高的反射率低,光谱曲线呈一定的规律排列.而且水位1和水位2的样本在700~920 nm的反射高原区出现“双峰”现象,双峰分别位于大约800 nm和890 nm处.Vogelmann amp; Moss[29]在对狭叶泥炭藓(S.cuspidatum)、疣泥炭藓 (S.papillosum)、假泥炭藓(S.fallax) 和尖叶泥炭藓 (S.capillifolium) 4种泥炭藓的光谱反射研究中指出,与其他3种泥炭藓显著不同的是,狭叶泥炭藓在750 nm和850 nm处有“双峰”现象,不论是湿润条件下的狭叶泥炭藓材料还是干燥条件下的狭叶泥炭藓,都有此“双峰”现象,而且在地表生长干燥的狭叶泥炭藓也有“双峰”现象,原因是细胞结构中的细胞壁/细胞间隙特征所造成的.本次实验中,在光谱的1050 nm处有一个仅次于700~920 nm的反射高原区的反射峰,不同水位的样本在此光谱反射率的排列方式也有一定的规律,这可能是由于随着细胞含水量的增加,导致反射率出现变化.在1250 μm处有一个再次于1050 nm处的反射峰,但是这个反射峰比普通绿色植物的反射峰更低,这验证了Vogelmann amp; Moss[29]实验中的研究结果.Vogelmann amp; Moss[14,29]认为,其研究的4个泥炭藓属植物的反射光谱在某些波段和普通绿色植物的反射峰是很相似的,但是泥炭藓属可以与普通植被所区分,泥炭藓属植物在1000 nm和1200 nm处有显著的水吸收特征,其次在1250 nm处有比普通植被更低的反射峰,再次在1660 nm和2250 nm附近也倾向于比典型绿色植被更低的反射值.这些实验结论可以作为遥感影像上区分泥炭藓植物和非泥炭藓植物的光谱依据.在2015年9月1日测量的暖地泥炭泥藓冠层光谱数据表明,其在1450 nm、1950 nm处的水吸收波段比普通绿色植物的吸收谷更深,反射率几乎接近于0.
实验进行20 d后获取的不同水位样本的反射率数据(图1b)表明,在可见光的绿峰附近,各个水位样本的反射率曲线不再是重合到一起,而是发生一定的差异,这说明经过长时间不同水位的控制实验,使得各个不同水位样本的叶绿素含量差异拉大,从而导致反射率在绿峰出现一定的变化.水位1 cm和2 cm的样本相比其他样本,受到长时间的干旱胁迫,其叶绿素含量呈现下降趋势,叶片发黄褪色严重,因此其在绿波段的反射率较其他3个水位(3、4、5 cm)有增加的趋势;700~920 nm的反射高原区内不同水位的反射率曲线的波动比10 d前测量的曲线波动要大,这可能是因为随着时间的推移各样本叶片和细胞结构及细胞形态发生了变化;水位1 cm和水位2 cm的样本在1050 nm处的反射峰相比前10 d的反射率要高,尤其是水位1 cm的反射率达到48%左右;另外在1200~1400 nm范围内,不同样本的反射率曲线之间的距离也拉大,在1450~1900 nm和1950~2400 nm范围内的反射率均比前10 d测量的略有增加,且样本之间的差异也在拉大.
2.2 不同水位条件下光谱反射率曲线一阶导数分析
对光谱进行导数计算可以消除大气效应的影响,减弱土壤背景信息等,反映出植物中叶绿素等物质吸收产生的波形变化,并能揭示光谱峰值的内在特征[30].
一阶导数光谱的基本定义为
FDRλi=(Rλi+1-Rλi)/Δλ
(1)
其中:Rλi和Rλi+1为波段i,i+1处的反射率,Δλ为波段i到i+1的波长值.
另外“红边位置”和“红边斜率”是绿色植物特有的光谱特征.红边是指反射光谱一阶微分的最大值对应的光谱位置(波长),依叶绿素含量、生物量和物候变化而沿长波方向移动,普通绿色植物范围在680~750 nm之间.已有研究表明,在普通维管植物中,红边位置和叶绿素含量有高度相关性[14,28,31],健康叶片的红边位置大约在715~724 nm之间,叶绿素的损失会导致红边位置向短波方向偏移,如果红边位置低于710 nm则意味着明显的叶绿素损失.Bubier等[15]的研究表明,泥炭藓属的红边位置位于682~704 nm之间,羽藓属(Thuidium)植物的红边位置位于682~684 nm,地衣类的红边位置位于682~686 nm.
本次实验中不同水位样本红边位置分布的变化如表1所示.各样本的一阶导数分布如图2所示.

表1 暖地泥炭藓不同水位的样本红边位置分布Tab. 1 The red edge position of Sphagnum junghuhnianum under different water levels
由表1可知,前后2次测量,不同水位处理组的实验样本红边位置均发生一定的变化.水位3和水位4的红边位置分别为715 nm和716 nm,基本还在第一次测量的范围内.而低水位的水位1、2和高水位的水位5,其红边位置都向短波方向偏移,尤其以水位1和水位5的偏移幅度较大.这说明过低或过高的水位都不利于暖地泥炭藓光合色素的形成,使其细胞内的色素逐渐消失,从而导致叶绿素含量的下降(图3),致使红边位置向短波方向的偏移.实验样本外表颜色的变化也验证了这一说法,水位1、2和水位5的样本颜色在实验后期逐渐由鲜绿色变成白黄色,而水位3和水位4的植物生长良好,植物体颜色在整个实验过程中一直保持鲜绿色.

a.不同水位处理10 d后 b. 不同水位处理20 d后图2 不同水位一阶导数示意图Fig.2 The first derivation of the different water levels
处理10 d后测量的不同水位暖地泥炭藓的一阶导数光谱在512~515 nm和712~719 nm处出现2个峰值,代表光谱反射率增速最快的极点,512~515 nm处反射率上升是由于叶绿素的反射作用增强引起的,而712~719 nm处主要是红边效应的作用.处理20 d后测量的水位3和水位4的暖地泥炭藓一阶导数光谱反射率在515 nm和715 nm处分别出现2个极大值,而水位1、2和5 cm的两个极大值分别出现在517 nm和712 nm、517 nm和702 nm、517 nm和712 nm(图2).
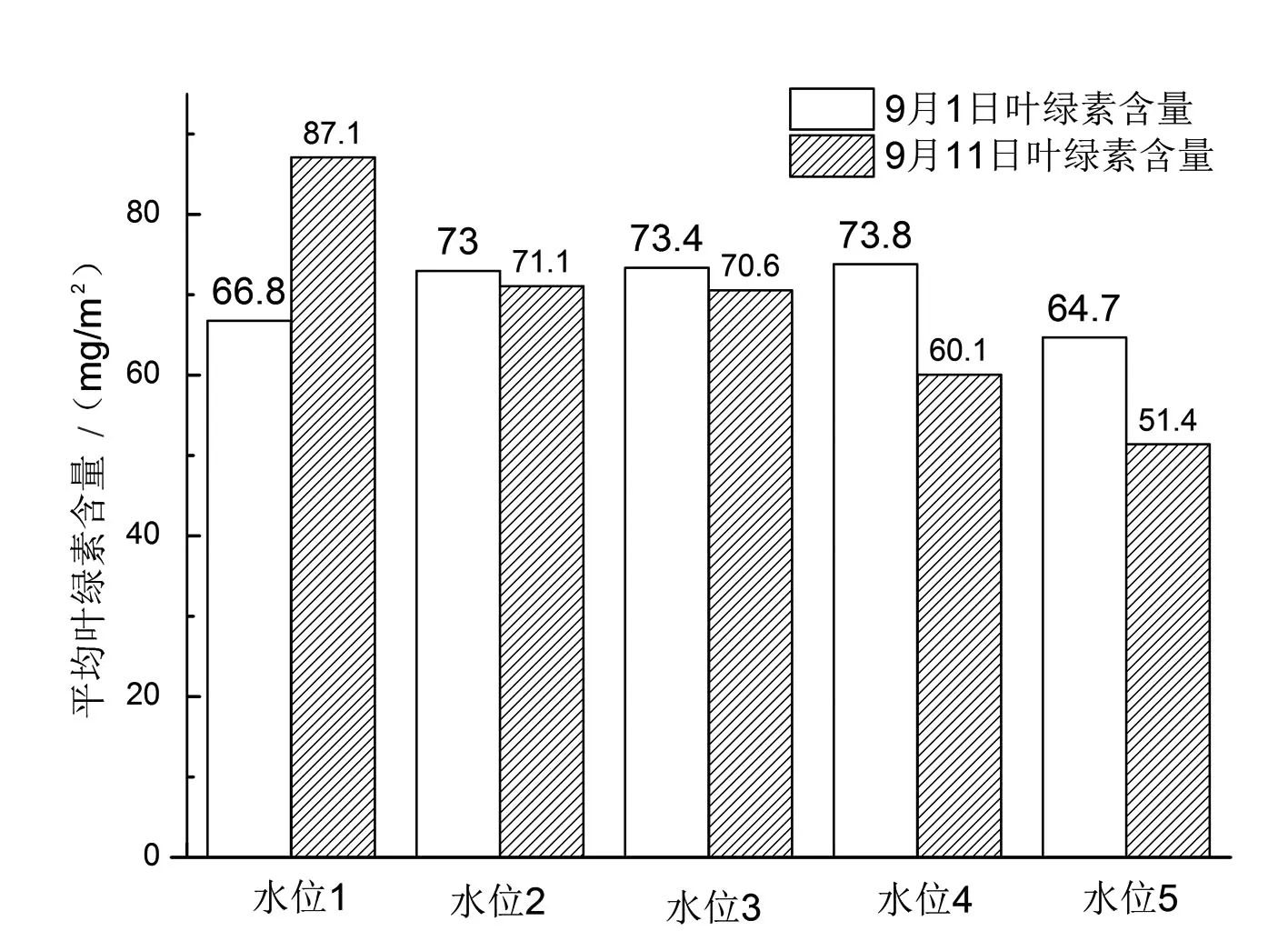
图3 暖地泥炭藓在不同水位条件下的平均叶绿素含量变化
2.3 不同光照条件下光谱反射曲线分析
在不同光照强度实验开始10 d后(2015年9月1日)和20 d后(2015年9月11日)测量的数据(图4)表明,6000 Lux光照强度下,在可见光绿波段附近,其反射率值达到10%,比3000 Lux光照强度时的反射率(5%~8%)高,且两个吸收谷的吸收深度降低.一般来说绿色植物在可见光波段的反射峰(550 nm处)是由于叶绿素对绿光的反射引起的,所以植被看起来呈绿色.而在0.33~0.45 μm及0.65 μm附近有两个吸收谷,是因为叶绿素对紫外线和紫色光的高吸收率,对蓝色光和红色光也强烈吸收,才导致有2个吸收谷.这说明强光抑制了暖地泥炭藓色素的合成,导致叶绿素含量的降低,从这也从侧面说明了暖地泥炭藓喜阴性特点.曹学仁等[32]对白粉菌侵染后田间小麦叶片叶绿素含量与光谱反射率的关系进行了研究,结果表明小麦在受到白粉病危害后,530~551 nm波段的反射率与叶绿素含量有显著的正相关关系,在绿光波段,随着叶绿素含量的增加,光谱反射率也逐渐增大.本次同步测量不同光照水平样本的平均叶绿素浓度数据也表明,在强光条件下5个水平的样本比一般光照条件下的叶绿素浓度衰减速度快.在反射光谱的700~900 nm之间,强光条件下样本的反射率也比一般光照条件下的反射率高,这说明在强光的作用下,泥炭藓叶片的细胞结构可能出现某些变化.对于绿色植物,从800~1300 nm之间是一个相对平坦反射率高的区域,这种对红外光的强反射是由叶子的细胞结构所导致的[33].

a.6000 Lux光照强度 b. 3000 Lux光照强度图4 暖地泥炭藓在不同光照强度下的光谱反射特征Fig.4 Spectral reflectance characteristics of Sphagnum junghuhnianum under different illumination intensity
3 讨 论
泥炭藓属植物是苔藓植物的特殊类群,覆盖着陆地表面的1%,具有重要的碳汇功能,在全球碳循环中作用巨大,是泥炭湿地的主要造炭植物,对于区域和全球碳平衡具有重要的生态学意义,泥炭藓属植物的固碳能力在很大程度上取决于其水分.因此,通过遥感手段大面积快速地获取泥炭藓湿地植被的水分状况,有助于相关政府部门对湿地的保护与利用提供决策.通过实验室和野外的实地光谱测量,找出水分状况和泥炭藓反射光谱之间的规律,也是大面积遥感调查的前提工作.国外一些生态学者对于泥炭藓属植物光谱特征与水分变化的关系也颇为关注,研究主要集中于不同水分状况下或受到干旱缺水胁迫下泥炭藓属植物的反射光谱特征和植物含水量的变化[14-20,34-36].大部分研究者认为通过光谱数据实地探测泥炭藓植物的水分状况是可行的,泥炭藓不同于其他维管植物,其对于水分变化异常敏感,水分变化能够迅速反应在泥炭藓的光谱特征上.本研究初步揭示了泥炭藓属植物在不同水分情况下其光谱曲线的变化有一定规律,下一步将构建泥炭藓属植物中与水分相关的植被光谱指数模型,并开展其他种类的泥炭藓属植物的光谱特征研究.
光是植物进行光合作用的能量来源.不同植物在其形成和发育过程中,形成了不同的途径来适应、利用所能得到的光照.大部分苔藓植物,都能够在很低的光照条件下进行光合作用,表现出喜阴的光合特征[37],遮阴条件下的土生墙藓(Totularuralis)具有比来自光照条件下的土生墙藓具有高的光合速度,其原因在于光合色素(叶绿素、胡萝卜素和叶黄素)适于在遮阴条件下合成,而处于很强的光照条件下的同种植物都表现出很低的光合色素能力.这表明,强光照抑制光合色素的合成.本研究结果表明在强光条件下,暖地泥炭藓的叶绿素浓度显著下降,植株呈病态,植株颜色褪色发白,且光谱反射曲线的红边位置也出现“蓝移”,说明暖地泥炭藓也不适于在强光条件下生长,强光会抑制暖地泥炭藓叶片光合色素的合成.
泥炭藓属植物是北方泥炭湿地的重要组成植物,其分布在很大程度上受气候的制约,在中国的亚热带高山也有泥炭藓属植物的分布.我国目前报道的亚热带地区的泥炭藓沼泽湿地有:浙江安吉小鲵国家级自然保护区千亩田泥炭藓沼泽[38]、福建永安天宝岩自然保护区的大洋、天斗洋两地的泥炭藓沼泽[39],另还有湖北神农架大九湖泥炭藓沼泽湿地、湖北七姊妹山国家级自然保护区泥炭藓沼泽、湖北省咸丰县二仙岩亚高山泥炭藓沼泽湿地、湖北后河地区等[40-42].本研究对不同水位条件下暖地泥炭藓的高光谱反射数据进行分析,试图为在野外测量光谱数据提供相关的验证数据,为进一步开展野外调查提供先验知识.相关数据分析表明,泥炭藓在不同水位条件下的反射曲线有很大的区别,这为不同季节不同降水条件下泥炭藓湿地生态状况的遥感监测提供了一条可行的路线.因此,下一步结合野外水文数据以及高分辨率遥感卫星照片的相关信息解译与提取,以进一步实现对大尺度泥炭藓湿地水文状况的遥感监测.但在野外实际监测中,泥炭藓属植物的光谱特征往往还受到大气条件和周围环境的影响,有可能导致室内测的某些波段的反射率和野外测得的数据有一定差异,如何将室内小尺度的监测应用到大尺度野外环境中需要进一步的研究.
4 结 论
1) 在可见光波段暖地泥炭藓的光谱反射特征与普通绿色植物的很相似,也有一个“绿峰”,大致位于550 nm处,不同水位样本的光谱反射曲线在可见光波段范围内几乎一致,在700 nm处暖地泥炭藓有一个比普通植物更陡的红边.
2) 暖地泥炭藓在1000 nm处和1200 nm处有2个非常明显的水吸收特征区间.
3) 暖地泥炭藓在不同的水位条件下其光谱曲线有很大差异,随着水位的降低其在可见光和近红外的反射率升高,在近红外的几个水吸收波段的吸收谷深度随着水位的增加不断加深.
4) 与实验前期相比,实验后期水位1、2和5 cm的样本,随着叶绿素含量的降低,其红边位置都出现了明显向短波方向移动的趋势.
5) 强光条件会造成暖地泥炭藓叶片光合色素的下降,从而导致其光谱反射率在绿波波段的增加.
致谢感谢杭州植物园莫亚鹰博士在野外采集时提供的帮助,感谢官飞荣及刘光在室内标本鉴定、仪器使用和数据分析方面提供的帮助.
[1] VITT D H, HALSEY L A, ZOLTAI S C. The bog landforms of contimental western Canada in relaition to climate and permafrost patterns[J]. Arctic Antarctic and Alpine Research, 1994,26(1):1-13.
[2] 曹同,郭水良,娄玉霞,等.苔藓植物多样性及其保护[M].北京:中国林业出版社,2011.
[3] CROSBY M R, MAGILL R E, ALLEN B, et al.A Checklist of the Mosses[M]. St Louis: Missouri Botanical Garden,1999.
[4] GAO C, CROSBY M R, HE S. Moss Flora of China, English Version.Vol.1[M]. St Louis:Science Press, Beijing and Missouri Botanical Garden,1999.
[5] 陈邦杰, 黎兴江. 中国泥炭藓属植物的初步观察[J]. 植物分类学报,1956,5(3):165-203.
[6] 马广礼,雷耘,汪正祥,等.鄂西七姊妹山泥炭藓沼泽植物多样性[J].武汉植物学研究,2008,26(5):482-488.
[7] CLYMO R S,HAYWARD P M. The Ecology ofSphagnum[M]. Berlin:Springer Netherlands, 1982:229-289.
[8] 童庆禧,张斌,郑兰芬.高光谱遥感——原理,技术与应用[M].北京:高等教育出版社,2006.
[9] WESSMAN C A , ABER J D, PETERSON D L, et al. Remote sensing of canopy chemistry and nitrogen cycling in temperate forest ecosystems[J]. Nature, 1988,335:154-156.
[10] WESSMAN C A, ABER J D, PETERSON D L. An evaluation of imaging spectrometry for estimating forest canopy chemistry[J]. International Journal of Remote Sensing, 1989, 10(8): 1293-1316.
[11] SMITH M L, OLLINGER S V, MARTIN M E, et al. Direct estimation of above ground productivity through hyperspectral remote sensing of canopy nitrogen[J]. Ecology Application, 2003, 12(5): 1286-1302.
[12] MARTIN M E, ABER J D. High spectral resolution remote sensing of forest canopy lignin,litrogen,and ecosystem processes[J]. Ecology Application, 1997, 7(2): 431-443.
[13] 林川,宫兆宁,赵文吉.叶冠尺度野鸭湖湿地植物群落含水量的高光谱估算模型[J].生态学报,2011,31(22):6645-6658.
[14] VOGELMANN J E, MOSS D M. Spectral reflectance measurements in the genusSphagnum[J]. Remote Sensing of Environment, 1993,45:273-279.
[15] BUBIER J L, ROCK B N, CRILL P M. Spectral reflectance measurements of boreal wetland and forest mosses[J]. Journal of Geophysical Research,1997, 102(24): 29483-29494.
[16] BRYANT R G, BAIRD A J. The spectral behaviour ofSphagnumcanopies under varying hydrological conditions[J]. Geophysical Research Letters, 2003, 30(3): 1134-1137.
[17] HARRIS A, BRYANT R G, BAIRD A J. Detecting near-surface moisture stress inSphagnumspp[J]. Remote Sensing of Environment, 2005, 97(3): 371-381.
[18] HARRIS A, BRYANT R G, BAIRD A J. Remote sensing ofSphagnumstress:a proxy for near-surface wetness conditions in northern peatlands? [C] //Globwetland Symposium, Looking at Wetlands from Space, Frascati: 2006.
[19] HARRIS A, BRYANT R G. A multi-scale remote sensing approach for monitoring northern peatland hydrology: present possibilities and future challenges[J]. Journal of Environmental Management, 2009, 90(7/S1): 2178-2188.
[20] NETA T, CHENG Q, BELLO R L, et al. Lichens and mosses moisture content assessment through high-spectral resolution remote sensing technology: a case study of the Hudson Bay Lowlands, Canada[J]. Hydrological Processes, 2010: 24(18):2617-2628.
[21] NETA T, CHENG Q, BELLO R L, et al. Development of new spectral reflectance indices for the detection of lichens and mosses moisture content in the Hudson Bay Lowlands, Canada[J]. Hydrological Processes, 2011, 25(6): 933-944.
[22] 梅安新,彭望琭,秦其明,等.遥感导论[M].北京:高等教育出版社,2001.
[23] 高谦,中国苔藓志:第一卷[M].北京:科学出版社,1994.
[24] 刘茂春,施德法.安吉龙王山天然森林植被的研究[J].浙江林学院学报,1991,8(3):355-365.
[25] 邓懋彬,方炎明.浙北安吉龙王山维管植物区系分析[J].植物资源与环境学报,1999,8(2):36-42.
[26] 袁敏,卜兆君,刘超,等.水位与光强变化对尖叶泥炭藓孢蒴生产动态的影响[J].植物生态学报,2015,39(5):501-507.
[27] CURTISS B, USTIN S L. Parameters affecting reflectance of coniferous forests in the region of chlorophyll pigment absorption[C]//12th Canadian Symposium. Remote Sensing and IGARSS. IEEE Geoscience and Remote Sensing, Vancouver:1989: 2633-2636.
[28] ROCK B N, HOSHIZAKI T, MILLER J R. Comparison ofinsituand airborne spectral measurements of the blue shift associated with forest decline[J]. Remote Sensing of Environment, 1988, 24(1): 109-127.
[29] VOGELMANN J E, MOSS D M. Spectral analyses in the genusSphagnumusing Landsat TM and high spectral resolution laboratory measurements[C]//Geoscience and Remote Sensing Symposium paper, Institute of Electrical and Electronics Engineers,New York:1992:1292-1294.
[30] BECKER B L, LUSCH D P, QI J G. Identifying optimal spectral bands from in situ measurements of Great Lakes coastal wetlands using second-derivative analysis[J]. Remote Sensing of Environment, 2005, 97(2): 238-248.
[31] ROCK B N, WILLIAMS D L, MOSS D M, et al. High-spectral resolution field and laboratory optical reflectance measurements of red spruce and eastern hemlock needles and branches[J]. Remote Sensing of Environment, 1994, 47(2): 176-189.
[32] 曹学仁,周益林,段霞瑜,等.白粉菌侵染后田间小麦叶绿素含量与冠层光谱反射率的关系[J].植物病理学报,2009,39(3):290-296.
[33] 刘圣伟,甘甫平,王润生.用卫星高光谱数据提取德兴铜矿区植被污染信息[J].国土资源遥感,2004(1):6-10.
[34] HARRIS A. Spectral reflectance and photosynthetic properties ofSphagnummosses exposed to progressive drought[J]. Ecohydrology, 2008, 1(1): 35-42.
[35] VAN GAALEN K, FLANAGAN L, PHOTOSYNTHESIS P D. Chlorophyll fluorescence and spectral reflectance inSphagnummoss at varying water contents[J]. Oecologia, 2007, 153(1): 19-28.
[36] ROLLIN E M, MILTON E J. Processing of high spectral resolution reflectance data for the retrieval of canopy water content information[J]. Remote Sensing of Environment, 1998,65:86-92.
[37] TUBA Z. Light, temperature and desiccation responses of CO2-exchange in the desiccation-tolerant moss,Tortularuralis[J]. Symposia Biologica Hungarica, 1987,35: 137-149.
[38] 苏秀,朱曦.龙王山自然保护区生物物种多样性及其保护[J].林业调查规划,2007,32(1):76-79.
[39] 黄承勇.福建天宝岩自然保护区泥炭藓沼泽植物资源调查[J].福建林业科技,2009,36(1):134-138.
[40] 马广礼,张巧莲,郑俊霞.亚热带泥炭藓沼泽生态学研究概述[J].安徽农业科学,2012,40(13):7859-7860.
[41] 毛瑞,汪正祥,雷耘,等.七姊妹山自然保护区泥炭藓湿地剖面特征及元素垂直分布规律[J].土壤学报,2009,46(1):159-163.
[42] 汪正祥,雷耘,刘胜祥,等.湖北七姊妹山自然保护区发现亚高山泥炭藓湿地[J].华中师范大学学报(自然科学版),2005,39(3):387-388.
SpectralCharacteristicsofSphagnumjunghuhnianumunderDifferentWaterLevelsandIlluminationIntensities
WANG Linfeng1, SHENG Wei1, XU Junfeng2,WU Yuhuan1
(1.College of Life and Environmental Sciences, Hangzhou Normal University, Hangzhou 310036, China;2.Institute of Remote Sensing and Earth Science,Hangzhou Normal University, Hangzhou 310036, China )
The hyperspectral resolution reflective data ofSphagnumjunghuhnianumwas analyzed under different water levels. The results showed that the spectral curves ofS.junghuhnianumvaried under different water levels and illumination intensities, along with the reduction of water levels, the reflectance in the visible and near infrared wavelength increased significantly, and in several near infrared water absorption bands, the absorption depth continuously deepened as the water level increased. The first-derivative analysis ofS.junghuhnianumspectrum showed that the water levels both too high and too low caused stress on the plant, the chlorophyll content of which decreased obviously, leading to the red edge position moving to the short wave direction. Excessive illumination intensity would cause the decrease of photosynthetic pigment content in the leaves, and the reflectance in the green wave would increase. The results would provide spectral reflectance references for the verification of field spectral survey and the remote sensing monitoring of the water status inSphagnumwetlands with high-resolution satellite.
Sphagnum; reflectance spectrum; water status; illumination intensity
2016-11-08
国家自然科学基金项目(41571049);科技部基础性工作专项(2015FY110200).
吴玉环(1972—),女,教授,博士,主要从事苔藓植物学研究. E-mail:yuhuanwu@hznu.edu.cn
10.3969/j.issn.1674-232X.2017.05.010
Q948.1
A
1674-232X(2017)05-0505-09

