豆瓣辣酱高酶活霉菌筛选及豆醅促熟性研究
但茜,毛佳怡,曾海英
(贵州大学 酿酒与食品工程学院,贵阳 550025)
豆瓣辣酱高酶活霉菌筛选及豆醅促熟性研究
但茜,毛佳怡,曾海英*
(贵州大学 酿酒与食品工程学院,贵阳 550025)
以豆瓣辣酱微生物区系中已分离鉴定的5株优势霉菌M2~M6为试验菌株,通过筛选高产蛋白酶和肽酶菌株,并将之应用于发酵豆醅,对比传统发酵以探索其在缩短周期、促进风味及提高品质等方面的应用可行性。研究表明:M3产蛋白酶活力达到139.49 U/mL;M6肽酶活力达1.039 mg/dL。采用高酶活菌株进行人工接种菌群强化发酵蚕豆,促熟效果显著,发酵时间缩短至20天(传统周期为60~90天),M3组呈味氨基酸含量达56.63%,M6组为48.03%,而传统优质CK组仅为45.23%,差异显著(P<0.05)。
豆瓣辣酱;高蛋白酶;高肽酶;促熟;风味
1 概述
近年来,由于人们保健意识逐渐提升,发酵食品因其高营养价值和生理功能,尤其是具有浓郁酱香和醇厚鲜美口感的豆瓣酱受到越来越多消费者的喜爱[1]。然而传统豆瓣辣酱成熟周期长、品质不稳定,已逐渐成为制约豆瓣辣酱产业发展的瓶颈,故生产过程中的促熟、增香、提高营养价值日益成为产业发展拟待解决的问题。微生物能使豆瓣辣酱发酵时间缩短、提高豆瓣辣酱营养价值等作用使其越发受人追捧[2-4],因此,通过筛选高酶活菌株并且研究其特性,再应用筛选后的高酶活菌株到产品中从而使豆瓣辣酱达到促熟、增香、提高品质等目的是本研究的意义所在。
2 材料与方法
2.1 试验材料与仪器
2.1.1 试验材料
试验菌种:试验选用的5株霉菌均系贵州大学食品免疫与毒理评价实验室从豆瓣辣酱制品中分离而来的具有益酵益生作用的优势菌种,编号分别是M2平革菌科(Porostereumcrassum),M3杂色曲霉(Aspergillusversicolor),M4蜡叶枝孢霉(Cladosporiumsphaerospermum),M5桔青霉(Penicilliumcitrinum),M6阿姆斯特丹曲霉(Eurotiumamstelodami),所有菌种使用前均进行活化、纯检;发酵成熟豆瓣。
2.1.2 主要试剂
三氯乙酸、Na2CO3、磷酸二氢钠、磷酸氢二钠、干酪素、NaOH、马铃薯葡萄糖琼脂培养基、脱脂奶粉、水合茚三酮试剂。
2.1.3 主要培养基
牛奶培养基:脱脂奶粉2.5 g、马铃薯葡萄糖琼脂培养基0.401 g、蒸馏水100 mL,分装,经115 ℃ 20 min灭菌,备用。
蚕豆粉液体培养基:蚕豆粉3 g、葡萄糖0.8 g、蒸馏水100 mL。
马铃薯葡萄糖液体培养基:去皮马铃薯200 g、葡萄糖20 g、蒸馏水1000 mL,分装,经121 ℃ 20 min灭菌,备用。
马铃薯葡萄糖琼脂培养基:取本品40.1 g,加蒸馏水1000 mL,加热煮沸至完全溶解,分装,经121 ℃ 20 min灭菌,备用。
2.1.4 主要设备
PSHP-250型智能生化培养箱 上海光都仪器设备有限公司;CJ-1D超净工作台 天津市泰斯特仪器有限公司;TGL20M台式高速冷冻离心机 长沙迈佳森仪器设备有限公司。
2.2 试验方法
2.2.1 菌种活化及扩大培养
将菌种接种于蚕豆培养基中,(29±1) ℃条件下培养3~4天,使霉菌充分生长,反复转接2~3次后,可将退化及衰老的细胞除去,使菌种达到生长旺盛、菌活量高的对数期。通过对菌株的反复连续培养,使菌体中保持原有典型性状的单细胞恢复原有菌株典型性状,可继续传代扩大培养[5]。
2.2.2 待测酶液制备
将种子液接种于蚕豆培养基中,摇床参数设定180 r/min,30 ℃培养48 h后转移至50 mL离心管中于4 ℃,10000 r/min条件下离心5 min,收集上清液,置于4 ℃冰箱中保存备用。
2.2.3 高产蛋白酶菌株的筛选
2.2.3.1 平板透明圈法[6]初筛选出具有产蛋白酶能力的菌株
用接种环刮取1环试验菌株孢子到装液量20 mL/100 mL的大豆培养基中,设定参数30 ℃,180 r/min,培养48 h。制备牛奶培养基,取发酵液10 mL,5000 r/min离心10 min,然后取上清液100 μL加入到初筛平板点样孔中,28 ℃培养48 h后,比较水解圈大小[7]。所有试验均设3组平行。
2.2.3.2 Folin-酚法复筛确定高产蛋白酶菌株
根据SB/T 10317-1999,稍做修改。
2.2.3.3 酪氨酸标准曲线的制作
准备6支无菌试管并编号,按表1调配不同浓度标准的酪氨酸溶液。
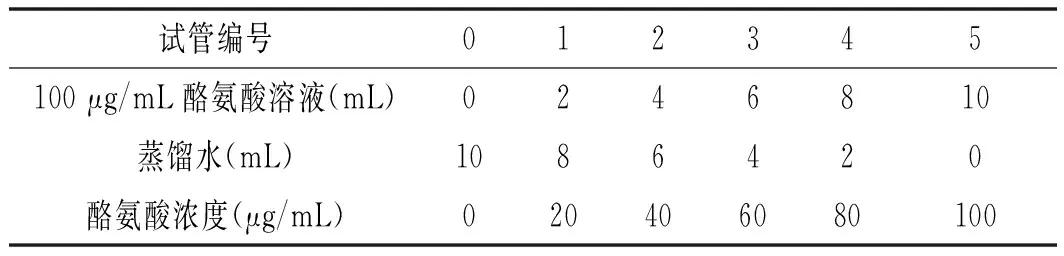
表1 酪氨酸标准曲线的制作Table 1 The making of standard curve of tyrosine
取16支干燥无菌的试管编号,将表1中配制的各浓度酪氨酸溶液分别取1 mL,分别加入0.4 mo1/mL Na2CO3溶液5 mL、Folin试剂溶液1 mL后,置于(40±2) ℃水浴中恒温20 min。
在波长660 nm处,以0号试管为对照空白,测定吸光度。
建立回归方程,计算出当吸光度为1时的酪氨酸的量(μg),即为吸光常数K值。
2.2.3.4 蛋白酶活力的测定
取待测酶液1.0 mL于20 mL刻度管中,(40±2) ℃预热5 min,加入1.0 mL 2%酪蛋白溶液,于(40±2) ℃准确反应10 min后,加2.00 mL 0.4 mo1/L TCA溶液终止反应,摇匀后10000 r/min离心10 min,再取上清液1 mL于试管中,相继加入5 mL 0.4 mo1/L Na2CO3溶液,1 mL Folin-酚试剂稀释液,混匀后于(40±2) ℃水浴中显色20 min,加蒸馏水定容至20 mL。
空白对照:先在样品中加入TCA使酶失活,再加入酪蛋白溶液,以后操作步骤参考上述方法。
在660 nm波长下测定OD值。
“古道”则是用典,用了《咸阳别李处士》“古道自迢迢,咸阳离别桥。”典故。古道是分别的最后一站,牵手走过的地方注定是预示着分别的存在,这使歌曲充满了离愁别绪,牵手走过的道路也成为了离别的道路,这使歌曲充满了戏剧化的魅力。
对蛋白酶活力的规定:1 mL酶液在40 ℃时1 min水解酪蛋白产生1 μg酪氨酸量,将此定义为1个酶活力单位(U)。
粗酶液的蛋白酶活力(U)=(OD1-OD2)×K×V×N/t。
式中:OD1为样品的吸光度值;OD2为空白对照的吸光度值;V为反应试剂总体积;N为稀释倍数;t为反应时间;K为由酪氨酸标准曲线求出的吸光常数,本试验所求的K=97。
2.2.4 高产肽酶菌株筛选[8]
2.2.4.1 亮氨酸标准曲线的测定
取8支20 mL具塞刻度试管并编号,参照文献中操作步骤加入各种试剂,盖上玻璃塞,混匀。再在100 ℃水浴中加热15 min(加热时封口),取出后立即置于冷水中迅速冷却。然后迅速向每管中加入5 mL 95%乙醇,塞好塞子,猛摇试管,此时溶液呈紫色。然后用60%乙醇稀释至20 mL,以0号管为参比进行调零,于570 nm波长处测定溶液的吸光度,重复3次,然后绘制标准曲线,求出线性方程。
2.2.4.2 肽酶活力测定反应体系
取待测酶液1 mL,加入质量浓度2 g/dL的无菌大豆肽溶液1 mL,置于3 mL pH 7.5的Tris-HCl缓冲液中反应过夜,最后取反应液1 mL,测定其中游离氨基酸总量。
2.2.4.3 反应体系中游离氨基酸总量计算[9]
游离氨基酸总量(mg/dL)=(m1×V)/(Vs×m×1000)×100。
式中:m1为从标准曲线查得的氨基酸的质量(μg);V为样品提取液总体积(mL);Vs为测定时所取样品液体积(mL);m为样品质量(g)。
2.2.5 氨基酸态氮含量测定
参照GB/T 5009.40-2003规定的方法测定。
2.2.6 游离氨基酸测定
本试验是测定发酵成熟的豆醅中游离氨基酸,选用了LC-20AT高效液相色谱仪测定;测定依据为GB/T 16631-2008《高效液相色谱法通则》。
3 结果分析
3.1 高酶活菌株筛选
3.1.1 高产蛋白酶菌株筛选
牛奶平板蛋白酶初筛结果见图1。
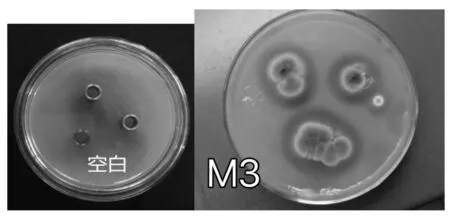
图1 牛奶平板蛋白酶初筛结果Fig.1 The initial screening results of protease by milk plate count method
将粗酶液置于牛奶平板上过夜培养,除M4无明显产酶能力外,4株均显示出具有产蛋白酶的能力。
按照2.2.3所述方法测定吸光值,并绘制标准曲线,见图2。可知酪氨酸标准曲线回归方程为y=0.0103x-0.00129。
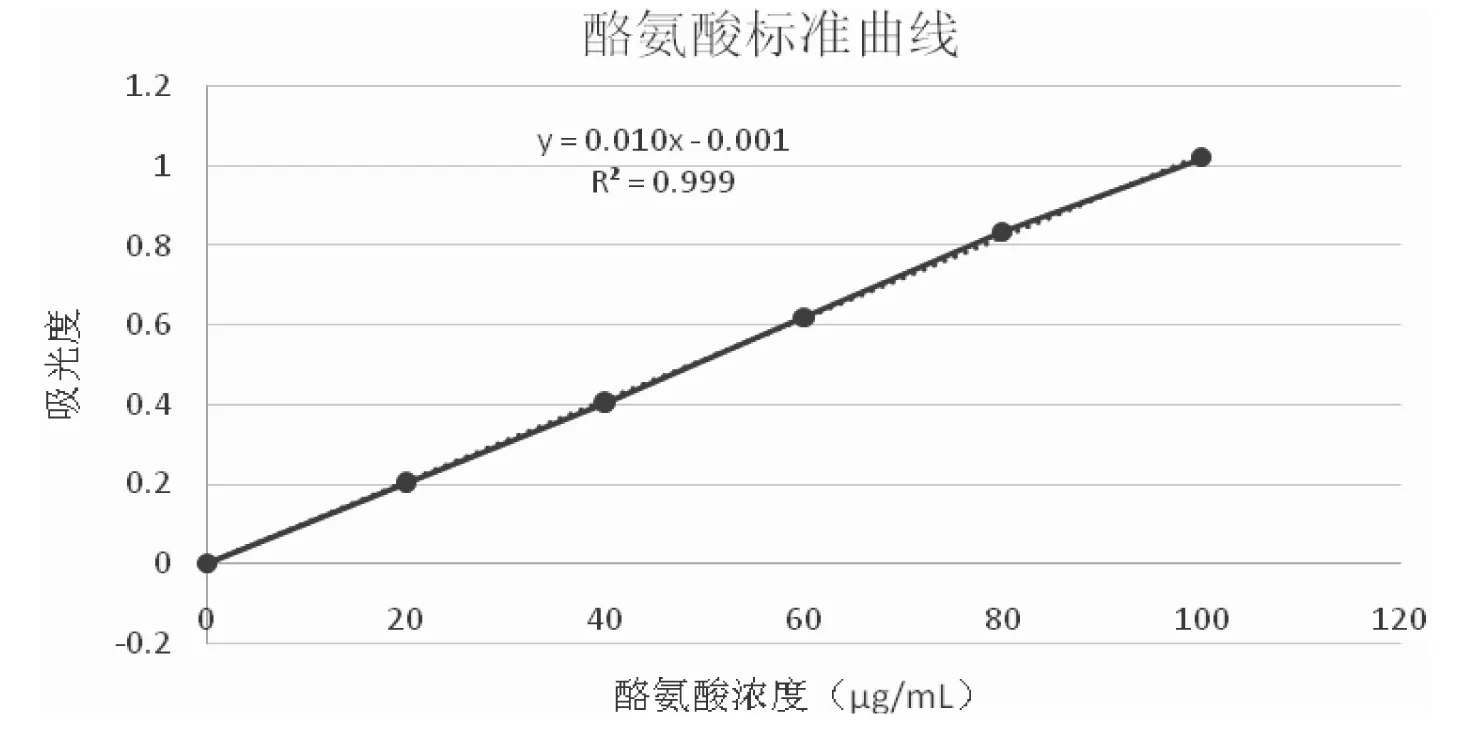
图2 酪氨酸标准曲线Fig.2 The standard curve of tyrosine
由图3可知,M3菌株产蛋白酶活力与其余产蛋白酶菌株活力存在显著差异,菌株M3蛋白酶活力最强,为139.49 U/mL。
3.1.2 高产肽酶菌株筛选
亮氨酸标准曲线见图4,利用一元线性回归方程分析得到亮氨酸标准曲线回归方程为y=0.181x+0.015,相关系数R2=0.9998,表明亮氨酸与OD570之间线性回归比较显著,可用于以大豆肽粉为底物测定菌株产肽酶活力。
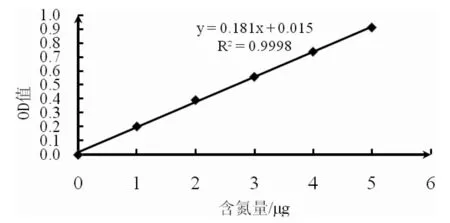
图4 亮氨酸标准曲线Fig.4 The standard curve of leucine
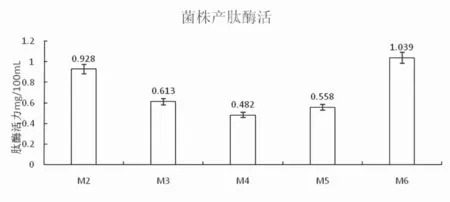
图5 菌株产肽酶酶活力Fig.5 Strains' producing peptidase enzyme activity
由图5可知,试验菌株均具有产肽酶能力,但能力大小存在差异,总肽酶活力上菌株M6产肽酶能力最强,为1.039 mg/dL,M2次之,为0.928 mg/dL,其余菌株产肽酶能力均弱于这2株。
结合高产蛋白酶菌株筛选结果,确定高产肽酶菌株为M6,并对菌株M3,M6进行菌株性能评定及应用。
3.2 豆醅促熟性研究
3.2.1 豆醅氨基酸态氮含量测定

表2 氨基酸态氮含量Table 2 Amino acid nitrogen content
氨基酸态氮指以氨基酸形式存在的氮元素含量,是判定发酵产品发酵程度的特性指标,含量越高,鲜味越好。由表2可知,M6菌株强化菌群组氨基酸态氮的含量最为突出,含量高达0.748 g/100 g,在发酵过程中利用了更多的底物,使之分解为游离氨基酸,提高豆醅品质。
3.2.2 豆醅游离氨基酸测定
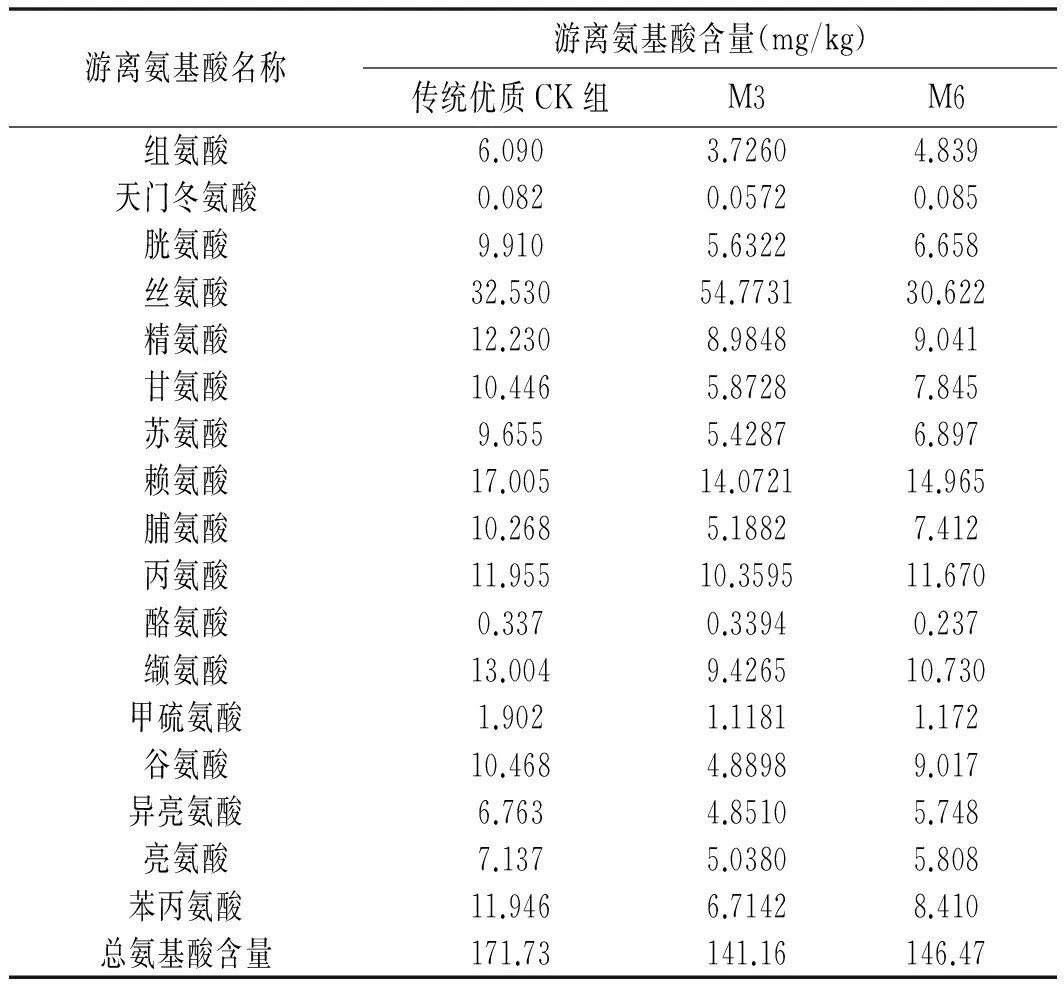
表3 游离氨基酸含量表Table 3 Table of free amino acid content
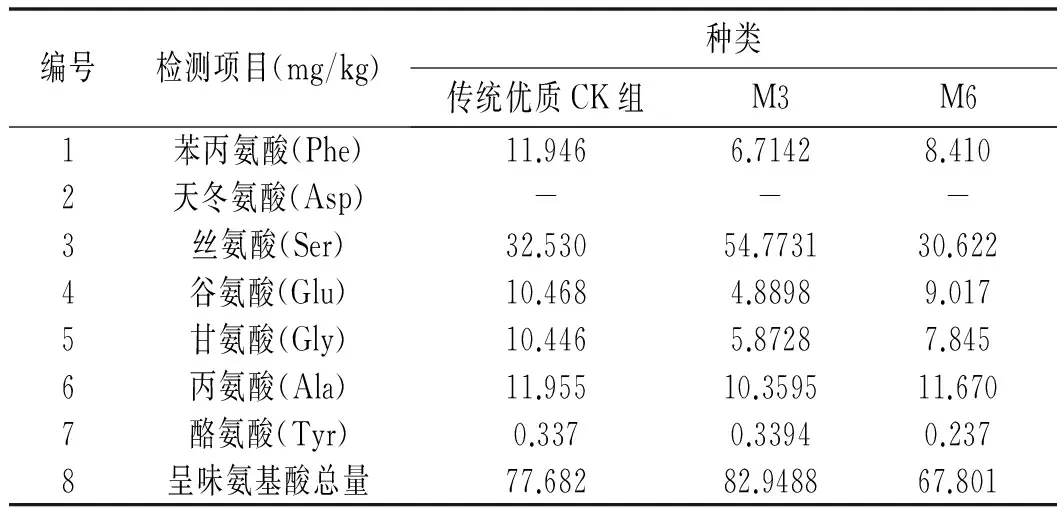
表4 呈味氨基酸含量表Table 4 Table of flavor amino acid content
注:-表示未检出。
决定豆瓣辣酱风味的氨基酸主要为苯丙氨酸(Phe)、天冬氨酸(Asp)、丝氨酸(Ser)、谷氨酸(Glu)、甘氨酸(Gly)、丙氨酸(Ala)及酪氨酸(Tyr),由表3和表4可知,传统优质CK组豆醅中的呈味氨基酸为77.682 mg/g,占总氨基酸的45.23%;加M3菌组豆瓣辣酱中的呈味氨基酸为82.9488 mg/g,占总氨基酸的56.63%;加M6菌组豆瓣辣酱中的呈味氨基酸为67.801 mg/g,占总氨基酸的48.03%。可知菌群强化对于风味氨基酸的产出是有利的,所占比重均比传统优质CK组值大,这说明2株高产酶菌株对风味有着明显改善作用。
4 结论与讨论
4.1 结论
对从豆瓣辣酱微生物区系中筛选且已鉴定的5株霉菌菌株M2~M6进行高产蛋白酶菌株及高产肽酶菌株的筛选,结果表明:菌株M3产蛋白酶能力明显,菌株M6产肽酶能力突出,因此确定这2株菌为目标菌株,进行引用。
将菌株应用于发酵中,使发酵豆醅成为菌群强化实验组,与传统优质CK强化组比较,可明显看出2株高酶活菌株具有一定的促熟、增香作用。且2株高酶活菌株应用于发酵后,产品理化指标均有部分优化,这表明高酶活菌株应用于生产上是切实可行的,具有优势。
4.2 讨论
本试验所得结论证实了高酶活菌株对豆醅发酵起到促进作用的预想,且证明了高酶活菌株应用于产品中确实能改善产品风味,提高产品营养价值。但是,菌株如何高效使用和菌株的保存,以及工业化生产还是拟待解决的问题。同时,菌株的安全性测试还应该继续完善。传统工艺与现代科学技术的完美结合将是今后努力追求的目标。
[1]李红玫,刘忠华.豆瓣酱发酵工艺的优化[J].中国调味品,2012,37(6):65-70.
[2]Caplice E,Fitzgerald G F.Food fermentations: role of microorganisms in food production and preservation[J].International Journal of Food Microbiology,1999,50(1-2):131-149.
[3]Wanakhachornkrai P,Lertsiri S.Comparison of determination method for volatile compounds in Thai soy sauce[J].Food Chemistry,2003,83(4):619-629.
[4]Hansen E B.Commercial bacterial starter cultures for fermented foods of the future[J].International Journal of Food Microbiology,2002,78(1-2):119-131.
[5]杨永成.培养条件对发酵果蔬制品乳酸菌生长的影响研究[J].商品与质量·学术观察,2014(3):162.
[6]陈方博.传统豆酱中蛋白酶和淀粉酶高产菌株的选育[D].哈尔滨:黑龙江大学,2010.
[7]杨天波.蛋白酶水解酪蛋白透明圈初筛方法的条件探索与应用效应[J].河北大学学报(自然科学版),1982(2):19-23.
[8]李永霞,秦礼康.细菌胞壁破碎条件优化及高肽酶菌株的筛选[J].食品与发酵工业,2012,38(4):89-93.
[9]赵建,郭本恒,陈卫,等.肽酶高产菌株的筛选及其生物学特性研究[J].乳业科学与技术,2007,30(2):69-72.
ScreeningofHighEnzymeActivityStrainsfromBeanChiliSauceandResearchonRipeningPromotionofBeanFermentedGrains
DAN Qian, MAO Jia-yi, ZENG Hai-ying*
(College of Liquor and Food Engineering,Guizhou University,Guiyang 550025,China)
Take the five dominant moulds M2~M6 separated and identified from microflora of bean chili sauce as test strains, screen high-yield protease and peptidase strains and apply them for fermenting bean fermented grains, in order to explore the application feasibility of shortening fermentation period, promoting flavor and improving quality compared with the traditional fermentation. The protease activity of M3 reaches 139.49 U/mL and the peptidase activity of M6 reaches 1.039 mg/dL. The fermentation time is shortened to 20 days (the traditional fermentation period is 60~90 days). The content of amino acid in M3 group is 56.63% and that in M6 group is 48.03%.At the same time, that of the traditional high-quality CK group is only 45.23%, the difference is significant (P<0.05).
bean chili sauce;high proteinase;high peptidase;ripening promotion;flavor
TS264.29
A
10.3969/j.issn.1000-9973.2017.12.010
1000-9973(2017)12-0050-04
2017-06-12 *通讯作者
曾海英(1978-),女,贵州贵阳人,副教授,研究方向:食品发酵与安全。

