静脉动脉模式体外膜肺氧合辅助导致左心室卸载不足的防治
胡伟航,龚仕金
·专家述评·
静脉动脉模式体外膜肺氧合辅助导致左心室卸载不足的防治
胡伟航1,龚仕金2
在静脉动脉模式体外膜肺氧合(venoarterial extracorporeal membrane oxygenation,VA ECMO)辅助治疗心源性休克过程中,逆向血流常导致左心室卸载不足,影响支持效果。在此我们总结左心室卸载不足的防治经验。通过一些临床实践的观察,发现通过床边超声、Swan_Ganz导管、平均动脉压和脉压差等监测能预防左心室卸载不足;在临床监测手段的严格指导下,调整流量及药物辅助可以纠正大部分左心室卸载不足;严重患者可以行左心室减压。在严密的临床监测下,仔细调整离心泵流量和/或辅以药物治疗,左心室卸载不足大部分能被防治。选择左心室减压要慎重。
VA ECMO就是将静脉血从右心房引出体外,在氧合器内排出二氧化碳,吸进氧气,再用离心泵通过股动脉逆向将氧合血送回体内(见图1)[1]。VA ECMO最大可提供7L/min流量的循环支持,主要用于心源性休克患者的辅助支持[2,3]。但离心泵所产生的血流为逆向血流①,受损心脏自身泵出血流为前向血流②,①和②相遇形成分水岭(见图2)[1]。
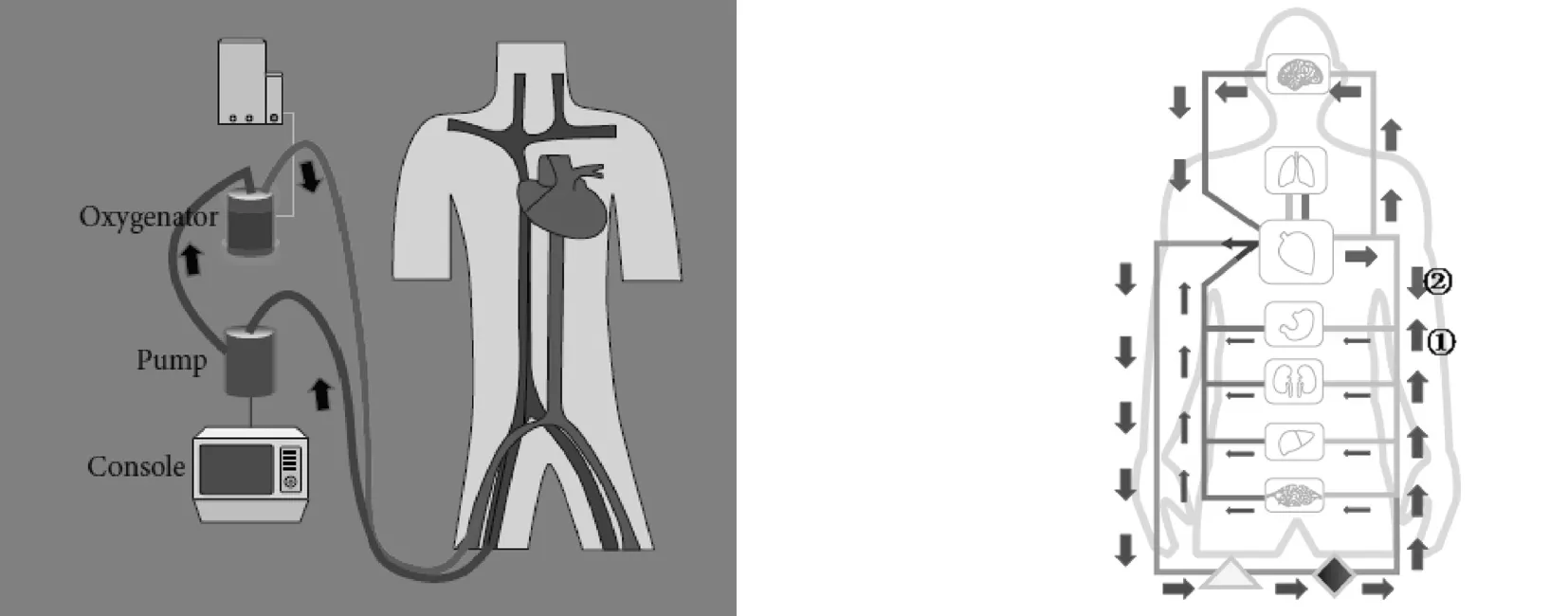
图1 VA ECMO的模拟图 图2 VA ECMO的模拟血流
Rupprecht等[4]通过CT扫描已经证实这现象(见图3)。如果①和②不相匹配,会增加心脏后负荷,室壁应力上升,左心室扩张,心肌氧耗增加,影响心脏功能恢复。进一步可能影响瓣膜的开闭或引起返流,左心室腔内血流减慢、形成涡流及附壁血栓,同时可导致左心室舒张末期压力升高,左心室、左心房和肺静脉高压,肺血管静水压升高,肺水肿,最终导致急性呼吸窘迫综合征[5~8]。
VA ECMO逆向血流导致负荷增加的现象又称左心室卸载不足[9,10]。文献提示10%~60%VA ECMO辅助患者发生左心室卸载不足,影响支持效果,严重者甚至可能需要进行左心室减压[4~7]。而左心室减压增加ECMO复杂性的同时,有创的操作也增加了发生并发症的可能,应尽量避免。本文重点关注VA ECMO支持左心室卸载不足的防治。
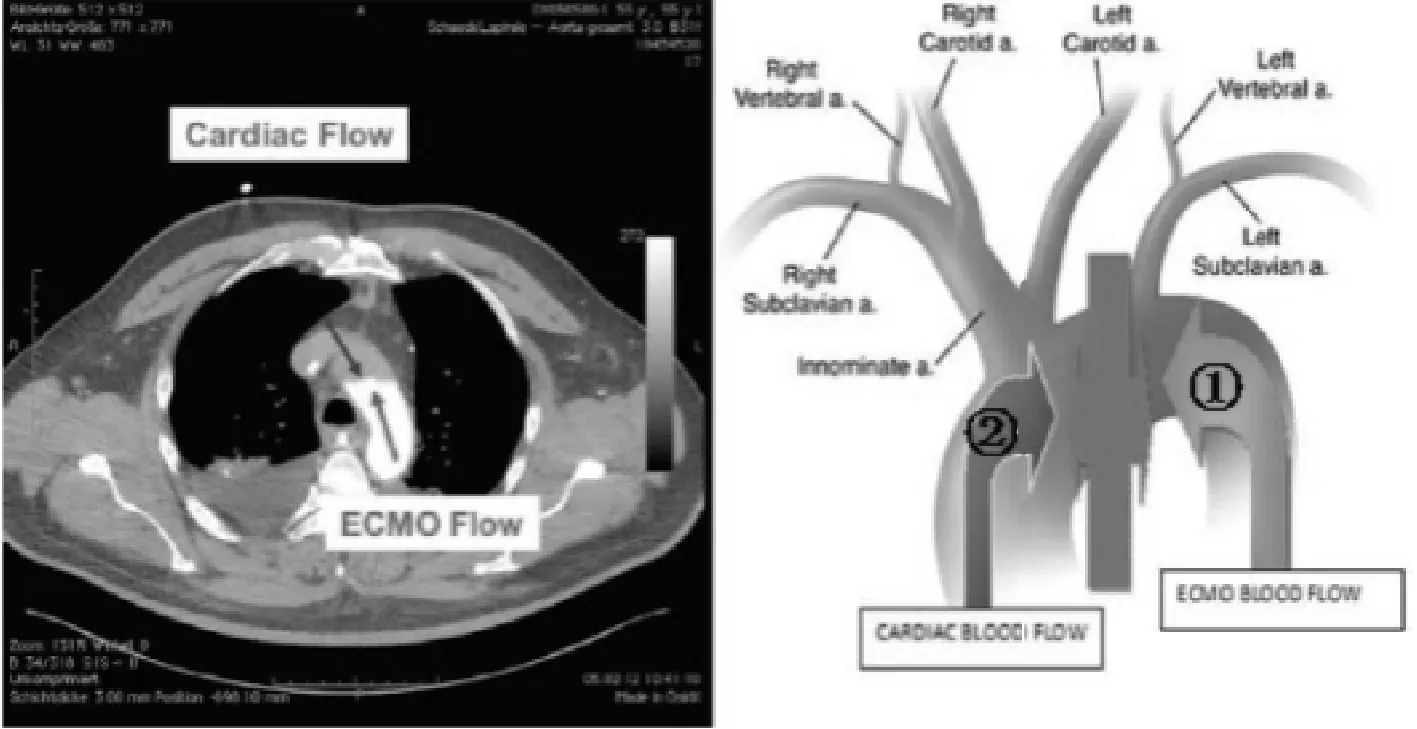
图3 摘自Rupprecht L,et al.ASAIO J,2013,59(6):547_553
1 预防VA ECMO左心室卸载不足常见监测手段
①和②相匹配的理想状态是ECMO引流充分(减轻心脏前负荷,让左心室尽可能休息);离心泵提供最佳灌注压,能满足机体所需的血供和氧供;同时分水岭没有增加心脏后负荷及心脏做功;从而病理状态的心脏能得到充分休息(最佳的心脏前后负荷),为心脏恢复创造理想的条件。针对理想状态目前几乎没有专业文献推荐,只有一些临床实践指导[4,5,11]。
每日床边超声监测VA ECMO的血流动力学是首选[12,13]。超声确定静脉插管的头端位于下腔的开口,以起到最佳引流效果;每天监测左心室大小,保证左心室足够低的前负荷;监测心肌收缩和瓣膜情况,了解左心室腔内是否存在血流静止、涡流、血栓和各瓣膜是否存在返流;最主要可通过监测左室流出道速度时间积分(left ventricular outflow tract velocity time integral,LVOT VTI),在排除主动脉瓣膜病变的情况下,调节离心泵的流量,根据LVOT VTI的变化,大致可判断①和②相匹配的程度。
Swan_Ganz导管可监测肺毛细血管楔压(pulmonary capillary wedge pressure,PAWP)及右心室心排血量[4,5]。PAWP监测值,在排除右心引流欠佳和容量过负荷的情况下,基本可作为左心室前负荷的判断依据。超过18mmHg认为左心室卸载不足[5]。而心排血量由于是右房引流的关系,存在高估,只作为参考指标[4]。
有创监测平均动脉压和脉压差[14,15]。左心室功能极差的患者,为维持平均压50~60mmHg,满足机体灌注需求,不建议无限提高离心泵流量,可以辅助强心药(如肾上腺素、左西孟旦)和升压药(如去甲肾上腺素)。脉压差反应①和②博弈的结果[11,16,17]。①是平流血流;②是搏动血流。排除主动脉瓣膜病变等,脉压差大时,说明②能流向远端。但脉压差个位数甚至平流灌注时,①占据主流,预示左心室卸载不足将可能发生[17]。
2 左心室减压流指针
不是所有VA ECMO左心室卸载不足患者均需要进行左心室减压。Rupprecht团队超过500例VA ECMO患者,需要左心室减压也仅占1%[4]。目前没有指南推荐左心室减压的指征,仅凭临床经验。左心室卸载不足绝大部分发生在VA ECMO辅助后心脏功能未恢复处于休息状态阶段[4~6,11,14]。此时,心肌收缩力最低,受损心脏心排血最小,②前向动力最差,为满足机体高应激代谢需求,离心泵提高的逆向血流①又需最大负载。故此,①和②最有可能发生不相匹配,导致左心室卸载不足。加用强心药、升压药或血管舒张剂,增加②前向力量,降低①流量,使两者分水岭离主动脉瓣膜足够远,能缓解大部分左心室卸载不足[1,2,18]。但强心药和升压药能增加心肌氧耗和重构,因此建议在监测手段的指导下调整,尽量减少用量,达到最佳临床效果。
经过床边监测和调整流量及药物后,出现下列情况时,临床建议左心室减压[4,5]:心脏心排血量极其低下和主动脉瓣膜没有开放,左心室血流静止、涡流或血栓形成;主动脉瓣膜返流导致左室膨胀;无法控制“白肺”。
3 左心室减压方式
目前左心室减压主要分为外科手术和经皮两种方式[4,5]。我们团队为内科性质团队,故更关注操作简单、快速的经皮左心室减压方法。经皮左心室减压按减压效果分为部分减压和完全减压。部分减压常用的方法是ECMO联合主动脉球囊反搏(intra_aortic balloon pump,IABP)[19,20]。我们团队研究ECMO辅助暴发性心肌炎患者发现IABP能将平流灌注转化为搏动灌注,提高灌注效能超过20%,降低交感兴奋(见图4、5)[16,17]。

图4 左心室卸载不足 A,B为心室停滞。床边心超:左室扩大(前后径5.6cm),室间隔厚约1.2cm,室壁运动弥漫性减弱,LVEF约20%左右,左室腔见云雾影。心电监护:脉压差未0mmHg。C为平流灌注。心电监护:脉压差未0mmHg。
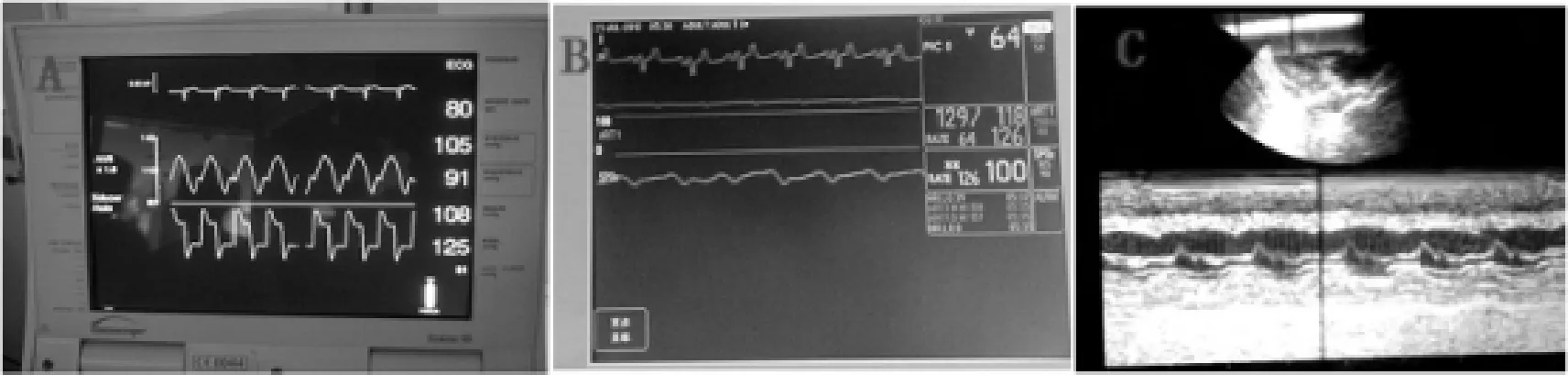
图5 ECMOL联合IABP A,B:植入IABP恢复搏动灌注,ES未再发作。C:心脏超声左室略大(前后径5.1cm),室间隔厚约1.1cm,室壁运动好转,LVEF约36%左右,左室腔未及血栓形成。
IABP能降低逆向血流增加的后负荷。两者作用的叠加,起到左室卸载的功能[16,17]。然而动物实验证实[21]IABP降低了ECMO辅助患者的平均动脉压和冠状窦血氧含量,加上只是部分减压效果,由此外推用于急性心肌梗死心源性休克患者的支持可能不是十分理想的方法。Barbone团队[22]利用7F猪尾巴进入左室和Avalli团队[23]使用肺动脉导管进入肺动脉通过“Y”管连接ECMO静脉端进行引流减压取得了成功。Yen_Nein团队[24]将房间隔造口术用于充血性心力衰竭和肺动脉高压患者,救治了部分ECMO左心室卸载不足患者。部分减压方式对严重主动脉瓣返流和顽固性“白肺”患者减压不彻底,需要完全减压方式[4,5]。Impella 2.5[25,26]选择至少14F的导管从股动脉进入左心室进行引流,TandemHeart[27]引流导管从股静脉入右心房穿房间隔入左心室,引流效果优于Impella 2.5,但操作更复杂,费用更昂贵。另外,花费较少、引流较完全的方式还有16F~20F的引流管从股动脉或锁骨下动脉进入左心室或股静脉入右心房穿房间隔入左心室完全引流左心室血,通过“Y”管进入ECMO静脉端,回到体循环[28~30]。弊端在于管径粗,容易损伤血管,同时增加ECMO的复杂性[4,5]。
受限于样本量,目前对左心室减压的成功率没有临床统计,只有临床实践案例的报道。
VA ECMO辅助心源性休克,逆向血流引起的左心室后负荷增加与受损心脏自身血流之间不匹配导致左心室卸载不足,通过严格的临床监测、调整离心泵流量或辅以药物治疗,大部分能被防治。我国大部分医院在现有的技术条件下,左心室减压是严重病例的最后选择。由于缺乏指南等权威文献的推荐和对照研究结论,上述结果只是临床观察的经验。
[1]Zhong ZP, Wang H, Hou XT. Extracorporeal Membrane Oxygenation as a Bridge for Heart Failure and Cardiogenic Shock[J]. Biomed Res Int,2016,2016:7263187.
[2]Tariq S, Gass A. Use of Extracorporeal Membrane Oxygenation in Refractory Cardiogenic Shock[J]. Cardiol Rev,2016,24(1):26-29.
[3]Werdan K, Gielen S, Ebelt H, et al. Mechanical circulatory support in cardiogenic shock[J]. Eur Heart J,2014,35(3):156-167.
[4]Rupprecht L, Florchinger B, Schopka S, et al. Cardiac decompression on extracorporeal life support: a review and discussion of the literature[J]. ASAIO J,2013,59(6):547-553.
[5]Alkhouli M, Narins CR, Lehoux J, et al. Percutaneous Decompression of the Left Ventricle in Cardiogenic Shock Patients on Venoarterial Extracorporeal Membrane Oxygenation[J]. J Card Surg, 2016,31(3):177-182.
[6]Jumean M, Pham DT, Kapur NK. Percutaneous bi_atrial extracorporeal membrane oxygenation for acute circulatory support in advanced heart failure[J]. Catheter Cardiovasc Interv, 2015,85(6):1097-1099.
[7]Eudailey KW, Yi SY, Mongero LB, et al. Trans_diaphragmatic left ventricular venting during peripheral venous_arterial extracorporeal membrane oxygenation[J]. Perfusion,2015,30(8):701-703.
[8]Weymann A, Schmack B, Sabashnikov A, et al. Central extracorporeal life support with left ventricular decompression for the treatment of refractory cardiogenic shock and lung failure[J]. J Cardiothorac Surg,2014,9:60.
[9]Peterss S, Pfeffer C, Reichelt A, et al. Extracorporeal life support and left ventricular unloading in a non_intubated patient as bridge to heart transplantation[J]. Int J Artif Organs,2013,36(12):913-916.
[10]Cheng A, Swartz MF, Massey HT. Impella to unload the left ventricle during peripheral extracorporeal membrane oxygenation[J]. ASAIO J,2013,59(5):533-536.
[11]Burkhoff D, Sayer G, Doshi D, et al. Hemodynamics of Mechanical Circulatory Support[J]. J Am Coll Cardiol,2015,66(23):2663-2674.
[12]Doufle G, Roscoe A, Billia F, et al. Echocardiography for adult patients supported with extracorporeal membrane oxygenation[J]. Crit Care,2015,19:326.
[13]Platts DG, Sedgwick JF, Burstow DJ, et al. The role of echocardiography in the management of patients supported by extracorporeal membrane oxygenation[J]. J Am Soc Echocardiogr,2012,25(2):131-141.
[14]Chung M, Shiloh AL, Carlese A. Monitoring of the adult patient on venoarterial extracorporeal membrane oxygenation[J]. ScientificWorldJournal,2014,2014:393258.
[15]Ostadal P, Kruger A, Vondrakova D, et al. Noninvasive assessment of hemodynamic variables using near_infrared spectroscopy in patients experiencing cardiogenic shock and individuals undergoing venoarterial extracorporeal membrane oxygenation[J]. J Crit Care,2014,29(4):611-690.
[16]Hu W, Chen L, Liu C, et al. Three cases of electrical storm in fulminant myocarditis treated by extracorporeal membrane oxygenation[J]. Am J Emerg Med, 2015,33(4):603-606.
[17]Hu W, Liu C, Chen L, et al. Combined intraaortic balloon counterpulsation and extracorporeal membrane oxygenation in 2 patients with fulminant myocarditis[J]. Am J Emerg Med,2015,33(5):731-736.
[18]Patrick H. “The rhythm is gonna get you...”: extracorporeal membrane oxygenation with and without intra_aortic balloon pumps[J]. Crit Care Med,2014,42(9):2143-2144.
[19]Petroni T, Harrois A, Amour J, et al. Intra_aortic balloon pump effects on macrocirculation and microcirculation in cardiogenic shock patients supported by venoarterial extracorporeal membrane oxygenation[J]. Crit Care Med,2014,42(9):2075-2082.
[20]Yang F, Jia ZS, Xing JL, et al. Effects of intra_aortic balloon pump on cerebral blood flow during peripheral venoarterial extracorporeal membrane oxygenation support[J]. J Transl Med,2014,12:106.
[21]Lehmann S, Uhlemann M, Etz CD, et al. Extracorporeal membrane oxygenation: experience in acute graft failure after heart transplantation[J]. Clin Transplant,2014,28(7):789-796.
[22]Barbone A, Malvindi PG, Ferrara P, et al. Left ventricle unloading by percutaneous pigtail during extracorporeal membrane oxygenation[J]. Interact Cardiovasc Thorac Surg,2011,13(3):293-295.
[23]Avalli L, Maggioni E, Sangalli F, et al. Percutaneous left_heart decompression during extracorporeal membrane oxygenation: an alternative to surgical and transeptal venting in adult patients[J]. ASAIO J,2011,57(1):38-40.
[24]Yen_Nein Lin, Ping HL. Trans_septal decompression of the left atrium during extracorporeal membrane oxygenation by Inoue balloon cathetert[J]. J Am Coll Cardiol,2015,65:S46-S47.
[25]Koeckert MS, Jorde UP, Naka Y, et al. Impella LP 2.5 for left ventricular unloading during venoarterial extracorporeal membrane oxygenation support[J]. J Card Surg,2011,26(6):666-668.
[26]Narain S, Paparcuri G, Fuhrman TM, et al. Novel combination of impella and extra corporeal membrane oxygenation as a bridge to full recovery in fulminant myocarditis[J]. Case Rep Crit Care,2012,2012:459296.
[27]Li YW, Rosenblum WD, Gass AL, et al. Combination use of a TandemHeart with an extracorporeal oxygenator in the treatment of five patients with refractory cardiogenic shock after acute myocardial infarction[J]. Am J Ther,2013,20(2):213-218.
[28]Hong TH, Byun JH, Yoo BH, et al. Successful Left_Heart Decompression during Extracorporeal Membrane Oxygenation in an Adult Patient by Percutaneous Transaortic Catheter Venting[J]. Korean J Thorac Cardiovasc Surg,2015,48(3):210-213.
[29]Chocron S, Perrotti A, Durst C, et al. Left ventricular venting through the right subclavian artery access during peripheral extracorporeal life support[J]. Interact Cardiovasc Thorac Surg,2013,17(1):187-189.
[30]Kang MH, Hahn JY, Gwon HC, et al. Percutaneous transseptal left atrial drainage for decompression of the left heart in an adult patient during percutaneous cardiopulmonary support[J]. Korean Circ J,2011,41(7):402-404.
2017_5_2)

〔专家简介〕胡伟航(1979_),杭州市第一人民医院危重病医学科副主任,副主任医师。目前博士在读。擅长ECMO用于严重循环呼吸衰竭的支持,对ARDS、急性肾衰、重症急性胰腺炎、MODS,高危孕产妇抢救的较丰富的临床经验。负责省市2项科研课题,发表专业学术论文10篇。

〔专家简介〕龚仕金(1963_),浙江医院重症医学科ICU主任,主任医师,医学硕士。担任浙江省医学会重症医学分会常委兼秘书,浙江省中西医结合学会重症医学专业委员会副主任委员,浙江省ICU质控中心常务副主任。曾在美国纽约州立大学上州医学院访问学习。擅长老年危重病的诊治,对多种危重症如心力衰竭、呼吸衰竭、感染性休克和多脏器功能失常综合征具有极其丰富的诊治与抢救经验,对老年高血压、心律失常、β_受体阻滞剂的临床应用及危重病血流动力学监测有较深的造诣,能承担血流动力学监测与支持、机械通气、营养支持治疗、严重感染与严重创伤救治等全省性技术指导工作。负责多项科研课题,取得多项科研成果。负责的项目《持续右心舒张末容量检测对伴胸内压增高的老年危重病容量状态的评估》获2010浙江省医药卫生科技三等奖,参与的有关老年危重病诊治的课题获浙江省科技进步三等奖。发表专业学术论文30余篇,出版专著1本。为国家临床重点专科及浙江省医学重点学科、支撑学科——重症医学的主要参与者。第七届浙江省优秀医师奖获得者。
(收稿日期:2016_11_30)
1.310006 杭州市第一医院危重病医学科;2.310013 浙江医院重症医学科
胡伟航(详见文后专家简介),科副主任,副主任医师
龚仕金(详见文后专家简介),电子邮箱:gsj801@126.com
R54
A
1009_816X(2017)04_0249_04
10.3969/j.issn.1009_816x.2017.04.02

