40排螺旋CT血管成像对疑似颅内动脉瘤患者的应用价值研究
周 军,单 凯,张秀富
(重庆市江津区中心医院放射科,重庆 402260)
40排螺旋CT血管成像对疑似颅内动脉瘤患者的应用价值研究
周 军,单 凯,张秀富
(重庆市江津区中心医院放射科,重庆 402260)
目的探讨40排螺旋CT血管成像(CTA)对疑似颅内动脉瘤患者的应用价值。方法对153例疑似颅内动脉瘤患者分别采用40排螺旋CTA和数字减影血管造影(DSA)检查,对比两种方法检测颅内动脉瘤的例数、敏感性、特异性、准确性、阳性预测值、阴性预测值、真阳性率、假阳性率、假阴性率。结果40排螺旋CTA与DSA比较,检出颅内动脉瘤患者55例、敏感性为100%、特异性为98.99%、准确性为99.35%、阳性预测值为98.18%、阴性预测值为100%、真阳性率为100%、假阳性率为1.01%、假阴性率为0%。其图像能够清楚地显示动脉瘤位置、瘤体的大小、载瘤动脉与血管的三维空间关系等。结论40排螺旋CT可以作为疑似颅内动脉瘤患者筛查的主要手段。
颅内动脉瘤;CT血管成像;数字减影血管造影
颅内动脉瘤是脑血管局部异常改变而产生的血管瘤样突起,占自发性蛛网膜下腔出血(subarachnoid hemorrhage,SAH)的50%~80%[1],病死率、致残率极高,总病死率40%~50%[2]。因此,早期发现并确诊颅内动脉瘤对患者的治疗及预后意义重大。本研究通过对153例临床疑似颅内动脉瘤的患者分别行CT血管成像(CTA)与相应数字减影血管造影(DSA)检查对比分析,探讨40排螺旋CTA检查在筛查颅内动脉瘤中的应用价值,现报道如下。
1 资料与方法
1.1一般资料2009~2015年我院收治的153例疑似颅内动脉瘤患者,男90例,女63例;年龄29~75岁[(43.2±17.5)岁]。均行40排螺旋CT脑血管成像检查和DSA检查。入选标准:临床表现为突发异常剧烈全头痛不典型,或伴发一过性意识障碍和恶心、呕吐,或发病前数日或数周有轻微头痛表现,或头痛可持续数日不变而10天后逐渐减轻,或头痛再次加重,或有一项以上流行病学因素如吸烟,高血压,饮酒(特别是在一次性社交聚会后或狂饮后),或有一项以上SAH的个人史或家族史如多囊肾、遗传性结缔组织缺陷病如肌纤维性发育不良等,或有一项以上体征如视网膜或玻璃体膜下出血、颈强、任何确切的局部或全身的神经体征等,或镰状细胞贫血和al-抗胰岛蛋白酶缺乏等;但均无昏睡、昏迷等严重意识障碍。
1.2CTA仪器与方法应用SemenzsSomatom Sensation 40排螺旋CT扫描系统,DSA模式进行扫描(双序列,即平扫+增强双期);应用370 mgI/100 ml造影剂,注射速度4.5~5.0 ml/s,注射总量65~75 ml;扫描参数:由颅底至颅顶扫描,100 kV,160 mAs,探测器用64×0.6 mm,扫描层厚0.75 mm,螺距0.75∶1,转速0.33 s/周,床速13.90 mm/s;CTDIvol:2~4 mSv,平均2.39 mSv。获得图像自动传输至工作站进行图像后处理,分别进行减影后容积再现(volune rendering,VR)、最大密度投影(maximum intensity projection,MIP),动脉期VR、曲面重组(cured planner reformation,CPR)、多平面重组(multiple planner reformation,MPR)等,由2名长期从事血管影像诊断的高年资医师负责对图像进行独立分析,遇有争议者两人协商取得共识。
1.3DSA仪器与方法检查时间为发病后1~30天,采用SemenzsArtis zee floor DSA系统,头部扫描定位后行对比增强扫描,经颈内静脉注入非离子造影剂1.0~2.0 ml/kg,共6 s,延迟0.5 s开始扫描,颅内动脉在扫描过程中持续显影,原始图像传至思创工作站进行后处理。高压注射器采用MEDRAD 公司的MARKⅡ 型高压注射器系统。
1.4判定标准颅内动脉薄弱部分局限性膨出改变[3]。以DSA检查结果作为“金标准”[4~6],若两种检查结果同为阳性,则定义CTA结果为真阳性;两种检查结果同为阴性,则定义CTA结果为真阴性;DSA结果阴性,而CTA结果阳性,则定义CTA结果为假阳性;DSA结果阳性,而CTA结果阴性,则定义CTA结果为假阴性。
1.5统计学方法采用SPSS 19.0软件对所得数据进行统计学分析。计数资料比较采用χ2检验,Kappa指数评估两种方法的一致性。P< 0.05为差异有统计学意义。
2 结果
本组CTA检出颅内动脉瘤55例,阳性检出率35.95%,阴性检出率64.05%;DSA检出颅内动脉瘤54例,阳性检出率35.29%,阴性检出率64.71%。40排螺旋CTA检出动脉瘤瘤体75个,其中直径小于10 mm的一般性动脉瘤瘤体数55个(73.33%),直径10~25 mm的大动脉瘤瘤体数15个(20.00%),直径大于25 mm的巨大动脉瘤瘤体数5个(6.67%);小于30岁3例(5.45%),30~50岁38例(69.09%),大于50岁14例(25.46%);检出颅内动脉瘤位置分布见表1。DSA检出动脉瘤瘤体74个,其中直径小于10 mm的一般性动脉瘤瘤体数54个(72.97%),直径10~25 mm的大动脉瘤瘤体数15个(20.27%),直径大于25 mm的巨大动脉瘤瘤体数5个(6.76%)(图1~图3)。其中小于30岁3例(5.56%),30~50岁38例(70.37%),大于50岁13例(24.07%),检出颅内动脉瘤位置分布见表2。以DSA检查结果作为“金标准”,两种方法对颅内动脉瘤检测结果比较,差异无统计学意义(P> 0.05),Kappa=0.986,说明两种方法检测颅内动脉瘤一致性好,见表3。40排螺旋CTA检测颅内动脉瘤的敏感性为100%、特异性为98.99%、准确性为99.35%、阳性预测值为98.18%、阴性预测值为100%、真阳性率为100%、假阳性率为1.01%、假阴性率为0%。

表1 40排螺旋CTA检出颅内动脉瘤位置分布情况

表2 DSA检出颅内动脉瘤位置分布情况
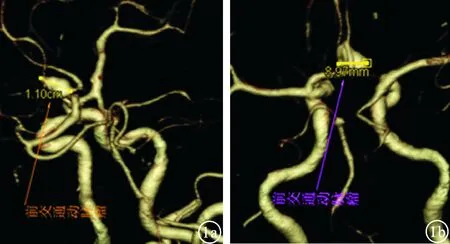
图1 显示前交通动脉动脉瘤VR图像 a:去骨斜位长径;b:去骨正位短径
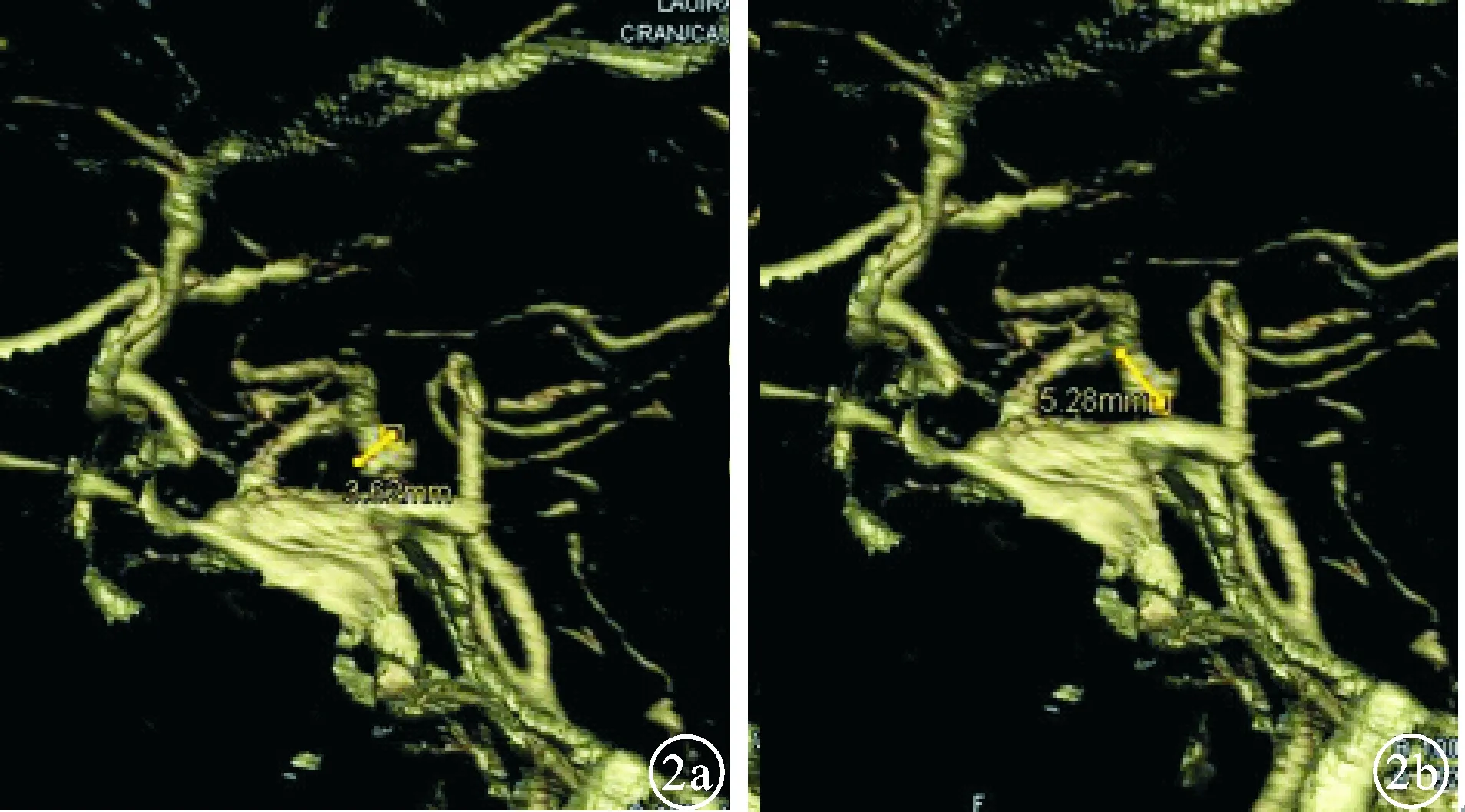
图2 显示后交通动脉瘤VR图像 a:去骨斜位短径;b:去骨斜位长径
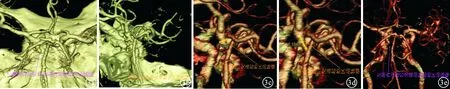
图3 显示后交通动脉动脉瘤VR图像 a:带骨正位;e:去骨正位;b:带骨斜位;c:去骨斜位短径;d:去骨斜位长径
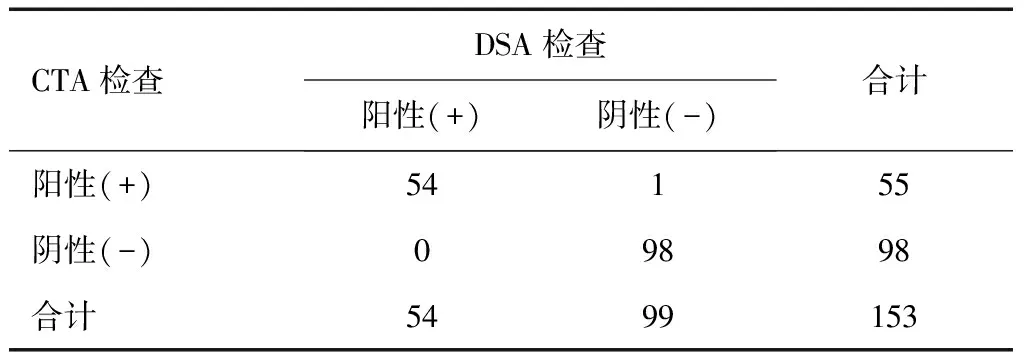
CTA检查DSA检查阳性(+)阴性(-)合计阳性(+)54155阴性(-)09898合计5499153
3 讨论
临床上颅内动脉瘤的平均发病率为2.4%[1],总死亡率却高达40%~50%[2],该病早期诊断主要依赖于影像学检查。DSA一直被认为是评价颅内血管病变的“金标准”,尤其对于动脉瘤等有较高的诊断价值[4~6]。近年来随着多层螺旋CT技术的不断发展,CT在本病诊断中发挥着重要作用,尤其对疑似颅内动脉瘤患者的筛查,意义更是日趋显著。
3.140排螺旋CTA与DSA检查对疑似颅内动脉瘤患者的比较本研究CTA检出颅内动脉瘤55例,阳性检出率35.95%;DSA检出54例,阳性检出率35.29%,阳性病例年龄30~50岁,与既往研究一致[7,8]。与DSA检查结果相比,CTA检出1例假阳性,且CTA在颅内动脉瘤检出率、敏感性、阴性预测值方面与DSA一致,与既往报道一致[9,10]。值得注意的是,DSA为有创检查且操作复杂,在图像采集过程中因颅内动脉持续显影,成像时间长,加大了患者的X射线辐射剂量;此外,该检查费用昂贵,对比剂使用量大,检查过程中有一定诱发动脉瘤破裂的风险,因此,临床上大多数患者不愿作为动脉瘤筛查首选的检查手段,更多作为介入治疗手段[11]。
3.240排CT的CTA检查疑似颅内动脉瘤的优点随着多层螺旋CT技术的迅速发展及相关后处理软件的日益成熟,目前CTA检查已成为颅内动脉瘤诊断及筛查的主要检查方法。Westerlaan等[12,13]报道,CTA检出颅内动脉瘤的敏感性为77%~97.8%,特异性为100%,检出的动脉瘤最小直径为2 mm,本研究40排螺旋CTA检查对疑似颅内动脉瘤的检出率、灵敏度和特异度分别为100%、100%和98.99%,与上述报道差别不大;此外,本研究中颅内动脉瘤多位于Willis环,与相关文献报道一致[14]。多排螺旋CTA检查因其强大的后处理技术,其中薄层多平面重建不仅减少了脑皮质干扰,使细小血管分支显示更清晰,而且在保持血管连续性的同时,更加便于影像医生观察血管走行及其邻近关系,如:VR动态图像能够清晰地显示瘤体与血管及邻近结构情况,使得颅内动脉瘤显示更加清晰和立体,在提高诊断特异性的同时[15],还为临床医生制定手术方案提供了重要信息。此外,CTA检查凭借无创,价格低廉,检查时间短,低造影剂使用量,低辐射剂量,低动脉瘤破裂风险率等优点,患者更容易接受行该种检查方法进行筛查。
3.3CTA检查疑似颅内动脉瘤展望颅内动脉瘤致使SAH 30~40岁发病率最高,出血后及时明确诊断对患者治疗和预后有重要意义,出血前及时筛查对颅内动脉瘤患者的的治疗和预后意义重大[3,7]。近年来,有研究表明CTA检查颅内动脉瘤的X线辐射量显著下降,其CTA检查颅内动脉瘤的剂量相当于CT平扫的检查剂量,远远低于DSA检查的辐射剂量[16]。
综上所述,40排螺旋CT的CTA检查可以作为疑似颅内动脉瘤患者筛查首选,阳性患者可以根据CTA评估情况选择DSA放射介入治疗或手术治疗,阴性患者结合临床评估确定是否进一步行DSA检查,以减少患者痛苦和经济负担。
[1] 贾建平.神经病学[M].北京:人民卫生出版社,2013:192-781.
[2] 顾文豪,唐旦华.MSCTA在自发性蛛网膜下腔出血动脉瘤筛查中的价值[J].中国现代药物应用,2013,7(8):8.
[3] Vlakm H,Algra A,Brandenburg R,et al.Prevalence of unruptured intracranial aneurysms,with emphasis on sex,age,comorbidity,country,and time period:a systematic review and meta-analysis[J].Lancet,2011,10(7):626-636.
[4] 黄俊,郭富强,陈士俊.大脑中动脉粥样硬化狭窄的3.0 T HR-MRI和DSA比较研究[J].中国临床医学影像杂志,2014,25(8):551.
[5] Cao YL,Wang Y,Hou HT,et al.The application valueof 3D DSA in diagnosis intracranial aneurysms[J].Journal of Medical Imaging,2011,4:500-502.
[6] Marinho P,Thines L,Verscheurel L.Recent advances in cerebrovascular simulation and neuronavigation for the optimization of intracranial aneurysm clipping[J].Comput Aided Surg,2012,17(2):47-55.
[7] 郭启勇.实用放射学[M].北京:人民卫生出版社,2012:198.
[8] 李金坤,孙晓娟,吴洪涛,等.颅内动脉瘤破裂的患者预后影响因素分析[J].中华老年心脑血管病杂志,2015,17(6):614-615.
[9] 徐文,郑晓林.256层螺旋CT血管成像诊断脑动脉瘤的价值并与DSA的比较[J].中国CT和MRI杂志,2014,12(4):91-93.
[10]毛文,刘海潮,龚一令.64 排双能CT 与数字减影血管造影诊断颅内动脉瘤的对比研究[J].实用医技杂志,2013,20(10):1059-1060.
[11]刘新峰.脑血管病介入治疗学[M].北京:人民卫生出版社,2006:22-23.
[12]Donmez H,Serifov E,Kahriman G,et al.Comparison of 16-row multslice CT angiographywith conventional angiography for detection andevaluation of intracranial aneurysms[J].Eur J Ridiol,2011,80(2):455-461.
[13]林荣良,李传旺,唐平太,等.急诊3D-CTA 对破裂性颅内动脉瘤的临床诊断价值[J].罕少疾病杂志,2013,20(5):36-39.
[14]熊伟.脑动脉系统组成和结构研究进展[J].福建医药杂志,2013,35(8):153.
[15]Numminen J,Tarkiainen A,Niemel M,et al.Detection of unrupturedcerebral artery aneurysms byMRA at 3.0 tesla:comparison withmultislice helical computed to-mographicangiography[J].ActaRadiol,2011,52(6):670-674.
[16]吴伟民,盛大膺.DSA工作人员及受检者受照剂量调查[J].中国辐射卫生,2008,17(6):201.
40 ROW helical ct angiography in patients with suspected intracranial aneurysms sah the application value of research
ZHOU Jun,SHAN Kai,ZHANG Xiu-fu
R814.42
B
1672-6170(2017)06-0257-03
2017-03-21;
2017-05-23)

