麻醉影响神经系统的作用机制研究进展
黄蕊,肖辉,崔小岱
麻醉影响神经系统的作用机制研究进展
黄蕊1,肖辉2,崔小岱1
麻醉是通过药物或其他方法产生的一种神经系统的可逆性功能抑制。临床上主要使用麻醉药物进行麻醉,但麻醉药物对神经系统的作用机制目前尚未完全阐明。本文将目前关于麻醉对神经系统作用机制的认识进行综述,包括麻醉药对大脑功能的抑制作用、麻醉药的意识开关学说、麻醉药破坏脑区间的功能性连接、麻醉药引发大脑神经网络断裂造成无意识、麻醉药打破入射与反射间的平衡、麻醉药阻碍信息整合、麻醉药对神经元整体工作状态的影响等前沿理论,以期帮助读者全面了解麻醉药作用于神经系统的可能机制,对阐明麻醉的作用机制及未来的研究方向有所启发。
麻醉;麻醉药物;中枢神经系统;意识;作用机制
在临床上,将患者对言语和动作无应答的状态定义为无意识,此定义可以很好的区分脑部状态,但从神经生物学的微观角度来看,此定义存在局限性。认知是一种高级脑功能,认知障碍的严重程度与血液学的多个指标密切有关[1,2]。意识是人脑对大脑内外表象的觉察,麻醉药可使人从有意识进入无意识,但麻醉药对中枢神经系统的作用机制尚不十分清楚[3,4]。全麻药(general anesthesia)是一种可逆性的诱导药,可以诱导机体丧失意识、丢失记忆和镇定疼痛等[5]。借助现代神经科学的技术,例如神经生理学和神经功能影像,可以观察到全麻状态下脑网络动力学的特征,这些结果颠覆了人们以前对全麻下脑活动状态的认识。通过改变全麻药的种类以及剂量来控制意识状态,为研究意识的不同水平提供了实验方法。本文对近年来麻醉影响神经系统的作用机制研究进展总结如下。
1 麻醉药对大脑功能的抑制作用
通常认为抑制大脑功能是麻醉药诱导意识丧失的主要原因。麻醉药能降低大脑的新陈代谢并抑制脑电活动[6,7]。多数麻醉药先抑制脑电活动,接着诱导脑电中的β波活化[8]。但氯胺酮例外,其诱导的麻醉可使大脑的新陈代谢率升高[8],并伴随脑电活动增强。由此可见,不同的麻醉药诱导麻醉的机制不尽相同。应用现代影像学技术,例如脑电图(electroencephalogram,EEG)、正电子发射断层成像术(positron emission tomography,PET)、功能性磁共振成像(functional magnetic resonance imaging,fMRI)等研究麻醉状态下的大脑功能,发现不同的麻醉药作用于不同的特定脑区。不同用量的异丙酚可作用于丘脑、网状结构、楔叶、扣带回皮质后部、额叶前皮质和联络皮质侧壁[9]。巴比妥盐酸类、苯二氮卓类和α-2-肾上腺素能激动剂等挥发性麻醉药可以降低相似脑区的活性[9,10];而氯胺酮可以增加前扣带回皮质、额皮质、丘脑、豆状核壳的活性[11]。
2 麻醉药的意识开关学说
麻醉诱导意识丧失的一个重要学说是“意识开关”学说。意识的“开关系统”包括特异性上行投射和非特异性上行投射系统(主要指脑干网状结构的上行网状激活系统)[12]。“开关系统”可激活皮质并使之兴奋(麻醉药可以改变丘脑-皮质连接处丘脑的活性,因此其是一个非常重要的开关候选部位,见图1。意识模型被描述为中央丘脑、额叶皮质、顶-枕-颞叶皮质、纹状体和苍白球等结构间的信息传递[13]。研究表明,多数麻醉药通过增加γ-氨基丁酸(gamma-aminobutyric acid,GABA)神经递质的浓度和降低谷氨酸盐及胆碱能递质的浓度使丘脑-皮质和皮质-丘脑通路超极化来诱导意识丧失[14]。人们认为楔前叶在意识丧失的过程中起到关键作用,因此楔前叶被认为是意识的第2个重要的开关候选部位。但是研究发现并不是所有的麻醉药在脑区有相同的激活或抑制作用,因此简单的定义某一种物质是意识开关并不科学。
3 麻醉药破坏脑区间的功能性连接
最近一种新的假说认为大脑连接的改变是麻醉诱导意识丧失的基础,见图1。麻醉使视觉、听觉、语言、情绪、记忆和疼痛觉发生改变[15]。由于麻醉药促进抑制性神经递质的传递,因此首先可研究大脑皮质及其高级传导网络。麻醉药通过改变既定网络的连接模式来执行网络控制,并改变了其他高级传导网络的连接[16]。虽然保留了低级感觉网络中的连接,但是其中的感觉-运动连接增多了。在亚催眠状态下,丘脑皮质中的连接存在,但是对皮质下(豆状核)及丘脑的活动控制性降低。在更深的镇静状态下高级神经网络的连接减少更多,默认网络和执行控制网络间的对应投射关系消失。在深麻醉状态下低等的感觉仍然存在,只是感觉传导的模式发生了改变。
4 麻醉药引发大脑神经网络断裂造成无意识
有学者通过在癫痫患者中记录单极点的放电情况绘制了大脑皮质电图,研究了二异丙酚破坏神经元和环路的机制[14,17]。研究发现二异丙酚引发意识丧失开始时在局部和皮质的神经网络信号交换同时进行。慢波(0.1~1 Hz)突然在皮质下部的基底部不同步出现,破环了皮质区域的功能性连接。慢波可在大脑皮质中产生,或由大脑皮质、丘脑和丘脑网状核的交互作用产生[18]。二异丙酚通过引发神经网络断裂并破坏大脑皮质脑区间功能的联系,可能是其造成无意识的物质基础[17],但在局部网络中还保留了一些有功能的连接。未来需要在动物模型中进一步探索慢波是否造成无意识以及其他麻醉药和二异丙酚的作用机制(即分子和神经环路机制)是否相同。
5 麻醉药打破入射与反射间的平衡
反射神经在觉知状态下占主导,但是在全麻状态下反射在皮质间的传递减少。麻醉造成无意识很可能是由于反射信号选择性的减少,见图2。二异丙酚、七氟烷和氯胺酮造成的全麻会出现从前至后的方向性反射脑区连接减少[19]。当患者对言语性指令恢复反应的时候,反射性连接增加。此外,全麻状态下二异丙酚诱导的反射性连接减少,但同时入射性连接的数量保持不变,这说明在全麻状态下初级感觉中枢仍然保持功能[20]。当受试者在语言任务中没有应答的时候,二异丙酚可减少额-颞叶间瞬时性联系,并可在颞叶激活之前抑制额叶活动[15]。麻醉剂干扰皮质反射的机制还不是十分清楚。麻醉剂抑制突触间传递导致信号丢失,如果更多的突触被抑制则可导致整体性的抑制。大量的突触联系是复杂信息处理的基础,因此也最容易被干扰。麻醉剂阻断无髓鞘轴突的电传导是其最可能的机制[21]。意识的丧失很可能是由于大脑皮质的外侧后部皮质信息传递的改变,包括感觉和协调的区域,导致全身信息整合失败。
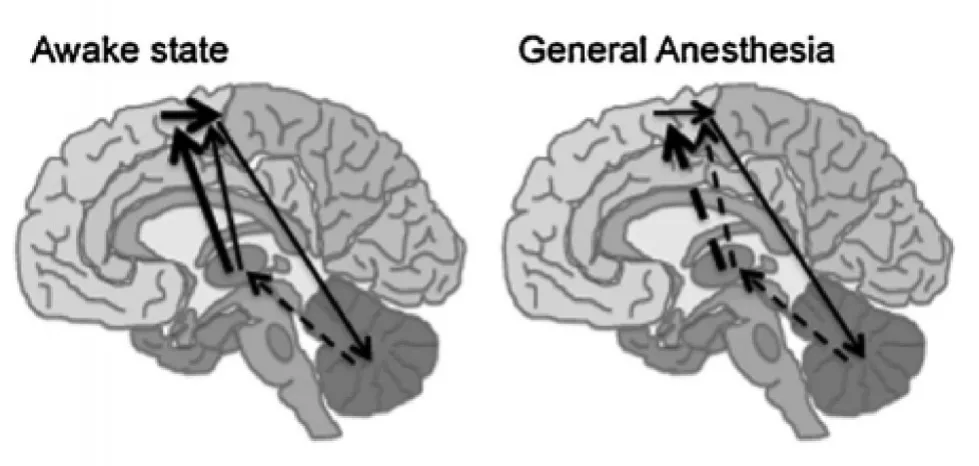
图1 麻醉药改变丘脑-皮质连接处丘脑的活性[25]
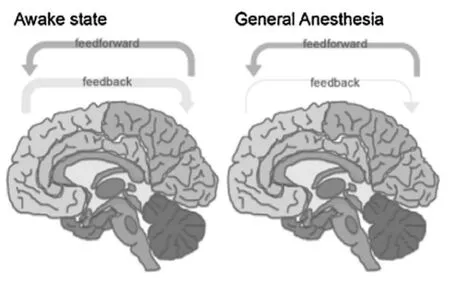
图2 反射信号选择性减少的示意图[25]
6 麻醉药阻碍信息整合
如果在全麻状态下通过激活皮质相关区域可以获得感觉刺激,那么是什么导致了在全麻和觉醒状态下信息处理的不同?研究认为有意识的认知依赖于皮质大区域的信息整合。研究发现有意识的基础不仅在于激活或抑制丘脑-皮质不同位置和数量的神经元,而且在于所激活神经元组信息整合的速度和效率。觉醒需要依赖丘脑-皮质的信息整合。通过PET和fMRI发现麻醉药能阻碍大脑功能性连接[22]。有研究认为麻醉诱导无意识可能是由于大脑对于接收的感觉信息整合和解释失败,以及麻醉药可阻碍丘脑-皮质系统信息整合[14,23]。但此观点还需要其他证据的支持,比如麻醉药如何通过神经系统影响功能整合[24]、如何通过众多复杂脑区的协同影响皮质的整合等。因为皮质-皮质连接对整合至关重要,尤其是对觉醒的恢复。
7 麻醉药对神经元整体工作状态的影响
大脑皮质分散的神经元根据各自的功能,接收或回馈信息,通过多数起源于锥体第二、三细胞层的长轴突向位于其他皮质区域对应的神经元发射信息,构成了神经元的整体工作环境[25]。最新研究表明,顶-底间的连接依赖于α-氨基-3-羟基-5-甲基-4-异恶唑丙酸(α-amino-3-hydroxy-5-methylisoxazole-4-propionate,AMPA)受体。当AMPA受体被拮抗时,前驱力的活动显著的减少[23]。更多实验数据表明神经元活性在长距离连接中受麻醉药的影响较大[24]。因此研究神经元的整体环境和在全麻状态下无意识的因果联系将是未来的研究重点。
目前,麻醉药作为大脑抑制剂的观点并没有得到实验数据的支撑。然而,新的理论可以解释在全麻状态下的无意识。这些基于神经科学对于意识研究的理论可以从临床研究、基础建模中得到验证。综上所述,虽然我们对麻醉的研究已经到了神经科学的意识程度,但对麻醉药作用于意识的具体机制仍然具有很大的探索空间。
[1]刘亮,王文静,王前友.SPECT联合血清S100β蛋白在血管性认知障碍无痴呆诊断中的应用[J].神经损伤与功能重建,2014,9:36-39.
[2]刘宇明,邓燕华,许治强,等.缺血性卒中患者血清NSE、BDNF水平变化与认知功能的相关性[J].神经损伤与功能重建,2016,11:296-298.
[3]Brown EN,Lydic R,Schiff ND.General anesthesia,sleep,and coma[J].N Engl J Med,2010,363:2638-2650.
[4]Mashour GA.Integrating the science of consciousness and anesthesia[J].Anesth Analg,2006,103:975-982.
[5]Alkire MT.Quantitative EEG correlations with brain glucose metabolic rate during anesthesia in volunteers[J].Anesthesiology,1998,89:323-333.
[6]Bennett C,Voss LJ,Barnard JP,et al.Practical use of the raw electroencephalogram waveform during general anesthesia:the art and science[J].Anesth Analg,2009,109:.539-950.
[7]Långsjö JW,Maksimow A,Salmi E,et al.S-ketamine anesthesia increases cerebral blood flow in excess of the metabolic needs in humans[J].Anesthesiology,2005,103:258-268.
[8]Veselis RA,Reinsel RA,Beattie BJ,et al.Midazolam changes cerebral blood flow in discrete brain regions:an H2(15)O positron emission tomography study[J].Anesthesiology,1997,87:1106-1117.
[9]Långsjö JW,Kaisti KK,Aalto S,et al.Effects of subanesthetic doses of ketamine on regional cerebral blood flow,oxygen consumption,and blood volume in humans[J].Anesthesiology,2003,99:614-623.
[10]Alkire MT,Haier RJ,Fallon JH.Fallon,Toward a unified theory of narcosis:brain imaging evidence for a thalamocortical switch as the neurophysiologic basis of anesthetic-induced unconsciousness[J].Conscious Cogn,2000,9:370-386.
[11]Heinke W,Fiebach CJ,Schwarzbauer C,et al.Sequential effects of propofol on functional brain activation induced by auditory language processing:an event-related functional magnetic resonance imaging[J].Br J Anaesth,2004,92:641-650.
[12]符锋,张赛.神经创伤救治新进展[J].中华神经创伤外科电子杂志,2017,3:57-59.
[13]Alkire MT,Gruver R,Miller J,et al.Neuroimaging analysis of an anesthetic gas that blocks human emotional memory[J].Proc Natl Acad Sci U S A,2008,105:1722-1727.
[14]Lewis LD,Weiner VS,Mukamel EA,et al.Rapid fragmentation of neuronal networks at the onset of propofol-induced unconsciousness[J].Proc Natl Acad Sci U S A,2012,109:3377-3386.
[15]Blethyn KL,Hughes SW,Tóth TI,et al.,Neuronal basis of the slow(<1 Hz)oscillation in neurons of the nucleus reticularis thalami in vitro[J].J Neurosci,2006,26:2474-2486.
[16]Lee U,Ku S,Noh G,et al.Disruption of frontal-parietal communication by ketamine,propofol,and sevoflurane[J].Anesthesiology,2013,118:1264-1275.
[17]Ku SW,Lee U,Noh GJ,et al.Preferential inhibition of frontal-toparietal feedback connectivity is a neurophysiologic correlate of general anesthesia in surgical patients[J].PLoS One,2011,6:e25155.
[18]Swindale NV.Neural synchrony,axonal path lengths,and general anesthesia:a hypothesis[J].Neuroscientist,2003,9:440-445.
[19]Imas OA,Ropella KM,Ward BD,et al.Volatile anesthetics disrupt frontal-posterior recurrent information transfer at gamma frequencies in rat[J].Neurosci Lett,2005,387:145-150.
[20]Mashour GA.Consciousness unbound:toward a paradigm of general anesthesia[J].Anesthesiology,2004,100:428-433.
[21]Cariani P.Anesthesia,neural information processing,and conscious awareness[J].Conscious Cogn,2000,9:387-395.
[22]Dehaene S,Kerszberg M,Changeux JP.A neuronal model of a global workspace in effortful cognitive tasks[J].Proc Natl Acad Sci U S A,1998,95:14529-14534.
[23]Self MW,Kooijmans RN,Supèr H,et al.Different glutamate receptors convey feedforward and recurrent processing in macaque V1[J].Proc Natl Acad Sci U S A,2012,109:11031-11036.
[24]Noirhomme Q,Soddu A,Lehembre R,et al.Brain connectivity in pathological and pharmacological coma[J].Front Syst Neurosci,2010.4:160.
[25]White NS,Alkire MT.Impaired thalamocortical connectivity in humans during general-anesthetic-induced unconsciousness[J].Neuroimage,2003,19:402-411.
R741;R741.02;R641
ADOI10.16780/j.cnki.sjssgncj.2017.06.023
1.首都儿科研究所北京100020 2.中国医学科学院&北京协和医学院北京100730
2017-03-16
崔小岱395954495@qq.com
(本文编辑:唐颖馨)

