高迁移率族蛋白1在鱼藤酮诱导的多巴胺能神经细胞损伤中的作用
熊婧,陈真真,张兆辉
高迁移率族蛋白1在鱼藤酮诱导的多巴胺能神经细胞损伤中的作用
熊婧1,陈真真2,张兆辉1
目的:观察高迁移率族蛋白1(HMGB1)在鱼藤酮诱导的帕金森病(PD)细胞模型中的作用,探讨HMGB1在PD发病机制中的作用。方法使用鱼藤酮作用于SH-SY5Y细胞建立PD细胞模型;免疫荧光染色观察细胞内HMGB1、α-synuclein及微管相关蛋白轻链3(LC3)的表达及定位;免疫印迹法检测不同浓度鱼藤酮作用下及siRNA-HMGB1干扰HMGB1后HMGB1、LC3II/I、自噬底物P62及Toll样受体4(TLR4)的表达水平;通过雷帕霉素(Rap)和3-甲基腺嘌呤(3-MA)分别激活或抑制自噬,实时荧光定量PCR检测HMGB1的mRNA转录水平。结果在PD细胞模型中,HMGB1出现胞浆转位,并与胞浆中α-synuclein及LC3颗粒样聚集物共定位;随着鱼藤酮浓度增加,HMGB1蛋白表达上调,伴有LC3II/I比例增高、P62及TLR4蛋白水平降低;Rap和3-MA分别激活或抑制自噬可引起HMGB1 mRNA的转录水平相应增加或降低;干扰HMGB1表达可抑制自噬的激活。结论胞浆转位的HMGB1通过作用于自噬溶酶体途径参与PD的发病,可能是PD治疗的新靶点。
高迁移率族蛋白1;帕金森病;自噬;胞浆转位
帕金森病(Parkinson’s disease,PD)是中老年常见的神经退行性疾病,65岁以上人群中发病率达1%[1],典型病理改变为黑质区多巴胺能神经细胞丢失及残存神经元中路易小体形成。在PD患者尸检标本中发现路易小体中存在高迁移率族蛋白1(high mobility group box 1,HMGB1)表达,并与路易小体的α-synuclein共定位[2]。研究还发现HMGB1可能参与了中枢神经系统的发育及神经退变过程[3]。笔者推测HMGB1可能参与了PD的发病过程。本研究将在鱼藤酮诱导的体外多巴胺能细胞模型中探讨HMGB1在PD发病中的作用。
1 材料与方法
1.1 实验细胞和试剂
人神经母细胞瘤细胞系(SH-SY5Y)购自武汉大学典型培养物储藏中心;小鼠抗HMGB1抗体购自Abcam公司,兔抗α-synuclein抗体及兔抗Toll样受体4(Toll-like receptor 4,TLR4)抗体购自cell signal technology公司,兔抗微管相关蛋白轻链3多克隆抗体(anti-LC3B)及兔抗P62多克隆抗体购自Sigma公司,异硫氰酸荧光素(FITC)标记羊抗兔荧光二抗、罗丹明(Tritc)标记羊抗小鼠二抗及Hoechst 33258染料购自ProteinTech Group公司;siRNA-HMGB1干扰质粒购自吉凯基因公司;鱼藤酮(Rotenone,Rot)、雷帕霉素(Rapamycin,Rap)、3-甲基腺嘌呤(3-Methyladenine,3-MA)购自Sigma公司。
1.2 方法
1.2.1 细胞培养 SH-SY5Y细胞置于含10%(体积分数)灭活胎牛血清的DMEM/F12培养基,于37℃含5%CO2的细胞培养箱中培养,隔天换液,细胞生长达70%~80%丰度时,0.25%胰酶消化传代或用于实验。
1.2.2 细胞转染 将SH-SY5Y细胞置于12孔板培养,生长丰度至60%左右时转染。将siRNA-HMGB1干扰质粒与Lipofectamine 2000按2 μg/μL比例混合,制备成转染复合体,加入无血清培养基中与细胞共培养6 h后换用含10%血清的培养基培养48 h。之后加鱼藤酮(2.5 μM)处理24 h后用于后续检测。
1.2.3 免疫荧光染色 制备SH-SY5Y细胞爬片,鱼藤酮(2.5 μM)处理24 h后,弃培养基,漂洗,4%多聚甲醛固定,破膜,5%BSA封闭,分别加入小鼠抗HMGB1(1:500),兔抗α-synuclein(1:200)抗体及兔抗LC3(1:200)抗体于4℃孵育过夜,复温后加入FITC标记羊抗兔荧光二抗、Tritc标记羊抗小鼠二抗37℃孵育1 h,Hoechst33258染色,封片,激光共聚焦显微镜下观察。
1.2.4 免疫印迹法检测 SH-SY5Y细胞分别经0.5 μM、1 μM、2.5 μM及5 μM鱼藤酮作用24 h后收集细胞,加入细胞裂解液后置于冰上裂解30 min,4℃12000 r/min离心15 min,取上清液,BCA法测定蛋白浓度后进行聚丙烯酰胺凝胶电泳,电转至PVDF膜上,分别加入小鼠抗 HMGB1、兔抗 α-synuclein、兔抗 LC3、兔抗 P62及TLR4抗体4℃孵育过夜,辣根过氧化物酶标记的二抗室温孵育2 h后显色、曝光。转染siRNA-HMGB1干扰质粒后的SH-SY5Y细胞及对照组细胞,分别经鱼藤酮处理24 h,提取细胞内蛋白,进行聚丙烯酰胺凝胶电泳,电转至PVDF膜上,分别加入小鼠抗HMGB1、兔抗LC3抗体4℃孵育过夜,辣根过氧化物酶标记的二抗室温孵育2 h后显色、曝光。
1.2.5 HMGB1的mRNA转录水平检测 分别使用100 nM的Rap(自噬增强剂)预处理SH-SY5Y细胞24 h,5 mM的3-MA(自噬抑制剂)预处理SH-SY5Y细胞2 h,然后加入鱼藤酮(2.5 μM)作用 24 h,Trizol法提取SHSY5Y细胞总RNA,逆转录PCR后行实时定量PCR检测HMGB1的mRNA转录水平。
1.3 统计学处理
2 结果
2.1 鱼藤酮诱导HMGB1胞浆转位,并与α-synuclein共定位
在对照组SH-SY5Y细胞中,HMGB1均匀分布于细胞核,胞浆中未见α-synuclein聚集颗粒。鱼藤酮 2.5 μM处理SH-SY5Y细胞24 h后,细胞核中HMGB1表达增加,同时胞浆中可见HMGB1及α-synuclein颗粒状聚集物,部分HMGB1及α-synuclein颗粒状聚集物共定位,见图1。
2.2 鱼藤酮诱导HMGB1胞浆转位,并与LC3共定位
鱼藤酮2.5 μM处理SH-SY5Y细胞24 h后,LC3在胞浆中形成散在颗粒样聚集体,提示自噬体形成,同时看到胞浆中也出现HMGB1颗粒样聚集物,并有部分HMGB1及LC3颗粒状聚集物共定位;对照组细胞中LC3均匀分布于细胞中,HMGB1均一分布于细胞核中。
2.3 鱼藤酮诱导HMGB1、LC3及TLR4表达改变
不同浓度的鱼藤酮作用于SH-SY5Y细胞24 h,随着药物浓度的增加,HMGB1的表达增加,自噬分子LC3II/LC3I的比例增加,自噬底物P62的含量减少,提示自噬途径激活,而HMGB1下游的炎症因子TLR4表达降低,见图3。
2.4 鱼藤酮模型中HMGB1与自噬的相互作用
鱼藤酮2.5 μM处理SH-SY5Y细胞24 h后,HMGB1 mRNA转录水平增加,Rap(100 nM)预处理24 h激活自噬途径后,细胞内HMGB1 mRNA转录水平较对照组增高;3-MA(5 mM)预处理2 h抑制自噬途径后,HMGB1 mRNA的转录水平较对照组减少,见图4A。鱼藤酮2.5 μM作用于细胞24 h后,细胞内LC3II/LC3I比例较对照组增高,提示自噬激活,但通过siRNAHMGB1干扰HMGB1表达后,鱼藤酮作用于细胞将不引起LC3II/LC3I比例改变,见图4B1-B2。
3 讨论
遗传基因突变、氧化应激、线粒体功能障碍、蛋白质异常聚集、自噬/泛素蛋白酶体功能障碍及炎症反应等均与PD的发病密切相关。寻找在上述途经中发挥作用的关键分子并加以干预将为PD的治疗提供重要作用。本研究发现HMGB1在鱼藤酮诱导的SH-SY5Y细胞模型中可以由细胞核向胞浆转位,与Lewy小体中的关键蛋白α-synuclein和自噬标志蛋白LC3共定位,且HMGB1与自噬途径有直接关系,激活自噬时伴有HMGB1表达增加,抑制自噬时伴有HMGB1表达减少,而干扰HMGB1的表达则会抑制自噬途径的激活,提示HMGB1可能通过影响自噬溶酶体途径而干扰αsynuclein的降解,从而参与PD的发病。
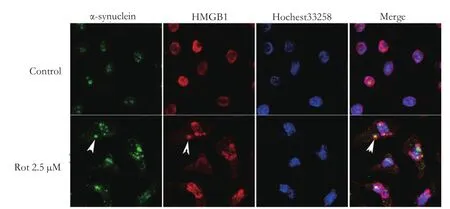
图1 鱼藤酮处理24 h后HMGB1及α-synuclein的表达情况(×400)
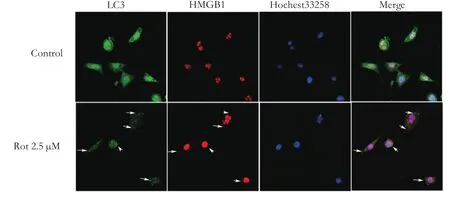
图2 鱼藤酮处理24h后HMGB1及LC3的表达情况(×400)

图3 不同浓度鱼藤酮作用后对HMGB1、LC3、P62、TLR4蛋白表达水平的影响
HMGB1是一种高度保守的非组蛋白的染色体结合蛋白,主要存在于真核细胞细胞核内,参与DNA的复制、重组、转录及修复[4],也可转移到细胞外,作为信号分子,参与细胞炎症介质的释放和调节细胞分化[5,6];HMGB1也是氧化应激的一个重要效应分子,可能与缺血再灌注损伤[7]、动脉粥样硬化及衰老等密切相关[8];在氧化应激刺激下,HMGB1会与胞浆内Beclin1结合使Beclin1-Bcl-2复合体解聚,启动自噬溶酶体途径应对氧化应激损害[9];体外实验中发现,胞浆外的HMGB1会持续作用于小胶质细胞,释放炎性物质及引起氧化应激,使得与小胶质细胞共培养的多巴胺能神经元进行性死亡[10];此外,HMGB1在线粒体功能异常时也能调节线粒体自噬,保护细胞功能[11]。以上提示HMGB1与PD发病机制中的多个环节密切相关。
此外,有证据显示HMGB1也参与了神经退行性疾病的发病。如在阿尔茨海默病的细胞模型中发现,HMGB1与β淀粉样蛋白结合,影响小胶质细胞对β淀粉样蛋白的清除[12];在亨廷顿病和脊髓小脑共济失调细胞模型中,发现HMGB1与疾病标志性蛋白huntingtin及ataxin-1存在相互作用并导致可溶性HMGB1蛋白的减少[13];PD患者尸检中也发现,其脑组织黑质区路易小体中也存在HMGB1与α-synuclein的共定位,并且在体外实验中证实HMGB1与聚集状态的α-synuclein具有高亲合力[2]。本研究也证实了HMGB1在鱼藤酮诱导的PD体外模型中可以出现胞浆转位,并与α-synuclein共定位,提示HMGB1可能与细胞内异常蛋白如αsynuclein的聚集及路易小体的形成有关。

图4 鱼藤酮模型中干扰自噬对HMGB1转录的影响及抑制HMGB1对自噬途径激活的影响
细胞内异常蛋白主要是通过自噬溶酶体途径及泛素蛋白酶体途径降解。本研究中也发现鱼藤酮诱导的细胞模型中观察到胞浆转位的HMGB1与自噬标志蛋白LC3存在共定位,并且随着鱼藤酮浓度的升高,细胞内HMGB1表达增加,同时自噬标志分子LC3II/I的比值升高、自噬的降解底物P62表达减少,提示自噬途径激活。使用自噬抑制剂3-MA处理后,细胞内HMGB1 mRNA的转录水平受到抑制,而使用自噬激活剂雷帕霉素处理后,细胞内HMGB1 mRNA的转录水平增高,干扰HMGB1的表达也抑制了细胞内自噬途径的激活。Tang D等[9]在饥饿或雷帕霉素诱导的鼠胚胎成纤维细胞及某些肿瘤细胞系的自噬激活过程中,也发现存在HMGB1向胞浆转移,调节自噬的活性。因此推测HMGB1可能通过胞浆转位调解PD的自噬活性。
HMGB1也是重要的炎症介质,PD的发病与炎症反应存在关联,研究认为,HMGB1可以通过激活TLR4等下游通路,引起氧化应激反应及神经炎症反应的激活,诱导神经元死亡[10]。本研究中观察到HMGB1表达增加的同时不伴有下游炎症受体TLR4的表达上调,反而有下降趋势,提示在此过程中HMGB1没有导致炎症反应的激活,而主要通过调节自噬溶酶体途径影响异常蛋白的降解,参与PD发病。
综上所述,HMGB1是PD发病中的重要分子,可能通过胞浆转位参与自噬溶酶体途径而发挥调节作用,而具体的相关作用机制还需进一步探明。
[1]Zhang ZX,Roman GC,Hong Z,et al.Parkinson's disease in China:prevalence in Beijing,Xian,and Shanghai[J].Lancet,2005,365:595-597.
[2]Lindersson EK,Højrup P,Gai WP,et al.alpha-Synuclein filaments bind the transcriptional regulator HMGB-1[J].Neuroreport,2004,15:2735-2739.
[3]Fang P,Schachner M,Shen YQ.HMGB1 in development and diseases of the central nervous system[J].Mol Neurobiol,2012,45:499-506.
[4]Naglova H,Bucova M.HMGB1 and its physiological and pathological roles[J].Bratisl Lek Listy,2012,113:163-171.
[5]Yang H,Tracey KJ.Targeting HMGB1 in inflammation[J].Biochim Biophys Acta,2010,1799:149-156.
[6]Harris HE,Andersson U,Pisetsky DS.HMGB1:a multifunctional alarmin driving autoimmune and inflammatory disease[J].Nat Rev Rheumatol,2012,8:195-202.
[7]Singh V,Roth S,Veltkamp R,et al.HMGB1 as a Key Mediator of Immune Mechanisms in Ischemic Stroke[J].Antioxid Redox Signal,2016,24:635-651.
[8]Tang D,Kang R,Zeh HJ,et al.High-mobility group box 1,oxidative stress,and disease[J].Antioxid Redox Signal,2011,14:1315-1335.
[9]Tang D,Kang R,Livesey KM,et al.Endogenous HMGB1 regulates autophagy[J].J Cell Biol,2010,190:881-892.
[10]Gao HM,Zhou H,Zhang F,et al.HMGB1 acts on microglia Mac1 to mediate chronic neuroinflammation that drives progressive neurodegeneration[J].J Neurosci,2011,31:1081-1092.
[11]Tang D,Kang R,Livesey KM,et al.High-mobility group box 1 is essential for mitochondrial quality control[J].Cell Metab,2011,13:701-711.
[12]Takata K,Kitamura Y,Tsuchiya D,et al.High mobility group box protein-1 inhibits microglial Abeta clearance and enhances Abeta neurotoxicity[J].J Neurosci Res,2004,78:880-891.
[13]Qi ML,Tagawa K,Enokido Y,et al.Proteome analysis of soluble nuclear proteins reveals that HMGB1/2 suppress genotoxic stress in polyglutamine diseases[J].Nat Cell Biol,2007,9:402-414.
The Role of High Mobility Group Box 1 in Dopaminergic Neuronal Damage Induced by Rote⁃none
XIONG Jing1,CHEN Zhen-zhen2,ZHANG Zhao-hui1.1.Department of Neurology,Renmin Hospital of Wuhan University,Wuhan 430060,China;2.Department of Neurology,The Central Hospital of Wuhan,Tongji Medical College,Huazhong University of Science and Technology,Wuhan 430020,China
Objective:To identify the role of high mobility group box 1(HMGB1)in dopaminergic neuronal damage induced by rotenone.Methods:SH-SY5Y cells were treated with rotenone with different concentration to make cell model of Parkinson’s disease(PD).The expression and location of HMGB1,α-synuclein and LC3 were analyzed by immnofluorescence staining.The protein expression of HMGB1,LC3II/I,P62 and TLR4 were assessed by western blot.Activated or inhibited autophagy by rapamycin or 3-MA,the transcription level of HMGB1 mRNA was detected by real-time fluorescent quantitative PCR.Results:HMGB1 translocated in cytoplasm and colocalized with α-synuclein and LC3 in PD cells,accompanied by enhanced autophagy.Increased autophagosomes of autophagy directly increased the expression of HMGB1.Knocked down HMGB1 expression using RNA interferenc inhibited the intracellular activation of autophagy pathway.Conclusion:HMGB1 cytoplasmic translocation is involved in the activation of autophagy in PD,which may be a novel therapeutic target for PD.
high mobility group box 1;Parkinson’s disease;autophagy;cytoplasmic translocation
R741;R741.02;R742
ADOI10.16780/j.cnki.sjssgncj.2017.06.002
1.武汉大学人民医院神经内一科武汉430060 2.华中科技大学同济医学院附属武汉中心医院神经内科武汉430020
国家自然科学基金青年基金项目(No.81501107)
2017-09-06
张兆辉zhzhqing1990@163.com
(本文编辑:唐颖馨)

