β1肾上腺素能受体基因多态性与青年缺血性卒中的关联性研究
刘赟,韦玮,黄元志
β1肾上腺素能受体基因多态性与青年缺血性卒中的关联性研究
刘赟1,2,韦玮1,黄元志1
目的:探讨陕西地区汉族人群中中青年缺血性卒中与β1肾上腺素能受体(ADRB1)基因多态性的关系。方法选择136例中青年缺血性卒中患者为卒中组,同期另选择青年健康体检者150例为对照组,采用聚合酶链反应结合DNA直接测序法检测ADRB1基因型,比较各组基因型和等位基因分布频率的差异。结果多因素Logistics回归分析结果显示ADRB1基因Ser49Gly位点等位基因模型(Ser v.s.Gly)和显性基因模型(Ser/Ser v.s.Ser/Gly+Gly/Gly)与青年缺血性卒中的相关性具有统计学意义(OR=2.5,95%CI1.2~5.2,P=0.009;OR=1.8,95%CI1.2~3.3,P=0.011);Arg389Gly位点各基因模型与青年缺血性卒中相关性均无统计学意义(P>0.05)。结论:对于陕西地区汉族中青年人群缺血性卒中患者,ADRB1基因Ser49Gly位点多态性与缺血性卒中相关。
β1肾上腺素能受体;青年;缺血性卒中;基因多态性
缺血性脑卒中已成为我国,乃至全世界人民致死、致残最主要的疾病之一。近年来,有流行病学调查结果显示缺血性卒中发病呈现年轻化趋势,越来越多青年人罹患缺血性卒中,给家庭和国家带来严重的经济和社会负担[1]。究其原因,生活方式的改变可能是一方面因素,另外,基因遗传因素对青年人发生缺血性卒中所起到的作用更值得关注。β1肾上腺素能受体(beta-1 adrenergic receptor,ADRB1)是G蛋白偶联受体家族的一员,参与第二信使cAMP的形成。研究显示ADRB1活性降低及继发性cAMP生成减少均与多种心脑血管疾病的病理改变相关[2-4]。因此,有理由相信ADRB1基因多态性与缺血性卒中发病存在某种关联。目前,有研究发现ADRB1基因多态性与糖尿病、胰腺肿瘤、高血压、冠心病等疾病相关[4-6],但ADRB1基因多态性与缺血性卒中相关性的研究相对较少[7],本研究以中国北方汉族青年人作为观察人群,比较缺血性卒中患者与健康体检者ADRB1基因多态性的差异,为临床工作提供参考。
1 资料与方法
1.1 一般资料
选择2013年1月至2016年6月延安大学附属医院和西安交通大学第一附属医院治疗的青年缺血性卒中患者作为卒中组,纳入标准:年龄>18岁,≤45岁;出生并长期生活于陕西地区,汉族人;缺血性卒中诊断符合2010年《中国急性缺血性卒中诊治指南》诊断标准[8]。排除标准:缺血性卒中明确为心源性栓塞、颈动脉夹层、梅毒、大动脉炎、吸食毒品等继发性原因所致;合并恶性肿瘤,或其他肝、肾等重要脏器合并严重器质性病变或功能障碍。卒中组共纳入136例患者。另随机选择同期于我院体检中心接受体检的健康人员150例为对照组。所有入组人员均接受头颅CT和(或)MR检查,以诊断或排除缺血性卒中。本研究通过本院伦理委员会审核批准,所有受试者知情同意。
1.2 方法
1.2.1 收集临床资料 包括年龄、性别、体重指数、吸烟史、高血压、糖尿病、血脂异常情况,及入院时血压、血糖、血脂。吸烟定义为吸烟超过1年,每日平均≥ 1支。高血压、糖尿病和血脂异常诊断标准见参考文献[9]。
1.2.2 基因多态性检测 采集清晨空腹时外周静脉血5 mL,按照氯仿饱和酚法提取基因组DNA,以基因组DNA为模板,采用聚合酶链反应联合DNA直接测序法检测ADRB1基因Ser49Gly多态性和Arg398Gly多态性。采用Primer5.0及Oligo6.0软件设计引物并进行特性验证,引物由上海生共生物有限公司合成,其中Ser49Gly上游引物:5'-AGCCCGGTAACCTGTCGT-3',下 游 引 物 :5'-CGCTGTCCACTGCTGAGA-3';Arg398Gly上游引物:5'-TTATCCGTTGGTCTTAGGAA-3',下游引物:5'-GCGGCATGGTAATTAAGCTC-3'。PCR反应体系(25 μL):10×Buffer 2.5 μL,上、下游引物各1 μL,dNTP混合物2 μL,TaqDNA聚合酶0.25 μL,模板DNA 1 μL,剩余由灭菌蒸馏水补足,反应条件:95 ℃预变性4 min,然后按照95℃ 20 s、55 ℃ 30 s、72℃30 s顺序循环30周期,最后72℃延长 3 min,经1%琼脂糖凝胶电泳确定,对PCR产物直接测序。
1.3 统计学处理
采用SPSS19.0统计软件分析数据,计量资料均服从正态分布,结果以(±s)表示,t检验;计数资料以构成百分比(%)表示,χ2检验。基因型分布采用Hardy-Weinberg平衡定律检验。将单因素分析P<0.05的参数均作为混杂因素,采用多因素Logistic回归分析法评价ADRB1基因多态性与青年缺血性卒中的相关关系,采用比值比(Odd Ratio,OR)及其95%可信区间(Confidence Interval,CI)表示相对风险度。P<0.05为差异有统计学意义。
2 结果
2.1 2组临床资料比较
卒中组和对照组在吸烟、糖尿病两项指标差异具有统计学意义(均P<0.05),在年龄、性别、体重指数、高血压、血脂异常、入院时血压、血糖和血脂等临床参数差异无统计学意义(均P>0.05),见表1。
2.2 基因分型及Hardy-Weinberg遗传平衡检验结果
人群中ADRB1基因Ser49Gly多态包括三种基因型,分别为纯合野生型(Ser/Ser)、杂合突变型(Ser/Gly)及纯合突变型(Gly/Gly);Arg389Gly多态同样存在三种基因型,分别为纯合野生型(Arg/Arg)、杂合突变型(Arg/Gly)及纯合突变型(Gly/Gly)。本研究基因型分布均符合Hardy-Weinberg遗传平衡,其基因频率已达到遗传平衡,具有群体代表性,见表2。
2.3 ADRB1各基因模型与青年缺血性卒中的相关性
单变量分析结果显示ADRB1基因Ser49Gly位点等位基因模型、显性基因模型和隐性基因模型均与青年缺血性卒中相关,经Logistics回归校正年龄、性别、吸烟、糖尿病等混杂因素后,ADRB1基因Ser49Gly位点等位基因模型和显性基因模型与青年缺血性卒中的相关性具有统计学意义(P<0.05)。未校正时Arg389Gly位点仅隐性基因模型与青年缺血性卒中相关,经校正后,隐性基因模型与青年缺血性卒中相关性也无统计学意义(P>0.05),见表3。
3 讨论
长期以来对缺血性卒中的研究主要集中在高血压、糖尿病、高脂血症和吸烟等常见危险因素上,然而有不少患者脑卒中发病不能以这些常见危险因素加以解释,对于青年缺血性卒中患者更是如此,有研究发现仅有20%~30%青年缺血性卒中患者存在动脉粥样硬化[10]。近年来不断有双生子和家族遗传的研究提示基因遗传因素可解释部分缺血性卒中[7]。目前,探讨基因多态性与缺血性卒中关系的研究众多,然而由于各研究之间在研究方法、技术水平等方面的差异,这些研究结果多数不能复制,甚至部分研究结果相互矛盾。笔者认为缺血性卒中作为一种基因遗传因素、环境因素和行为因素共同作用疾病,随着年龄的增长,基因遗传因素在缺血性卒中中所起到的作用也逐渐被掩盖。因此研究青年缺血性卒中患者基因遗传因素与发病的相关性,对全面认识缺血性卒中具有重大意义。
人 类 ADRB1基 因 位 于 10q24~26,Ser49Gly和Arg389Gly是目前研究较多的两个多态性位点,近年来有研究发现Ser49Gly和(或)Arg389Gly基因多态性与高血压、糖尿病、心衰均存在相关性[2-7,11]。Mason等[12,13]将ADRB1基因不同基因型转染到仓鼠成纤维细胞上,在体外发现Gly49和Gly389均可降低腺苷酸环化酶活性,进而减少cAMP生成。cAMP作为第二信使参与血管舒张调控,Gly49和Gly389所导致的cAMP表达减少可加重血管收缩和血小板聚集[14,15]。基于上述机制,Kumar等[7]以北印度人群为研究对象,比较224例缺血性卒中患者和224例健康对照组ADRB1基因Ser49Gly和Arg389Gly多态性的差异,发现Ser49Gly和Arg389Gly多态性均与缺血性卒中相关,其中前者与大血管性缺血性卒中相关性更为密切,而Arg389Gly多态性与小血管缺血性卒中相关性更大。
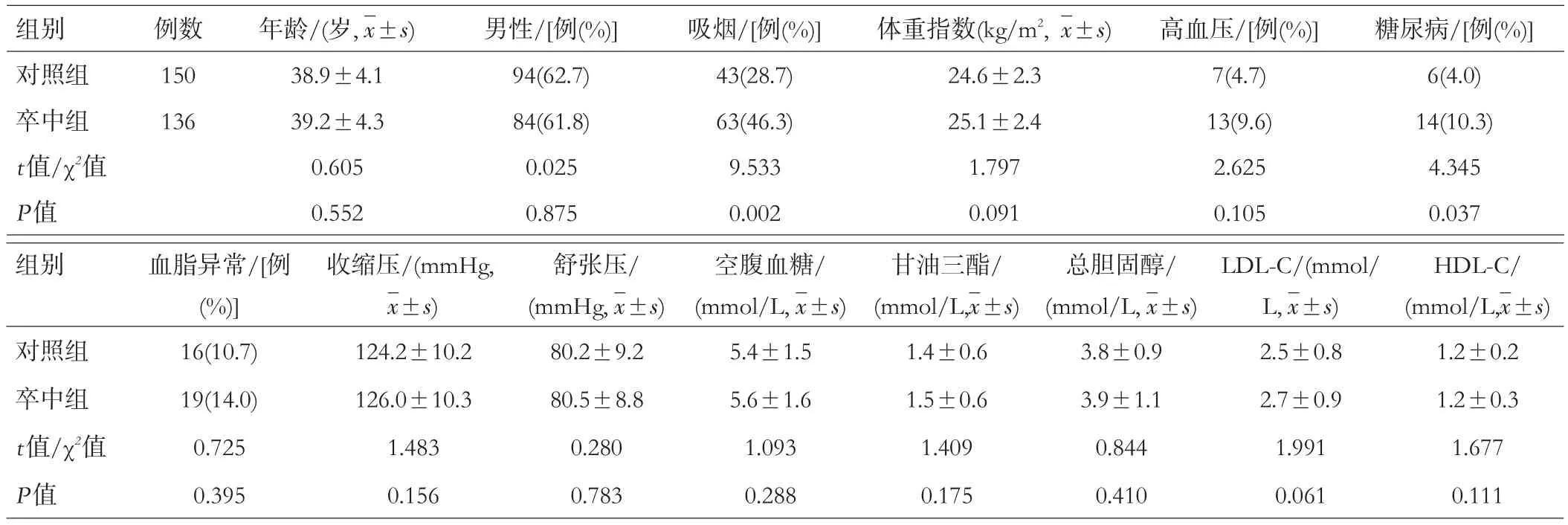
表1 2组患者临床资料比较
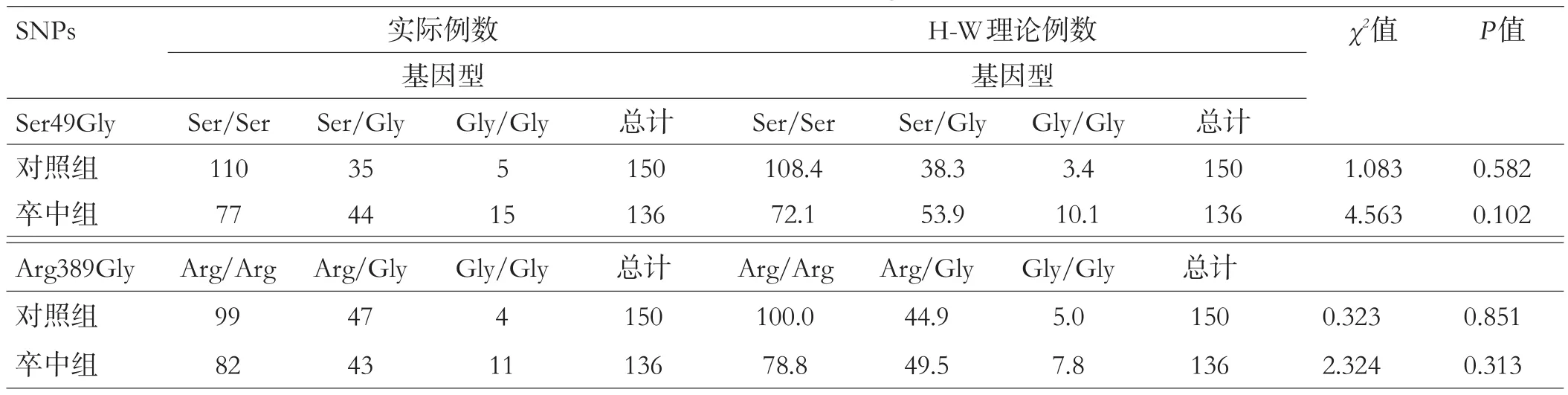
表2 ADRB1基因Hardy-Weinberg遗传平衡检验

表3 ADRB1各基因模型与青年缺血性卒中的相关性
本研究以陕西地区年龄<45岁的汉族青年为研究对象,结果显示Gly49等位基因与缺血性卒中密切相关,且显性基因模型(Ser/Gly+Gly/Gly)与缺血性卒中相关性具有统计学意义,提示Gly49基因突变在体内显性表达,突变杂合子和突变纯合子均可能加大缺血性卒中发生的危险度。本研究单变量分析Arg389Gly位点隐性基因模型与缺血性卒中相关,考虑年龄、性别、吸烟、糖尿病等混杂因素,经校正该模型与缺血性卒中相关性无统计学意义。由于相关研究较少,ADRB1基因Gly49和Gly389与缺血性卒中的相关性尚无定论,本研究结果与Kumar等的研究结果不一致,笔者认为可从以下两个方面解释:第一,两个研究收集的研究对象存在差异,Kumar等的研究未限定卒中组患者年龄,本研究所有入组人员均为年龄<45岁的青年人,缺血性卒中发病本身具有一定年龄依赖性,这样的差异可能对结果造成一定影响;第二,人种差异,根据目前研究报告Gly389在不同人种中分布频率差异较大。总之,两个研究均为小样本病例对照研究,需要进一步大样本多中心研究验证结论。
本研究也存在不足之处,由于本研究卒中组例数较少,未进一步按照卒中类型分层进行讨论,且研究提示ADRB1基因多态性可能与高血压和糖尿病存在相关性,但本研究合并高血压和糖尿病的患者较少,仅在综合分析各基因模型与卒中相关性时作为混杂因素进行校正,未进一步分层讨论,需要后续研究深入讨论。另外,缺血性卒中发病机制十分复杂,可能与多基因共同表达相关,ADRB1基因多态性与其他基因相互作用的具体机制也仍需进一步研究。
[1]Cotter PE,Agarwal S,Martin PJ.Etiologic investigation of ischemic stroke in young adults[J].Neurology,2011,76:1983-1988.
[2]Parvez B,Chopra N,Rowan S,et al.A common beta1-adrenergic receptor polymorphism predicts favorable response to rate-control therapy in atrial fibrillation[J].J Am Coll Cardiol,2012,59:49-56.
[3]Pei J,Chen J,Zhang Y,et al.beta 1-adrenergic receptor autoantibody predicts sudden cardiac death in patients with chronic heart failure[J].Cardiology,2011,120:49-50.
[4]Zuckerman DM,Hicks SW,Charron G,et al.Differential regulation of two palmitoylation sites in the cytoplasmic tail of the beta1-adrenergic receptor[J].J Biol Chem,2011,286:19014-19023.
[5]Karlsson J,Lind L,Hallberg P,et al.Beta1-adrenergic receptor gene polymorphisms and response to beta1-adrenergic receptor blockade in patients with essential hypertension[J].Clin Cardiol,2004,27:347-350.
[6]于层,孙正燕,于文娟,等.β1肾上腺素能受体基因多态性与胰腺癌的关系[J].青岛大学医学院学报,2014,50:22-25.
[7]Kumar A,Pandit AK,Vivekanandhan S,et al.Association between beta-1 adrenergic receptor gene polymorphism and ischemic stroke in North Indian population:A case control study[J].J Neurol Sci,2015,348:201-205.
[8]中华医学会神经病学分会脑血管病学组急性缺血性脑卒中诊治指南撰写组.中国急性缺血性脑卒中诊治指南2010[J].中国医学前沿杂志电子版,2010,2:16-19.
[9]中华医学会神经病学分会.中国缺血性脑卒中和短暂性脑缺血发作二级预防指南(2010)[J].中华神经科杂志,2015,43:154-160.
[10]白文,张治中,曹立平,等.MRAS基因多态性与青年缺血性卒中患者的关系[J].中国脑血管病杂志,2014,11:564-568.
[11]李俊萍,郭晓华,陈丽珠,等.β1肾上腺素能受体Ser49Gly基因多态性与心肌梗死后心室重构的关系[J].中华临床医师杂志:电子版,2016,10:2527-2530.
[12]Mason DA,Moore JD,Green SA,et al.A gain-of-function polymorphism in a G-protein coupling domain of the human beta1-adrenergic receptor[J].J Biol Chem,1999,274:12670-12674.
[13]Rathz DA,Brown KM,Kramer LA,et al.Amino acid 49 polymorphisms of the human beta1-adrenergic receptor affect agonist-promoted trafficking[J].J Cardiovasc Pharmacol,2002,39:155-160.
[14]Iwamoto Y,Ohishi M,Yuan M,et al.|[beta]|-Adrenergic receptor gene polymorphism is a genetic risk factor for cardiovascular disease:a cohort study with hypertensive patients[J].Hypertens Res,2011,34:573-577.
[15]Zhang F,Steinberg SF.S49G and R389G polymorphisms of the β-adrenergic receptor influence signaling via the cAMP-PKA and ERK pathways[J].Physiol Genomics,2013,45:1186-1192.
Association between Polymorphism of Beta-1 Adrenergic Receptor and Young Patients with Ischemic Stroke
LIU Yun1,2,WEI Wei1,HUANG Yuan-zhi1.1.Department of Neurosurgery,Affiliated Hospital of Yan'an University,Shanxi Yan,716000,China;2.Yan'an University medical school,Shanxi Yanan,716000,China
Objective:To investigate the genetic association between Beta-1 adrenergic receptor(ADRB1)gene polymorphism of young patients with ischemic stroke in the Han descent population in Shan'xi province.Methods:Total 136 young patients with ischemic stroke were recruited as the stroke group.One hundred and fifty healthy volunteers were randomly enrolled in the same period of time as the control group.Genotype was determined by polymerase chain reaction-restriction fragment length polymorphism combined with DNA direct sequencing technique for the polymorphism of the ADRB1 gene.The genotype fequencies of the ADRB1 gene among groups were analyzed.Results:Multivariate Logistic regression analysis showed an independent association between Ser49Gly polymorophism and ischemic stroke for young patients under the allele model(Serv.s.Ser)and the dominant model(Ser/Serv.s.Ser/Gly+Gly/Gly)of inheritance(OR=2.5,95%CI:1.2~5.2,P=0.009;OR=1.8,95%CI:1.2~3.3,P=0.011).However,there was no significant difference in the frequencies of genotype and allele of Arg389Gly polymorphism between the stroke group and the control group(bothP>0.05).Conclusion:For young people in the Han descent population in Shanxi province,Ser49Gly polymorphism ofADRB1 gene may closely related to ischemic stroke.
beta-1 adrenergic receptor;youth;ischemic stroke;gene polymorphism
R741;R741.02;R743
ADOI10.16780/j.cnki.sjssgncj.2017.06.004
1.延安大学附属医院神经外科陕西 延安 716000 2.延安大学医学院陕西 延安 716000
2017-01-12
黄元志383263246@qq.com
(本文编辑:王晶)

