脂联素干预改善血管性痴呆大鼠认知功能的作用研究
舒敏,刘煜敏,张洪,邓敏,张仁伟
脂联素干预改善血管性痴呆大鼠认知功能的作用研究
舒敏,刘煜敏,张洪,邓敏,张仁伟
目的:探讨血管性痴呆(VD)大鼠脑组织脂联素(APN)水平变化及其与脑微血管新生和认知功能的关系。方法:45只SD大鼠随机分为假手术组、模型组和APN组,各15只。模型组采用手术永久结扎大鼠双侧颈总动脉的方法制备VD模型,APN组在造模后将携带APN基因的慢病毒载体注入大鼠尾静脉。干预后8周,采用Morris水迷宫检测大鼠的认知功能,免疫组织化学法测定脑组织APN、血管内皮细胞生长因子(VEGF)和CD31的表达水平。结果与假手术组相比,模型组大鼠逃避潜伏期延长,目标象限停留的时间百分比缩短,脑组织APN表达水平下降,VEGF及CD31表达水平增加,差异均有统计学意义(P<0.05)。与模型组比较,APN组大鼠逃避潜伏期降低,目标象限停留时间百分比增加,大鼠脑组织APN、VEGF及CD31表达水平增加,差异均有统计学意义(P<0.05)。结论:APN干预有利于改善VD大鼠的认知功能,可能与增加脑白质血管形成有关。
脂联素;血管性痴呆;认知障碍;血管内皮生长因子类;大鼠
血管性痴呆(vascular dementia,VD)是由各种血管危险因素包括年龄增加、糖尿病、高血压、动脉粥样硬化和中风等导致的严重认知功能障碍,脂联素(adiponectin,APN)与以上危险因素密切相关。APN是由脂肪细胞分泌的一种蛋白质,其血浆水平随着年龄增加而下降,低APN水平增加中风、高血压、糖尿病等的风险。APN可延缓高血压、动脉粥样硬化、糖尿病的进展[1],降低VD的风险、改善认知功能及VD相关的病理如脑血管功能障碍、受损的胰岛素信号转导及神经炎症。本研究主要通过观察APN、血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)及CD31在大鼠脑内的表达及APN对大鼠认知功能的影响,探讨APN在VD中的作用及其作用机制。
1 材料与方法
1.1 主要试剂
携带APN基因的慢病毒载体由上海吉凯基因化学技术有限公司构建;VEGF、CD31兔抗鼠抗体购于abcam公司;二氨基联苯胺显色盒购于北京中杉金桥生物技术有限公司。
1.2 方法
1.2.1 动物模型制作及分组 SPF级成年雄性SD大鼠45只,体质量200~250 g,由湖北省实验动物研究中心提供,正常环境饲养。大鼠随机分为3组:假手术组,模型组及APN组,各15只。采用手术永久结扎大鼠双侧颈总动脉法制备VD模型,以10%水合氯醛常规麻醉动物,手术钝性分离双侧颈总动脉,0号线结扎远、近心端,并从中间剪断,缝合切口,放回笼中保温饲养。假手术组不结扎、不剪断双侧颈总动脉,其他处理同模型组。APN组于造模后1周将携带APN基因的慢病毒载体(1.0×107Ifu)注入大鼠尾静脉。
1.2.2 行为学检测 干预后8周通过Morris水迷宫观察大鼠行为学改变。定位航行试验:记录大鼠找到水下隐藏平台所需时间,即逃避潜伏期。如果大鼠在 60 s内未到达平台,记录逃避潜伏期为60 s。取4次训练的平均值。空间探索试验:在第6天进行空间探索试验,记录大鼠在60 s内的运动轨迹、在原平台象限游泳时间、进入该象限的次数及所有象限总时间,算出目标象限时间百分比。
1.2.3 组织取材 行为学检测结束后次日行常规多聚甲醛灌注取脑,全脑浸入4%多聚甲醛液中固定24 h后,石蜡包埋,冠状切片,片厚4.5 μm,行免疫组织化学检测。
1.2.4 免疫组织化学检测 使用免疫组化方法检测样本中APN、CD31、VEGF在脑白质中的表达,表现为棕色颗粒沉淀。切片常规脱蜡,EDTA修复,BSA封闭,分别滴加一抗 APN(1:100)、VEGF(1:200)、CD31(1:100),4℃过夜,滴加相应种属的二抗,37℃温箱孵育50 min,DAB显色,苏木素复染,脱水、透明、封固。APN的表达通过测取每个视野的积分光密度(integrated option density,IOD),取5个视野的平均值;CD31和VEGF的表达通过测每个视野里的血管个数,取5个视野的平均值。使用软件Image-Pro Plus检测。
1.3 统计学处理
2 结果
2.1 行为学检测结果
本研究模型大鼠存活24只,死亡6只,死亡率25%。与假手术组比较,模型组和APN组大鼠第4天起逃避潜伏期明显较长(P<0.05),目标象限游泳时间百分比低(P<0.05)。与模型组比较,VPN组大鼠第5天逃避潜伏期明显缩短(P<0.05),目标象限游泳时间百分比增加(P<0.05),见表1。
表1 大鼠水迷宫测试结果比较(±s)
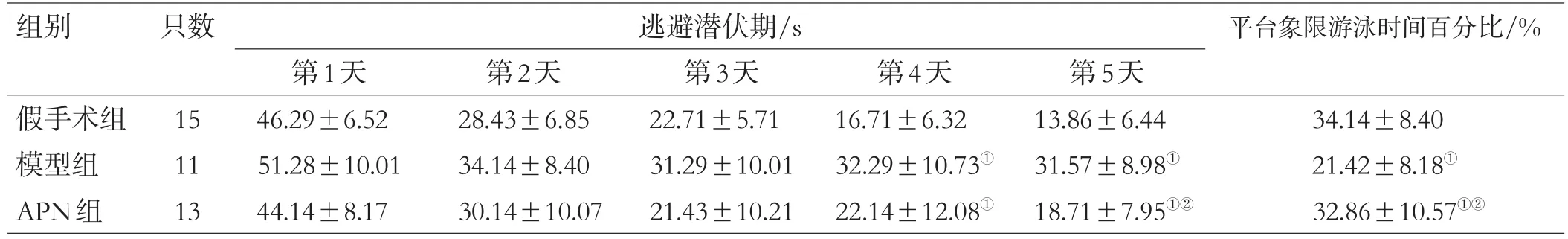
表1 大鼠水迷宫测试结果比较(±s)
注:与假手术组比较,①P<0.05;与模型组比较,②P<0.05
组别 只数 逃避潜伏期/s 平台象限游泳时间百分比/%假手术组模型组APN组15 11 13第1天46.29±6.52 51.28±10.01 44.14±8.17第2天28.43±6.85 34.14±8.40 30.14±10.07第3天22.71±5.71 31.29±10.01 21.43±10.21第4天16.71±6.32 32.29±10.73①22.14±12.08①第5天13.86±6.44 31.57±8.98①18.71±7.95①②34.14±8.40 21.42±8.18①32.86±10.57①②

图1 各组脑深部白质及胼胝体APN免疫组化染色图片(×200)
2.2 脑组织免疫组化染色结果
模型组大鼠脑深部白质及胼胝体APN表达水平低于对照组(P<0.05),APN组脑深部白质及胼胝体APN表达水平高于对照组和模型组(均P<0.05),见图2。
2.3 CD31、VEGF免疫组化结果
模型组和APN组大鼠脑深部白质及胼胝体VEGF、CD31表达水平高于对照组(P<0.05),APN组脑深部白质及胼胝体VEGF、CD31表达水平高于模型组(均P<0.05),见图3、4。
3 讨论
手术永久结扎大鼠双侧颈总动脉法是常用的VD研究模型,术后大鼠形成慢性全脑低灌注状态,主要的组织病理学改变是脑小血管病变和脑白质病变,表现为明显的学习记忆功能障碍。脑小血管功能障碍及其引起的血脑屏障破坏会损害大脑的微环境,导致对缺血敏感的认知关键区域脑组织(如皮质下白质、新皮质、海马)的损伤,出现神经功能缺损和认知障碍[2,3]。额叶和基底核是脑小血管病的好发部位,认知损害突出的特征是执行功能障碍和精神运动迟缓,其与前额叶和基底核的联系中断有关。本研究显示模型组大鼠逃避潜伏期长,目标象限游泳时间百分比显著低,学习记忆障碍明显。而给予APN干预后大鼠学习和记忆能力的损害有明显的改善。
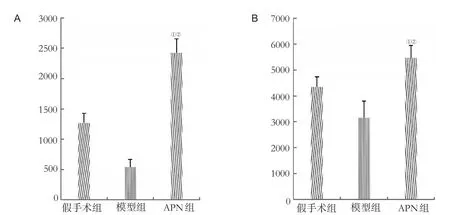
图2 各组脑深部白质及胼胝体APN蛋白表达水平比较
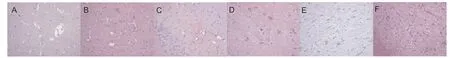
图3 各组脑深部白质及胼胝体VEGF免疫组化染色(×200)

图4 各组脑深部白质及胼胝体CD31免疫组化染色(×200)
表2 大鼠脑深部白质和胼胝体CD31和VEGF蛋白表达水平比较(±s)

表2 大鼠脑深部白质和胼胝体CD31和VEGF蛋白表达水平比较(±s)
注:与假手术组比较,①P<0.05;与模型组比较,②P<0.05
组别 只数CD31VEGF假手术组模型组APN组15 11 13深部白质5.75±0.25 11.18±1.24①17.00±2.50①②胼胝体5.25±1.25 11.00±1.50①16.83±1.61①②深部白质6.44±0.10 8.75±1.75①14.25±1.75①②胼胝体1.75±0.75 4.33±0.79①8.50±1.50①②
本研究显示模型组大鼠脑组织VEGF及CD31表达水平增加,说明慢性脑低灌注状态下VEGF表达上调,微血管代偿性增生。VEGF作用于血管内皮细胞,促进血管内皮细胞增殖及诱导新生血管形成,增加脑灌注,减少神经元凋亡或坏死,VEGF对神经元细胞还有直接营养作用,促进神经组织再生[4]。给予外源性APN后,大鼠脑组织VEGF及CD31表达水平明显增加,说明APN促进脑微血管形成,增加脑灌注,从而改善认知功能。APN可以通过抑制血管内皮细胞炎性反应、血管平滑肌细胞增殖及改善糖脂代谢等多重机制保护血管组织,参与血管损伤的修复,干预内膜的增生和血管狭窄的进展[5]。急性局灶性脑缺血的研究亦发现APN通过促进血管形成[6,7]和抑制白质炎性反应[8]等机制修复缺血脑损伤,改善神经功能缺损。有研究亦发现下丘脑乙酰胆碱水平与血清脂联素水平直接相关[9]。Zhang等[10]报道,脂联素激活脂联素受体-1后通过p38MAPK和GSK-3β/β-catenin信号级联刺激成年大鼠海马神经元的增殖。
总之,本研究结果提示,APN增加VEGF蛋白的表达,促进脑血管新生,从而改善VD大鼠认知功能障碍。鉴于APN与血管性痴呆的危险因素(包括衰老、糖尿病、高血压、动脉粥样硬化和卒中等)之间的关系,尚需要进一步研究APN在血管性痴呆中的作用。
[1] Song J,Lee WT,Park KA,et al.Association between Risk Factors for Vascular Dementia and Adiponectin[J].Biomed Res Int,2014,2014:261672.
[2] Gorelick PB,Scuteri A,Black SE,et al.Contributions to Cognitive Impairment and Dementia:A Statement for Healthcare Professionals From the American Heart Association/American Stroke Association[J].Stroke,2011,42:2672-2713.
[3]林琅,黎红华,武强,等.慢性低灌注对大鼠脑白质血管生成与血脑屏障的影响[J].神经损伤与功能重建,2016,11:9-11.
[4]沈雪玄,麓慧,秦荣印,等.血管内皮生长因子对脑缺血的保护作用[J].国际脑血管病杂志,2014,22:704-708.
[5]Li FY,Cheng KK,Lam KS,et al.Cross-talk between adipose tissue and vasculature:role of adiponectin[J].Acta Physiol(Oxf),2011,203:167-180.
[6]Miao J,Shen LH,Tang YH,et al.Overexpression of adiponectin improves neurobehavioral outcomes after focal cerebral ischemia in aged mice[J].CNS Neurosci Ther,2013,19:969-977.
[7]Shen L,Miao J,Yuan F,et al.Overexpression of adiponectin promotes focal angiogenesis in the mouse brain following middle cerebral artery occlusion[J].Gene Ther,2013,20:93-101.
[8]Chen B,Liao WQ,Xu NA,et al.Adiponectin protects against cerebral ischemia-reperfusion injury through anti-inflammatory action[J].Brain Res,2009,1273:129-137.
[9]Sakr HF.Effect of sitagliptin on the working memory and reference memory in type 2 diabetic Sprague-Dawley rats:possible role of adiponectin receptors 1[J].J Physiol Pharmacol,2013,64:613-623.
[10]Zhang D,Guo M,Zhang W,et al.Adiponectin stimulates proliferation of adult hippocampal neural stem/progenitor cells through activation of the p38MAPK/GSK-3b/b-catenin signaling cascade[J].J Biol Chem,2011,286:44913-44920.
Effect of Adiponectin Intervention on Cognitive Function in Rats with Vascular Dementia
SHU Min,LIU Yu-min,ZHANG Hong,DENG Min,ZHANG Ren-wei.Department of Neurology,Zhongnan Hospital,Wuhan University,Wuhan 430071,China
Objective:To investigate the changes of adiponectin(APN)levels in brain tissue of rats with vascular dementia(VD),and its role with brain angiogenesis and cognitive function.Methods:VD model was prepared by permanent bilateral carotid artery ligation(2VO).The lentiviral vectors encoding APN gene was injected into rat's tail vein for APN intervention.Forty-five SD rats were randomly divided into sham group(sham-operated,n=15),VD group(2VO,n=15)and APN group(2VO+APN,n=15).The cognitive function of rats was recorded by Morris water maze.The expressions of APN,VEGF and CD31 protein were determined by immunohistochemistry.Results:Compared with those in sham group,the escape latency was prolonged and the percentage of time spending in the goal quadrant was shortened in VD group;the expression of APN protein in brain tissue decreased but the expressions of VEGF and CD31 protein in brain tissue increased(P<0.05).Compared with those in VD group,APN intervention significantly reduced the escape latency and prolonged the percentage of time spending in the goal quadrant in APN group,and the expressions of APN,VEGF and CD31 proteins in brain tissue increased(P<0.05).Conclu⁃sion:APN intervention can improve the cognitive function of rats with VD,which may be related to the increase of angiogenesis in white matter.
adiponectin;vascular dementia;cognitive impairment;vascular endothelial growth factors;rats
R741;R741.05;R743
ADOI10.16780/j.cnki.sjssgncj.2017.06.003
武汉大学中南医院神经内科武汉430070
湖北省卫计委项目(No.WJ2015MB10 1)
2017-06-12
舒敏shumin917@hot -mail.com
(本文编辑:唐颖馨)

