永久性心房颤动患者左心房差异基因表达谱的建立与分析
高杰,周建,苏丕雄,刘岩,顾松,张希涛,安向光
临床研究
永久性心房颤动患者左心房差异基因表达谱的建立与分析
高杰,周建,苏丕雄,刘岩,顾松,张希涛,安向光
目的:探讨与永久性心房颤动(pAF)发生、发展相关的基因和信号通路,为研究pAF发生的分子机制提供基础。
方法:用Agilent 4x44K 基因芯片分析pAF患者(n=7例)与窦性心律健康者(n=4例)的左心房组织mRNA,寻找差异表达的基因。以Gene Ontology(GO)和KEGG、Biocarta数据库为基础,分析差异表达基因参与的功能和信号通路。选取差异显著的部分基因应用实时定量-聚合酶链式反应(qRT-PCR)在5例pAF患者与5例窦性心律健康者标本进行验证。
结果:表达谱结果显示,共有987个差异表达基因,其中567个基因表达下调,420个基因表达上调。选取9个差异显著的基因在新一组的病例标本上应用qRT-PCR验证,结果显示均有统计学差异,且改变与芯片结果一致。这些基因通过参与左心房组织纤维化、电重构、炎症、细胞应激、代谢调节、转录调节等与pAF的发生密切相关。GO和Pathway分析表明下调的基因主要参与调节代谢,表达上调的基因影响细胞应激反应、免疫应答、血小板活化等过程。
结论:通过基因芯片技术发现与pAF发生相关的重要基因,通过影响细胞代谢、炎症、免疫应答、血栓形成等参与左心房的结构、功能重构。
心房颤动;基因表达谱
我国成人心房颤动(AF)患病率为0.64%,其中70岁以上人群高达0.89%[1]。AF增加脑卒中及其他血栓栓塞事件的发生率,约15%的脑卒中由AF引发[2],还可导致室性心律失常和心功能不全。目前治疗AF的手段也不理想[1]。AF的发病机制是研究的热点和难点,尤其永久性心房颤动(pAF),具有高异质性和自我延续性的特点,其发病机制与心房的电重构和结构重构、神经体液及分子表达异常等有关[3,4]。基因芯片分析可以通过高通量途径研究差异性表达的基因,为pAF的发生、维持提供分子依据。本研究旨在应用基因芯片技术分析pAF患者与窦性心律健康者的左心房组织全基因表达谱,寻找与pAF发生和维持相关的基因,通过Gene Ontology(GO)和Pathway分析方法,分析与pAF发生相关的生物学过程和信号通路。
1 资料与方法
标本采集及临床资料:所有组织标本均来自首都医科大学附属北京朝阳医院心脏外科确诊的7例pAF患者,4例窦性心律(SR)健康者为对照,pAF患者患病时间(47.7±25.0)个月,左心房组织取自AF射频消融+左心耳切除术中,样本大小约5 mm×10 mm×2 mm,为尽量减小样本间差异,选取的心房组织均取自右肺静脉入左心房口处。 4例窦性心律健康者的样本组织取自心脏移植术的窦性心律的心脏供体。受试者的临床资料见表1。获取的样本组织立即置于液氮罐中,由北京朝阳医院伦理中心批准,并与患者签署知情协议书。
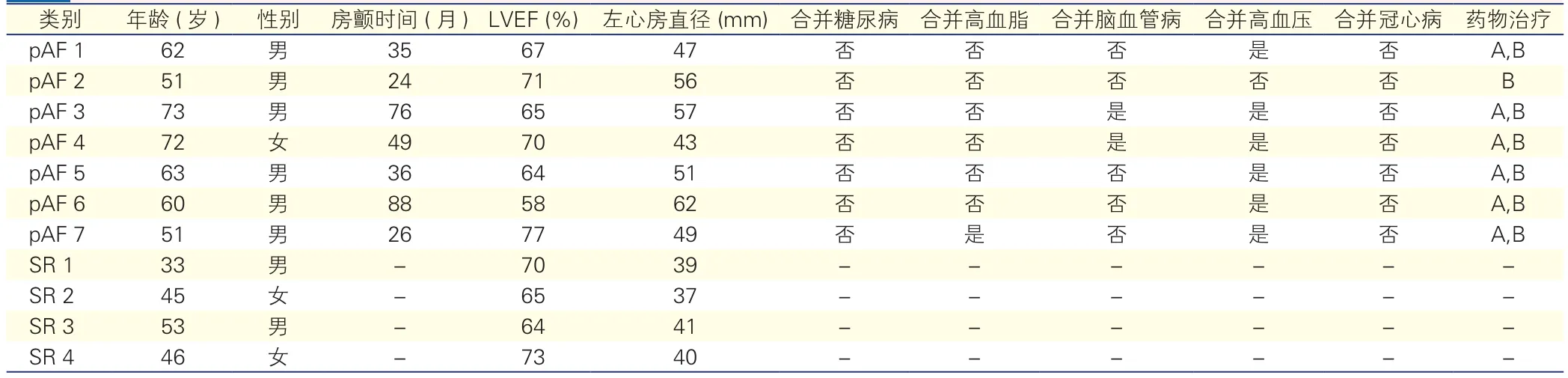
表1 7例永久性心房颤动患者和4例窦性心律健康者临床资料
cRNA制备、标记、芯片杂交:每例样本取100 mg组织,BioPulverizerTM冰冻粉碎组织,加1 ml的RNA抽提试剂Trizol(Invitrogen公司),Mini-Bead-Beater-16匀浆后抽提RNA。琼脂糖变性凝胶电泳对样品总RNA进行完整性检测,NanoDrop ND-1000分光光度法定量总RNA并评估纯度。RNA标记和芯片杂交按照Agilent单色芯片基因表达分析方法进行。cRNA合成并标记:取1 μg总RNA转录合成cRNA,同时用Cy3-CTP 荧光染料标记。使用QIAGEN RNeasy®Mini kit纯化cRNA,用NanoDrop测得cRNA浓度。cRNA样品片段化和芯片杂交:按以下配液 Cy3 cRNA 1.65g、10×Blocking Agent 11 μl、25×Fragmentation Buffer 2.2 μl、无核酸酶水补至总体积55 μl,在60℃温浴30 min进行片段化。加入55 μl 2×GEx 杂交缓冲液稀释cRNA。取100 μl上芯片,与Agilent人全基因组(4x44K)v2 芯片 (>27 000探针)杂交,65℃,17 h,10 rpm滚动杂交,芯片洗涤后,Agilent扫描仪中扫描,扫描仪自动以100%和10%的光电耦合装置各扫描一次,两次结果Agilent软件可自动合并。由上海康成生物公司提供技术帮助。
数据收集、分析:基因筛选:应用10.7.3.1版Agilent萃取软件,分析得到的阵列图像,GeneSpring GX v11.5.1(Agilent)。完成筛选及后续数据分析,应用聚类分析和火山图法分析,找到差异表达的mRNA(倍数变化>2)。
GO和Pathway分析:按照GO将差异表达的基因分类,并依据KEGG和Biocarta数据库进行Pathway分析,应用Agilent GeneSpring GX 软件的聚类分析法找出有意义的GO和Pathway。
实时定量-聚合酶链式反应(qRT-PCR)验证:收集新一组的左心房组织标本,其中pAF患者5例,SR健康者5例,临床资料见表2。qRT- PCR验证筛选的9个差异表达的基因,样本用RNeasy mini kit试剂盒提取总RNA,取2μg RNA进行反转录。SYBR Green(Thermo Fisher Scientific)法进行qRTPCR验证。引物设计如表3,采用18S作为内参,结果是3次独立实验的平均值。
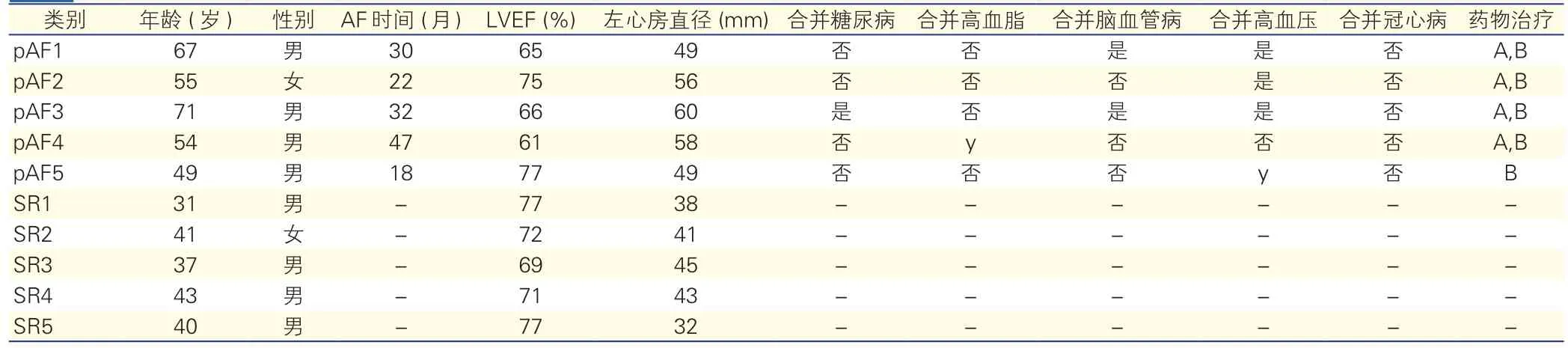
表2 5例永久性心房颤动患者和5例窦性心律健康者临床资料
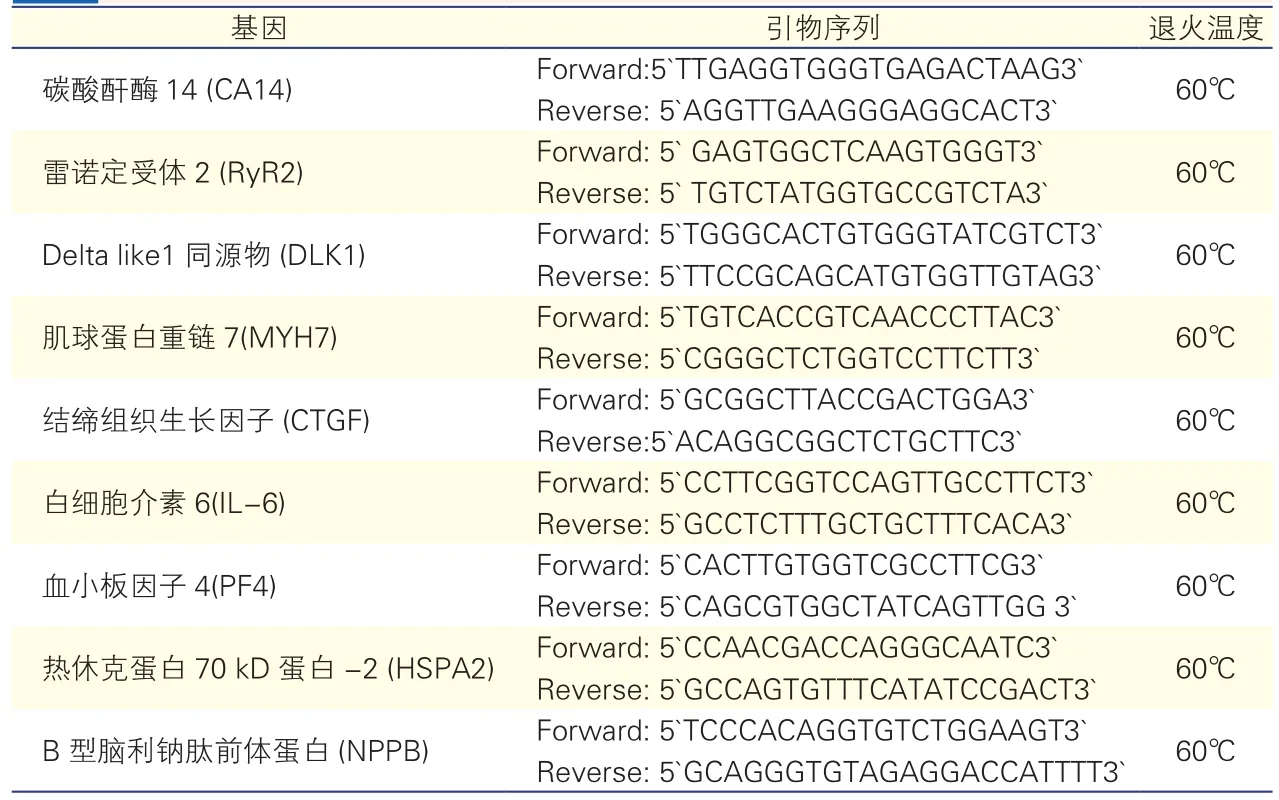
表3 引物设计
2 结果
2.1 pAF患者和SR健康者的左心房组织的差异表达基因
全基因组表达谱芯片结果显示,共有987个差异表达基因,其中420个基因表达上调,567个基因表达下调(图1),与pAF相关的表达发生显著改变前10个上调和下调基因见表4。其中,表达升高最明显的是B型脑利钠肽前体蛋白(NPPB),比窦性心律健康者升高30倍。
2.2 差异表达基因的功能和代谢通路分析
为系统认识pAF差异表达基因的生物学功能,以GO、KEGG和Biocarta数据库对差异表达基因进行分析。GO分析显示下调基因的功能中有明确参与物质代谢(图2A),通过升高长链脂酰CoA合成酶3(ACSL3)、长链脂酰CoA脱氢酶(ACADL)下调脂肪酸、丙酸盐代谢(图2C)[5],通过下调乙酰辅酶A羧化酶β(ACCβ)、脂肪酸合成酶(FASN)使脂肪酸的合成减少。Pathway分析也显示下调的信号通路有脂肪酸代谢、半胱氨酸和蛋氨酸代谢、酪氨酸代谢,甘油酯类代谢、丙酸盐代谢(图2B)。
GO分析显示上调基因的生物过程是细胞应激反应、免疫应答、炎性反应、血小板活化等,参与房颤的发生和维持机制(图3A),例如白细胞介素6(IL-6)、肿瘤坏死因子(TNF)、血小板4因子(PF4)等。其中,最重要的生物过程是免疫反应和血小板激活(图3C)。Pathway分析显示上调的信号通路有细胞因子-细胞因子受体相互作用、趋化因子信号通路、转化生长因子-β(TGF-β)信号通路、细胞外基质受体作用通路、补体和凝血级联反应(图3B),显示出炎症因子、免疫反应、心房纤维化在pAF发生和维持中的作用。同时,病毒性心肌炎和肥厚性心肌病也是参与AF病理生理的因素之一。
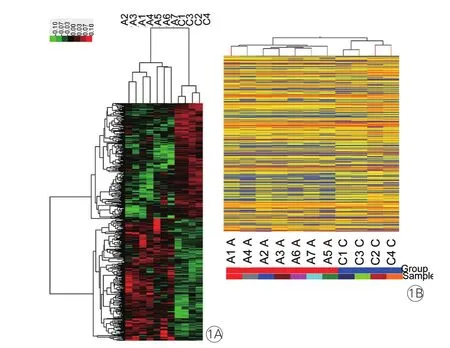
图1 永久性心房颤动患者和窦性心律健康者的左心房组织差异表达基因的热图(1A)和聚类分析图(1B)
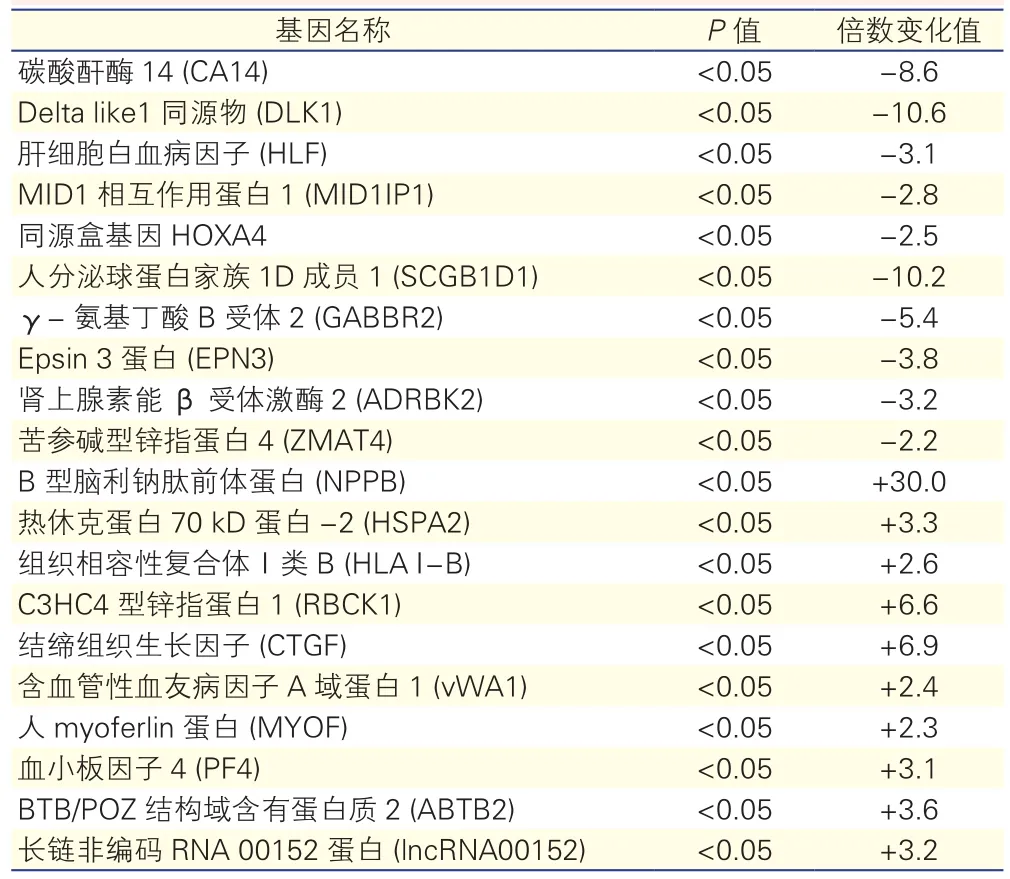
表4 表达谱芯片显示永久性心房颤动患者表达显著改变的前10个基因
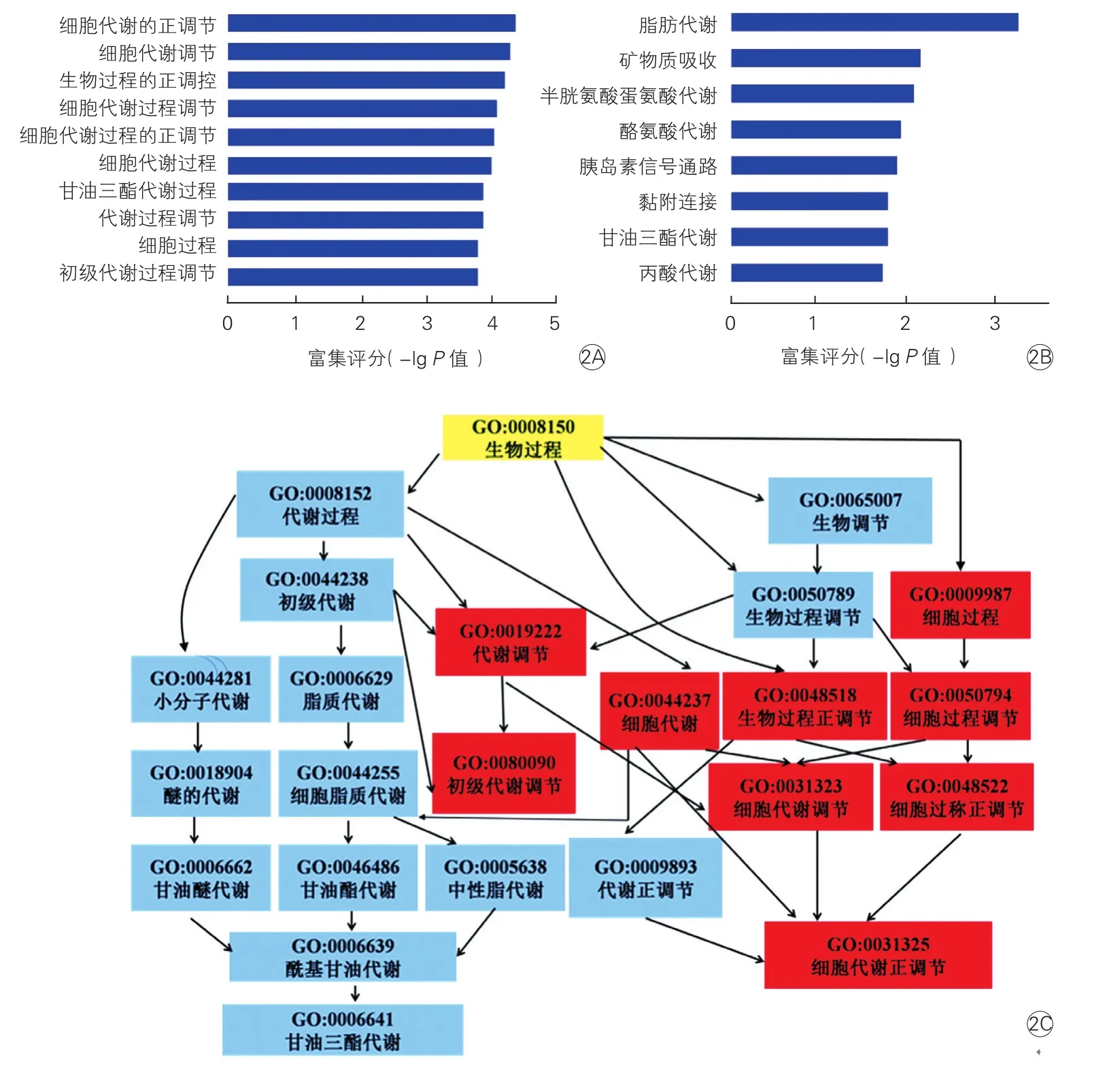
图2 差异表达下调基因的功能和通路分析
2.3 qRT- PCR验证结果
为验证芯片结果,收集新一组病例:pAF患者5例和SR健康者5例心房组织病例标本进行qRT-PCR分析。选择9个差异较大的感兴趣目标基因检测,分别是碳酸酐 酶 14(CA14), 细胞质监控基因;雷诺定受体 2(RyR2),肌浆网Ca2+通道受体;Delta like1同源物(DLK1),一种生长调节因子;肌球蛋白(MYH7);结缔组织生长因子(CTGF),左心房纤维化调节因子;IL-6,炎性因子;PF4,与凝血相关的细胞因子;热休克蛋白70 kD蛋白-2 (HSPA2),细胞应激反应蛋白;NPPB。结果显示均有显著性变化,且改变与芯片结果一致(表5)。
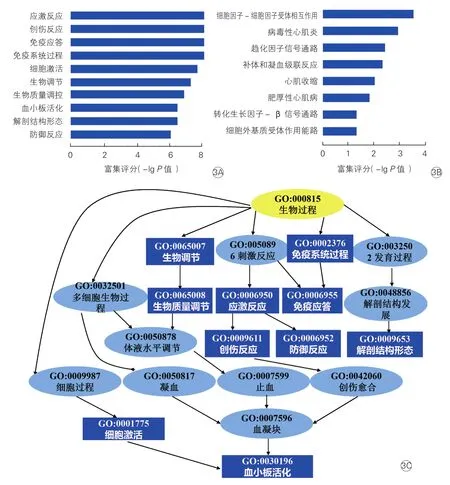
图3 差异表达上调基因的功能和通路分析
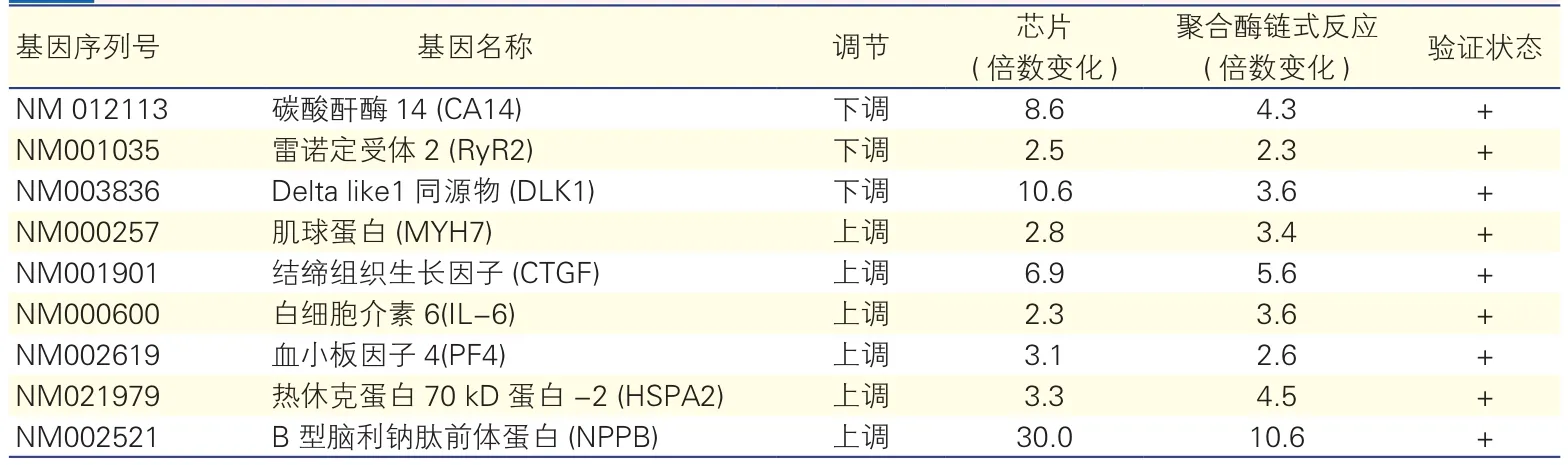
表5 差异表达基因的实时定量-聚合酶链式反应验证(结果是3次独立实验的均值)
3 讨论
本研究通过生物芯片技术对pAF的差异表达基因进行初步筛选,发现差异表达基因987个,其中420个基因表达上调,567个基因表达下调。GO和Pathway分析显示下调的基因主要参与细胞代谢如脂肪酸代谢,表达上调的基因影响细胞应激反应、免疫应答等过程。以下是本研究发现的AF相关基因和可能参与的AF发病机制。
左心房结构重构:在致病因素刺激下,左心房为维持稳态进行相应的调整,形成新的表型,称为结构重构。表现在心房肌细胞超微结构的改变、心肌间质胶原纤维重分布及纤维化等,结构重构可导致局部心肌电活动传导异常,如使激动传导速度减慢及传导曲折复杂,从而易形成较多的微折返环,进而促进AF的发生发展[6,7]。 本研究发现左心房结构蛋白发生改变,MYH7基因上调导致肌球蛋白由房性α-型向有收缩性质的室性β-型转变。心房纤维化也是结构重构的基础,本研究发现pAF患者CTGF显著上调,说明心肌间质纤维化增生。Pathway分析也显示TGF-β信号通路、ECM-受体作用通路上调,提示心房纤维化结构重构在AF发生、进展中的重要作用[8]。
左心房的电重构:Ca2+离子平衡失调在AF的产生和维持中发挥重要作用。本研究发现,心肌RyR2在pAF患者表达显著下调。正常心脏的Ca2+通过L型通道进入细胞并通过肌浆网上RyR2诱导Ca2+释放,作为心肌细胞内的钙释放通道,RyR2对心肌细胞内游离钙离子浓度有重要影响。本研究显示pAF中RyR2表达显著下降,RyR2降低使正常心肌细胞Ca2+泄漏促进心律失常发生。也有研究显示在AF心肌细胞,RyR2有高磷酸化修饰,其灵敏度增加,诱发更多的Ca2+泄漏,导致细胞内Ca2+升高,Na+-Ca2+交换增加,提高舒张期Ca2+电压,延迟心房去极化活动,诱导心律失常[9]。
左心房的脂肪酸代谢、氨基酸代谢下降:离子运输、心肌细胞收缩和左心房壁的高张力都可增加能源需求,pAF患者的左心房能量代谢处于高水平。虽然早期心肌细胞增殖的能量来源于糖酵解,成熟心肌细胞获得能量的主要方式是脂肪酸β氧化。然而,在AF发生过程中,一些脂肪酸合成、分解代谢的关键酶发生明显改变,如ACSL3、ACADL表达升高,而ACCβ、FASN表达减少,脂肪酸的合成、氧化分解都被下调[10]。另外,半胱氨酸和甲硫氨酸代谢、酪氨酸代谢,甘油酯类代谢、丙酸盐代谢也下调。Mayr等[11]发现心脏术后超过80%的患者如心肌代谢不正常都会导致AF,因此,在pAF发生中代谢功能障碍可能起重要作用。作为补偿,在AF早期,通过糖酵解增加能源,在冠状动静脉的乳酸增加和一些糖酵解转录因子上调也证明了这一点。Mayr等[11]用核磁共振波谱法发现在pAF患者心房组织β-羟基丁酸、生酮氨基酸的水平上升。从脂肪酸到葡萄糖的代谢转换和酮体负反馈调节中,反映出AF患者左心房的高代谢状态。β受体阻滞剂可以改善心肌代谢、减少心肌葡萄糖吸收、减轻心肌收缩和冠状动脉血流从而减少心肌氧耗和代谢,从而减轻AF的临床症状。
炎症:目前研究提示炎症在AF的发生、发展中起到重要作用。本研究发现IL-6在AF的左心房组织中表达超过正常2倍,作为多效性细胞因子,IL-6可能来源于免疫相关细胞、内皮细胞、心肌细胞,可以刺激纤维蛋白原和C反应蛋白的合成,促进内皮细胞的活化和损伤[12,13]。另有报道提示肿瘤坏死因子(TNF)的过表达可以下调Cx40,从而缩短有效不应期并易产生房性心律失常[14]。另外,C反应蛋白可能和AF有密切联系,如Avikes等[15]在大规模前瞻性的队列研究中发现C反应蛋白 升高可以作为预测AF发生的独立因素。同时,GO分析显示细胞因子-细胞因子受体相互作用、趋化因子信号通路也上调,提示炎症因子活化与AF发生密切相关。
本研究筛选出了一些与心房结构重构、电重构密切相关的基因,为进一步探索pAF发病的分子机制及相关信号通路提供了线索。
[1] Magnani JW, Rienstra M, Lin H, et al. Atrial fibrillation: current knowledge and future directions in epidemiology and genomics.Circulation, 2011, 124:1982-1993.
[2] Wijffels MC, Kirchhof CJ, Dorland R, et al. Atrial fibrillation begets atrial fibrillation: A study in awake chronically instrumented goats.Circulation, 1995, 92: 1954-1968.
[3] Thijssen VL, Ausma J, Borgers M. Structural remodeling during chronic atrial fibrillation: act of programmed cell survival. Cardiovasc Res, 2001, 52: 14-24.
[4] Hoit BD, Shao Y, Gabel M, et al. Left arterial mechanical and biochemical adaptation to pacing induced heart failure. Cardiovasc Res, 1995, 29: 469-474.
[5] Poppelreuther M, Rudolph B, Du C, et al. The N-terminal region of acyl-CoA synthetase 3 is essential for both the localization on lipid droplets and the function in fatty acid uptake. J Lipid Res, 2012, 53:888-900.
[6] Ohki R, Yamamoto K, Ueno S, et al. Gene expression profiling of human atrial myocardium with atrial fibrillation by DNA microarray analysis. Int J Cardiol, 2005, 102: 233-238.
[7] Kim NH, Ahn Y, Oh SK, et al. Altered pattems of gene expression in response to chronic artial fibrillation. Int Heart J, 2005, 46: 383-395.
[8] Gu J, Liu X, Wang QX, et al. Angiotensin II increase CTGF expression via MAPKs/TGF-beta1/TRAF6 pathway in atrial fibroblasts. Exp Cell Res, 2012, 318: 2105-2115.
[9] Voigt N, Li N, Wang Q, et al. Enhanced sarcoplasmic reticulum Ca2+leak and invreased Na+-Ca2+exchanger function underlie delayed afterdepolarizations in patients with chronic atrial fibrillation.Circulation, 2012, 125: 2059-2070.
[10] Poppelreuther M, Rudolph B, Du C, et al. The N-terminal region of acyl-CoA synthetase 3 is essential for both the localization on lipid droplets and the function in fatty acid uptake. J Lipid Res, 2012, 53:888-900.
[11] Mayr M, Yusuf S, Weir G, et al. Combined metabolomic and proteomic analysis of human atrial fibrillation. J Am Coll Cardiol, 2008, 51: 585-594.
[12] Kaski JC, Arrebola-Moreno AL. Inflammation and thrombosis in atrial fibrillation. Rev Esp Cardiol, 2011, 65: 551-553.
[13] Marcus GM, Whooley MA, Glidden DV, et al. Interleukin-6 and atrial fibrillation in patients with coronary artery disease: data from the Heart and Soul Study. Am Heart J, 2008, 155: 303-309.
[14] Guo Y, Lip GY, Apostolakis S. Inflammation in atrial fibrillation. J Am Coll Cardiol, 2012, 60: 2263-2270.
[15] Avikes RJ, Martin DO, Apperson-Hansen C, et al. Inflammation as a risk factor for atrial fibrillation. Circulation, 2003, 108: 3006-3010.
2017-03-21)
(编辑:许菁)
Establishment and Analysis for Differential Gene Expression Profile of Left Atrium in Permanent Atrial Fibrillation Patients
GAO Jie, ZHOU Jian, SU Pi-xiong, LIU Yan, GU Song, ZHANG Xi-tao, AN Xiang-guang.
Department of Cardiac Surgery, Beijing Chaoyang Hospital, Capital Medical University, Beijing (100020), China
AN Xiang-guang, Email: anxiangguang@sina.com
Objective: To explore the relevant gene, signaling pathway for permanent atrial fi brillation (pAF) occurrence in order to provide the molecular basis of the pathogenesis of pAF.
Methods: Our research included in 2 groups: pAF group, n=7 patients and Control group, n=4 healthy subjects with sinus rhythm. Agilent 4x44K microarray was used to analyze the mRNA in left atrium for differential gene expression prof i le.Based on Gene Ontology, KEGG and Biocarta databases, differentially expressed genes were studied for their relevant function and signaling pathway. Furthermore, the genes with signif i cant differences were verif i ed by quantitative real time PCR (qRT-PCR) in pathological specimen from 5 pAF patients and 5 normal heart donors.
Results: The expression prof i le identif i ed 987 abnormally expressed genes, 567 of them were down-regulated and 420 were up-regulated. 9 genes with signif i cant differences were verif i ed by qRT-PCR in pathological specimen and the changes were similar to microarray; those genes were closely related to pAF by involving left atrium fi brosis, electrical remodeling,inflammation, cellular stress response, metabolism and transcription regulation. GO and Pathway analysis indicated that down-regulated genes were mainly involved in metabolic processes; up-regulated genes had the effects on cellular stress response, immune response and platelet activation.
Conclusion: Microarray technology identif i ed some important genes related to pAF occurrence; such genes involved in left atrial structural and functional remodeling via affecting cellular metabolism, inflammation, immune response and thrombogenesis in relevant patients.
Atrial fi brillation; Gene expression prof i le
北京市教委科技面上项目(SQKM201410025018)
100020 北京市,首都医科大学附属北京朝阳医院 心外科
高杰 副主任医师 博士 主要从事心律失常学研究 Email:gaojie19750824@163.com 通讯作者:安向光 Email:anxiangguang@sina.com
R54
A
1000-3614(2017)11-1085-06
10.3969/j.issn.1000-3614.2017.11.010
(Chinese Circulation Journal, 2017,32:1085.)

