小剂量多巴酚丁胺负荷下超声斑点追踪技术与磁共振延迟增强显像技术评价陈旧性心肌梗死存活性研究
陈军红,李东野,韩曙光,徐通达, 王超凡,王晓瑛
冠心病研究
小剂量多巴酚丁胺负荷下超声斑点追踪技术与磁共振延迟增强显像技术评价陈旧性心肌梗死存活性研究
陈军红,李东野,韩曙光,徐通达, 王超凡,王晓瑛
目的:比较磁共振延迟增强显像(DE-MRI)技术与小剂量多巴酚丁胺负荷斑点追踪超声 (LDDS-STE) 技术评价陈旧性心肌梗死患者存活心肌方面的敏感性和特异性。
方法:选取30例本院住院陈旧性心肌梗死患者为研究对象。上述患者接受经皮冠状动脉介入治疗(PCI)术前进行心脏核磁共振检查及超声心动图检查,LDDS-STE方法分析静息和负荷条件下左心室室壁运动异常节段短轴径向应变(RS)及应变率(RSr),术后1,3,6个月复查超声心动图,观察室壁运动反常节段运动是否改善或恢复,以室壁运动分数改善作为判断存活心肌的金标准。
结果: 30例患者共获得510个左心室可分析节段,超声心动图判定室壁运动异常节段201个。与金标准比较,静息状态下左心室径向应变(RSrest)预测陈旧性心肌梗死患者存活心肌受试者工作特征(ROC)曲线下面积为0.636,敏感性为60.0%,特异性为60.5%;小剂量多巴酚丁胺负荷条件下左心室径向应变(RSLDDS)预测存活心肌ROC曲线下面积0.806,敏感性和特异性分别为79.1%及82.7%。静息状态下左心室径向应变率(RSrrest)预测陈旧性心肌梗死患者存活心肌敏感性为60.0%,特异性为60.5%,ROC曲线下面积0.646;小剂量多巴酚丁胺负荷条件下左心室径向应变率(RSrLDDS)预测存活心肌敏感性和特异性较静息状态下明显提高,分别为80.0%及83.7%,ROC曲线下面积0.808。DE-MRI技术预测存活心肌的敏感性和特异性分别为90.8%和87.1%,准确性89.5%,ROC曲线下面积为0.901。
结论:DE-MRI与LDDS-STE方法均能准确识别梗死后存活心肌, 但DE-MRI方法检测存活心肌的价值稍高于LDDS-STE,且准确率及重复性高,耗时短,为临床预测陈旧性心肌梗死患者PCI术的疗效及治疗策略的选择提供重要依据。
心肌梗死;磁共振成像;超声心动描记术;存活心肌
存活心肌是心肌缺血后的一种特殊存在形式,特点为有效的血运重建可使其功能部分或完全恢复,改善临床症状及预后。如无存活心肌,即使经有效的血运重建,局部心肌也不会恢复功能。如何前瞻性地确定心肌是否存活、心功能异常是否可逆对冠心病患者尤其是陈旧性心肌梗死患者临床治疗方案的选择、危险程度及预后评估有重要的临床意义。磁共振延迟增强显像(DE-MRI)技术可准确识别心肌梗死后坏死透壁的心肌疤痕组织[1,2],超声心动图是传统评价心肌存活性的重要工具之一。本研究拟比较两种方法在检测陈旧性心肌梗死存活心肌上不同,拟为临床提供一种经济有效评价存活心肌的方法。
1 资料与方法
临床资料:收集本院2014-02至2016-12收治的陈旧性心肌梗死患者30例,其中男性19例,女性11例,年龄35~70(56.2±14.6)岁,临床资料见表1。所有患者均签署知情同意书,试验过程中无不良事件发生。排除标准:严重的心律不齐及心律失常,严重的瓣膜病,肥厚型心肌病,慢性阻塞性肺病,心力衰竭急性期,不能配合检查者。
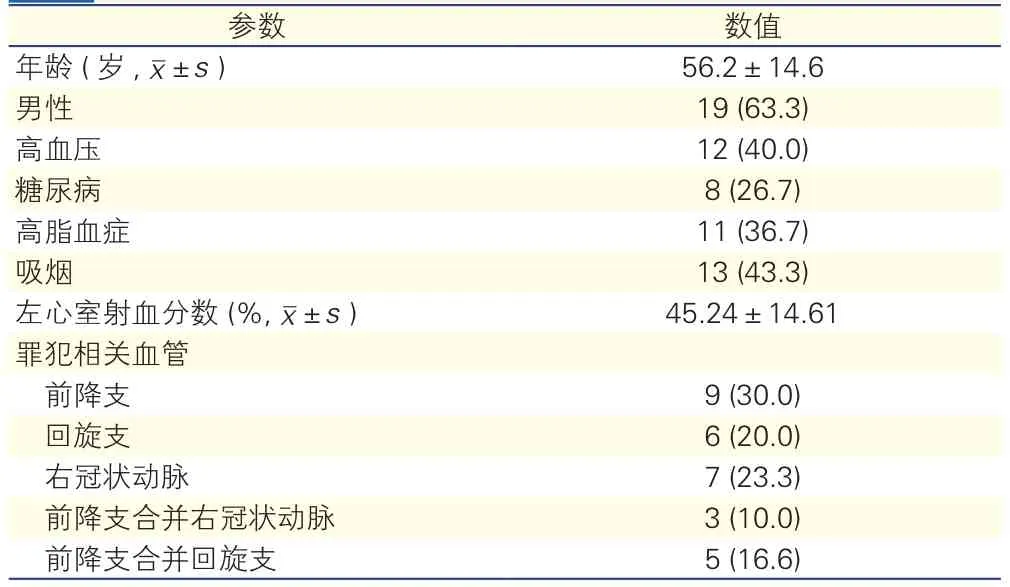
表1 30例受试者临床一般资料[例(%)]
DE-MRI扫描技术及方法:采用philips Intera 1.5T超导型磁共振扫描系统,磁场梯度为30 mT/m和60 mT/m,梯度切换率150mT/(m·ms),配有心脏专用5单元相位阵列线圈。在患者呼气末15 s心电向量门控触发扫描,心脏电影采用亮血序列,是回顾性心电门控真实稳态自由进动梯度回波序列(True FISP),分别行左心室两腔心长轴、四腔心长轴、左心室流出道切面以及6~8层左心室短轴电影。钆延迟增强磁共振扫描心肌首过灌注以0.1 mmol/kg体重,4~5 ml/s流速注入对比剂增强剂(即钆喷酸葡胺),完成以后追加20 ml生理盐水,注射与扫描同时开始,采用TSENSE EPI GRE序列。心肌灌注完成以后立即以2 ml/s的流速追加0.1~0.15 mmol/kg体重的对比剂,同时追加20 ml生理盐水,15 min以后行相位敏感反转恢复的T1WI扫描(PSIR),包括6~8层左心室短轴切面,左心室两腔心切面以及四腔心切面均各1层。脱机分析Philips Achieva Extended MR Workspace 2.6.3.1工作站心脏软件包,定量计算运动异常的心肌节段延迟增强的透壁程度。手动勾画左心室各延迟增强节段强化区域以及该节段室壁全层心肌的轮廓,并计算其面积,分别记为延迟强化区域面积(Ahyperenhancement)与室壁全层心肌面积(Amyocardium),室壁延迟增强透壁程度可按下面的公式计算[3]:延迟增强透壁程度(%)= 延迟强化区域面积/室壁全层心肌面积×100,见图1。左心室各心肌节段延迟增强采用以下5等级分法[3,4]:0分:正常,无延迟增强;1分:延迟增强透壁程度 1%~25%;2分:延迟增强透壁程度 26%~50%;3分:延迟增强透壁程度 51%~75%;4分:延迟增强透壁程度 76%~100%。目前磁共振成像(MRI)评价存活心肌的标准[5,6]:延迟增强透壁程度≤50%则是DE-MRI判断存活心肌的标准。
负荷斑点追踪超声心动图技术与方法:采用Philip iE33彩色超声诊断仪,S5-1探头,频率1~5 MHz,受检者左侧卧位,连接血压与12导联心电图监护,采集并存储连续3个心动周期胸骨旁左心室二尖瓣环、乳头肌、心尖水平短轴切面及胸骨旁左心室长轴切面。帧频维持在60~70 帧频/秒,采用美国超声心动图协会左心室17节段分法。检查前24 h内停用β受体阻滞剂、钙离子拮抗剂及硝酸酯类等抗心绞痛药物和其他影响心肌收缩力的药物。静息状态图像录入后,微量注射泵静脉注入小剂量多巴酚丁胺10 μg/(kg·min)5 min后,同样记录、存储上述左心室短轴切面。QLAB 8.1脱机分析软件沿二尖瓣瓣环及心尖部描记左心室心内膜,手工调节心内膜边界,获得含一定心肌厚度的感兴趣区(ROI),计算机逐帧追踪ROI内斑点组织的运动,得到二尖瓣环、乳头肌及心尖部水平左心室短轴切面每一节段收缩期峰值径向应变(RS), 径向应变率(RSr),每一个数值取3个心动周期的平均值。

图1 磁共振延迟增强透壁程度计算图
以超声心动图心内膜运动和室壁增厚率作为室壁运动评分,计算局部室壁运动异常(RWMA)节段数与评分。心内膜运动幅度≥5 mm或室壁收缩期增厚率≥25 %视为运动正常,记1分;心内膜运动幅度<5 mm或增厚率<25 %视为运动减弱,记2分;心内膜运动和室壁收缩期增厚率消失视为无运动,记3分;收缩期室壁变薄,向外运动为反常运动记4分;室壁瘤记为5分。金标准判定:以超声心动图经皮冠状动脉介入治疗(PCI)术前及术后左心室室壁运动分数改善作为判断存活心肌的金标准[7,8], PCI术后1、3及6个月复查超声心动图,有一次原来运动异常的节段室壁收缩期增厚率比术前静息时增加>10%或室壁运动记分减少1分以上,则认为是存活心肌,否则是坏死或瘢痕心肌。但反常运动转为无运动则判定为室壁运动无改善。
统计学分析:采用SPSS 16.0统计分析软件,所有数据以均数±标准差( ±s)表示,存活心肌与非存活心肌间参数检验采用独立样本t检验。受试者工作特征曲线(ROC曲线)计算不同状态RS和RSr参数的曲线下面积(AUC)及诊断存活心肌的最佳截断点、敏感性、特异性和准确性。率的组间比较则采用卡方检验。P<0.05视为差异具有统计学意义。
2 结果
术前30例确诊为陈旧性心肌梗死患者,均接受冠状动脉造影及PCI术,手术顺利完成。30例患者共获得510左心室可分析节段,传统超声心动图方法判定左心室室壁运动异常节段201个。PCI术后1、3及6个月复查超声心动图,对201个节段进行随访,金标准检出存活心肌131个,非存活心肌70个,其静息和负荷条件下应变及应变率变化见表2。静息状态下左心室径向应变(RSrest)预测存活心肌ROC曲线下面积为0.636,敏感性为60.0%,特异性为60.5%;小剂量多巴酚丁胺负荷条件下左心室径向应变(RSLDDS)预测存活心肌ROC曲线下面积0.806,敏感性和特异性较静息条件下明显提高,分别为79.1%及82.7%,见图2A。静息状态下左心室径向应变率(RSrrest)预测存活心肌ROC曲线下面积0.646,敏感性为60.0%,特异性为60.5%,小剂量多巴酚丁胺负荷条件下左心室径向应变率(RSrLDDS)预测存活心肌ROC曲线下面积0.808,敏感性和特异性较静息条件下明显提高,分别为80.0%及83.7%,见图2B。
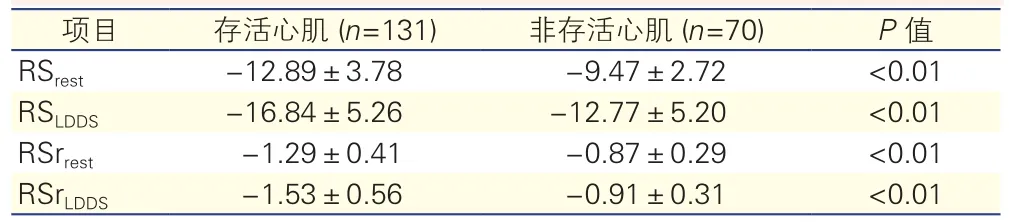
表2 金标准检出存活心肌与非存活心肌静息及负荷条件下径向应变及应变率参数变化( ±s)

图2 静息和负荷条件下斑点追踪超声及磁共振延迟增强技术预测陈旧性心肌梗死患者存活心肌ROC曲线
DE-MRI方法分析上述201个室壁运动异常节段,结果发现其中延迟增强透壁程度为1%~25% 1分的节段有56个,延迟增强透壁程度为26%~50% 2分的节段有72个,延迟增强透壁程度为51%~75% 3分的节段有41个,延迟增强透壁程度为76%~100% 4分的节段有32个。DEMRI根据延迟增强的程度判定其中128个节段判定为存活心肌,73个节段为非存活心肌,敏感性、特异性和准确性分别为90.8%、87.1%和89.5%,见表3,根据不同透壁程度绘制ROC曲线,见图2C。
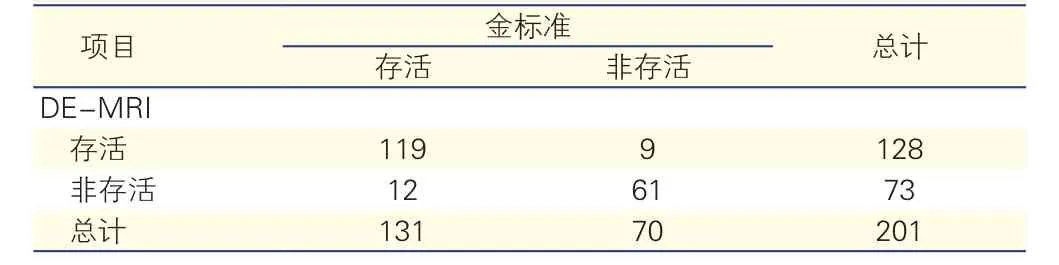
表3 DE-MRI评价陈旧性心肌梗死患者201个室壁运动异常节段存活心肌(例)
3 讨论
心肌梗死是心血管内科的急症,预后差,是心血管疾病最常见的死亡原因。研究证实心肌梗死后的局部室壁运动异常区域除坏死心肌外,尚有部分存活心肌,如冬眠心肌或顿抑心肌[9,10]。再血管化治疗早期识别存活心肌对冠心病患者心肌梗死后冠状动脉血运重建术的疗效判断、预后判断起重要作用。判断存活心肌的金标准主要有正电子发射断层显像(PET)和超声心动图等方法,PET因其检查费用昂贵,且难以划分心内膜下心肌梗死或心肌梗死透壁程度,目前在临床难以广泛普及。故我们选择目前国内外公认的以PCI术后超声室壁运动改善作为判定存活心肌的金标准。
斑点追踪超声(STE)技术因其可对高帧频二维图像的斑点回声进行逐帧追踪,无角度依赖性,能较准确地反映局部及整体心肌功能,因此检测存活心肌有较高的价值,前期研究表明超声心动图结合10 μg/(kg·min)多巴酚丁胺对存活心肌的检出率与双核素单光子发射计算机断层摄影术(DISASPECT)相当[11],故我们采取LDDS-STE方法与DE-MRI方法进行比较。
DE-MRI由于具有良好的空间分辨率及高度的组织特定性能力,其检测存活心肌的准确性及特异性较高,越来越引起临床医生的关注[12]。DE-MRI是通过检测细胞膜的完整性来评估心肌血流灌注,通过计算收缩功能障碍的心肌节段延迟增强的透壁程度来判断是否存在存活心肌[13,14]。急性心肌梗死归咎于细胞膜的完整性被破坏,造影剂得以渗透至细胞外,这种机制往往用于解释急性心肌梗死造影剂延迟增强,但对于陈旧性心肌梗死,其机理则不尽相同,心肌梗死随着时间进展,梗死区域心肌细胞密度显著降低,胶原纤维含量大幅增加,细胞外基质扩大。已经有研究表明陈旧性心肌梗死是由于重构的微血管侧支循环和残存扩张的血管允许造影剂的转运,疤痕心肌内微血管通透性增加允许细胞外造影剂如钆喷酸葡胺渗透至细胞外间隙。另外进展的瘢痕组织中增加的细胞外基质扩大了细胞外间隙也是造影剂聚集的一个重要因素[15,16]。所以DEMRI可以明确的显示心肌梗死或纤维化的心肌瘢痕,可以直观的显示其坏死心肌的透壁程度。
研究证实心脏延迟磁共振评价心肌梗死的范围和血运重建术后运动异常心肌的恢复密切相关[17,18]。Fieno等[19]发现DE-MRI可以区分可逆的和非可逆的心肌损伤,并且可以明确其梗死的时间,是否有再灌注的血流,梗死的范围等情况。同样DE-MRI在急性的心肌细胞缺血时可以区分心肌细胞坏死和心肌细胞水肿[20],相比于其他的传统检查方法,它有着许多潜在的优势。
本研究证实DE-MRI在评价陈旧性心肌梗死存活性方面明显优于静息及负荷斑点追踪超声,且较正电子发射断层显像价格低廉,重复性好,对患者无辐射。如患者心功能可耐受,对于陈旧性心肌梗死存活心肌的判断,急性心肌梗死水肿带范围及微血管阻塞程度判定,对PCI效果及预后有重要指导意义。本试验主要研究对象为陈旧性心肌梗死患者,因为大部分急性心肌梗死患者尤其是前壁心肌梗死患者急性期大多存在严重心功能不全,患者不能耐受核磁共振完整过程检查。目前市场现有的冠状动脉药物涂层支架为第二代、第三代药物支架,因其含铁量小,尤其是第三代药物涂层支架,在3.0T以下场强进行磁共振扫描证实是安全的。DE-MRI应用对于非急诊PCI术心肌梗死患者及其他类型冠心病患者治疗方案的选择、危险程度及预后评估有重要的临床意义,在临床可广泛推广。
[1] Mahrholdt H, Wagner A, Holly TA, et al. Reproducibility of chronic infarct size measurement by contrast-enhanced magnetic resonance imaging. Circulation, 2002, 106: 2322-2327.
[2] 杨滔, 陆敏杰, 孙寒松, 等. 延迟增强磁共振显像对冠状动脉旁路移植术后心功能改善的预测价值. 中国循环杂志, 2014, 29: 115-119.
[3] Rose SD, Kaandorp TA, Marsan NA, et al. Agreement and disagreement between contrast-enhanced magnetic resonance imaging and nuclear imaging for assessment of myocardial viability. Eur J Nucl Mol Imaging, 2009, 36: 594-601.
[4] Gerber BL, Rousseau MF, Ahn SA, et al. Prognostic value of myocardial viability by delayed-enhanced magnetic resonance in patients with coronary artery disease and low ejection fraction: impact of revascularization therapy. J Am Coll Cardiol, 2012, 59: 825-835.
[5] Kuhl HP, Lipke CS, Krombach GA, et al. Assessment of reversible myocardial dysfunction in chronic ischaemic heart disease: comparison of contrast-enhanced cardiovascular magnetic resonance and a combined positron emission tomography-single photon emission computed tomography imaging protocol. Eur Heart J, 2006, 27: 846-853.
[6] Wu YW, Tadamura E, Yamamuro M, et al. Comparision of contrastenhanced MRI with (18)F-FDG PET/201Tl SPECT in dysfunctional myocardium: relation to early functional outcome after surgical revascularization in chronic ischemic heart disease. J Nucl Med, 2007,48: 1096-1103.
[7] 杨跃进, 杨伟宪, 史蓉芳, 等. 药物负荷超声心动图与双核素心肌显像对比检测存活心肌. 中华心血管病杂志, 2005, 33: 323-327.
[8] Bansal M, Jeffriess L, Leano R, et al. Assessment of myocardial viability at dobutamine echocardiography by deformation analysis using tissue velocity and speckle-tracking. J Am Coll Cardiol, 2010, 2:121-131.
[9] Braunwald E, Kloner RA. The stunned myocardium: prolonged,postischemic ventricular dysfunction. Circulation, 1982, 66: 1146-1149.
[10] Anderson JL, Marshall HW, Bray BE, et al. A randomized trial of intracoronary streptokinase in the treatment of acute myocardialinfarction. N Engl J Med, 1983, 308: 1312-1318.
[11] 杨伟宪, 杨跃进, 史蓉芳, 等. 小剂量多巴酚丁胺、异舒吉单用及合用的超声心动图试验检测冠心病左心室收缩功能严重减低患者的存活心肌. 中国循环杂志, 2004, 19: 29-33.
[12] Jimenez Juan L, Crean AM, Wintersperger BJ. Late gadolinium enhancement imaging in assessment of myocardial viability: techniques and clinical applications. Radiol Clin North Am, 2015, 53: 397-411.
[13] Gerber BL, Rousseau MF, Ahn SA, et al. Prognostic value of myocardial viability by delayed-enhanced magnetic resonance in patients with coronary artery disease and low ejection fraction: impact of revascularization therapy. J Am Coll Cardiol, 2012, 59: 825-835.
[14] Arai AE. The cardiac magnetic resonance (CMR) approach to assessing myocardial viability. J Nucl Cardiol, 2011, 18: 1095-1102.
[15] Wang J, Xiang B, Lin HY, et al. Pathological mechanism for delayed hyperenhancement of chronic scarred myocardium in contrast agent enhanced magnetic resonance imaging. PLoS One, 2014 9: e96463.
[16] Smulders MW, Bekkers SC, Kim HW, et al. Performance of CMR methods for differentiating acute from chronic MI. JACC Cardiovasc Imaging, 2015, 8: 669-679.
[17] Schvartzman PR, Srichai MB, Grimm RA, et al. Nonstress delayedenhancement magnetic resonance imaging of the myocardium predicts improvement of function after revascularization for chronic ischemic heart disease with left ventricular dysfunction. Am Heart J, 2003, 146:535-541.
[18] Kelle S, Roes SD, Klein C, et al. Prognostic value of myocardial infarct size and contractile reserve using magnetic resonance imaging. J Am Coll Cardiol, 2009, 54: 1770-1777.
[19] Fieno DS, Kim RJ, Chen EL, et al. Contrast-enhanced magnetic resonance imaging of myocardium at risk: distinction between reversible and irreversible injury throughout infarct healing. J Am Coll Cardiol, 2000, 36: 1985-1991.
[20] Park CH, Choi EY, Yoon YW, et al. Quantitative T2 mapping after reperfusion therapy in patients with acute myocardial infarction: a comparison with late gadolinium enhancement and cine MR imaging.Magn Reson Imaging, 2015, 33: 1246-1252.
2017-04-25)
(编辑:汪碧蓉)
Assessment of Myocardial Viability by Low-dose Dobutamine Stress Speckle Tracking Echocardiography and Delayed Enhancement MRI in Patients With Old Myocardial Infarction
CHEN Jun-hong, LI Dong-ye, HAN Shu-guang, XU Tong-da, WANG Chao-fan, WANG Xiao-ying.
Department of Cardiology, Aff i liated Hospital of Xuzhou Medical University, Xuzhou (221000), Jiangsu, China
LI Dong-ye, Email: Dongyeli@medmail.com.cn
Objective: To compare the sensitivity and specificity between low dose dobutamine stress speckling tracking echocardiography (LDDS-STE) and delayed enhancement MRI (DE-MRI) for assessing viable myocardium (VM) in patients with old myocardial infarction (OMI).
Methods: A total of 30 in-hospitalized OMI patients were enrolled, all patients received cardiac MRI and LDDSSTE prior percutaneous coronary intervention (PCI). Radial peak systolic strain (RS) and strain rate (RSr) were analyzed by LDDS-STE at both resting and loading conditions, echocardiography was performed at 1, 3 and 6 months after PCI to observe the cardiac wall motion changes and the improvement of wall motion score was taken as golden standard of VM.
Results: 510 left ventricular segments were obtained for analysis in 30 patients and echocardiography indicated 201 segments with abnormal wall motion. Compared with golden standard, the area under ROC curve of RSrestfor detecting VM was 0.636 with the sensitivity at 60.0% , specif i city at 60.5% and the area under ROC curve of RSLDDSfor detecting VM was 0.806 with the sensitivity at 79.1%, specif i city at 82.7%; the area under ROC curve of RSrrestfor detecting VM was 0.646 with the sensitivity at 60.0% , specif i city at 60.5% and the area under ROC curve of RSrLDDSfor detecting VM was 0.808 with the sensitivity at 80.0%, specif i city at 83.7% which were obviously improved than RSrrest. By DE-MRI, the area under ROC curve for detecting VM was 0.901 with the sensitivity at 90.8%, specif i city at 87.1% and accuracy at 89.5%.
Conclusion: Both DE-MRI and LDDS-STE can recognize VM in OMI patients; while DE-MRI had the better accuracy and repeatability, cost less time which may provide important basis for predicting the eff i cacy of PCI and for making the treatment strategy.
Myocardial infarction; Magnetic resonance imaging; Echocardiography; Viable myocardium
221000 江苏省徐州市,徐州医科大学附属医院 心内科(陈军红、徐通达、王超凡、王晓瑛),心血管病研究所(李东野),放射科(韩曙光)
陈军红 副教授 博士 研究方向为无创心功能评价 Email:cjh1029@sina.com 通讯作者:李东野 Email:Dongyeli@medmail.com.cn
R541
A
1000-3614(2017)11-1066-05
10.3969/j.issn.1000-3614.2017.11.006
(Chinese Circulation Journal, 2017,32:1066.)

