合成生物催化中关键科学问题的研究进展
张松平,苏志国,姬晓元,2
1.中国科学院过程工程研究所,生化工程国家重点实验室,北京 100190 2.中国科学院大学,北京 100049
合成生物催化中关键科学问题的研究进展
张松平1,苏志国1,姬晓元1,2
1.中国科学院过程工程研究所,生化工程国家重点实验室,北京 100190 2.中国科学院大学,北京 100049
合成生物催化以多酶催化为特征,通过灵活选择不同功能的酶和反应路线设计,可以实现复杂生物基化学品的合成,在反应效率、原子经济性和环境友好方面有着不可替代性。但是其还存在两个关键科学问题:①氧化还原酶催化过程中辅酶的循环再生和重复利用;②酶在非水相和油水两相反应体系中如何实现稳定。以CO2合成生物甲醇和天然油脂制备生物聚氨酯材料这两个具有代表性的多酶催化过程为例,介绍了合成生物催化关键科学问题的研究进展。其中,新型纳米材料与生物技术相结合在解决催化体系中辅酶再生、多酶协同以及酶的界面稳定方面有着广阔的发展前景。
合成生物催化;辅酶再生;油-水界面催化;CO2转化;生物基聚氨酯
工业生物催化是全球生物经济发展的核心任务之一。近十年来,构建和应用多酶催化系统成为生物催化发展的主要趋势。将具有不同催化功能的生物酶组合在一起,通过灵活设计反应路线,可以在生物体外实现传统微生物发酵过程难以完成的复杂生物合成过程,并具有更高的原子经济性和环境友好性。如美国弗吉尼亚大学的研究团队曾构建了由13种酶和辅酶级联反应催化木糖产氢的路线,产氢率可以达到微生物产氢理论值的近3倍[1]。因此,以多酶催化为特征的合成生物催化过程,最初只是作为合成生物学的概念之一,到现在正迅速向实际应用推进,已经拓展至生物基化学品、材料、燃料等更加复杂的生物合成领域。
合成生物催化为生物催化技术带来新的发展机遇的同时,也为其应用带来更大的挑战。2012年,Bornscheuer等[2]展望了生物催化工程面临的挑战,并指出,将复杂的多酶体系在纳米器件上进行集成组装是生物催化工程未来发展的希望;然而,将多酶体系在非生物基质和纳米材料上进行集成,目前仍然效率低下。这主要是因为与单一酶催化过程相比,多酶催化体系和催化过程更加复杂。如在上述的木糖产氢的多酶体系中,辅酶的经济性循环再生和重复利用还没有实现。此外,酶来自水相,而许多的酶催化过程会涉及有机相催化、油水两相界面催化,甚至气液多相催化。酶在上述非天然环境下的活性和稳定性也是一个挑战。固定化酶是工业生物催化剂的主要形态。随着纳米材料科学的发展,通过将生物酶的高催化活性和纳米材料丰富的结构与功能结合为一体,创造纳米尺度的新的固定化酶和多酶系统,探索纳米材料结构和组成对多酶催化(包括辅酶再生)、非水相催化等复杂催化过程中的微观调控机理和作用规律,正在不断实现上述技术的突破[3-6]。本文将结合CO2经过多步酶催化生成甲醇,以及天然油脂经脂肪酶催化制备生物聚氨酯材料这两个具有代表性的生物基化学品制造过程,介绍合成生物催化的一些近期进展。前者是包括辅酶再生的多酶催化研究领域最具代表性的反应体系之一,而后者则涉及酶的油水界面稳定的难题。重点介绍新型纳米材料与生物技术相结合,在解决上述合成生物催化体系中辅酶再生和多酶协同,以及酶的界面稳定等问题中的创新应用。
1 CO2多酶催化合成甲醇的过程中辅酶再生的问题
1.1 CO2的多酶催化转化系统
CO2是主要的温室气体,也是自然界最重要和最丰富的碳源。CO2过量排放带来的环境问题受到国际社会的日益关注,将CO2转化为燃料或化学品,无疑是解决CO2排放和能源危机“一石二鸟”的策略。已有多篇综述报道了利用化学催化[7]、电催化[8]以及酶催化[9-10]来实现CO2的捕集并转化为甲酸、CO、甲烷以及甲醇等高附加值化学品。其中通过甲酸脱氢酶(FateDH)、甲醛脱氢酶(FaldDH)、醇脱氢酶(ADH)催化的级联反应,将CO2逐级还原为甲醇,具有环保节能、产物热值高的突出优势[9]。
由图1所示的反应式可知,每合成1mol甲醇,需要消耗3mol昂贵的辅酶NADH作为共同底物。因此无论是从反应热力学,还是提高过程的经济可行性方面,对辅酶进行有效的循环再生和重复使用都是至关重要的。
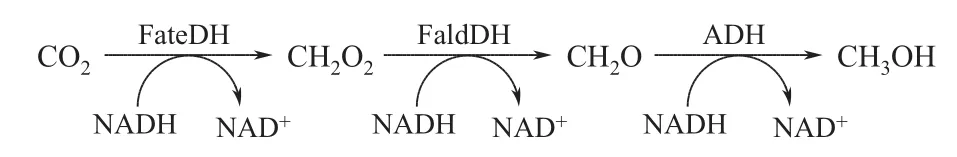
图1 FateDH、FaldDH和ADH级联反应催化CO2合成甲醇
1.2 通过多酶偶联实现辅酶再生的催化系统
自1999年Obert和Dave首次报道通过图1所示的级联反应路线成功实现CO2合成甲醇以来[11],人们针对这一反应体系进行了大量的研究,通过纳米颗粒表面固定化[12]、微囊包埋[13-15]等多种方法实现了酶的重复使用,并使反应效率得到一定程度的提高。如Wang等[15]基于生物矿化和生物黏合的方法,构建超薄杂化微囊共包埋多酶体系,使甲醇的得率由游离酶体系的35.5%提高到71.6%,并实现了3种酶的重复使用。但是过程的效率、产率,尤其是辅酶再生和循环使用的难题一直未能很好解决。其主要难点在于辅酶是一种小分子化合物,作为氧化还原酶催化过程中的电子传递载体,必须有效地结合到酶的活性中心才能发挥作用。通常用于酶固定化的物理包埋方法和材料,难以有效截留辅酶;而化学共价固定化,则会导致辅酶无法与氧化还原酶有效结合,使辅酶活性降低甚至完全失去活性[16]。如El-Zahab等[12]将CO2多酶催化合成甲醇这一反应体系与谷氨酸脱氢酶(GDH)相偶联用于NADH再生,并尝试将多酶与辅酶分别共价固定化在纳米颗粒的表面,实现了NADH再生与重复使用。虽然这种纳米颗粒多酶体系循环7次后产率仍能维持初始产率的80%,但是单次甲醇的得率却仅有5%左右。正是由于上述难点,近10年来Nature上发表的2篇关于酶催化的综述文章中,均将辅酶的重复利用和再生视为酶工程应用最大难题[2,17]。
为了解决这一难题,笔者研究团队发明了一种同轴共纺静电纺丝技术[18],可以直接制备出中空纳米纤维,制备过程如图2所示。由于其具有直径约300~500nm的空腔,可以将酶直接装载在空腔内部,装载率100%,纳米空腔促进酶和辅酶之间协同作用;多孔(3nm)纤维壁可以截留空腔内的酶分子,确保原料和产物小分子自由通过纤维壁,扩散阻力小,因此与其他的纳米材料相比,用于固定化酶,尤其是多酶体系具有明显优势[20]。
在设计和制备上述新型中空纳米纤维材料的基础上,为了进一步解决辅酶在中空纳米纤维腔室内截留的问题,结合分子组装的原理,笔者研究团队提出了一种通过线性聚合电解质拴绑辅酶的创新策略,在制备中空纳米纤维的过程中,加入带有正电荷的聚合电解质PAH,通过PAH与带有负电荷的辅酶之间的电荷相互作用,将辅酶像放风筝一样拴绑在纤维内壁上,避免了以往催化过程中辅酶的流失。同时,穿插到中空纳米纤维外表面的PAH还可以将碳酸酐酶定位组装在纤维外表面,促进CO2的水合作用。组装于纤维骨架和腔室中的多酶和辅酶偶联系统,实现了CO2转化为甲醇,同时腔室中的辅酶利用谷氨酸脱氢酶偶联反应,从氧化态恢复到还原态,实现了辅酶的原位再生以及多酶的重复使用。结果发现,利用中空纳米纤维材料强化了5种酶和辅酶之间的协同作用,在解决了辅酶再生和重复使用的难题的同时,其催化CO2合成甲醇基于辅酶的得率达到103%,比游离多酶体系提高了近3倍[19]。
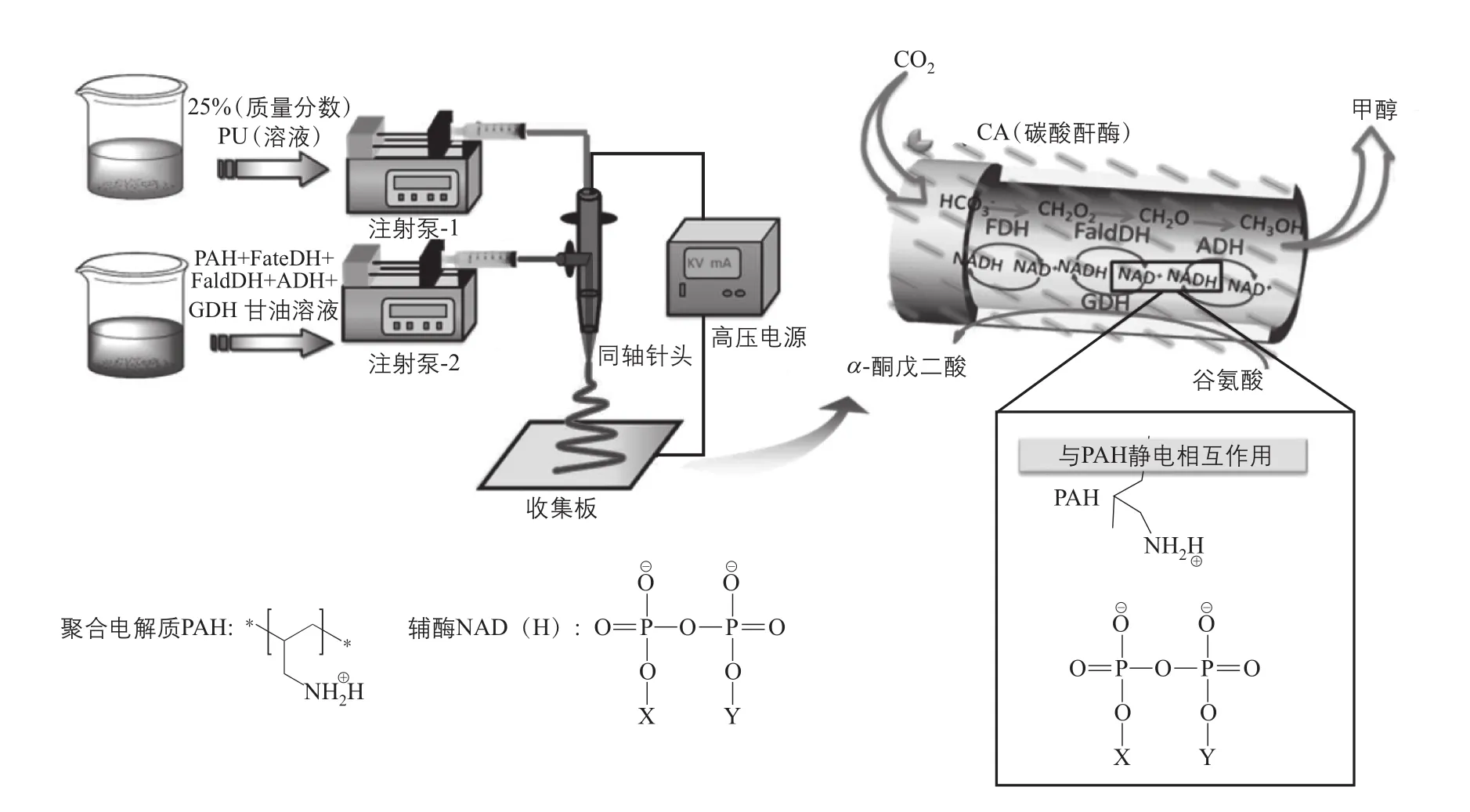
图2 利用中空纳米纤维强化包括辅酶再生的多酶催化系统,用于CO2合成甲醇[19]
1.3 通过光-酶偶联实现辅酶再生的催化系统
上述研究最大的突破是实现了辅酶的固定化和重复使用,而且通过线性聚合电解质实现并促进了辅酶与多种氧化还原酶之间的高效协同。但是辅酶NADH的循环再生,仍然是通过偶联另外一种以氧化型辅酶NAD+为底物的氧化还原酶来实现。与这一常用的通过多酶偶联反应进行辅酶再生方法相比,光化学辅酶再生不需要引入额外的酶以及相应的底物和产物,减少目标产物分离纯化的负担,因此更具经济性和优势[21-22]。特别是随着各种新型可吸收太阳能激发电子的光敏剂以及传递电子的电子媒介的成功合成,人们已经可以在可见光条件下,进行辅酶的光化学再生[23],通过与CO2还原的多酶催化反应相耦合,也成功实现了以太阳能驱动的甲醇的合成[24]。天津大学姜忠义团队的综述文章中,对酶-光耦合催化系统转化CO2的研究进展进行了详细的总结[25]。石墨烯[26]、C3N4[27-28]等一批具有优异光电性能的新型纳米材料,实现了辅酶的高效光催化再生。Huang等[28]受自然界光合作用体系中叶绿体类囊体结构启发,制备了一种高比表面积和光捕获性能优异的g-C3N4介孔微球进行NADH的光催化再生。在电子媒介[Cp*Rh(bpy)H2O]2+协助下,NADH再生率在反应30min后达到100%,即使在无电子媒介协助条件下,NADH在30min内的再生效率也能够达到50%。
在目前的研究中,大都是简单地将光敏剂、电子媒介、辅酶以及氧化还原酶体系按照一定的配比分散到反应溶液中。在这样的体系中,激发电子的随机传递和转移将显著影响太阳能的利用效率,甚至发生光电子的逆向传递,导致能量的损失[22,29];另外分散的光敏剂、电子媒介以及氧化还原酶、辅酶分子稳定性较差,价格昂贵且不能重复利用。如何将光催化-酶催化进行集成,构建有效的光-酶催化界面,更好地促进电子在两个过程间的有效传递,是一个难点。
笔者研究团队在上述聚合电解质掺杂的中空纳米纤维固定化含辅酶再生的催化CO2转化甲醇的多酶体系的基础上,借鉴自然界绿色植物叶绿体的结构,以掺杂有聚合电解质的中空纳米纤维为载体材料,将用于催化CO2还原合成甲醇的3种脱氢酶和辅酶NAD(H)原位包埋在材料的中空腔室内;结合层层自组装的技术原理,即通过分子组装依次将电子媒介和光敏剂分子通过与材料外壁上聚合电解质之间的静电力,精确地层层自组装到材料的外表面,由此实现了整个光化学辅酶再生与多酶级联反应体系高度集成,构建出一种自给式人工光合作用系统(图3),反应过程中,只需通入CO2和可见光光照,就可以利用太阳能实现辅酶的再生与甲醇的酶催化合成。这种仿生设计的人工光合作用系统,由于电子可以在光催化-酶催化过程中更直接的传递,缩短了电子传递距离,提高了电子传递效率,在可见光条件下,人工光合作用系统成功在CO2转化甲醇过程中实现了辅酶NADH的再生,效率达到84%,并且甲醇得率达到90%[30]。仿生构建的人工光合作用系统,不仅催化效率高,而且使其对光敏剂、电子媒介、酶以及辅酶分子的回收和重复利用成为可能,大大降低了反应成本,有望发展成为带有人工光合作用特征的新一代多酶级联催化合成生物基化学品的平台技术。
2 天然油脂制备生物基聚氨酯过程中的酶的油水界面稳定问题
油脂是和糖类、蛋白质同样重要的生物质资源之一,由于其强疏水性难以通过发酵法进行生物转化,同时其分子结构中可转化利用的功能基团较少,目前对于油脂资源的加工和利用还相对单一,主要集中于油脂的水解,以及通过酯化反应制备生物柴油。近年来,研究人员通过化学-酶催化相结合,首先将油脂分子中的双键在脂肪酶的催化作用下,被H2O2氧化为活泼的环氧基团,通过不同的化学试剂进行开环制备多元醇,并经进一步的交联聚合,制备出了一系列不同结构和功能的聚氨酯材料,被认为是新型生物基材料领域的重要进展[31-32]。油脂的酶催化环氧化反应不仅涉及油水两相界面反应,而且反应底物H2O2会引起脂肪酶的迅速变性失活,因此成为天然油脂合成聚氨酯过程中最大的挑战。疏水性高分子材料[33]、疏水性纳米碳管[34]均被尝试用于对酶分子进行修饰,使其能够自组装于油水两相界面,酶的界面稳定性和活性得到提高,但是酶的回收和重复使用仍然困难。
笔者研究团队近期发现,通过调控纳米纤维膜的表面亲疏水性,可以使其自发地分布到油水两相界面[35]。利用这一特性,他们设计了基于中空纳米纤维的高效界面活性的多酶催化体系,研制出了可以在油水界面自发分布的中空纳米纤维膜,并将酶原位地组装在纳米纤维中,实现油水界面多相催化过程的强化。将葡萄糖氧化酶(GOD)和脂肪酶(CALB)定位组装到中空纳米纤维,通过级联反应在油水两相界面催化油酸环氧化反应(图4)。一方面,纳米纤维膜的界面靶向性降低了传质阻力,提高了酶的稳定性;另一方面,GOD原位生成H2O2,避免了脂肪酶同高浓度的H2O2直接接触造成的迅速失活。与游离双酶体系相比,催化效率提高了115倍,而且重复使用10次,活性仍然保持90%以上[36]。
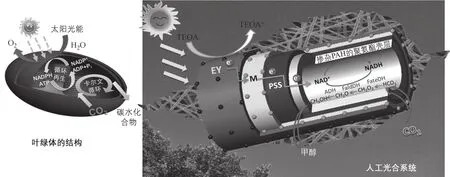
图3 用于CO2合成甲醇的高效多酶催化人工光合作用系统[30]
以植物油为原料,利用上述高活性、高稳定性纳米纤维界面双酶催化反应过程制备出的环氧油脂进一步通过水解反应,生成生物基多元醇,是合成生物聚氨酯的关键单体。通过对产品结构和合成路线进行创新设计,利用化学-酶催化法制备出了一系列新型生物基多元醇和生物聚氨酯材料[37]。这些材料不仅可以作为现有石油基聚氨酯材料的替代,而且还表现出一些新的特殊性能,如优异的生物相容性[38]、独特的形状记忆性能[39]等,进一步拓展了生物酶催化技术的应用领域,为新型生物材料的开发和应用以及生物油脂类可再生资源的开发和利用提供新的研究思路。
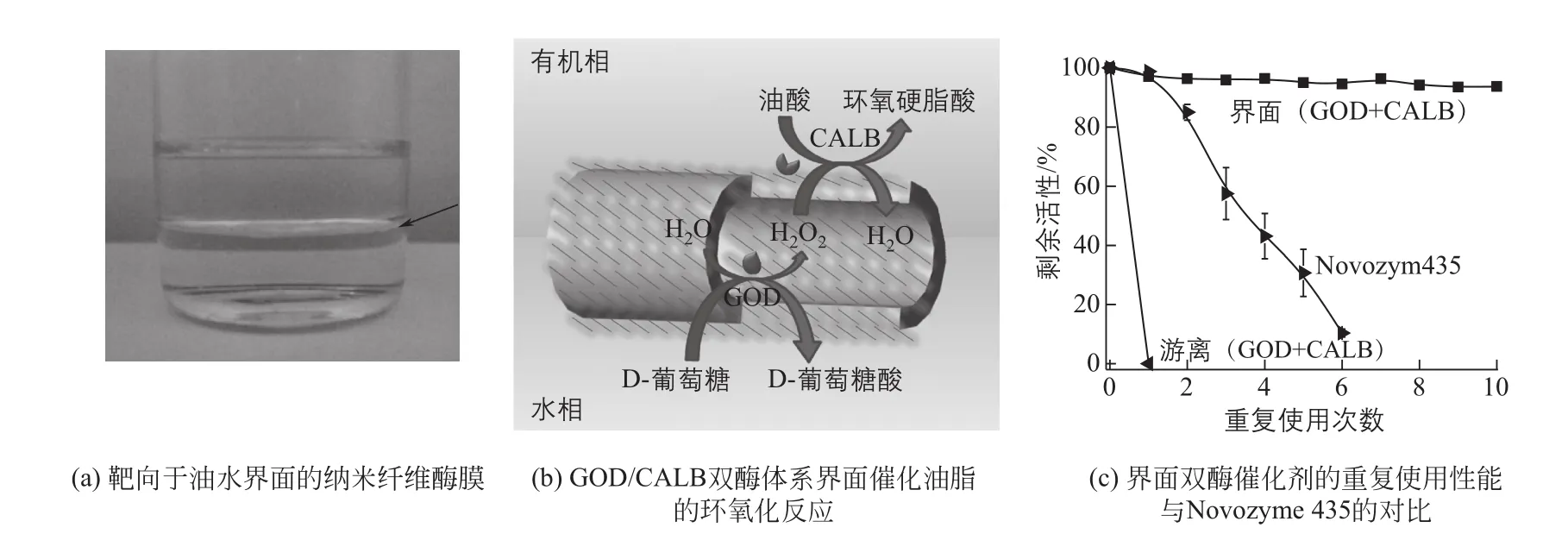
图4 基于中空纳米纤维的油水两相界面多酶催化体系[36]
3 纳米技术与生物技术的结合——展望
如上所述,以多酶催化为特征的合成生物催化技术,为复杂的生物基化学品合成带来新的机遇,尤其是纳米科学与生物技术的结合,为解决合成生物催化技术的工业化应用中面临的辅酶循环再生和重复使用、酶的油水界面活化与稳定等挑战开辟了新的思路。从最初的纳米颗粒,到微米催化剂中纳米孔道,再到中空纳米纤维材料,都反映了纳米技术与生物技术结合带来的变化。德国马普协会Ferdi Schüth教授认为多酶系统在中空纳米纤维中的定位组装是可以拓展应用于装载不同多酶系统的一种具有普适性的催化剂制备技术[40]。除了组装多种酶,通过在中空纳米纤维膜管的纳米空腔中、管壁的内外表面,空间定位组装或掺杂其他无机催化剂、染料、功能物质,已经可以制备出无机纳米催化剂-酶复合催化剂、多酶纳米纤维试纸等,在分析检测[19,41]和环境保护[42]等更多的领域实现了应用。
可以期待,随着各种新型纳米材料与生物催化技术的结合,必将会为生物催化技术的应用和发展带来更大的突破,并成为第四次浪潮。如生物催化人工光合作用系统涉及能量(光能和电子)、物质(生物分子、化学物质)以及材料之间的多个传递界面和过程。近期,一些具有更好的电子传递和可见光吸收性能的纳米材料正在引起人们的关注。如过渡金属硫化物TaS2纳米片已经被成功用于光催化辅酶再生,并偶联多酶体系实现了CO2到甲醇的高效转化[43]。
尽管合成生物催化技术,已经在可行性、稳定性和效率等方面解决了传统发酵工业和单一酶催化技术所面临的不足和限制,并已经取得突破性进展。但是也应该认识到,向产业化的推进,还有待从工程科学的角度,进一步论证体系的经济性,才能实现其在生物基化学品的制造和其他领域的应用取得更大的突破,支撑和推动我国和全球生物经济的发展。
[1] MARTIN DEL CAMPO J S,ROLLIN J,MYUNG S,et al. High-yield production of dihydrogen from xylose by using a synthetic enzyme cascade in a cell-free system[J]. Angew Chem Int Ed Engl,2013,52(17):4587-4590.
[2] BORNSCHEUER U T,HUISMAN G W,KAZLAUSKAS R J,et al.Engineering the third wave of biocatalysis[J]. Nature,2012,485(7397):185-194.
[3] KIM J,GRATE J W,W ANG P. Nanobiocatalysis and its potential applications [J]. Trends Biotechnol,2008,26(11):639-646.
[4] GE J,LEI J,ZARE R N. Protein-inorganic hybrid nanoflowers [J].Nat Nanotechnol,2012,7(7):428-432.
[5] FU J,YANG Y,JOHNSON B A,et al. Multi-enzyme complexes on DNA scaffolds capable of substrate channeling with an artificial swinging arm [J]. Nat Nanotechnol,2014,9(7):531-536.
[6] ZHANG Y,GE J,LIU Z. Enhanced activity of immobilized or chemically modi fi ed en zymes[J]. ACS Catal,2015,5(8):4503-4513.
[7] GANESH I. Electrochemical conversion of carbon dioxide into renewable fuel chemicals - The role of nanomaterials and the commercialization [J]. Renew Sust Energ Rev,2016,59:1269-1297.
[8] LIU X,INAGAKI S,GONG J L. Heterogeneous molecular systems for photocatalytic CO2reduction with water oxidation[J]. Angew Chem Int Ed,2016,55(48):2-29.
[9] SHI J,JIANG Y,JIANG Z,et al. Enzymatic conversion of carbon dioxide[J]. Chem Soc Rev,2015,44(17):5981-6000.
[10] SULTANA S,SAHOO P C,MARTHA S,et al. A review of harvesting clean fuels from enzymatic CO2reduction[J]. RSC Adv,2016,6(50):44170-44194.
[11] OBERT R,DAVE B C. Enzymatic conversion of carbon dioxide to methanol:enhanced methanol production in silica sol-gel matrices[J].J. Am. Chem Soc,1999,121(51):12192-12193.
[12] EL-ZAHAB B,DONNELLY D,WANG P. Particle-tethered NADH for production of methanol from CO2catalyzed by coimmobilized enzymes [J]. Biotechnol Bioeng,2008,99(3):508-514.
[13] JIANG Y,SUN Q,ZHANG L,et al. Capsules-in-bead scaffold:a rational architecture for spatially separated multienzyme cascade system[J]. J Mater Chem,2009,19(47):9068-9074.
[14] SHI J,ZHANG L,JIANG Z. Facile construction of multicompartment multienzyme system through layer-by-layer self-assembly and biomimetic mineralization[J]. ACS Appli Mater Interfaces,2011,3(3):881-889.
[15] WANG X,LI Z,SHI J,et al. Bioinspired approach to multienzyme cascade system construction for ef fi cient carbon dioxide reduction[J].ACS Catal,2014,4(3):962-972.
[16] LIU W,WANG P. Cofactor regeneration for sustainable enzymatic biosynthesis[J]. Biotechnol Advances,2007,25(4):369-384.
[17] SCHMID A,DORDICK J S,HAUER B,et al. Industrial biocatalysis today and tomorrow [J]. Nature,2001,409(6817):258-268.
[18] 张松平,姬晓元,苏志国,等. 一种中空聚合物纳米纤维的制备方法:201210217561.8[P]. 2014-04-02.
[19] JI X,SU Z,WANG P,et al. Tethering of nicotinamide adenine dinucleotide inside hollow nanofibers for high-yield synthesis of methanol from carbon dioxide catalyzed by coencapsulated multienzymes[J]. ACS Nano,2015,9(4):4600-4610.
[20] JI X,WANG P,SU Z,et al. Enabling multienzyme biocatalysis using coaxial-electrospun hollow na no fi bers:redesign of arti fi cial cells[J].J Mater Chem B,2014,2(2):181-190.
[21] WU H,TIAN C,SONG X,et al. Methods for the regeneration of nicotinamide coenzymes[J]. Green Chem,2013,15(7):1773-1789.
[22] KIM J H,NAM D H,PARK C B. Nanobiocatalytic assemblies for arti fi cial photosynthesis[J]. Curr Opin Biotechnol,2014,28:1-9.
[23] YADAV R K,BAEG J O,KUMAR A,et al. Graphene-BODIPY as a photocatalyst in the photocatalytic-biocatalytic coupled system for solar fuel production from CO2[J]. J Mater Chem A,2014,2(14):5068-5076.
[24] PARK C B,LEE S H,SUBRAMANIAN E,et al. Solar energy in production of L-glutamate through visible light active photocatalystredox enzyme coupled bioreactor[J]. Chem Commun,2008,42(42):5423-5425.
[25] 伍一洲,石家福,丁菲,等. 酶光耦合催化系统转化CO2研究进展[J].中国科学:化学,2017,47(3):315-329.
[26] YADAV R K,BAEG J O,OH G H,et al. A photocatalyst-enzyme coupled artificial photosynthesis system for solar energy in production of formic acid from CO2[J]. J Am Chem Soc,2012,134(28):11455-11461.
[27] LIU J,ANTONIETTI M. Bio-inspired NADH regeneration by carbon nitride photocatalysis using diatom templates[J]. Energ Environ Sci,2013,6(5):1486-1493.
[28] HUANG J,ANTONIETTI M,LIU J. Bio-inspired carbon nitride mesoporous spheres for artificial photosynthesis:photocatalytic cofactor regeneration for sustainable enzymatic synthesis[J]. J Mater Chem A,2014,2(21):7686-7693.
[29] NAM Y S,MAGYAR A P,LEE D,et al. Biologically templated photocatalytic nanostructures for sustained light-driven water oxidation [J]. Nat Nanotechnol,2010,5(5):340-344.
[30] JI X,SU Z,WANG P,et al. Integration of arti fi cial photosynthesis system for enhanced electronic energy-transfer ef fi cacy:a case study for solar energy driven bioconversion of carbon dioxide to methanol[J]. Small,2016,12(34):4753-4762.
[31] LLIGADAS G,RONDA J C,GALIA M,et al. Plant oils as platform chemicals for polyurethane synthesis:current state-of-the-art [J].Biomacromolecules,2010,11(11):2825-2835.
[32] ZHANG C,MADBOULY S A,KESSLER M R. Biobased polyurethanes prepared from different vegetable oils [J]. ACS Appl Mater Interfaces,2015,7(2):1226-1233.
[33] ZHU G,WANG P. Polymer-enzyme conjugates can selfassemble at oil/water interfaces and effect interfacial biotransformations [J]. J Am Chem Soc,2004,126(36):11132-11133.
[34] ASURI P,KARAJANAGI S S,DORDICK J S,et al. Directed assembly of carbon nanotubes at liquidliquid interfaces:nanoscale conveyors for interfacial biocatalysis[J]. J Am Chem Soc,2006,128(4):1046-1047.
[35] 张羽飞,张松平,李鹏举,等. 一种界面靶向膜和界面靶向纤维的制备方法:201210032999.9[P]. 2013-12-11.
[36] JI X,SU Z,WANG P,et al. Polyelectrolyte doped hollow nano fi bers for positional assembly of bienzyme system for cascade reaction at O/W interface [J]. ACS Catal,2014,4(12):4548-4559.
[37] MIAO S,WANG P,SU Z,et al. Vegetable oil-based polymers as future polymeric biomaterials[J]. Acta Biomaterialia,2014,10(4):1692-1704.
[38] MIAO S,CALLOW N,WANG P,et a l. Soybean oil-based polyurethane networks:shape-memory effects and surface morphologies[J]. J Am Oil Chem Soc,2013,90(9):1415-1421.
[39] MIAO S,WANG P,SU Z,et al. Soybeanoil-based shape-memory polyurethanes:synthesis and characterization [J]. Eur J Lipid Sci Tech,2012,114(12):1345-1351.
[40] PRIETO G,TUYSUZ H,DUYCKEARTS N,et al. Hollow n anoand microstructures as catalysts[J]. Chem Rev,2016,116(22):14056-14119.
[41] JI X,SU Z,WANG P,et al.“Ready-to-use”hollow nanofibers membrane-based glucose testing strips [J]. Analyst,2014,139(24):6467-6473.
[42] JI X,SU Z,XU M,et al. A TiO2-horseradish peroxidase hybrid catal yst based on hollow nano fi bers for simultaneous photochemicalenzymatic degradation of 2,4-dichlorophenol [J]. ACS Sustainable Chem E ng,2016,4(7):3634-3640.
[43] JI X,LIU C,WANG J,et al. Integration of f unctionalized twodimensional TaS2nanosheets and an electron mediator for more ef fi cient biocatalyzed arti fi cial photosynthesis[J]. J Mater Chem A,2017,5(11):5511 -5522.
Progress in key issue research of synthetic biocatalysis
ZHANG Songping1,SU Zhiguo1,JI Xiaoyuan1,2
1. State Key Laboratory of Biochemical Engineering, Institute of Process Engineering, Chinese Academy of Sciences, Beijing 100190, China 2. University of Chinese Academy of Sciences, Beijing 100049, China
Synthetic biocatalysis features multi-enzymatic catalytic processes, enabling complicated biochemical synthesis through genius selection of various enzymes and design of bioreaction routes. Synthetic biocatalysis is unique in term of reaction ef fi ciency, atom economy, and environmental friendliness. However, there are two key scienti fi c issues or problems to be answered: ① co-enzyme regeneration, recycling and reutilization in oxidization-reduction biocatalytic processes; ② stabilization of enzymes in no-aqueous phase or at the oil-water interface. In this paper, two examples are given to re fl ect the progress in solving the aforementioned problems, which are bio-conversion of CO2to methanol, and biosynthesis of natural lipids to bio-based polyurethane, both being multi-enzymatic catalysis systems involving co-enzyme or oil-water interface. In summary, combination of emerging nanotechnology and biotechnology may bring about wide area of the development in synthetic biocatalysis, including coenzyme regeneration, multienzyme synergism, as well as interfacial enzyme stabilization.
synthetic biocatalysis; coenzyme regeneration; oil-water interface; CO2bioconversion; bio-based polyurethane
10.3969/j.issn.1674-0319.2017.06.006

张松平,现任中国科学院过程工程研究所、生化工程国家重点实验室研究员,博士生导师。主要研究方向为纳米酶催化工程,生物技术药物和疫苗分离纯化与修饰。迄今已在ACS Nano,Small,ACS Catalysis等期刊上发表SCI论文70篇,他引近1000次。曾获全国百篇优秀博士论文提名奖(2006年),兼任Biochemical Engineering Journal编委、农业部兽药评审专家、中国颗粒学会青年理事、生物颗粒专业委员会委员。E-mail:spzhang@ipe.ac.cn
国家重点基础研究发展规划(2013CB733604);国家自然科学基金(21676276、91534126、21376249)

