应用糖基化碳量子点研究甘露糖与致病菌之间的相互作用
赵 斌,崔飞云,徐 溢,张晓凤,李泽全
(1.重庆大学 化学化工学院,重庆 400044;2.新型微纳器件与系统技术重点学科实验室,重庆 400044;3.重庆大学 光电工程学院微系统研究中心,重庆 400044;4.微纳系统及新材料技术国际研发中心,重庆 400044;5.重庆理工大学 化学化工学院,重庆 400050)
应用糖基化碳量子点研究甘露糖与致病菌之间的相互作用
赵 斌1,2,4,崔飞云1,2,4,徐 溢2,3,4*,张晓凤2,4,5,李泽全1*
(1.重庆大学 化学化工学院,重庆 400044;2.新型微纳器件与系统技术重点学科实验室,重庆 400044;3.重庆大学 光电工程学院微系统研究中心,重庆 400044;4.微纳系统及新材料技术国际研发中心,重庆 400044;5.重庆理工大学 化学化工学院,重庆 400050)
以柠檬酸为碳源,通过水热法制备得到荧光碳量子点(CQDs),基于其表面的—COOH,将4-氨基苯基-α-D-吡喃甘露糖苷以共价键的方式固定在CQDs表面,得到甘露糖基化碳量子点(Man-CQDs),并通过荧光竞争法,结合Scatchard方程计算了Man-CQDs与大肠杆菌JM109、大肠杆菌DH5a和沙门氏菌S.123443的结合常数Ka。实验得到CQDs的粒径为26 nm,最大发射波长为445 nm,荧光产率相较于54%硫酸奎宁为76%,Man-CQDs荧光强度与CQDs相比基本保持不变,通过苯酚-硫酸法计算得到Man-CQDs浓度为2.832 mmol/L,Man-CQDs纳米颗粒中甘露糖含量约为40%。根据Man-CQDs、D-Mannose与致病菌竞争结合实验,结合 Scatchard模型方程,计算得到Man-CQDs与大肠杆菌JM109的结合常数Ka=2.39×103L/mol,Man-CQDs与沙门氏菌S.123443的结合常数Ka=1.17×105L/mol,Man-CQDs与大肠杆菌DH5a无有效结合。研究结果显示,该方法可用于甘露糖与致病菌非共价结合的结合常数测定,为研究糖与致病菌相互作用提供了参考。
甘露糖基化碳量子点(Man-CQDs);大肠杆菌JM109;大肠杆菌DH5a;沙门氏菌S.123443;结合常数;相互作用;荧光光谱
致病菌对宿主细胞的粘附主要通过致病菌菌毛/鞭毛末端的凝集素与宿主细胞表面聚糖发生选择性识别结合完成,从而导致炎症和痢疾等疾病[1]。在细胞水平上定量研究致病菌与糖的相互作用,以及在分子水平上研究凝集素与糖的相互作用,均能为致病菌粘附机制的研究、致病菌的特异性检测提供新的策略。
目前,凝集素/细菌与糖相互作用的定量研究主要采用等温滴定量热法[2]、亲和毛细管电泳法[3]、石英晶体微天平[4]、表面等离子体共振法[5]和荧光光谱法[6]等。荧光光谱法具有检测灵敏度高、选择性好、所需样品量少以及方法简便等优点,是目前采用较多的测试手段。如Wang等[7]基于荧光竞争性结合实验研究了Man-Au与FITC-ConA的相互作用,FITC-ConA与Man-Au、D-Mannose竞争结合平衡后,根据Cheng-Prusoff方程计算得到Man-Au与ConA的解离常数在nmol级别。Okada等[8]在已修饰荧光染料的胶原蛋白肽的末端接枝甘露糖制备得到MPOG10复合物,采用荧光偏振结合非线性最小二乘法计算得到MPOG10与ConA的解离常数为1.9×10-5mol/L。然而,这些研究仅在分子水平上以凝集素替代致病菌菌毛/鞭毛末端的识别分子,难以真实地反映出致病菌与糖的相互作用,在细胞水平上对致病菌-糖相互作用的研究尚少。
本文以柠檬酸为碳源,采用水热法制备得到荧光产率高、水溶性和生物相容性好的CQDs-COOH,利用羧基和氨基的酰胺化反应将修饰有氨基的甘露糖固定在CQDs表面,制备得到甘露糖基化碳量子点(Man-CQDs)。将Man-CQDs作为甘露糖与致病菌相互作用的荧光探针,以大肠杆菌K12变异型菌种JM109、大肠杆菌DH5a和沙门氏菌S.123443为研究对象,通过加入系列浓度的Man-CQDs,与固定浓度的D-Mannose竞争结合致病菌的结合位点,结合平衡后离心将Man-CQDs/致病菌复合物与残余游离的Man-CQDs和D-Mannose分离,测试上清液的荧光光谱,结合Scatchard模型,计算得到Man-CQDs与大肠杆菌JM109/沙门氏菌S.123443 2种致病菌的结合常数。以期为糖与致病菌的相互作用的定量研究起到指导意义。
1 实验部分
1.1 仪器与试剂
RF-5301荧光光谱仪、UV-2450紫外可见光分光光度计和IRprestige-21傅立叶红外光谱仪(日本岛津公司);JEM-1230透射电子显微镜(日本电子光学研究所)。LB培养基、营养琼脂购自上海生工;柠檬酸、D-Mannose、4-氨基苯基-α-D-吡喃甘露糖苷(A-D-mannopyanoside)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)、奎宁均购自上海阿拉丁生化科技股份有限公司;乙二胺、N-羟基琥珀酰亚胺(NHS)等购自成都科龙化工试剂厂;所用试剂均为分析纯;实验用水为二次蒸馏水;实验在常温常压下进行。
磷酸盐缓冲溶液(PBS):精确称取 0.24 g KH2PO4、1.44 g Na2HPO4、8 g NaCl、0.2 g KCl 溶于去离子水中,用0.1 mol/L的NaOH调至pH 7.4。
大肠杆菌JM109/大肠杆菌DH5a/沙门氏菌S.123443标本:菌种均由第三军医大学检验系提供,在LB培养基中37 ℃培养12~14 h;将原菌液以8 000 r/min离心3 min,去除上清液后重悬于PBS缓冲液中,重复离心2~3次,最后悬浮在PBS缓冲液中。
1.2 实验方法
1.2.1Man-CQDs的制备参考Zhu等[9]的水热法制备高荧光产率CQDs。将0.42 g柠檬酸和536 μL乙二胺溶解于10 mL去离子水中,转移至聚四氟乙烯反应釜(30 mL)中,在200 ℃烘箱中反应5 h。自然冷却至室温后,避光透析(透析袋MW:3 500 Da)去除粒径小的纳米颗粒,得到粒径均匀的CQDs,并置于4 ℃储存。
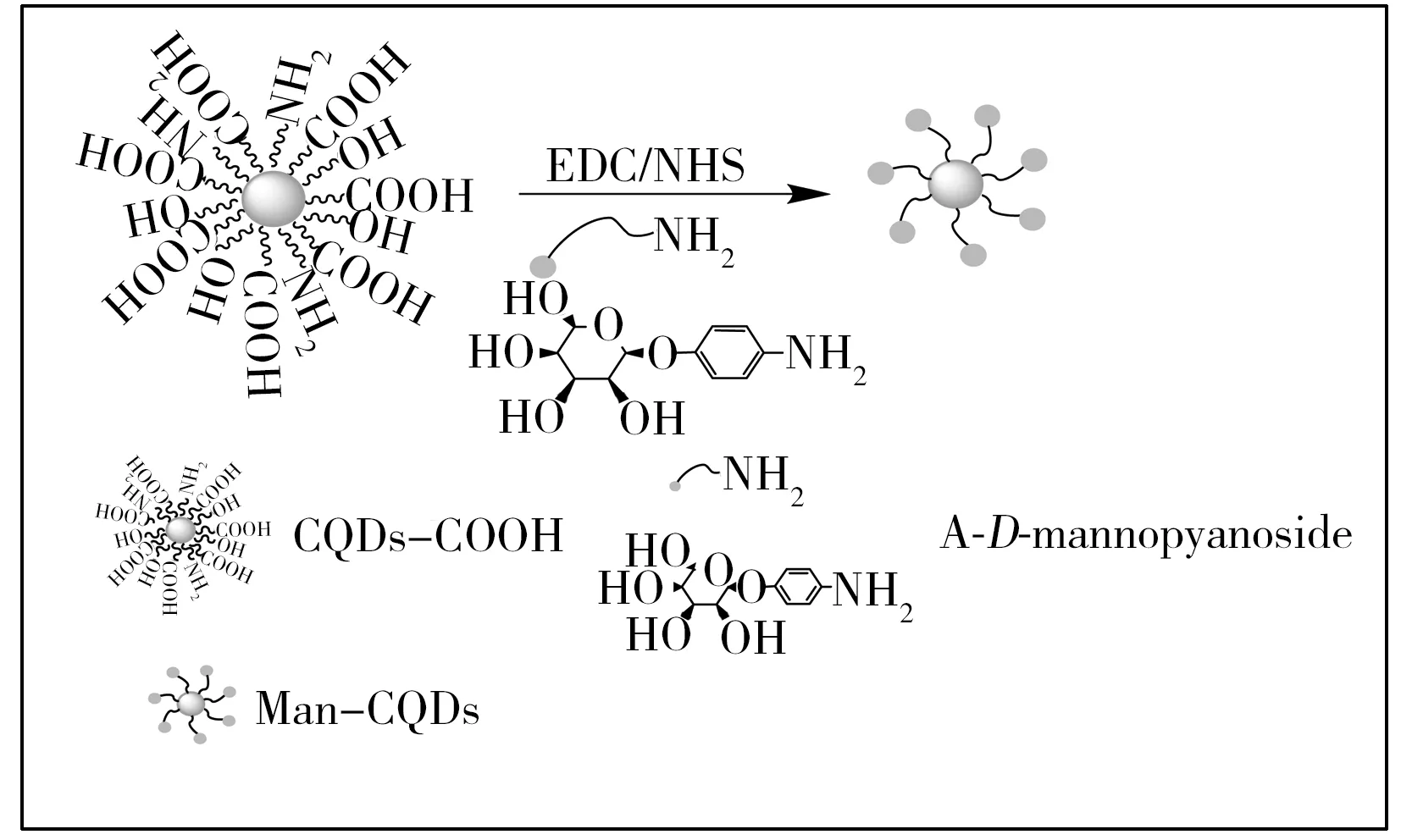
图1 Man-CQDs制备原理图Fig.1 Scheme of the coupling process of Man-CQDs
利用CQDs表面的—COOH,将氨基化的甘露糖通过酰胺键的方式固定在CQDs表面,制备得到Man-CQDs(如图1)。取1 mL稀释浓度[10]为1 mg/mL的CQDs,加入EDC(1 mL,60 mmol/L)和NHS(1 mL,30 mmol/L)于37 ℃活化30 min,随后加入4-氨基苯基-α-D-吡喃甘露糖苷(1 mL,1 mg/mL),振摇120 min,加入Tris-HCl缓冲溶液封闭未反应的活性羧基,4 ℃条件下反应过夜,最后透析(透析袋MW:3 500 Da)去除多余的4-氨基苯基-α-D-吡喃甘露糖苷,制备得到Man-CQDs。
1.2.2Man-CQDs与致病菌的结合实验将108cfu/mL的大肠杆菌JM109、沙门氏菌S.123443和大肠杆菌DH5a分别悬浮在pH 7.4的 PBS缓冲溶液中,加入1 mL 1 mmol/LD-Mannose溶液,随后各自加入系列浓度(0.023 4~0.291 6 mmol/L)的Man-CQDs,用PBS缓冲溶液定容至3 mL,37 ℃孵育60 min,结合平衡后8 000 r/min离心3 min,获得上清液测定其荧光光谱,记录激发波长350 nm时发射波长在445 nm处的荧光强度。
2 结果与讨论
2.1 CQDs及Man-CQDs表征结果
基于CQDs的荧光量子产率高、无毒、制备简单等优点,研究者将生物分子如蛋白[11]、适配体[10]和抗生素[12]等修饰固定在CQDs表面,用于致病菌的相关研究。而将糖分子固定在CQDs表面制备糖基化碳量子点,用于致病菌选择性识别的研究尚少。Huang等[13-14]将柠檬酸与甘露糖混溶后在高温下碳化制备得到Man-CQDs,其荧光量子产率仅为9.8%;随后通过包裹方式,在高温下将甘露糖包裹在制备好的CQDs表面,荧光量子产率有小幅提高。但上述方法制备的Man-CQDs存在以下问题:高温下甘露糖极易被碳化,结构被破坏;荧光量子产率不高,导致检测灵敏度低。实验采用水热法制备得到的CQDs荧光量子产率较高,其表面还结合有丰富的活性官能团,如—OH、—COOH和—NH2等,可与甘露糖的衍生物共价结合,制备得到Man-CQDs,这个过程不会破坏甘露糖结构,同时还可以改善CQDs的生物相容性。图2A显示实验制备得到粒径范围为2~6 nm,分布均匀,无团聚现象,水溶性好的CQDs,其紫外光谱测试结果显示260 nm和350 nm处分别是碳核峰和表面分子的吸收峰[9];CQDs的荧光光谱测试结果显示,激发波长(λex)为350 nm时,CQDs的最大发射波长(λem)为445 nm(图2B)。根据荧光量子产率计算公式(式1)计算其荧光量子产率相较于54%硫酸奎宁约为76%;CQDs的FTIR测试结果(图2C)显示,3 401 cm-1附近为羟基伸缩振动峰,2 926 cm-1附近为氨基伸缩振动峰,1 656 cm-1附近为羧基伸缩振动峰,说明CQDs表面有—COOH、—OH和—NH2等功能基团,其中—COOH基团可与修饰有氨基的甘露糖进一步共价结合制备获得Man-CQDs。
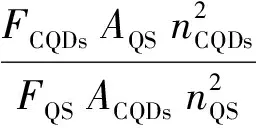
(1)
式中,YCQDs和YQS分别为CQDs与硫酸奎宁的荧光量子产率,FCQDs和FQS分别为CQDs与硫酸奎宁的积分荧光强度,ACQDs和AQS分别为CQDs与硫酸奎宁的吸光度值,nCQDs和nQS表示溶剂的折射率,对于CQDs溶液和硫酸奎宁溶液,两者的折射率均为1.33。

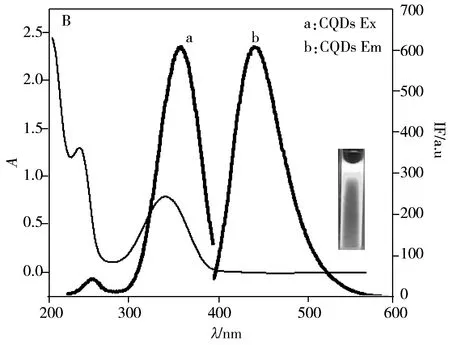
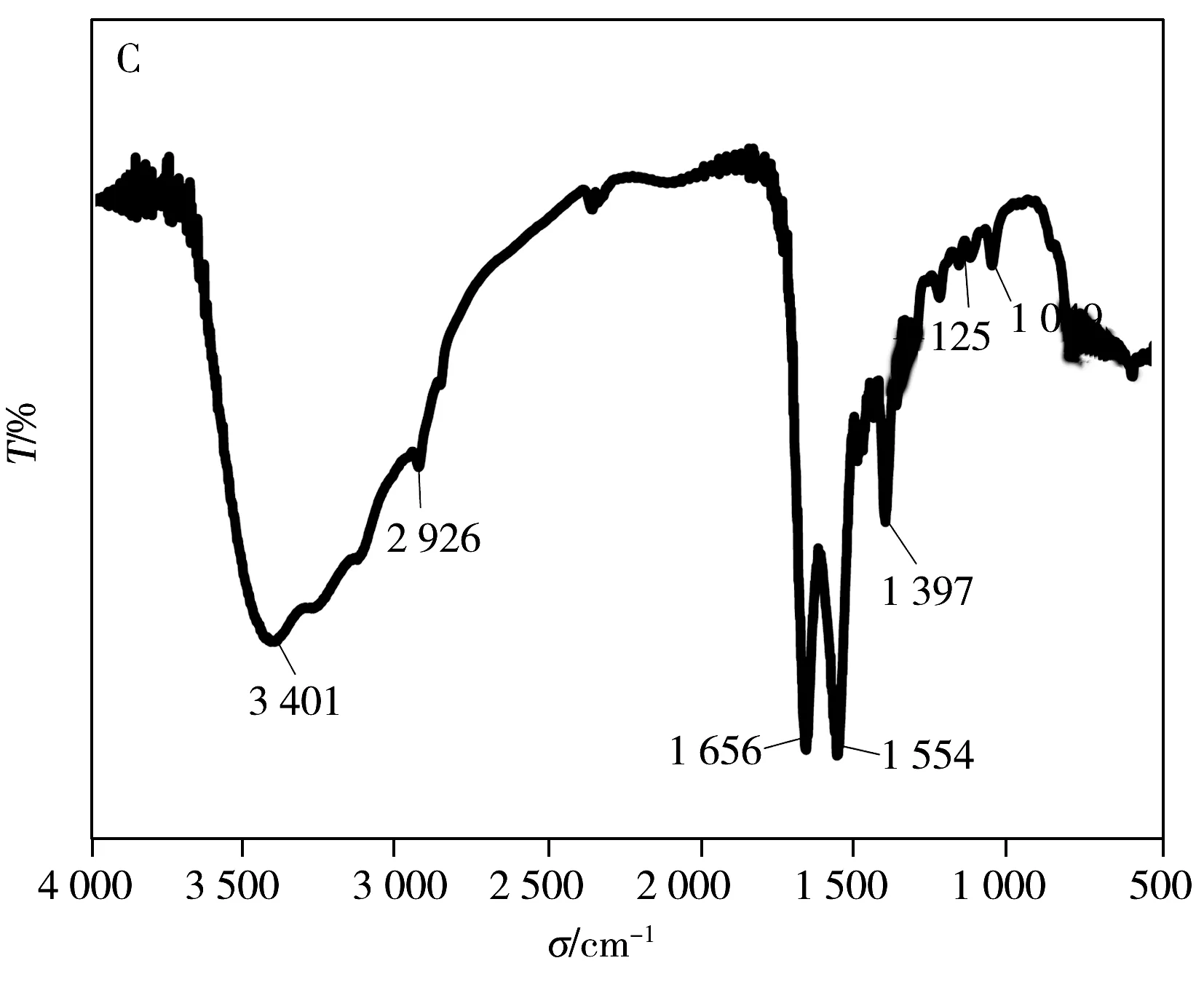
图2 CQDs的透射电镜图(A)、紫外和荧光光谱图(B)以及红外光谱图(C)Fig.2 TEM image(A),UV-Vis spectra and fluorescence spectra(B) and FTIR spectra(C)of CQDs
CQDs表面的—COOH官能团经EDC/NHS活化后,通过酰胺键将4-氨基苯基-α-D-吡喃甘露糖苷共价结合在CQDs表面。Man-CQDs的荧光光谱(图3A)显示最大发射波长仍为445 nm,荧光强度有较小的减弱;Man-CQDs的FTIR测试结果(图3B)显示,3 401~3 110 cm-1附近的羟基伸缩振动峰、2 964 cm-1和1 649 cm-1附近的氨基和羧基伸缩振动峰依然存在,1 649~1 406 cm-1附近的峰有明显变化,显示出苯环结构引入,推测甘露糖已被链接在CQDs表面;Man-CQDs的紫外光谱(图3C)显示除了230 nm和290 nm有CQDs的吸收峰,在288 nm处还有A-D-mannopyanoside的吸收峰,可进一步证实制备得到了Man-CQDs纳米颗粒。
2.2 Man-CQDs制备条件优化
CQDs的表面有多个可与氨基化甘露糖键合的活性羧基,CQDs与A-D-mannopyanoside的不同配比也会影响键合效果。实验设置了4组不同的配比(2∶1、1∶1、1∶5、1∶10),反应结束后,对制备得到的Man-CQDs进行荧光光谱测试。结果显示,当CQDs与A-D-mannopyanoside的配比为1∶1时,Man-CQDs的荧光值最大,故选择此条件为制备Man-CQDs的最优条件。
2.3Man-CQDs溶液中A-D-mannopyanoside含量的测定
Man-CQDs与致病菌的相互作用通过Man-CQDs表面接枝的甘露糖进行,因此,Man-CQDs表面接枝的甘露糖量对Man-CQDs与致病菌的识别和结合效果有很大影响。实验通过用苯酚-硫酸[15]溶液处理系列浓度(0.01~ 4.5 mmol/L)的D-Mannose,测定其在490 nm处的吸光度,得到D-Mannose浓度与吸光度的标准曲线方程为IOA=0.148C-0.051 2,r2=0.961 7。Man-CQDs用相同的方法处理,测得其吸光度为0.368,代入线性方程,即可计算得到Man-CQDs溶液中接枝A-D-mannopyanoside的浓度为2.832 mmol/L,换算后即为0.768 mg/mL,且Man-CQDs的终浓度为1.919 mg/mL。经计算,Man-CQDs纳米颗粒中的甘露糖含量约为40%。
2.4 Man-CQDs与致病菌结合时间的优化
Man-CQDs与致病菌的结合过程中,孵育时间是影响结合效率的关键因素。实验以大肠杆菌JM109为样本,考察了Man-CQDs与致病菌的不同孵育时间(15、30、45、60、90 min)。大肠杆菌JM109与250 μL 1 mg/mL Man-CQDs溶液孵育后,离心去除多余的Man-CQDs,将大肠杆菌JM109用PBS缓冲液重悬,测试标记后致病菌的荧光信号。结果显示,在60 min内荧光强度随时间的增加而增强,60 min后荧光强度基本保持不变。因此,选择结合时间为60 min。
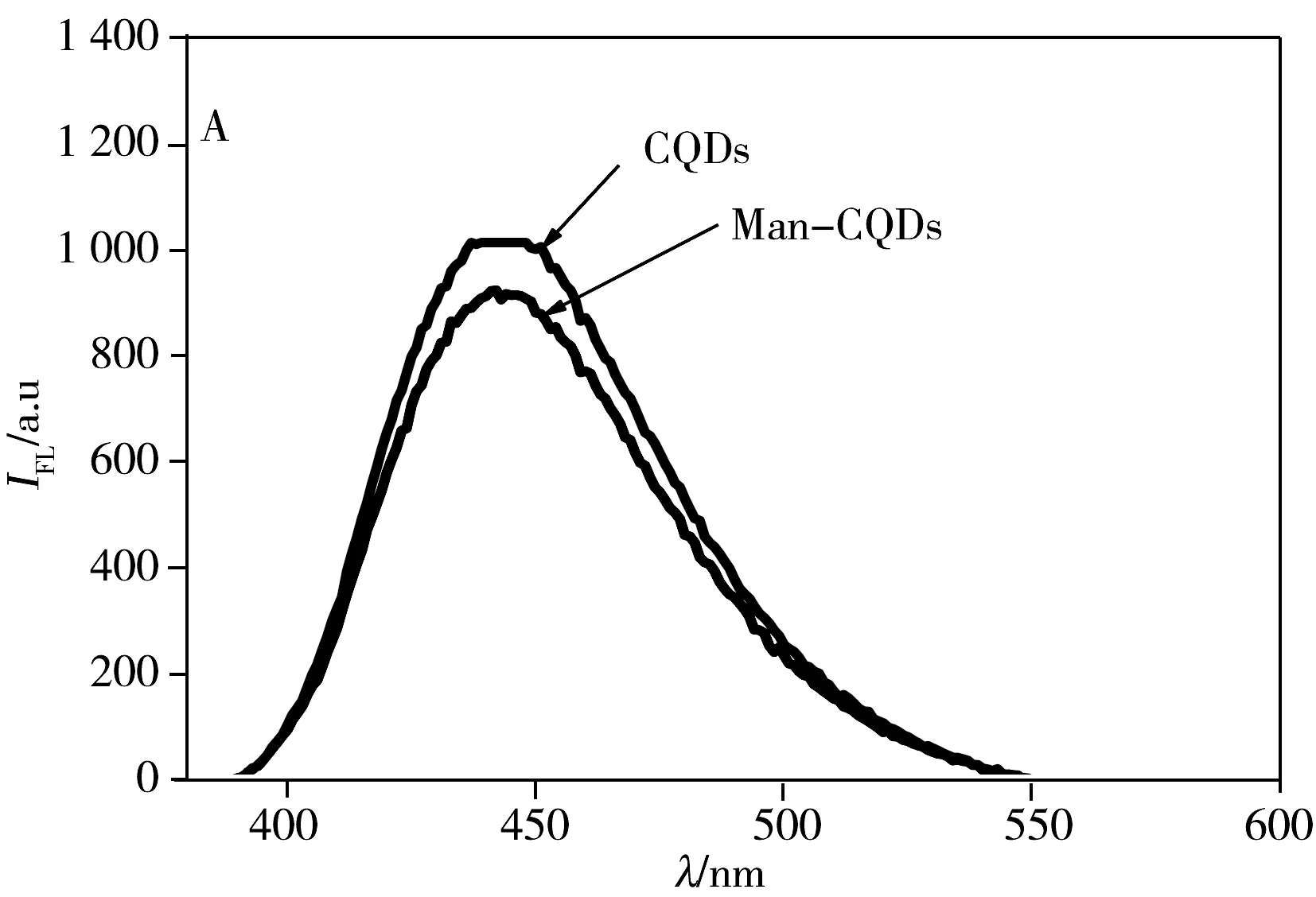
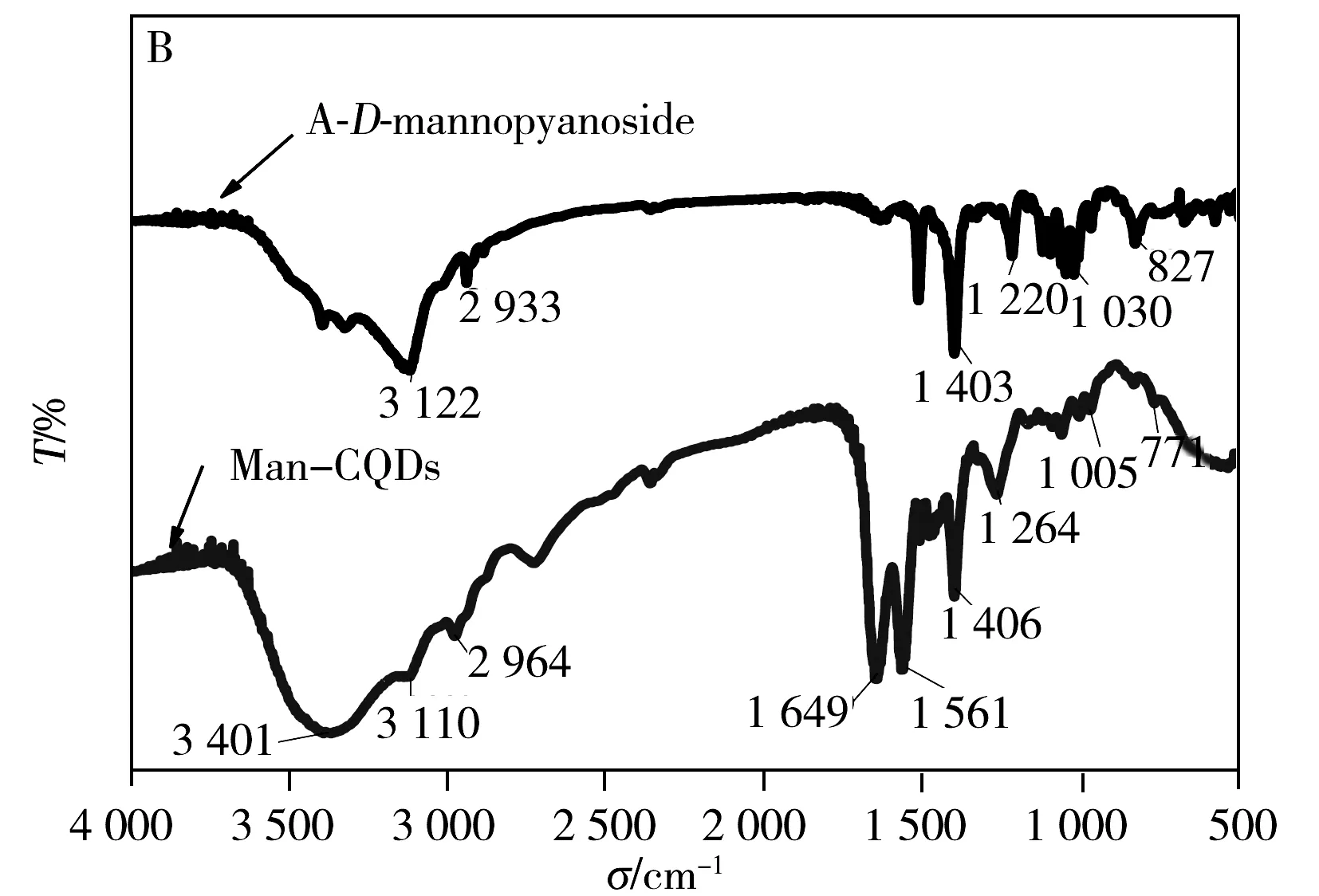
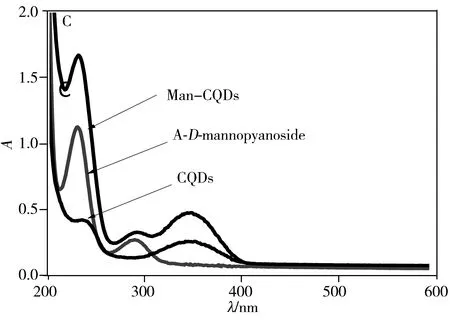
图3 Man-CQDs的荧光光谱(A)、红外光谱(B)与紫外光谱图(C)Fig.3 Fluorescence spectra(A),FTIR spectra(B)and UV-Vis spectra(C) of Man-CQDs
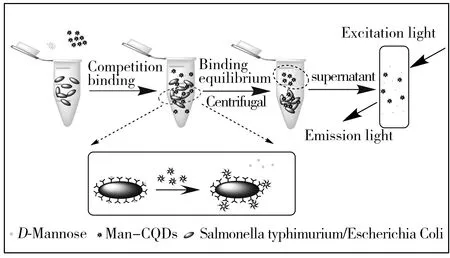
图4 D-Mannose、Man-CQDs和细菌竞争结合原理图Fig.4 Scheme of fluorescence-based competition binding assay between D-Mannose,Man-CQDs and bacteria
2.5 Man-CQDs与3种致病菌的相互作用
Man-CQDs与致病菌的相互作用采用竞争结合方式(图4),首先加入D-Mannose与致病菌结合,再加入Man-CQDs竞争结合D-Mannose与致病菌已结合的位点,使D-Mannose脱离位点,Man-CQDs占据结合位点。荧光光谱(图5A)测试结果显示,与直接结合相比,竞争结合后的上清液荧光强度下降更多,说明Man-CQDs与致病菌结合更好。相较于D-Mannose单个结合位点,Man-CQDs表面有多个甘露糖位点,能够有效地使D-Mannose与致病菌表面脱离,自身占据结合位点,能够真实地反映Man-CQDs与致病菌结合的过程[16],避免和尽量减少非特异性结合。待Man-CQDs、D-Mannose与致病菌结合平衡后,通过离心将Man-CQDs/致病菌复合物与游离的Man-CQDs和D-Mannose分离,沉淀用PBS重悬,测试其荧光光谱并分析(CQDs作为对照组)。测试结果显示,CQDs与致病菌不结合;Man-CQDs选择性识别大肠杆菌JM109和沙门氏菌S.123443,不与大肠杆菌DH5a结合,且Man-CQDs与沙门氏菌S.123443的结合能力强于大肠杆菌JM109(图5B,C,D)。结果表明,Man-CQDs能够选择性识别大肠杆菌JM109和沙门氏菌S.123443,而不是非特异性吸附。
2.6Man-CQDs与致病菌结合常数的计算
致病菌与糖非共价结合的机理研究,对致病菌的定量检测和抑制粘附细胞均有重要意义,结合常数不仅是判定致病菌与糖作用强弱的参数,还是两者结合方式和结合效果研究的基础[17]。表达Ⅰ型菌毛的细菌如沙门氏菌、大肠杆菌和肺炎链球菌等能与甘露糖及其衍生物识别结合,其结合主要是与细菌菌毛/鞭毛末端的凝集素(蛋白)进行糖-蛋白识别[18-19]。Cecioni等[20]提出致病菌的每个菌毛/鞭毛末端只有1个结合位点,其结合方式为1∶1结合,因此可采用Scatchard方程计算得到甘露糖与致病菌的结合常数,以此评价两者的亲和作用强弱。假设致病菌菌毛/鞭毛有m个区域,每个区域有n个同等强度的结合位点,且相互独立,可以结合n个Man-CQDs,则有Scatchard[21]方程:
μ/Cf=Ka(n-μ);μ=(Ct-Cf)/Cm
(2)
式中n、Ct、Cf、Ka、μ分别是结合位点数、加入Man-CQDs浓度、游离Man-CQDs浓度、结合常数和致病菌每个区域上结合Man-CQDs数量。Cf根据Man-CQDs浓度与其荧光强度的线性方程(IF=3 564C+41.09,r2=0.999 4)计算得到;根据细菌结合的Man-CQDs浓度与细菌浓度的比值,可计算得μ,由于致病菌为非均相溶液,浓度无法以摩尔浓度表示,通常以与致病菌结合最大的Man-CQDs浓度Cm替代。基于上述方程,以μ/Cf对μ线性回归后可求出结合常数Ka。
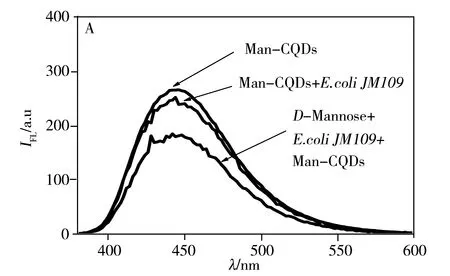
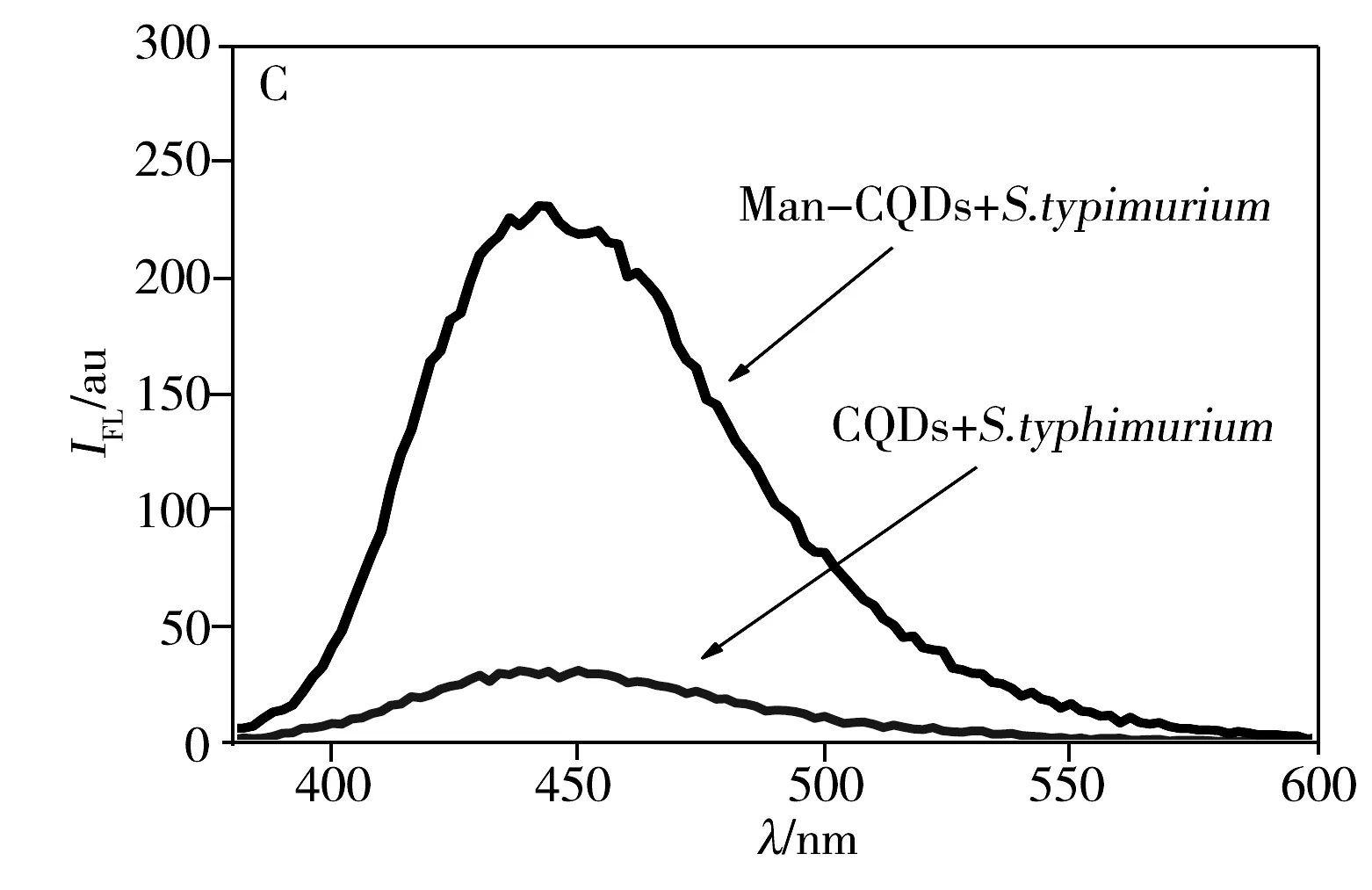
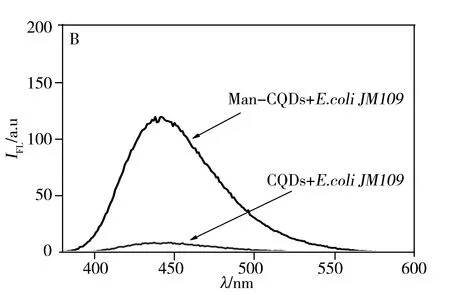

图5 D-Mannose、Man-CQDs和细菌竞争结合后上清液的荧光光谱图(A)以及细菌与Man-CQDs结合后的荧光光谱(B~D)Fig.5 Fluorescence spectra of the supernatant based on competition binding assay between D-Mannose,Man-CQDs (A)and bacteria,and fluorescence spectra of bacteria labeled Man-CQDs(B-D)B:E.coli JM109;C:typhimurium S.123443;D:E.coli DH5a

表1 Man-CQDs与细菌的结合常数Table 1 Binding constant of Man-CQDs and bacteria
3种致病菌与系列浓度(0.023 4~0.291 6 mmol/L)的Man-CQDs溶液结合后,其上清液的荧光光谱测试结果显示,随着Man-CQDs浓度的增加,上清液的荧光强度减弱,说明与致病菌结合的Man-CQDs也随之增加。当Cf=1.06×10-4mol/L时,μ由迅速增加到逐渐平稳,说明Man-CQDs与致病菌结合达到最大,对应结合最大的浓度为1.94×10-4mol/L。然而大肠杆菌DH5a与Man-CQDs结合实验中,随着Man-CQDs浓度增加,上清液的荧光强度也随之增加,并超出测试范围,说明其未与Man-CQDs结合,与文献[22]中甘露糖与大肠杆菌DH5a不结合是一致的。根据μ/Cf对μ线性回归计算得到沙门氏菌与Man-CQDs的Ka=1.17×105L/mol,大肠杆菌JM109与Man-CQDs的Ka=2.39×103L/mol(表1),与文献[17]中报道的糖与致病菌的结合常数同一数量级,Man-CQDs与这两种致病菌有较强的亲和作用,前者的Ka明显比后者强,可能是两者非共价结合的作用方式不同[17]所致。
3 结 论
本文以水热法制备得到了水溶性好、荧光量子产率高、结构稳定的Man-CQDs,结合Scatchard线性分析,计算得到沙门氏菌、大肠杆菌JM109与Man-CQDs的结合常数。据此建立了一种新型的定量研究甘露糖与细菌选择性识别结合的方法,该方法具有简单、直接、灵敏度高及无毒的优点,为表达Ⅰ型菌毛的细菌与宿主细胞表面糖类分子选择性识别结合的机理研究提供了理论基础。同时,也扩展了CQDs在细菌领域的应用范围,为后续细菌粘附宿主细胞机理的研究以及新型糖类抗菌药的研发等提供了新的技术途径。
[1] Ofek I,Hasty D L,Sharon N.FEMSImmunol.Med.Microbiol.,2003,3(38):181-191.
[2] Loka R S,McConnell M S,Nguyen H M.Biomacromolecules,2015,16(12):4013-4021.
[3] Hong M F,Cassely A,Mechref Y,Novotny M V.J.Chromatogr.B,2001,2(752):207-216.
[4] Coulibaly F S,Youan B B C.Biosens.Bioelectron.,2014,59:404-411.
[5] Smith E A,Thomas W D,Kiessling L L.J.Am.Chem.Soc.,2003,125(20):6140-6148.
[6] Ahmed K B A,Mohammed A S,Anbazhagan V.Spectrochim.Acta,A,2015,145:110-116.
[7] Wang X,Ramstro O,Yan M D.Anal.Chem.,2010,82(21):9082-9089.
[8] Okada T,Isobe C,Wada T,Ezaki S,Minourn N.BioconjugateChem.,2013,24(6):841-845.
[9] Zhu S J,Meng Q,Wang L,Zhang J H,Song Y B,Jin H,Zhang K,Sun H C,Wang H Y,Yang B.Angew.Chem.Int.Ed.,2013,52(14):3953-3957.
[10] Wang R J,Xu Y,Zhang T,Jiang Y.Anal.Methods,2015,7(5):1701-1706.
[11] Ma N,Jiang W T,Li T,Zhang Z Q,Qi H Z,Yang M H.Microchim.Acta,2015,182(1/2):443-447.
[12] Zhong D,Zhuo Y,Feng Y,Yang X M.Biosens.Bioelectron.,2015,74:546-553.
[13] Weng C I,Chang H T,Shen Y W,Unnikrishnan B,Li Y J,Huang C C.Biosens.Bioelectron.,2015,68:1-6.
[14] Lai I P J,Harroun S G,Chen S Y,Unnikrishnan B,Li Y J,Huang C C.Sens.ActuatorsB,2016,228:465-470.
[15] Dubois M,Gilles K A,Hamilton J K,Rebers P A,Smith F.Anal.Chem.,1956,28(3):350-356.
[16] Friguent B,Chaffatte A F,Djavadi-Ohaniance L,Goldberg M E.Immunol.Methods,1985,77(2):305-319.
[17] Abdelhamid H N,Wu H F.J.Mater.Chem.B,2013,1(44):6094-6106.
[18] Hartmann M,Lindhorst T K.Eur.J.Org.Chem.,2011,(20/21):3585-3609.
[19] Zeng X,Andrade C A S,Oliveira M D L,Sun X L.Anal.Bioanal.Chem.,2012,402(10):3161-3176.
[20] Cecioni S,Imberty A,Vidal S.Chem.Rev.,2015,115(1):525-561.
[21] Scatchard G,Ann N Y.Acad.Sci.,1949,51(4):660-672.
[22] Wang Y X,Ye Z Z,Si C Y,Ying Y B.FoodChem.,2013,136(3/4):1303-1308.
Study on Interaction between Mannose and Bacteria Using Glycosylated Carbon Quantum Dots
ZHAO Bin1,2,4,CUI Fei-yun1,2,4,XU Yi2,3,4*,ZHANG Xiao-feng2,4,5,LI Ze-quan1*
(1.School of Chemistry and Chemical Engineering,Chongqing University,Chongqing 400044,China;2.Key Disciplines Laboratory of Novel Micro-nano Devices and System Technology,Chongqing 400044,China;3.Microsystem Research Center,School of Optoelectronic Engineering,Chongqing University,Chongqing 400044,China;4.International R&D Center of Micro-nano Systems and New Materials Technology,Chongqing 400044,China;5.School of Chemistry and Chemical Engineering,Chongqing University of Technology,Chongqing 400050,China)
In this paper,citric acid was used as carbon source for preparing fluorescent carbon quantum dots(CQDs).Due to the obtained CQDs had carboxyl groups on their surfaces,Man-CQDs were synthesized by immobilizing 4-aminopheny-l-α-D-mannopyanoside on the surfaces of CQDs via covalent bond.Furthermore,the binding constants of Man-CQDs and Escherichia coliJM109/EscherichiaDH5a/SalmonellatyphimuriumS.123443 were obtained by fluorescent competition experiments.The results showed that the sizes of CQDs were approximately 26 nm,the maximum excitation wavelength for CQDs was 445 nm and the fluorescence yield was 76%in contrast to 54%quinine sulfate.Compared with the fluorescence intensity of CQDs,the prepared Man-CQDs remained unchanged in principle.By the Phenol-sulfate method,the concentration of Man-CQDs was calculated to be 2.832 mmol/L,and the content of mannose in Man-CQDs nanoparticles was approximately 40%.Based on competition binding experiments of Man-CQDs andD-mannose with bacteria,the binding constant of Man-CQDs and bacteria was calculated by Scatchard equation,namely the binding constants of Man-CQDs withEscherichiacoliJM109 andSalmonellatyphimuriumS.123443 were 2.39×103L/mol and 1.17×105L/mol,respectively.However,the reaction of Man-CQDs andEscherichiacoliDH5awas nonspecific binding.The results suggested that the proposed method was applicable for the determination of noncovalent binding constant between mannose and bacteria.Besides,it offered a valuable reference information for the research of interaction between carbohydrate and bacteria.
Man-CQDs;EscherichiacoliJM109;EscherichiacoliDH5a;SalmonellatyphimuriumS.123443;binding constant;interaction;fluorescence spectrum
2017-05-31;
2017-07-15
重庆市科学技术委员会社会民生科技创新一般项目(cstc2015shms zx00014);重庆市科学技术委员科技惠民计划项目(cstc2015jcsf8001)
*
徐 溢,博士,教授,研究方向:分析化学、应用化学和微型集成生化分析系统,E-mail:18883724394@163.com 李泽全,博士,副教授,研究方向:熔盐电化学、材料制备及性能、环境等,E-mail:lzq@cqu.edu.cn
10.3969/j.issn.1004-4957.2017.11.005
O433.4
A
1004-4957(2017)11-1318-07

