超声波辅助酶提取黄秋葵果胶工艺研究
陶阿丽,陈自豪,张国升
(安徽新华学院药学院,安徽 合肥 230088)
超声波辅助酶提取黄秋葵果胶工艺研究
陶阿丽,陈自豪,张国升
(安徽新华学院药学院,安徽 合肥 230088)
以黄秋葵为原料,采用超声波辅助纤维素酶对黄秋葵果胶的提取进行研究.在单因素试验的基础上,采用响应面分析考察超声温度、超声时间、料液比、酶解时间四个因素对果胶得率的影响.得出最佳工艺条件为超声时间15 min、液料比35∶1(mL/g)、超声温度43℃、酶解时间25 min.在该工艺条件下果胶得率为8.84%.
黄秋葵;超声提取;酶法;果胶得率;响应面分析
黄秋葵(Okra)为锦葵科秋葵属植物[1],富含黏性物质,其成分主要为果胶、阿拉伯聚糖、半乳聚糖等,尤其是果胶成分占有较大比例.果胶是以原果胶、果胶、果胶酸的形态存在,是一种亲水性植物多糖类物质,用途很广,可在食品中用做凝胶剂、增稠剂、组织成型剂、乳化剂和稳定剂等.现代药理表明果胶类多糖是可溶性纤维,具有排毒养颜的效果,减少毒素在体内沉积,降低血糖及胆固醇的含量[2-3].鉴于黄秋葵中含有丰富的果胶,对其进行开发具有潜在的应用价值.从植物中提取果胶是深入开发的前提,目前果胶的提取方法主要有酸提取乙醇沉淀法、离子交换法、酸提取盐沉淀法以及微生物法等[4-5].这些提取方法普遍存在着提取率低、耗时长、能耗高等不足,因此研究新的果胶提取工艺是当前的方向之一.超声波提取主要是利用超声波的空化效应增大介质分子的运动速度,使可溶性活性成分迅速溶出,因此在天然产物提取中广泛应用[6].另外果胶属于植物成分,植物中由于富含大量的纤维成分,对于果胶在提取过程中的溶出为不利因素,因此,采用纤维素酶辅助对于果胶的提取具有积极意义.因此,本实验采用超声提取结合酶辅助提取黄秋葵果胶工艺,并运用响应面法确定最佳工艺条件,为黄秋葵果胶的提取与开发提供参考.
1 材料仪器
1.1 实验试剂
黄秋葵:将嫩果置于35℃烘箱中烘干,粉碎过40目筛,在沸水中煮5-7 min,灭果胶酶,除去色素、苦味和糖分等后烘干备用;纤维素酶(酶活性大于15 000 U/g),95%乙醇溶液为分析纯;
1.2 仪器
DHG-9023型电热恒温鼓风干燥箱(上海三发科学仪器有限公司);KQ118超声波清洗器(昆山市超声仪器有限公司);T22型可见分光光度计(上海成光仪器有限公司);FA2004型电子天平(上海良平仪器有限公司);SHZDIII型循环水真空泵(河北润联科技开发有限公司);FY130中草药粉碎机(天津市泰斯特仪器有限公司).
2 实验方法
2.1 工艺流程
黄秋葵→烘干→粉碎→灭酶→酶解→超声提取→离心浓缩→乙醇沉淀→抽滤→稀释定容→测吸光度
2.2 标准曲线的绘制
葡萄糖标准溶液配制:精确称取105℃干燥恒重的葡萄糖0.050 0 g于烧杯中,用蒸馏水溶解后转移至100 mL容量瓶中,用水稀释并定容至刻度.用移液管精密移取上述稀释液1.0,2.0,3.0,4.0,5.0 mL置于5个50 mL容量瓶中,定容至刻度.
葡萄糖标准曲线的绘制:分别吸取上述葡萄糖标准溶液各0.2 mL置于10 mL试管中,加入5%苯酚溶液0.4 mL,混合后迅速加入浓硫酸2.0 mL,混合均匀.在490 nm波长处测量吸光值,空白试剂为参比.以葡萄糖的浓度为横坐标,吸光度为纵坐标,绘制标准曲线,得曲线方程为A=0.0256C+ 0.0146,R2=0.9989,曲线见图1.
2.3 供试品溶液的制备

图1 葡萄糖标准曲线
精密称取1.000 0 g黄秋葵粉末,加入0.002 5 g纤维素酶,按照设计好的液料比、超声时间、超声温度和酶解时间进行提取.将提取后的溶液趁热用纱布过滤,得滤液,离心20 min.取其上清液加热浓缩,并边搅拌边缓慢加入体积分数95%乙醇溶液.使浓缩液中乙醇的体积分数达到75%,放入冰箱中静置24 h醇沉,抽滤,弃去滤液,将滤饼全部转入10 mL容量瓶中,用水稀释至刻度,混匀.取1 mL稀释液定容至100 mL容量瓶中,按葡萄糖标准曲线绘制项下的方法显色,用于比色测定.在波长为490 nm处测定吸光度A,带入回归方程,计算样品果胶得率.

其中,C为样品中葡萄糖浓度(mg/mL),m为样品质量(g),V为配制的溶液体积(mL),稀释倍数为1000.
2.4 方法学考察
2.4.1 精密度试验结果
精密吸取葡萄糖对照品溶液0.2 mL置于10 mL试管中,加入质量分数5%苯酚溶液0.4 mL,混合后迅速加入浓硫酸2.0 mL,混合均匀,水浴(40℃)放置30 min,以不加葡萄糖对照品为空白,在490 nm波长处连续6次测定吸光度,RSD为1.29%,精密度良好.
2.4.2 稳定性实验结果
精密称取黄秋葵粉末1.000 0 g,加入0.002 5 g纤维素酶,置圆底烧瓶中,加入适量水,超声提取15 min,过滤得供试品.精密吸取2 mL供试品溶液,按葡萄糖标准曲线绘制项下的方法显色,分别在0,10,20,30,40,50,60 min下测定吸光度,6次测量结果无明显变化,RSD为1.10%,稳定性良好.
2.4.3 重现性实验结果
按照2.3方法制备供试品溶液6份,按葡萄糖标准曲线绘制项下的方法显色测定吸光度,RSD为1.39%,重现性良好.
3 结果与分析
3.1 单因素实验
3.1.1 超声温度对黄秋葵果胶得率的影响
精密称取5份1.000 0 g黄秋葵粉末,按照设计好的酶解时间25 min、液料比40∶1(mL/g)、超声时间20 min、超声温度分别为30,40,50,60,70℃做超声波提取,结果如图2.实验结果表明,黄秋葵果胶得率开始随着温度的升高增大,当温度高于50℃时,果胶得率明显下降.所以随着温度的升高黄秋葵果胶的溶出速率增大,温度过高后会破坏果胶的结构,高温也会破坏酶的辅助性能,不利于果胶的提取.因此,得出超声温度在50℃左右时为最佳.
3.1.2 超声时间对黄秋葵果胶得率的影响
精密称取5份1.000 0 g黄秋葵粉末,按照设计好的酶解时间25 min、液料比40∶1(mL/g)、超声温度50℃、超声时间10,15,20,25,30 min做超声波提取,结果如图3.实验结果表明,黄秋葵果胶的得率开始随着超声时间的增长而提高,超声时间超过15 min时明显下降.一开始可能是时间过短,没有充分溶出.而超声时间过长会引起果胶结构变化导致提取率降低,所以提取效果在超声时间15 min处较好.
3.1.3 料液比对黄秋葵果胶得率的影响
精密称取5份1.000 0 g黄秋葵粉末,按照设计好的酶解温度25 min、超声温度50℃、超声时间20 min、液料比20∶1,30∶1,40∶1,50∶1,60∶1(mL/g)做超声波提取,结果如图4.实验结果表明,黄秋葵果胶得率开始随着液料比的增大而增大.料液比高于40∶1(mL/g)时,果胶提取率下降,可能由于溶剂量增加,溶液中果胶浓度降低,有助于果胶的扩散,液料比40∶1(mL/g)附近果胶得率最大,超过后有下降趋势,所以液料比在40∶1(mL/g)左右较好.
3.1.4 酶解时间对黄秋葵果胶得率的影响

图2 超声温度对黄秋葵果胶得率的影响
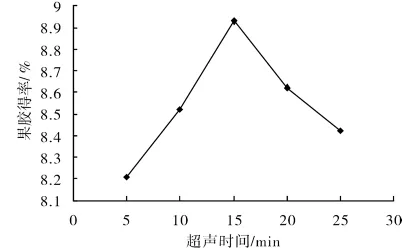
图3 超声时间对黄秋葵果胶得率的影响
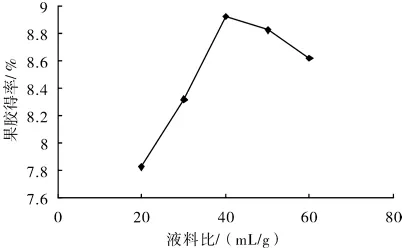
图4 液料比对黄秋葵果胶得率的影响
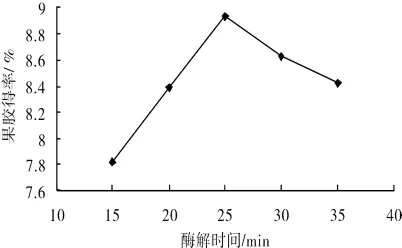
图5 酶解时间对黄秋葵果胶得率的影响
精密称取5份1.000 0 g黄秋葵粉末,按照设计好的超声时间15 min、液料比40∶1(mL/g)、超声温度50℃、酶解时间15,20,25,30,35 min做超声波提取,结果如图5.实验结果表明,黄秋葵果胶的得率开始随着酶解时间的增长而增大;酶解时间超过25 min时,果胶得率下降.可能由于酶解时间的增长,酶活性降低.因此,酶解时间25 min附近果胶得率最大,超过后有下降趋势.
3.2 响应面试验
以单因素试验结果为基础,根据Box-Behnken中心组合试验设计原则,选酶解时间、超声时间、液料比、超声温度4个对果胶得率影响显著的因素,采用4因素3水平条件的响应面分析方法对工艺参数进行优化.试验因素与水平设计见表1.

表1 响应面分析因素与水平安排表
由Design-Expert 8.0.6软件处理数据,其方差分析结果见表3.对响应值与各个因素进行回归拟合,该模型对应的回归方程:
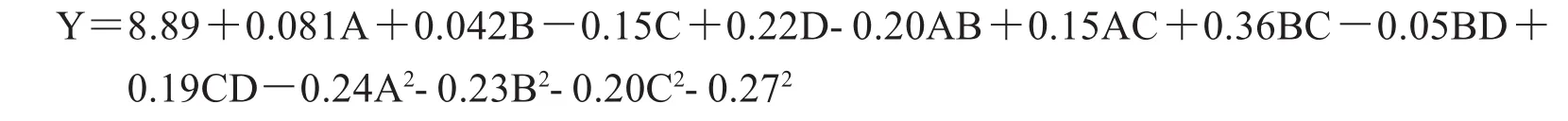

表2 响应面试验安排与结果
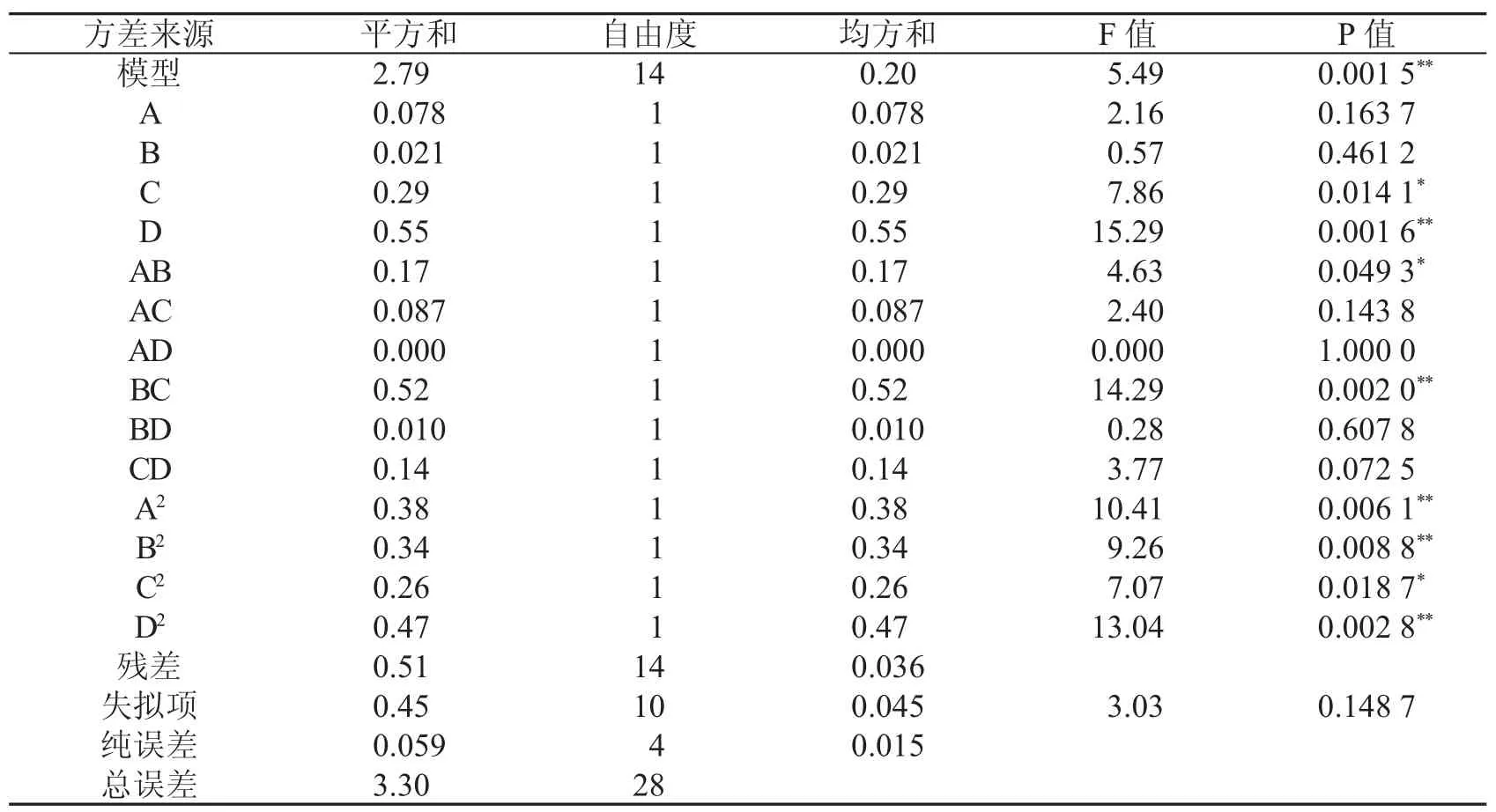
表3 响应面分析法对果胶得率的ANOVA分析结果
对二次回归方程和表3进行方差分析,模型P<0.01,此时回归方差模型极显著,该试验方法可靠.方程失拟项不显著,该回归模型与实测值能较好的拟合.回归方程各项的方差分析表明:D、BC、A2、B2、D2均达到极显著水平.选定的因素对果胶提取率的影响大小依次为酶解时间、超声温度、超声时间、液料比.
响应面Y对于各因素A、B、C、D值的三维空间图如下:
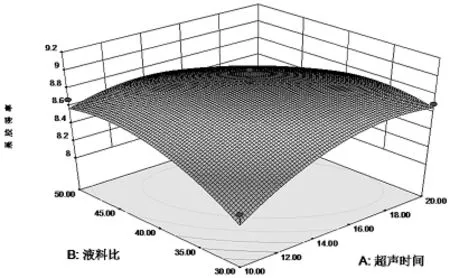
图6 超声时间和液料比影响果胶提取率的响应面图
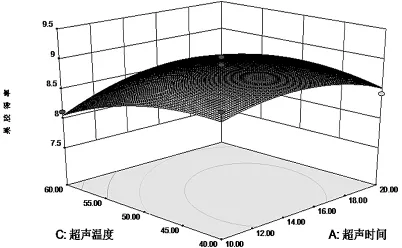
图7 超声时间和超声温度影响果胶提取率的响应面图
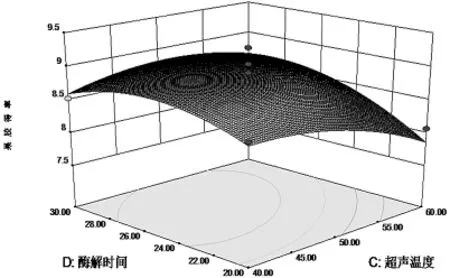
图8 超声温度和酶解时间影响果胶提取率的响应面图

图9 超声时间和酶解时间影响果胶提取率的响应面图
通过响应面图(图6、图7、图8、图9),能够很直观的观察各因素以及各因素之间的关系.从图中可看出4个因素对果胶得率都具有很大的影响,表3回归分析结果也与此吻合.
通过软件对试验结果进一步分析得,果胶最佳提取工艺条件为超声时间15.03 min、液料比35.66∶1(mL/g)、超声温度42.57℃、酶解时间24.42 min,在此条件下果胶得率为8.952 8%.对响应面二次回归所得最佳条件进行修正,确定最佳提取工艺为:超声时间15 min、液料比35∶1(mL/g)、超声温度43℃、酶解时间25 min.
3.3 验证实验结果
为了验证响应面法的可行性,根据上述修正条件,同条件下重复3次实验,得黄秋葵果胶提取率为8.84%.将所得实测值与二项式拟合方程预测的最大值进行比较,计算偏差RSD为1.51%,偏差较小,说明该模型有效.
4 结论
本研究采用超声波辅助酶提取黄秋葵果胶,以果胶得率为指标,对影响果胶得率的4个因素进行考察,优选出超声波酶辅助提取果胶的最佳工艺.在单因素试验结果之上,采用响应面分析法优化最佳提取工艺参数.实验结果表明,最佳提取工艺条件为超声时间15 min、液料比35∶1(mL/g)、超声温度43℃、酶解时间25 min.在此条件下果胶的实际得率为8.84%.本研究为黄秋葵果胶的提取工艺提供了参考,有利于对黄秋葵和黄秋葵果胶的进一步开发利用.
[1]SENGKHAMPARN N,SAGIS L M C,VRIES R D,et al.Physicochemical properties of pectins from okra(Abelmoschus esculentus(L.)Moench)[J].Food Hydrocolloids,2010,24(1):35-41.
[2]李加兴,覃敏杰,吴越,等.响应面法优化黄秋葵果胶微波辅助提取工艺[J].食品科学,2013,34(14):12-16.
[3]孙元琳,汤坚.果胶类多糖的研究进展[J].食品与机械,2004,20(6):60-63.
[4]陶阿丽,冯学花,尹伟,等.响应面优化微波辅助提取豆腐柴果胶工艺及其抗氧化研究[J].汕头大学学报(自然科学版),2014,29(4):53-60.
[5]耿敬章.纤维素酶辅助提取橘皮中果胶类化合物[J].中国食品添加剂,2010(5):57-61.
[6]李建凤,任磊,王真,等.响应曲面法用于超声波提取柠檬皮渣果胶研究[J].食品工业科技,2013,34(4):267-269.
Study on Extraction Technology of Polysaccharides from Okra
TAO Ali,CHEN Zihao,ZHANG Guosheng
(College of Pharmaceutical Sciences,Anhui Xinhua University,Hefei 230088,Anhui,China)
In this paper,okra was used as raw materials by ultrasonic assisted extraction of cellulase on okra pectin.Ultrasonic temperature,ultrasonic time,material liquid ratio and enzymatic hydrolysis time of four factors were investigated.Its extraction process was optimized by Box-Behnken design based on the series of single-factor experiments.The results indicated that the optimal technological conditions are the enzymatic hydrolysis time 25 min,ultrasonic temperature 43℃,ultrasonic time 15 min and liquid material ratio 43∶1(mL/g).Under these conditions,the yield of pectin was 8.84%.
Okra;ultrasonic extraction;enzymatic extraction;pectin yield;response surface analysis
1001-4217(2017)04-0010-07
TS 255
A
2016-12-09
陶阿丽(1983—),女,安徽合肥人,副教授,硕士研究生.E-mail:taoali84@163.com
安徽省教育厅高校优秀青年人才支持计划重点项目(gxyqZD2016395);国家大学生创新训练项目(201512216023);安徽新华学院校级科研团队项目(2016td016);安徽新华学院教改课程项目(2014jgkcx15);

