扁桃斑鸠菊抗氧化活性成分的提取与筛选
黄晓颖,许振平,魏万千,陈 璇,梁钰仪,邓慧华,马 群,陈美珍
(汕头大学理学院生物学系,广东 汕头 515063)
扁桃斑鸠菊抗氧化活性成分的提取与筛选
黄晓颖,许振平,魏万千,陈 璇,梁钰仪,邓慧华,马 群,陈美珍
(汕头大学理学院生物学系,广东 汕头 515063)
目的 研究提取扁桃斑鸠菊(Vernonia amygdalina Del)叶中抗氧化活性成分的最佳工艺条件,并筛选活性最强的部位.方法 以DPPH自由基清除能力为响应值,利用响应面法优化提取条件;用不同极性有机溶剂对扁桃斑鸠菊乙醇提取物进行萃取分离,以DPPH自由基清除能力和还原能力为指标,筛选抗氧化活性最强部位.结果 响应面法优化的最优提取条件为:提取温度58.5℃、乙醇体积分数62%和料液比1∶24,在此条件下,获得的提取物DPPH自由基清除能力最强,理论预测值IC50为70.04 μg/mL,实际值IC50为(69.20±0.61)μg/mL,说明建立的模型可较好地描述该实验中因素与指标的关系;各萃取部位的抗氧化能力大小依次为:正丁醇部位>氯仿部位>石油醚部位>水相部位,其中正丁醇部位对DPPH自由基清除能力IC50为18.78 μg/mL,与乙醇提取物比较提高了2.68倍.结论 扁桃斑鸠菊体积分数为62%乙醇提取物的正丁醇萃取部位具有很强的抗氧化活性,值得进一步研究利用.
扁桃斑鸠菊;响应面法;抗氧化活性
扁桃斑鸠菊(Vernonia amygdalina Del)俗称南非叶,原产于热带非洲,近年来从新加波、马来西亚移植到中国.目前,在我国广东、福建等地已有种植.扁桃斑鸠菊具有抗氧化、抗肿瘤等多种生理活性,其叶既可入药,也可作为蔬菜食用.民间常用其治疗乳腺癌、鼻咽癌、前列腺癌、肺癌、结肠癌等多种癌症.在东南亚、台湾等地民间使用较多[1].
对尼日利亚普遍食用的扁桃斑鸠菊的研究发现,其叶子含有抗坏血酸、木犀草素等多酚类物质,鲜叶自由基清除能力为(32.9±0.2)%[2].扁桃斑鸠菊的水提物、醇提物的氯仿、乙酸乙酯、正己烷、正丁醇部位对肿瘤细胞生长都有显著抑制作用[3-6].然而,目前所见扁桃斑鸠菊的研究,其原料多限于国外种植的,而对引进种植于我国的扁桃斑鸠菊活性成分的研究未见报道.为此,本文开展对采集于中国广东省的扁桃斑鸠菊叶子的抗氧化活性物质的研究,以期为扁桃斑鸠菊的进一步研究提供科学基础.
1 材料与方法
1.1 材料与试剂
1.1.1 实验材料 扁桃斑鸠菊新鲜叶片,采集于中国广东省汕头市.
1.1.2 试剂 1,1-二苯基-2-苦肼基(日本分装进口,齐云生物技术有限公司);无水乙醇,石油醚(60-90),氯仿,正丁醇,抗坏血酸(VC),FeSO4·7H2O,水杨酸,质量分数30%过氧化氢,十二水磷酸氢二钠,二水磷酸二氢钠,铁氰化钾,三氯乙酸,氯化铁等,均为国产AR级.
1.2 仪器与设备
Universal 320R台式冷冻离心机(德国Hettich公司);FD-1C-50真空冷冻干燥器(上海比朗仪器有限公司);旋转蒸发器RE-52AA(上海亚荣生化仪器厂);高速万能粉碎机(天津市泰斯特仪器有限公司);2100型UV-2100分光光度计(龙尼柯(上海)仪器有限公司);数显恒温水浴锅HH-2(国华电器有限公司);101-1型电热鼓风干燥箱(江苏省东台市电器厂).
1.3 方法
1.3.1 原料预处理
扁桃斑鸠菊新鲜叶片洗净,轻轻甩干水分,放置60℃干燥箱中烘干,粉碎、过40目筛,将粉末置于棕色瓶中保存备用.
1.3.2 抗氧化活性成分的提取
取扁桃斑鸠菊叶干粉,用乙醇溶液恒温浸提,提取液离心分离,减压浓缩,冷冻干燥得乙醇提取物.
1.3.3 乙醇提取的单因素实验
据报道扁桃斑鸠菊活性成分主要为甾醇类化合物、皂苷、生物碱、多酚类、单萜、倍半萜类化合物和不饱和脂肪酸[1,7]等.因此,以乙醇为提取溶剂、以提取物对DPPH自由基半数清除浓度即DPPH·IC50为考察指标,在提取时间固定为120 min和其他条件不变的情况下进行单因素实验,分别考察提取温度、乙醇体积分数和料液比三个因素对乙醇提取物抗氧化活性的影响.
实验方法:精确称取5 g扁桃斑鸠菊叶粉末,在设定的条件下进行单因素提取实验,提取物冷冻干燥后用蒸馏水配制成一定的浓度梯度,测定DPPH自由基清除率.通过SPSS 19.0统计分析软件处理,得各提取条件下样品的DPPH·IC50.
1.3.4 响应面法优化乙醇提取条件
在单因素试验的基础上,以提取温度、乙醇体积分数、料液比三个变量为Box-Behnken设计的自变量,以三次实验所得的DPPH·IC50平均值作为响应值(YDPPH),运用Minitab 15统计软件进行实验设计、数据分析及建立模型.响应面实验设计见表1.

表1 响应面法实验因素与水平
1.3.5 乙醇提取物的萃取分离
按1.3.4得到的最优提取工艺,提取获得扁桃斑鸠菊乙醇提取液,利用旋转蒸发仪除去乙醇得到乙醇浸膏,按乙醇浸膏与萃取剂1∶2体积比依次进行石油醚、氯仿、正丁醇分级萃取分离,得到乙醇提取物各萃取部位,将各萃取部位冷冻干燥48 h得干粉备用.
1.3.6 乙醇提取物活性部位的筛选
分别测定扁桃斑鸠菊乙醇提取物各萃取部位体外对DPPH自由基清除能力和对铁离子的还原能力作为筛选指标.
1) DPPH自由基清除能力的测定
参考Capek.P等人[8]的方法进行.分别将样品溶于水中配制成6个浓度梯度(20、40、80、160、320、640 μg/mL),在各试管中依次加入样品溶液2 mL(空白管不加)、DPPH溶液(0.08 mg/mL)2 mL(本底管不加),各管用蒸馏水补足至4 mL,振荡器混匀,室温静置30 min,在517 nm处以蒸馏水调零测定吸光度,得清除率.抗坏血酸(VC)作为阳性对照.计算公式如下:

式中:A空白为未加入样品的DPPH溶液的吸光度;A实验为DPPH溶液加入样品的吸光度;A本底为未加入DPPH的样品溶液的吸光度.
2) 还原能力的测定
参照Oyaizu M[9]的方法进行.分别取pH6.6磷酸缓冲液(PBS)和质量分数为1%铁氰化钾溶液各2.5 mL,加入不同浓度的样品液(0.2、0.4、0.6、0.8、1 mg/mL)1 mL,混匀,50℃水浴加热20 min,迅速冷却.加入质量分数为10%三氯乙酸溶液2.5 mL,混匀,4000 r/min离心10 min.取上清液2.5 mL,加入质量分数为0.1%FeCl3和蒸馏水各2.5 mL,混匀,静置10 min后,以蒸馏水调零、于700 nm波长处测定吸光度.抗坏血酸(VC)作为阳性对照.吸光度的大小即代表体系还原能力的大小[10].
2 结果与分析
2.1 单因素实验结果
考察了提取温度、乙醇体积分数和料液比(m:v)三个因素对乙醇提取物DPPH自由基清除活性的影响,结果见图1-3.
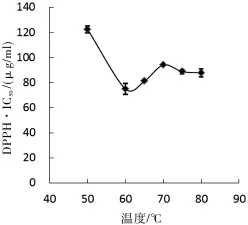
图1 温度对提取物 DHHP·IC50的影响

图2 乙醇体积分数对提取物 DHHP·IC50的影响

图3 料液比对提取物 DHHP·IC50的影响
从图中可知,在单因素试验中,当提取温度60℃时,乙醇体积分数为60%,料液比1∶20,提取物对DPPH自由基清除活性最强,此时的DPPH·IC50最低.在此基础上设计了响应面的因素水平进一步优化提取条件.
2.2 响应面实验结果及分析
2.2.1 响应面实验结果
响应面实验结果见表2.

表2 乙醇提取Box-Behnken实验结果
2.2.2 回归模型显著性检验
运用Minitab 15统计软件分析实验结果,得到二次多元回归方程为:YDPPH=71.604-1.161X1-1.391X2-7.267X3+6.162X12+4.526X22+9.621X32+1.315X1X2+6.613X1X3+ 0.461X2X3.
通过回归方程方差分析结果考察模型的可靠性,结果如表3.结果显示,回归方差模型(P=0.018<0.05)显著,失拟项(P=0.150>0.05)不显著,说明模型是有效的.模型的决定系数R2为0.934 0,说明响应值的变化有93.40%来源于所选因素,因此,该回归模型能很好地拟合所选因素与响应值的关系,可应用该模型对乙醇提取物DPPH自由基清除能力进行分析和预测.

表3 回归模型方差分析
由表4回归方程系数显著性检验结果表明:一次项系数X3(P<0.01)极显著,X1和X2(P>0.05)不显著,平方项系数X12(P<0.05)显著,X32(P<0.01)极显著,而交叉乘积项系数除X1*X3外的P值均大于0.05为不显著,说明提取温度和料液比存在交互作用.结合表3得出,回归模型线性显著(P<0.05),平方(P<0.01)极显著,交互作用不显著(P>0.05).因此,所选因素与响应值之间并非是简单的线性关系,对乙醇提取物DPPH自由基清除能力的影响大小依次为料液比(X3)>乙醇体积分数(X2)>提取温度(X1).

表4 回归方程系数显著性检验
2.2.3 响应曲面分析
通过回归模型方程绘出3D响应曲面图及2D等高线图(见图4),以此确定各个因素的最佳水平范围.



图4 各因素交互作用对提取物DPPH自由基清除能力IC50值的影响
由图4A可知,在提取温度55~65℃、乙醇体积分数55%~70%的条件下,对提取物的DPPH自由基清除能力有较强的影响;如图4 C所示,乙醇体积分数在50%~70%、料液比在1∶15~1∶30的条件下,对提取物的DPPH自由基清除能力有较强的影响;从图4 B可以看出,其等高线为椭圆形,故提取温度和料液比这两因素之间交互作用显著.
通过Minitab 15软件分析,得出扁桃斑鸠菊叶乙醇提取抗氧化成分最佳提取工艺条件是:提取温度58.48℃、乙醇体积分数61.52%和料液比1∶24.34.在此条件下,得到的提取物具有最强的DPPH自由基清除能力,其DPPH·IC50理论值可达70.04 μg/mL.考虑实际的可操作性,将优化的提取条件修正为:提取温度58.5℃、乙醇体积分数62%和料液比1∶24,在此条件下进行重复三次的验证实验,所得DPPH·IC50实际值为(69.20±0.61)μg/mL,与理论值相比,相对误差为1.20%,说明回归模型方程具有可行性,优选的工艺能有效地提取扁桃斑鸠菊叶的抗氧化活性成分.
2.2.4 乙醇提取物各部位抗氧化活性
1) 对DPPH自由基清除能力
分别测定了乙醇提取液不同浓度石油醚部位、氯仿部位、正丁醇部位、水相部位对DPPH自由基清除能力,结果见图5.以SPSS 19.0软件Probit回归分析,置信区间为95%,获得在一定的浓度梯度下各部位的DPPH·IC50(见表5).

图5 乙醇提取物各萃取部位对DPPH自由基清除能力

表5 各萃取部位的DPPH·IC50
由图5可见,在一定作用浓度范围内,各部位对DPPH自由基都具有较强清除活性,且存在浓度梯度效应.结合表5,可知各活性部位对DPPH自由基清除能力大小依次为正丁醇部位>氯仿部位>石油醚部位>水相部位,其中正丁醇部位活性最强,其DPPH·IC50为18.778 μg/mL,清除能力接近阳性药物抗坏血酸. 2) 还原能力的测定结果
分别测定了石油醚部位、氯仿部位、正丁醇部位、水相部位和抗坏血酸的还原能力,结果如图6和图7.

图6 乙醇提取物各活性部位的还原能力

图7 抗坏血酸的还原能力
由图6可知,各活性部位的还原能力均随着其浓度的增加而增强,其还原能力的大小依次为正丁醇部位>氯仿部位>石油醚部位>水相部位,与1)中的清除DPPH自由基的实验结果相似,说明提取物的抗氧化与还原能力呈正相关.当样品质量浓度为0.4 mg/mL时,正丁醇部位的还原能力达0.483±0.021,是其他活性部位的3倍以上,但与图7阳性药物比较,仍弱于抗坏血酸.
实验结果表明,正丁醇部位是扁桃斑鸠菊叶乙醇提取物的最强抗氧化活性部位.
3 讨论
1) 通过响应面法优化扁桃斑鸠菊抗氧化活性物质的提取工艺条件为:提取温度58.5℃、乙醇体积分数62%和料液比1∶24.在此条件下,提取120 min,得到的乙醇提取物DPPH·IC50为(69.20±0.61)μg/mL,与模型预测值70.04 μg/mL误差较小,认为建立的实验模型具有实际应用价值.
2) 检测了乙醇提取物各有机相提取部位对DPPH自由基清除能力和对铁离子的还原能力,得出各部位的抗氧化能力大小依次为:正丁醇部位>氯仿部位>石油醚部位>水相部位.正丁醇部位显示出最强抗氧化活性.Erasto P.等利用DPPH法等筛选扁桃斑鸠菊叶的丙酮、甲醇和水提取物的抗氧化活性,发现甲醇提取物表现出较强的DPPH自由基清除活性,其清除能力为75%~99.3%,强过丁基羟基甲苯,与儿茶酚类物质相当,而水提取物的活性最低[11],这与本研究水提取物的抗氧化活性最低的结果相似.
3) 据文献[2]扁桃斑鸠菊正丁醇部位主要含有倍半萜类、多糖类和黄酮类等,它们具有体外抗氧化和抗肿瘤活性.江燕从扁桃斑鸠菊叶醇提正丁醇部位分离鉴定出三个化合物,分别是丁二酸、Vemodalinol和木犀草苷[12].Erasto P等指出了扁桃斑鸠菊的抗氧化活性成分中Vemolide对DPPH自由基的还原能力比Vemodalol的强[13].然而,上述报道所用扁桃斑鸠菊原料均采集于尼日利亚或南非等国,而移植于我国南方的扁桃斑鸠菊其叶的化学组成是否发生变化?其抗氧化成分的种类与含量等尚待今后进一步分离鉴定等研究加以阐明.
[1]杨早.南非叶化学成分及药理作用研究进展[J].南京中医药大学学报,2013,29(4):397-400.
[2]OBOH G.Effect of blanching on the antioxidant properties of some tropical green leafy vegetables[J]. LWT-Food Science and Technology,2005,38(5):513-517.
[3]IZEVBIGIE E B,BRYANT J L,WALKER A.A novel natural inhibitor of extracellular signal-regulated kinases and human breast cancer cell growth[J].Experimental Biology and Medicine,2004,229(2):163-169.
[4]OPATA M M,IZEVBIGIE E B.Aqueous Vernonia amygdalina extracts alter MCF-7 cell membrane permeabilityand efflux[J].International Journal of Environmental Research and Public Health,2006,3(2):174-179.
[5]QYUQIDA,LUOX,LEEKS,et al.Activity makers of the antibreast carcinoma cell growth of Vernonia amygdalinaextracts[J].Exp Biol Med(Maywood),2009,234(4):410-417.
[6]IZEVBIGIE E B.Discovery of water-soluble anticancer agents(edotides)from a vegetable found in Benin City,Nigeria[J].Experimental Biology and Medicine,2003,228(3):293-298.
[7]江燕,林翠梧,柴桦,等.扁桃斑鸠菊挥发性化学成分的顶空固相微萃取-气相色谱-质谱法分析[J].时珍国医国药,2010,21(11):2884-2886.
[8]CAPEK P,MACHOVÁ E,TURJAN J.Scavenging and antioxidant activities of immunomodulating polysaccharidesisolated from Salvia officinalis L[J].International Journal of Biological Macromolecules,2009,44(1):75-80.
[9]OYAIZU M.Antioxidative activities of browning products of glucosamine fractionated by organic solvent and thin-layer chromatography[J].Journal of the Japanese Society for Food Science and Technology(Japan),1988,35(11):771-775.
[10]蔡凌云,周江菊,乐利,等.空心莲子草多糖的体外抗氧化活性[J].食品科学,2011,32(17):186-189.
[11]ERASTO P,GRIERSON D S,AFOLAYAN A J.Evaluation of antioxidant activity and the fatty acid profile of the leaves of Vernonia amygdalina growing in South Africa[J].Food Chemistry,2007,104:636-642.
[12]江燕.抗癌植物扁桃斑鸠菊化学成分的研究[D].南宁:广西大学,2010:37-58.
[13]ERASTO P,GRIERSON D S,AFOLAYAN A J.Antioxidant constituents in Vernonia amygdalina leaves[J].Pharmaceutical Biology,2007,45(3):195-199.
Study on Extracting and Screening Antioxidant Active Properties of Vernonia amygdalina Del
HUANGXiaoying,XUZhenping,CHENXuan,WEI Wanqian,DENG Huihua, LIANGYuyi,MAQun,ZHANG Yueling,CHENMeizhen*
(Department of Biology,College of Science,Shantou University,Shantou515063,Guangdong,China)
Objective:The optimum extraction process of antioxidant active properties ofVernonia amygdalinawasdetermined and the strongest antioxidant properties were screened as well.MethodsThe extract conditions were optimized bythe Response Surface Methodology,response value on DPPH radical scavenging ability.Different polar organic solvents were used to separate theVernonia amygdalinaethanol extract.Based on DPPH radical scavengingabilityand reducingpower,screening the strongest antioxidant properties.Results:At last the optimum conditions of extraction were determined as follows:extraction temperature 58.5℃,ethanol concentration 62%and solid-liquid ratio 1:24.Under the optimal extraction condition,the predictive maximum value of ethanol extract’s DPPH radical scavenging capacity was IC50=70.04 μg/mL and the actual value was IC50=(69.20± 0.61)μg/mL,indicating the model could well describe the relationship between the factors and indexes in the experiment.The antioxidant activities of different extracts were determined as follows: butanol fraction>chloroform fraction>petroleum ether fraction>aqueous fraction.Butanol fraction has the strongest antioxidant activities(DPPH radical scavenging capacity,IC50=18.778 μg/mL), which has improved 2.68 times by comparing with the previous ethanol extract.Conclusion:The results showedthat the butanol fraction ofVernonia amygdalinafromthe 62%ethanol extraction had strongantioxidant activities,and deserves further study.
Vernonia amygdalina;response surface methodology;antioxidant activity
1001-4217(2017)04-0017-09
R284.2
A
2016-02-04
陈美珍(1956—),女,教授,研究方向为天然活性物质研究与开发.E-mail:chenmz@stu.edu.cn
2015年广东省大学生科技创新培育专项资金重点项目

