红细胞生成素抑制活性氧诱导的红细胞衰亡*
孙 云, 柳 刚, 蒋雅丽, 张 斌, 赵 璇, 李学刚
(山东大学第二医院肾内科, 山东 济南 250033)
红细胞生成素抑制活性氧诱导的红细胞衰亡*
孙 云, 柳 刚△, 蒋雅丽, 张 斌, 赵 璇, 李学刚
(山东大学第二医院肾内科, 山东 济南 250033)
目的观察红细胞生成素(erythropoietin, EPO)对过氧化氢(H2O2)刺激后红细胞衰亡(eryptosis)和红细胞中活性氧簇(reactive oxygen species,ROS)生成的影响,并探讨其可能机制。方法将1%健康人红细胞悬液在以下3组不同的体外培养液中孵育:对照组(C组,培养基为PBS液)、H2O2组(H组,培养基为H2O2终浓度100 μmol/L的PBS液)和EPO组(E组,培养基为H2O2终浓度100 μmol/L、EPO终浓度2×104U/L的PBS液)。分别在孵育24 h和60 h时,留取红细胞以备检测。使用流式细胞术检测红细胞的衰亡率、红细胞内ROS和红细胞内钙离子浓度([Ca2+]i),观察各检测指标的变化并分析其相关性。结果红细胞衰亡率在C组随孵育时间延长而增加,在相同观察时点,H组较C组明显增加(P<0.01),E组较H组明显降低(P<0.01)。H组红细胞的ROS 生成较C组明显增多,[Ca2+]i较C组明显升高(P<0.01);E组红细胞的ROS生成较H组明显减少,[Ca2+]i较H组明显降低(P<0.05或P<0.01)。结论H2O2诱导健康红细胞加速衰亡,而EPO可以抑制H2O2诱导的红细胞衰亡,其机制可能与抗氧化及 [Ca2+]i的改变有关。
过氧化氢; 红细胞衰亡; 红细胞生成素; 活性氧簇; 细胞内钙离子浓度
红细胞生成素(erythropoietin,EPO)分泌相对或绝对不足是导致慢性肾功衰竭患者发生贫血的最主要原因[1],故EPO 的定期体内补充[2]是迄今以来治疗肾性贫血的最有效和最广泛的方法。EPO作为红系祖细胞生成阶段的刺激因子,它治疗贫血的主要机理是在骨髓中血细胞分化初始阶段刺激红系祖细胞分化。近年发现,EPO这种内分泌激素还具有其它多种特性,包括促进血管增生[3]、抗氧化[4-6]和抗凋亡[7-8]等。慢性肾衰阶段,尤其在进入替代治疗之后,体内环境中的氧化应激状态不仅持续存在,并且逐渐加剧,导致过氧化产物生成过多,抗氧化产物不足。尿毒症已经成为心血管疾病的危险因素之一[9-10]。同时这种不平衡的内环境状态对于红细胞的生存也产生了负面影响。我们在研究EPO治疗肾性贫血的过程中发现其抗氧化和抗凋亡特性能减少尿毒症状态下氧化应激对红细胞的损伤。我们将通过体外实验观察EPO对过氧化氢(hydrogen peroxide, H2O2)损伤的红细胞的保护作用,并通过红细胞内活性氧簇(reactive oxygen species,ROS)和细胞内钙离子浓度(intracellular calcium ion concentration,[Ca2+]i)的变化探讨其可能的机制,以期为临床防治肾性贫血提供新的思路和途径。
材 料 和 方 法
1材料
EPO(商品名益比奥;沈阳三生,10 000 U/支);Annexin Ⅴ-FITC细胞凋亡检测试剂盒(BD);细胞ROS试剂盒和钙离子荧光探针Fluo-3/AM (Abcam);0.22 μm无菌滤器(Millipore);无菌12孔板(Greiner)。
2主要方法
2.1外周血红细胞的体外培养 抽取健康志愿者空腹静脉血6 mL,EDTA抗凝, 用PBS调整细胞浓度为1×109/L(即1% 的红细胞悬液)再分别置于12孔板, 加入如下不同培养基后,置于37 ℃、5% CO2培养箱中培养。
2.2实验设计 将新鲜配置的1% 红细胞悬液按照不同的体外培养基分成以下3组: (1)正常对照(control,C)组:培养基为 PBS溶液;(2) H2O2(H)组:培养基为H2O2终浓度100 μmol/L的PBS溶液; (3) EPO (E)组:培养基为H2O2终浓度100 μmol/L和EPO终浓度2×104U/L的PBS溶液。
设24 h和60 h 2个观察点,定点收集孵育中的红细胞,离心、洗涤,至少2次。并在1 h内使用相应仪器检测相关数据。其中E组红细胞提前加入相应浓度的EPO孵育2 h后,以PBS洗涤,再加入EPO与其它2组同时开始孵育。每个观察点设有3个平行对照孔,相同试验重复3次,测得同一时点数据后,取平均值作为该时点最终值。
2.3检测红细胞衰亡率 红细胞没有细胞核,故称其凋亡为衰亡,在早期衰亡时,仍同样表达磷脂酰丝氨酸(phosphatidylserine,PS)。Annexin V是一种分子量为35 kD的Ca2+依赖性磷脂结合蛋白,可在凋亡早期结合细胞外膜暴露的PS。Annexin V不仅可作为检测细胞早期凋亡的灵敏指标之一,且它测定的PS表达率可代表红细胞的衰亡率。本实验将收集到的红细胞用PBS洗涤后,加入缓冲液和10 μL Annexin V-FITC,轻轻混匀,避光室温反应15 min。流式细胞仪选择激发波长488 nm和发射波长530 nm,检测荧光强度。
2.4检测红细胞内ROS的水平 将收集到的红细胞中加入以PBS稀释终浓度为10 μmol/L的二氯荧光素二乙酸酯(DCFH-DA)。37 ℃摇床孵育20 min,使探针与细胞充分结合,DCFH-DA与ROS反应后生成带有荧光特性的二氯荧光素(DCF)。PBS洗涤细胞3次,彻底去除未进入细胞的DCFH-DA。PBS将红细胞重悬后,流式细胞仪选择激发波长488 nm和发射波长530 nm,检测荧光强度。
2.5检测红细胞内钙离子浓度 将红细胞和经DMSO稀释的终浓度为5 μmol/L的Fluo-3/AM混合,37 ℃孵育40 min 进行荧光探针装载,随后适当洗涤。洗涤后再孵育25 min以确保Fluo-3/AM在细胞内完全转变成Fluo-3。流式细胞仪选择激发波长为488 nm,发射波长为530 nm,测定相对荧光强度(X-mode)。计算荧光指数(FI)=lg(X-mode×340),表示红细胞内钙离子相对含量。
3统计学处理
所有数据均用SPSS 12.0处理,所有计数资料均用均数±标准误(mean±SEM)表示,多个组间比较采用单因素方差分析(one-way ANOVA),组间两两比较使用Bonferroni校正的t检验,两指标间相关性分析采用Pearson法。以P<0.05 为差异有统计学意义。
结 果
1健康人红细胞在不同培养基中的衰亡率
随着体外孵育时间延长,红细胞衰亡率增加。加入H2O2后,即在H组,红细胞衰亡率较C组明显增加(P<0.01),而E组红细胞衰亡率较H组明显降低(P<0.01),见图1。
2健康人红细胞在不同培养基中的ROS和[Ca2+]i的变化
随着体外孵育时间延长,红细胞ROS生成增加,[Ca2+]i升高;当加入H2O2后,二者变化更为明显,即在H组同样时点,红细胞ROS生成较C组明显增加,同时[Ca2+]i明显升高(P<0.05);当加入EPO后,即在E组,红细胞ROS生成较H组明显减少,[Ca2+]i降低(P<0.05或P<0.01),见图2、3。
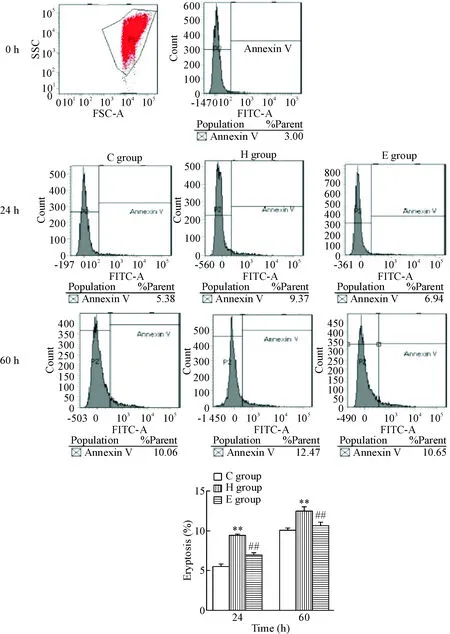
Figure 1. The results of eryptosis detected by flow cytometry. Mean±SEM.n=6.**P<0.01vsC group;##P<0.01vsH group.
图1流式细胞术检测红细胞衰亡率
3各指标间相关性分析
以ROS为自变量,进一步分析与红细胞衰亡率之间相关性,呈正相关;以[Ca2+]i为自变量,进一步分析与红细胞衰亡率之间相关性,呈正相关;以ROS为自变量,进一步分析与[Ca2+]i之间相关性,呈正相关,见表1。
讨 论
EPO自可人工合成以来,对于治疗各种贫血发挥了巨大作用,它主要作用于红细胞生成的第一阶段,当红系祖细胞表达EPO受体后,形成了红系爆式集落形成单位(burst-forming unit of erythriod,BFU-E),继续分化成红系集落形成单位(colony-forming unit of erythroid,CFU-E),只有在EPO存在情况下CFU-E才可存活,并分化成幼红细胞或前体细胞。在红细胞产生的第二阶段,前体细胞继续分化成熟,无需EPO的参与[11]。EPO最初专门用于治疗肾性贫血[12],并且起到了有效的治疗作用。随着EPO在临床广泛应用,逐渐发现了其相关的一些其它生物特性,如抗氧化、促进血管增生和抗凋亡等。本研究使用H2O2刺激健康红细胞,通过观察红细胞衰亡率变化证实EPO对红细胞的保护作用,并同时观察了红细胞内ROS和[Ca2+]i水平的变化。
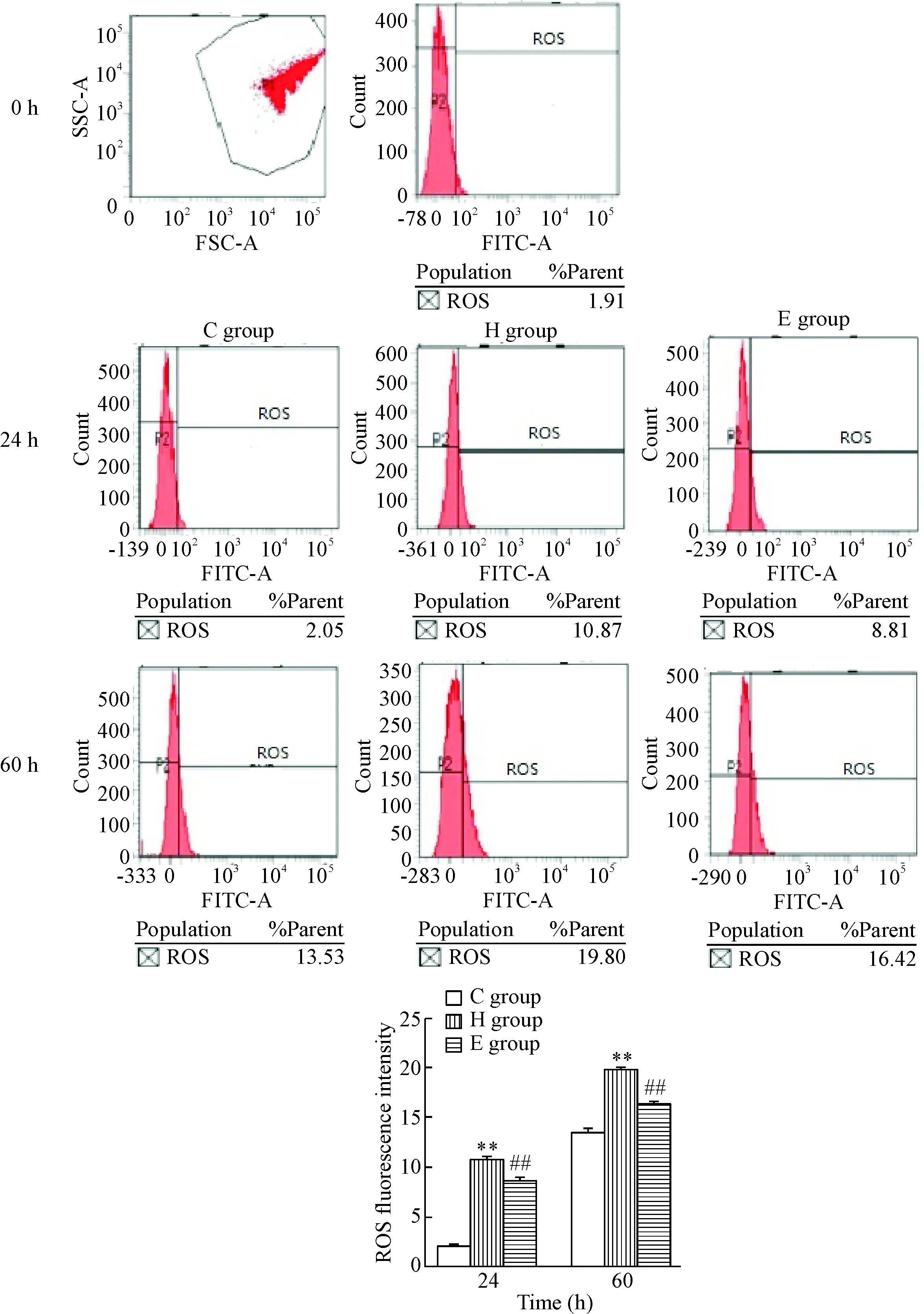
Figure 2. ROS production in the erythrocytes detected by flow cytometry. Mean±SEM.n=6.**P<0.01vsC group;##P<0.01vsH group.
图2流式细胞术检测红细胞的ROS水平
本研究通过向培养基中加入H2O2制造氧化应激环境,是常见的氧化应激损伤细胞的体外实验模型,有利于从细胞水平上探讨相应的病理生理机制。氧化应激在肾脏疾病的进展中发挥重要作用[13],同时也是细胞衰亡的强烈刺激剂[14],因此抗氧化治疗具有重要意义[15]。EPO具有抗氧化和抗衰亡作用,对多种细胞的保护作用已经得到了证实。本研究结果证明100 μmol/L H2O2可有效诱导红细胞衰亡,使细胞衰亡率明显升高。健康红细胞体外孵育时,随孵育时间延长衰亡发生增加。加入H2O2后,在相同观察时点红细胞衰亡明显增加,提示氧化剂诱导了红细胞加速衰亡。而EPO干预后,相同观察时点的红细胞衰亡率明显降低。本实验证实了EPO对氧化应激环境中的红细胞发挥了抗衰亡的作用。慢性肾功衰竭终末期,尤其进入维持性血液透析治疗后,体内氧化应激状态加剧[16],伴随有过多的氧化产物生成。氧化产物成为红细胞衰亡的危险因素。红细胞衰亡具有重要的生理意义,比如直接缩短红细胞寿命[17]、造成细胞之间黏附还可激活凝血过程[18-19]。红细胞的衰亡同时是个可逆的过程[20],这提示有效抑制红细胞衰亡有利于治疗肾性贫血或者减弱凝血倾向。另外,EPO在抑制H2O2对红细胞衰亡作用的同时,也明显阻断红细胞ROS的生成。这一方面提示H2O2通过活性氧升高损伤红细胞,另一方面表明EPO对抗H2O2损伤红细胞的保护机制可能与抗氧化作用相关。同时也证实了EPO的抗衰亡作用与其抗氧化作用相关。
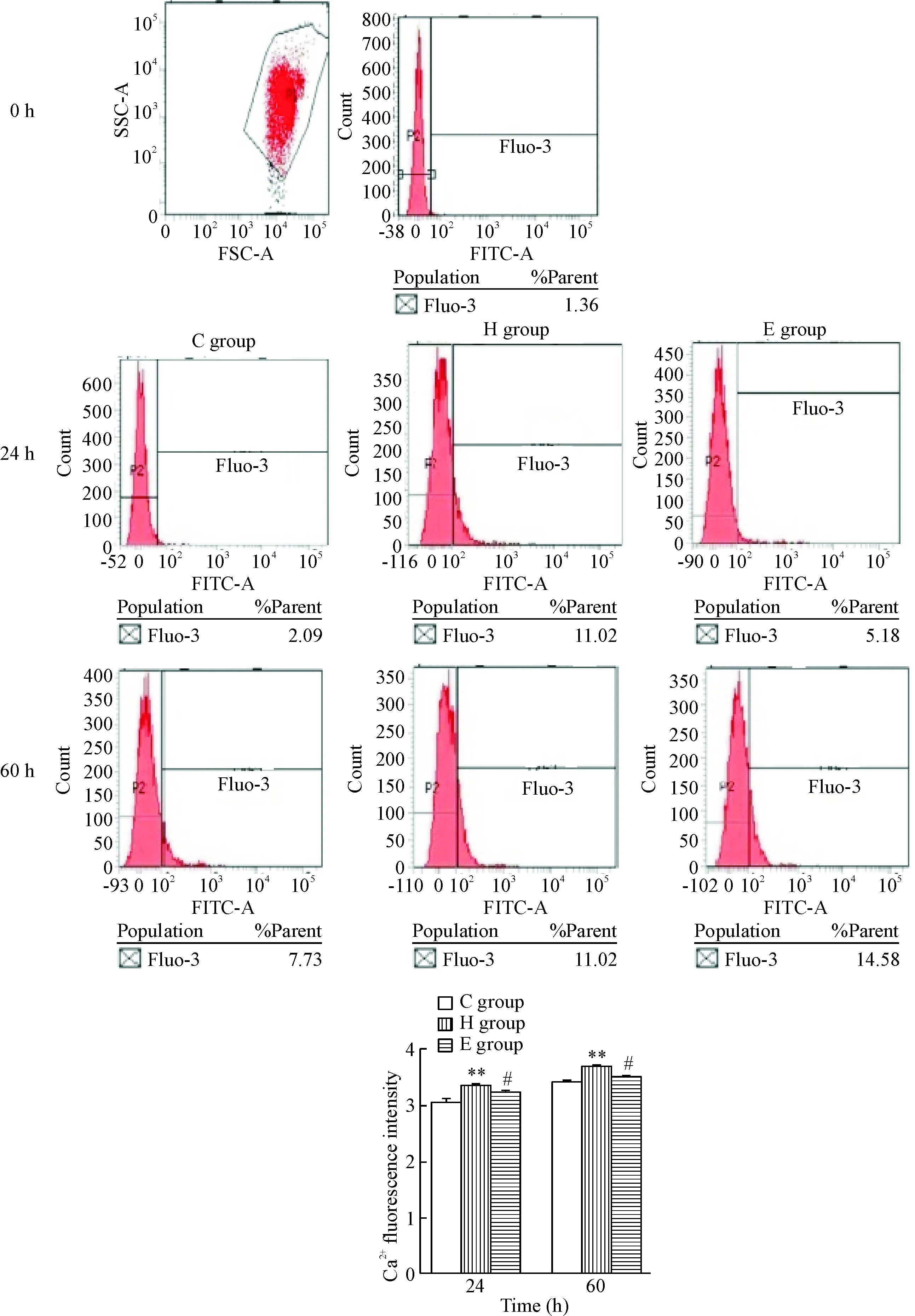
Figure 3. [Ca2+]ilevels in the erythrocytes detected by flow cytometry. Mean±SEM.n=6.**P<0.01vsC group;#P<0.05vsH group.
图3流式细胞术检测红细胞[Ca2+]i水平

表1 在不同观察时点各指标间相关性分析
钙是参与红细胞重要功能调节的重要因素之一[21]。红细胞内钙离子浓度变化与红细胞衰亡具有密切的关系[22]。生理状态下,红细胞通过钙泵使细胞内钙离子浓度维持在较低浓度,各种原因导致了钙泵功能障碍,细胞内钙离子浓度增加,细胞膜骨架结构和脂质双分子层改变,膜脂流动性降低。即红细胞内钙离子浓度增加导致红细胞膜上PS外翻,自身寿命缩短。我们的研究发现,在红细胞衰亡增加的同时,红细胞ROS生成增加,同时红细胞 [Ca2+]i增加,且在不同的观察时点红细胞衰亡率与ROS呈正相关,与红细胞 [Ca2+]i呈正相关。这提示红细胞衰亡不仅与氧化应激产物之间存在直接相关,而且 [Ca2+]i的变化也是红细胞衰亡的直接相关因素。当对含有H2O2的培养液中红细胞进行EPO干预后,红细胞衰亡明显减少,并且伴随着ROS明显减少和 [Ca2+]i明显降低,且各指标相互间存在着显著的相关性。EPO在本实验中体现了抗氧化的药理作用。说明在治疗贫血的过程中,EPO可以作为有效的氧自由基清除剂,通过减少活性氧生成,从而降低 [Ca2+]i,最终发挥了抑制红细胞衰亡,减轻贫血的作用。
综上所述,本研究证实了EPO通过减少红细胞内活性氧保护红细胞对抗氧化应激诱导的衰亡,其作用机制与降低 [Ca2+]i有关。本研究为深入阐明EPO的抗氧化作用和对红细胞的保护作用提供了实验依据。
[1] Paganini EP. Overview of anemia associated with chronic renal disease: primary and secondary mechanisms[J]. Semin Nephrol, 1989, 9(1 Suppl 1):3-8.
[2] Albertazzi A, Di Liberato L, Daniele F, et al. Efficacy and tolerability of recombinant human erythropoietin treatment in pre-dialysis patients: results of a multicenter study[J]. Int J Artif Organs, 1998, 21(1):12-18.
[3] Heeschen C, Aicher A, Lehmann R, et al. Erythropoietin is a potent physiologic stimulus for endothelial progenitor cell mobilization[J]. Blood, 2003, 102(4):1340-1346.
[4] Ugurluer G, Cebi A, Mert H, et al. Neuroprotective effects of erythropoietin against oxidant injury following brain irradiation: an experimental study[J]. Arch Med Sci, 2016, 12(6):1348-1353.
[5] Gradinaru D, Margina D, Ilie M, et al. Correlation between erythropoietin serum levels and erythrocyte susceptibility to lipid peroxidation in elderly with type 2 diabetes[J]. Acta Physiol Hung, 2015, 102(4):400-408.
[6] d’Uscio LV, Santhanam AV, Katusic ZS. Erythropoietin prevents endothelial dysfunction in GTP-cyclohydrolase I-deficient hph1 mice[J]. J Cardiovasc Pharmacol, 2014, 64(6):514-521.
[7] Chen S, Li J, Peng H, et al. Administration of erythropoietin exerts protective effects against glucocorticoid-induced osteonecrosis of the femoral head in rats[J]. Int J Mol Med, 2014, 33(4):840-848.
[8] Kong D, Zhuo L, Gao C, et al. Erythropoietin protects against cisplatin-induced nephrotoxicity by attenuating endoplasmic reticulum stress-induced apoptosis[J]. J Nephrol, 2013, 26(1):219-227.
[9] Tosic Dragovic J, Popovic J, Djuric P, et al. Relative risk for cardiovascular morbidity in hemodialysis patients regarding gene polymorphism for IL-10, IL-6, and TNF[J]. Can J Physiol Pharmacol, 2016, 94(10):1106-1109.
[10] Tonelli M, Karumanchi SA, Thadhani R. Epidemiology and mechanisms of uremia-related cardiovascular disease[J]. Circulation, 2016, 133(5):518-536.
[11] Wu H, Liu X, Jaenisch R, et al. Generation of committed erythroid BFU-E and CFU-E progenitors does not require erythropoietin or the erythropoietin receptor[J]. Cell, 1995, 83(1):59-67.
[12] De Marchi S, Pirisi M, Ferraccioli GF. Erythropoietin and the anemia of chronic diseases[J]. Clin Exp Rheumatol, 1993, 11(4):429-444.
[13] Small DM, Coombes JS, Bennett N, et al. Oxidative stress, anti-oxidant therapies and chronic kidney disease[J]. Nephrology (Carlton), 2012, 17(4):311-321.
[14] 任应国, 唐石磊, 高园林. 白藜芦醇对氧化应激诱导的大鼠海马神经元损伤的影响[J]. 中国病理生理杂志, 2016, 32(6):1057-1061.
[15] Khalil SK, Amer HA, EI Behairy AM, et al. Oxidative stress during erythropoietin hyporesponsiveness anemia at end stage renal disease: molecular and biochemical studies[J]. J Adv Res, 2016, 7(3):348-358.
[16] Eiselt J, Racek J, Opatrny K Jr, et al. Oxidative stress: the effect of erythropoietin and the dialysis membrane[J]. Int J Artif Organs, 2000, 23(1):33-40.
[17] Bissinger R, Artunc F, Qadri SM, et al. Reduced erythrocyte survival in uremic patients under hemodialysis or peritoneal dialysis[J]. Kidney Blood Press Res, 2016, 41(6):966-977.
[18] Qadri SM, Donkor DA, Bhakta V, et al. Phosphatidylserine externalization and procoagulant activation of erythrocytes induced byPseudomonasaeruginosavirulence factor pyocyanin[J]. J Cell Mol Med, 2016, 20(4):710-720.
[19] Gao C, Ji S, Dong W, et al. Indolic uremic solutes enhance procoagulant activity of red blood cells throgh phosphatidylserine exposure and microparticle release[J]. Toxins (Basel), 2015, 7(11):4390-4403.
[20] Bonomini M, Sirolli V, Settefrati N, et al. Increased erythrocyte phosphatidylserine exposure in chronic renal failure[J]. J Am Soc Nephrol, 1999, 10(9):1982-1990.
[21] Downes P, Michell RH. Human erythrocyte membranes exhibit a cooperative calmodulin-dependent Ca2+-ATPase of high calcium sensitivity[J]. Nature, 1981, 290(5803):270-271.
[22] Polak-Jonkisz D, Purzyc L. Ca2+influx versus efflux during eryptosis in uremic erythrocytes[J]. Blood Purif, 2012, 34(3-4):209-210.
(责任编辑: 林白霜, 罗 森)
Erythropoietin inhibits eryptosis induced by reactive oxygen species
SUN Yun, LIU Gang, JIANG Ya-li, ZHANG Bin, ZHAO Xuan, LI Xue-gang
(DepartmentofNephrology,TheSecondHospitalofShandongUniversity,Jinan250033,China.E-mail:gangliu@sdu.edu.cn)
AIM: To observe the influence of erythropoietin (EPO) on eryptosis and production of reactive oxygen species (ROS) in erythrocytes under stimulation of hydrogen peroxide (H2O2),.and to explore its related mechanism.METHODSThe erythrocyte suspension (1%) was culturedinvitroand divided into 3 groups: control group (C group, the culture medium was PBS), H2O2group (H group, the culture medium was PBS containing H2O2at final concentration of 100 μmol/L) and EPO group (E group, the culture medium was PBS containing H2O2at final concentration of 100 μmol/L and EPO at final concentration of 2×104U/L). The erythrocytes were collected at 24 h and 60 h. The eryptosis was detected by flow cytometry with Annexin V staining. The production of ROS and intracellular calcium ion concentration ([Ca2+]i) were also analyzed by flow cytometry.RESULTSThe eryptosis in C group was increased as the incubating time extended. The eryptosis in H group was higher than that in C group (P<0.01), while that in E group was lower than that in H group (P<0.01). Meanwhile, ROS production and [Ca2+]iwere higher in H group than those in C group (P<0.01), but those were lower in E group than those in H group (P<0.05 orP<0.01).CONCLUSIONEPO inhibits eryptosis induced by H2O2and its mechanism may be related to antioxidant effect and change of [Ca2+]i.
Hydrogen peroxide; Eryptosis; Erythropoietin; Reactive oxygen species; Intracellular calcium ion concentration
1000- 4718(2017)11- 2084- 07
2017- 04- 10
2017- 06- 13
山东大学第二医院种子基金资助项目(No. S2015010001);山东省自然科学基金资助项目(No. ZR2014HM045)
△通讯作者 Tel: 0531-85875451; E-mail: gangliu@sdu.edu.cn
R363; R692.5
A
10.3969/j.issn.1000- 4718.2017.11.026

