MiR-152对转化生长因子β1诱导的气管上皮细胞向间质细胞转化的影响
朱融和,孙媛媛,钱燕
(温州医科大学附属第一医院 儿科,浙江 温州 325015)
MiR-152对转化生长因子β1诱导的气管上皮细胞向间质细胞转化的影响
朱融和,孙媛媛,钱燕
(温州医科大学附属第一医院 儿科,浙江 温州 325015)
目的:研究miR-152在转化生长因子β1(TGF-β1)诱导的气管上皮细胞向间质细胞转化(EMT)中的表达情况,探讨miR-152能否影响EMT的发生.方法:用10 ng/mL的TGF-β1诱导人气管上皮16HBE细胞EMT发生,光镜下观察细胞形态变化,qRT-PCR和Western blot检测细胞中EMT相关标志物α平滑肌肌动蛋白(α-SMA)、E-cadherin和Vimentin的改变;qRT-PCR检测有或无TGF-β1处理的16HBE细胞中miR-152的表达情况;通过转染miR-152 mimics和miR-NC至细胞后,再次检测细胞中EMT标志物的表达情况.结果:与对照组比,TGF-β1处理72 h时能引起16HBE细胞发生EMT,细胞形态在72 h改变明显,α-SMA和Vimentin表达增加,E-cadherin表达下降(P<0.01);转染miR-152 mimics,细胞内miR-152的表达显著增加(P<0.01);与miR-NC组比,转染miR-152过表达后,气管上皮细胞中α-SMA和Vimentin的表达降低(P<0.01),E-cadherin表达增加(P<0.01),EMT受到抑制.结论:TGF-β1能诱导离体培养的气管上皮细胞发生EMT;miR-152可以抑制TGF-β1诱导的气管上皮细胞EMT的发生.
哮喘;气管上皮细胞;间质细胞;miR-152
哮喘是最常见的儿科疾病之一,其特征是嗜酸性粒细胞性气道炎症、可逆性气道阻塞、气道高反应性和气道重塑[1].大多数国家的哮喘患病率逐年上升,哮喘的治疗需要花费大量人力、物力和财力[2],但现有的控制哮喘的方式并不令人满意.研究发现气管上皮细胞向间质细胞转化(epithelialmesenchymal transition,EMT)在气道重塑中具有重要的作用[3].转化生长因子β1(transforming growth factor-β1,TGF-β1)是公认的可以诱导EMT的因子,并且有报道称哮喘患者肺组织内TGF-β表达上调[4].因此,本研究采用10 ng/mL的TGF-β1来诱导气管EMT发生.MicroRNA(miRNA)是一种非编码蛋白的小分子RNA,大量研究证实miRNA在儿童哮喘诊断和治疗中的作用[5-7].MiR-152是miR-148/152家族的一员,可作为肿瘤抑制因子参与肿瘤进展.有研究发现miR-152的表达水平与哮喘的疗效相关[8].
本研究通过qRT-PCR发现TGF-β1处理的气管上皮细胞内miR-152的表达水平下降,提示miR-152可能参与TGF-β1诱导的EMT.随后进一步通过转染miR-152 mimics至人气管上皮细胞,研究miR-152在TGF-β1诱导的气管EMT中的作用,以期寻找早期干预哮喘气道重塑的新途径.
1 材料和方法
1.1 材料 人支气管上皮细胞16HBE细胞株购自美国模式培养物集存库(ATCC);TGF-β1抗体购自美国Sigma-Aldrich公司;MEM培养液、胰蛋白酶、1%青链霉素、胎牛血清购于美国Gibco公司;RNA提取试剂、转染试剂脂质体Lipofectamine2000购于美国Invitrogen公司;miR-152 mimics及阴性对照miR-NC、PCR相关引物由上海生工公司设计合成;Takara反转录试剂盒、SYBR Green I荧光染料试剂盒购于大连宝生物公司;兔或鼠抗人E-cadherin、Vimentin、α平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、GAPDH多克隆抗体购自英国Abcam公司;Western blot相关试剂、辣根过氧化酶标记的山羊抗兔或者抗鼠二抗购自江苏碧云天生物技术研究所;倒置显微镜购自日本Olympus公司;ABI 7500 Fast PCR扩增仪购自美国Applied Bio-systems公司.
1.2 方法
1.2.1 细胞培养和转染:人支气管上皮细胞16HBE在含有10%胎牛血清和1%青链霉素的MEM培养液中培养,常规置于37 ℃、5% CO2环境下生长.细胞融合至90%左右时常规传代.配置10 ng/mL的TGF-β1的溶液并无菌处理,细胞在接受药物处理前先用无血清培养液饥饿处理24 h.在倒置显微镜下(200倍)观察不同时间TGF-β1处理后细胞的形态学变化.miR-152 mimics转染按照Invitrogen公司提供的转染说明书,应用Lipofectamine2000进行转染.
1.2.2 实验分组:细胞分为无TGF-β1处理组(对照组)、TGF-β1处理24 h组、48 h组和72 h组;在miR-152 mimics转染支气管上皮细胞后,将细胞分为TGF-β1处理48 h组、TGF-β1+miR-NC组和TGF-β1+miR-152 mimics组.
1.2.3 qRT-PCR检测基因表达:用苯酚氯仿抽提法提取各组细胞中的总RNA,在NanoDrop2000紫外分光光度计测定A260 mm、A280 mm及RNA浓度.按照说明书将总RNA反转录成cDNA,反应体系为20 μL,反应条件为:16 ℃(30 min),45 ℃(30 min),80 ℃(5 min).随后,以U6和GAPDH为内参基因,运用SYBR Green I法在ABI 7500 Fast PCR扩增仪上检测目的基因的表达情况,反应条件为:预变性94 ℃(5 min),变性94 ℃(30 s),退火60 ℃(30 s),延伸72 ℃(60 s),扩增40个循环;最后72 ℃延伸8 min.每组样品重复3次.目的基因的相对表达量采用2-ΔΔCt法计算.各引物序列见表1.

表1 qRT-PCR相关引物序列
1.2.4 Western blot检测蛋白表达量:提取各组细胞总蛋白,用BCA法定量蛋白,SDS-PAGE每孔加入20 μL的样品进行蛋白电泳,随后用孔径0.45 μm的PVDF膜行转膜.常温下TBST洗膜3次、封闭1 h,孵育α-SMA抗体(1:1 000)、E-cadherin(1:500)、Vimentin(1:2 000)和GAPDH(1:5 000),4 ℃过夜,常温下TBST洗膜3次,再加入辣根过氧化物酶标记羊抗兔(鼠)二抗孵育2 h,ECL化学发光法显影;柯达胶片暗室显影,Quantity One 4.0软件计算蛋白条带灰度值.蛋白表达强度以各条带灰度值/GAPDH灰度值表示.
1.3 统计学处理方法 采用SPSS20.0和GraphPad Prism 5.5软件进行统计分析.计量资料以表示,多组比较采用单因素方差分析和SNK-q检验.P<0.05为差异有统计学意义.
2 结果
2.1 TGF-β1刺激对气管EMT的影响 对照组16HBE细胞分布呈铺石路样,形态成椭圆形或者是多边,细胞间存在连接(见图1A);TGF-β1 24 h组细胞形态改变不大(见图1B),TGF-β1 72 h组细胞形态变为长梭形,并且细胞间隙较大(见图1C).qRT-PCR检测结果表明,与对照组比,TGF-β1 24 h组α-SMA和Vimentin mRNA开始增加,TGF-β1 72 h组α-SMA和Vimentin mRNA明显升高,E-cadherin mRNA下降(P<0.01),见表2.Western blot发现16HBE细胞内α-SMA、Vimentin和E-cadherin蛋白的表达量在TGF-β1刺激后呈现出和相应的mRNA改变相同的趋势(P<0.01),见图2.
2.2 TGF-β1刺激气管上皮细胞后miR-152的改变采用qRT-PCR发现10 ng/mL的TGF-β1处理16HBE细胞后,细胞内miR-152的表达量呈下降趋势,在24 h开始下降(P<0.01),72 h和24 h比差异无统计学意义(P>0.05),见表2.

图1 TGF-β1刺激对气管上皮细胞形态学的影响(X200)
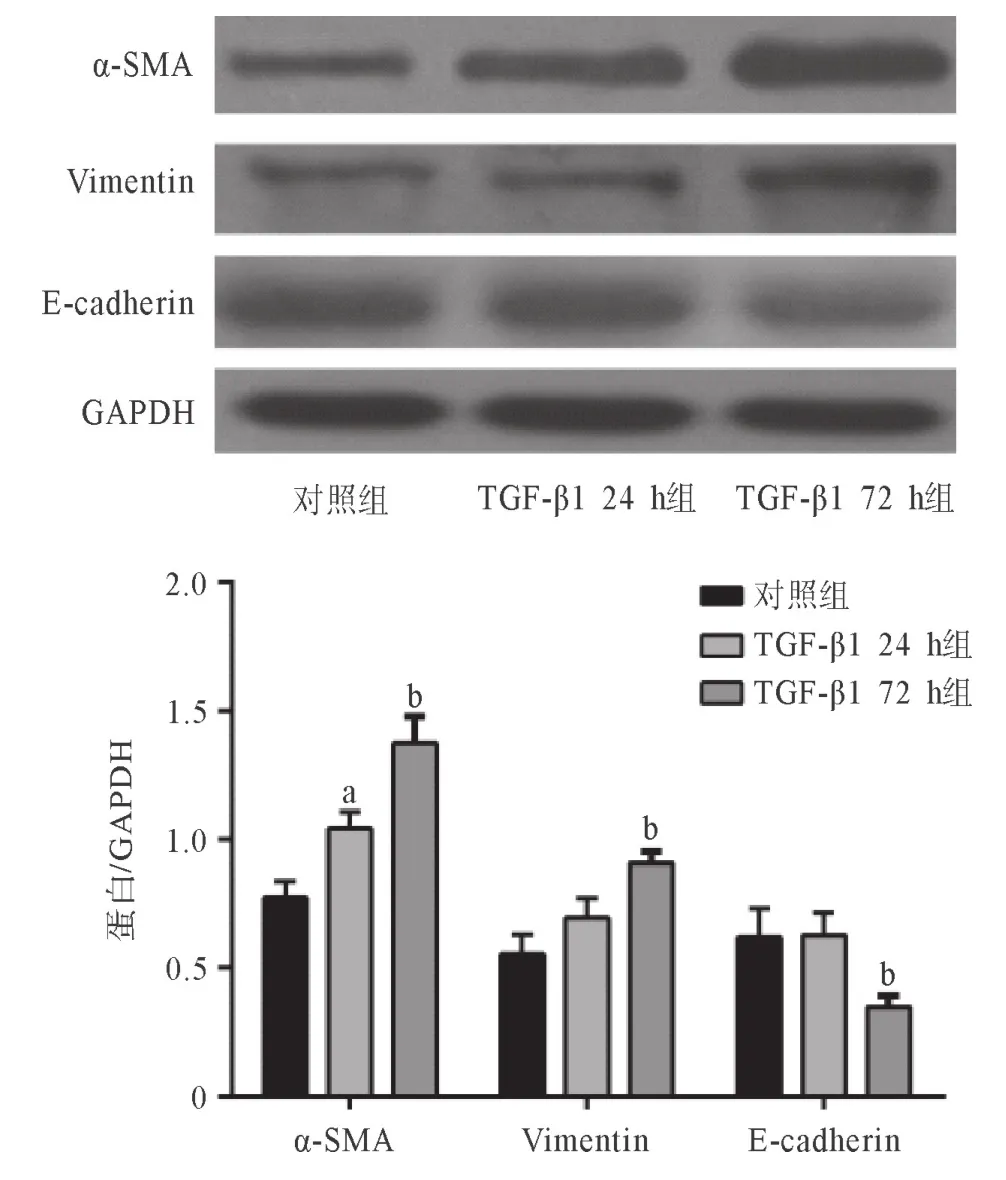
图2 TGF-β1刺激对气管EMT相关蛋白的改变
2.3 miR-152对气管EMT的影响 转染miR-152 mimics后,对照组、TGF-β1组、TGF-β1+miR-NC组和TGF-β1+miR-152 mimics组16HBE细胞内miR-152的2-△△CT值分别为1.03±0.13,0.62±0.06,0.67±0.10和31.70±1.31(P<0.01).qRT-PCR结果显示,TGF-β1、TGF-β1+miR-NC和TGF-β1+miR-152 mimics组EMT标志蛋白存在明显差异;与TGF-β1+miR-NC组比,TGF-β1+miR-152 mimics组α-SMA和Vimentin mRNA下降,而E-cadherin mRNA表达升高(均P<0.01),见表3.Western blot检测发现,与TGF-β1组比,TGF-β1+miR-152 mimics组细胞中α-SMA和Vimentin蛋白表达减少,但E-cadherin蛋白表达增加(P<0.01),见图3.
3 讨论
目前治疗哮喘的有关药物,包括糖皮质激素、白三烯拮抗剂以及长效β2受体激动剂,对阻止或逆转气道重塑的作用非常有限[9].气道重塑的始动因素为气管内免疫细胞分泌炎症介质,包括TGF-β、肿瘤坏死因子α和白介素等[10].有研究认为由于儿童时期肺组织生长迅速,气道重塑很可能在儿童哮喘患者中已经发生[11].气管EMT在哮喘相关的气道重塑中具有重要作用,抑制EMT可以有效阻止气道重塑的进展[12].气管上皮细胞可以通过EMT向肌成纤维细胞转变,引起细胞收缩能力增加和气道的高反应性[3].EMT过程主要表现为气管上皮细胞间连接缺失,变得松散;细胞极性消失;细胞形态由椭圆形向梭形转变;上皮细胞标志物细胞角蛋白、紧密连接蛋白和E-cadherin下降,而间质细胞标志物Vimentin和N-cadherin表达升高;肌成纤维细胞相关蛋白α-SMA、成纤维细胞特异性蛋白Collagen等表达增加[13].TGF-β已被证实可以诱导内皮细胞EMT,是目前最常用的用来诱导EMT的药物,因此本研究采用10 ng/mL的TGF-β1来诱导离体培养的气管上皮16HBE发生EMT[14].
表2 TGF-β1刺激后α-SMA、Vimentin,E-cadherin mRNA和miR-152的改变(n=3,

表2 TGF-β1刺激后α-SMA、Vimentin,E-cadherin mRNA和miR-152的改变(n=3,
与对照组比:aP<0.01;与TGF-β1 24 h组比:bP<0.01
组别 α-SMA Vimentin E-cadherin miR-152对照组 0.99±0.09 0.96±0.04 0.98±0.14 1.09±0.11 TGF-β1 24 h组 1.35±0.13a 1.24±0.08a 0.81±0.09a 0.69±0.06a TGF-β1 72 h组 1.91±0.08b 1.55±0.14b 0.55±0.10b 0.52±0.09 F 36.78 87.96 36.40 24.61 P<0.001 <0.001 <0.001 0.0013
表3 MiR-152过表达对TGF-β1诱导的16HBE细胞EMT相关基因的影响(n=3,

表3 MiR-152过表达对TGF-β1诱导的16HBE细胞EMT相关基因的影响(n=3,
与TGF-β1+miR-NC组比:aP<0.01
组别 α-SMA Vimentin E-cadherin TGF-β1组 1.79±0.12 1.48±0.17 0.62±0.06 TGF-β1+miR-NC组 1.75±0.16 1.39±0.14 0.65±0.11 TGF-β1+miR-152 mimics组 0.96±0.08a 1.01±0.05a 0.95±0.06a F 39.32 137.43 26.44 P<0.001 <0.001 0.0019

图3 MiR-152过表达对TGF-β1诱导的16HBE细胞EMT相关蛋白的影响
TGF-β1处理16HBE细胞24 h和48 h,通过细胞大体形态、EMT标志物mRNA和蛋白的改变等综合表现,验证了10 ng/mL TGF-β1诱导实验细胞EMT的有效性.哮喘患者气管上皮细胞内miRNAs表达存在异常,提示其可能参与上皮细胞异常介导的哮喘病理生理机制[15].因此,我们检测TGF-β1处理的细胞内miR-152的表达情况,意外发现其表达下降,在设置时间梯度后发现miR-152在TGF-β1处理24 h后下降明显,而72 h表达量与前者差异无统计学意义.鉴于大量研究发现miRNA在内皮细胞EMT中的作用[16-17],我们猜测miR-152也参与了TGF-β1诱导的气管EMT.
研究表明miR-152作为一个抑癌因子参与肿瘤的发生发展[18],但是对于其在哮喘中的作用的研究却寥寥无几.2015年,NAIDOO等[8]在他汀类药物改善哮喘的机制研究中,使用辛伐他汀处理B淋巴母细胞永生细胞株,检测miR-152家族(包括miR-148a、miR-148b和miR-152)的表达变化,发现miR-152表达明显升高,并且上调的miR-152能靶向结合HLA-G的3'-UTR,引起其降解,从而改善肺功能.为了探讨miR-152是否参与哮喘的气道重塑,我们通过miRNA模拟物转染提高细胞内miR-152的表达量,结果发现miR-152过表达可以抑制TGF-β1诱导的16HBE细胞的EMT.并且miR-152过表达不仅逆转EMT相关蛋白,同时对EMT相关标志物转录层面产生影响,这提示miR-152很可能通过作用于某个靶基因从而调节这些相关基因的转录.因此,在后续实验中我们将进一步寻找miR-152作用的可能潜在靶点,深入探讨miR-152在TGF-β1诱导气管上皮细胞EMT中的作用,并通过动物实验进一步证实miR-152参与哮喘的气道重塑.
综上所述,本研究通过细胞实验发现miR-152介导TGF-β1诱导的气管EMT,为抑制EMT相关的哮喘气道重塑治疗提供新的思路.
[1] TANG M L, POWELL C V. Childhood asthma as an allergic disease: rationale for the development of future treatment[J]. Eur J Pediatr, 2001, 160(12): 696-704.
[2] BRAMAN S S. The global burden of asthma[J]. Chest, 2006,130(1 Suppl): 4s-12s.
[3] JOHNSON J R, NISHIOKA M, CHAKIR J, et al. IL-22 contributes to TGF-beta1-mediated epithelial-mesenchymal transition in asthmatic bronchial epithelial cells[J]. Respir Res, 2013, 14:118.
[4] TORREGO A, HEW M, OATES T, et al. Expression and activation of TGF-beta isoforms in acute allergen-induced remodelling in asthma[J]. Thorax, 2007, 62(4): 307-313.
[5] ELBEHIDY R M, YOUSSEF D M, EL-SHAL A S, et al.MicroRNA-21 as a novel biomarker in diagnosis and response to therapy in asthmatic children[J]. Mol Immunol,2016, 71: 107-114.
[6] MIDYAT L, GULEN F, KARACA E, et al. MicroRNA expression profiling in children with different asthma phenotypes[J]. Pediatr Pulmonol, 2016, 51(6): 582-587.
[7] LIU F, QIN H B, XU B, et al. Profiling of miRNAs in pediatric asthma: Upregulation of miRNA-221 and miRNA-485-3p[J]. Mol Med Rep, 2012, 6(5): 1178-1182.
[8] NAIDOO D, WU A C, BRILLIANT M H, et al. A polymorphism in HLA-G modifies statin benefit in asthma[J]. Pharmacogenomics J, 2015, 15(3): 272-277.
[9] BERAIR R, BRIGHTLING C E. Asthma therapy and its effect on airway remodelling[J]. Drugs, 2014, 74(12): 1345-1369.
[10] LAMBRECHT B N, HAMMAD H. The airway epithelium in asthma[J]. Nat Med, 2012, 18(5): 684-692.
[11] BOXALL C, HOLGATE S T, DAVIES D E. The contribution of transforming growth factor-beta and epidermal growth factor signalling to airway remodelling in chronic asthma[J]. Eur Respir J, 2006, 27(1): 208-229.
[12] CHENG M, LIU F, PENG Y, et al. Construction of a CTGF and RFP-coexpressed renal tubular epithelial cell and its application on evaluation of CTGF-specific siRNAs on epithelial-mesenchymal transition[J]. Urology, 2014, 83(6): 1443.e1-8.
[13] YOU J, WANG J, XIE L, et al. D-4F, an apolipoprotein A-I mimetic, inhibits TGF-beta1 induced epithelial-mesenchymal transition in human alveolar epithelial cell[J]. Exp Toxicol Pathol, 2016, 68(9): 533-541.
[14] CHU S, ZHANG X, SUN Y, et al. Atrial natriuretic peptide:A novel mediator for TGF-β1-induced epithelial-mesenchymal transition in 16HBE-14o and A549 cells[J]. Peptides,2017, 90: 1-9.
[15] SOLBERG O D, OSTRIN E J, LOVE M I, et al. Airway epithelial miRNA expression is altered in asthma[J]. Am J Respir Crit Care Med, 2012, 186(10): 965-974.
[16] HONG J P, LI X M, LI M X, et al. VEGF suppresses epithelial-mesenchymal transition by inhibiting the expression of Smad3 and miR192, a Smad3-dependent microRNA[J]. Int J Mol Med, 2013, 31(6): 1436-1442.
[17] HAJ-SALEM I, FAKHFAKH R, BERUBE J C, et al. MicroRNA-19a enhances proliferation of bronchial epithelial cells by targeting TGFbetaR2 gene in severe asthma[J]. Allergy, 2015, 70(2): 212-219.
[18] LIU X, LI J, QIN F, et al. miR-152 as a tumor suppressor microRNA: Target recognition and regulation in cancer[J].Oncol Lett, 2016, 11(6): 3911-3916.
(本文编辑:赵翠翠)
The effects of miR-152 on transforming growth factor-beta1-mediated epithelial-mesenchymal transition in human bronchial epithelial cells
ZHU Ronghe, SUN Yuanyuan, QIAN Yan.
Department of Pediatrics, the First Affiliated Hospital of Wenzhou Medical University, Wenzhou, 325015
Objective:To verify whether transforming growth factor-beta1 (TGF-β1) could induce epithelial-mesenchymal transition (EMT) in vitro and to determine the role of miR-152 in TGF-β1-mediated EMT in bronchial epithelial cells.Methods:10 ng/mL of TGF-β1 was used to induce the EMT of human bronchial epithelial cells 16HBE. Morphological changes were observed and qRT-PCR and Western blot were employed to test the alteration of αSMA, E-cadherin and Vimentin, thus to verify the occurrence of EMT. qRT-PCR was then used to test the expression profile of miR-152 in TGF-β1 treated 16HBE cells. After miR-152 was successfully transfected into 16HBE cells, EMT related markers were then detected using qRT-PCR and Western blot.Results:Compared with control group, TGF-β1-treated cells presented a myofibroblast-like morphology,especially at 72 h, characteristic by the loss of cell-to-cell junction, denovo expression of α-SMA and Vimentin,and loss of epithelial marker E-cadherin (P<0.01). The expression levels of miR-152 in TGF-β1 treated 16HBE cells were dramatically increased after transfected with miR-152 mimics (P<0.01). Compared with the control group, α-SMA and Vimentin were decreased, whereas E-cadherin was increased in the miR-152 group (P<0.01),suggesting overexpression of miR-152 could reverse the EMT induced by TGF-β1 in 16HBE cells.Conclusion:TGF-β1 induces EMT of human bronchial epithelial cells in vitro; miR-152 inhibits TGF-β1-mediated EMT in 16HBE cells.
asthma; bronchial epithelial cells; mesenchymal cells; miR-152
R725.6
A
10.3969/j.issn.2095-9400.2017.10.008
2017-04-13
温州市科技计划项目(2014Y0143).
朱融和(1985-),女,浙江温州人,住院医师,硕士.
钱燕,主任医师,硕士生导师,Email:qianyan_paw@163.com.

