碱性成纤维细胞生长因子对大鼠II度烧伤伤口的促愈合作用
林蓓蓓,郁引飞
(温州医科大学附属眼视光医院 药剂科,浙江 温州 325027)
碱性成纤维细胞生长因子对大鼠II度烧伤伤口的促愈合作用
林蓓蓓,郁引飞
(温州医科大学附属眼视光医院 药剂科,浙江 温州 325027)
目的:通过碱性成纤维细胞生长因子(bFGF)在大鼠Ⅱ度烧伤伤口中的局部应用,观察其对烧伤伤口愈合和烧伤创面愈合各个阶段中相关因子的作用.方法:10%水合氯醛(3.5 mL/kg)腹腔注射麻醉大鼠.采用同体对照的方法,用砝码在其背部以脊柱为对称轴,做2个直径为2 cm的烧伤创面,2个创面间距>1.5 cm.右边伤口给予不同浓度的bFGF,左边伤口给予等体积的0.9%氯化钠溶液为对照.随机分成3组,每组15只,分别给予125、500和2 000 ng bFGF.隔天给药1次至第14天.在造模后3 d、7 d、14 d、21 d和28 d处死大鼠,并取下伤口组织进行包埋切片.采用Masson染色法检测组织中胶原的产生,并用免疫组织化学法检测组织中巨噬细胞标记蛋白(CD68)、基质金属蛋白酶2(MMP-2)、增殖细胞核抗原(PCNA)和转化生长因子β1(TGF-β1)的表达.结果:伤口愈合率统计显示bFGF可以促进大鼠皮肤烧伤伤口愈合.Masson染色显示bFGF可以促进伤口肉芽组织形成和胶原产生.免疫组织化学结果显示bFGF可以调节伤口中CD68、MMP-2、PCNA和TGF-β1的表达.结论:bFGF可以调节伤口中CD68、MMP-2、PCNA和TGF-β1的表达从而促使大鼠II度烧伤伤口愈合.
碱性成纤维细胞生长因子;II度烧伤;伤口愈合;大鼠
在所有的损伤中,烧伤被认为是引起年轻群体死亡率上升的主要原因之一.然而,到目前为止,除了皮肤的自体移植,几乎不存在有效方法帮助大面积的烧伤伤口愈合.
伤口愈合的早期阶段以炎症为主,之后伤口慢慢修复与重塑[1].这个过程需要各种组织和各细胞间相互合作,包括炎症细胞、成纤维细胞、角质细胞、内皮细胞和巨噬细胞等.这些细胞受到细胞因子、生长因子和细胞外基质(extracellular matrix,ECM)分子的调节[2].伤口部位的炎症细胞、角质细胞和成纤维细胞会产生和释放各种生长因子[3].研究表明,局部应用外源性生长因子和细胞因子可以加速急性和慢性伤口的修复[4].
碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)是生长因子家族的成员之一,它可以诱导DNA的合成和血管新生,刺激ECM的合成,降低I型胶原的合成[5].研究表明,bFGF应用到皮肤伤口可以促进皮肤急慢性伤口的愈合[6].此外,bFGF基因敲除小鼠皮肤伤口愈合非常缓慢[7],这些研究都表明,bFGF在伤口愈合中起关键性作用.但是关于bFGF对促进烧伤的愈合作用的相关机制研究较少.本研究检测了bFGF在大鼠皮肤烧伤中的作用,并进一步探索了bFGF在伤口愈合各个阶段中可能影响的促愈合相关蛋白的表达.
1 材料与方法
1.1 模型建立 清洁级雌性SD大鼠,体质量200~220 g,由上海斯莱克实验动物中心提供,动物生产许可证号:SCXK(浙)2012-0028.参照文献[8]报道的方法构建大鼠II度烧伤模型,用8%的水合氯醛腹腔注射麻醉,固定于简易操作台,剪去背部毛发,用碘伏对背部皮肤进行消毒.将在热水浴中加热的砝码在其背部以脊柱为对称轴,做2个相距1.5 cm以上直径2 cm的伤口.右边伤口给予bFGF,左边给予等量的0.9%氯化钠溶液.
1.2 分组 对照组:n=45,0.9%氯化钠溶液0.5 mL;实验组(bFGF混合0.9%氯化钠溶液稀释至0.5 mL):高剂量组,n=15,bFGF浓度为4 000 ng/mL;中剂量组,n=15,bFGF浓度为1 000 ng/mL;低剂量组,n=15,bFGF浓度为250 ng/mL;
1.3 给药途径及治疗时间 给药方法:伤口涂抹0.5 mL的bFGF或0.9%氯化钠溶液后,无菌纱布包扎伤口,隔天换药至14 d.
1.5 伤口愈合评价 分别于21 d和28 d量取伤口未愈合面积(用透明的纸画下伤口面积,再将画下的面积复印到坐标纸上,数格计算出面积),计算比较伤口愈合率.伤口愈合率(%)=(开始时伤口面积-取材日伤口面积)/开始时伤口面积X100%[8].
1.6 病理学评价 分别在造模后3、7、14、21、28 d取bFGF与相应的0.9%氯化钠溶液的组织块,每个时间点取3只大鼠,进行石蜡包埋,切片.进行Masson染色,光镜观察;免疫组织化学染色方法分别检测巨噬细胞标记蛋白(CD68)、基质金属蛋白酶2(matrix metalloproteinase 2,MMP-2)、增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)和转化生长因子β1(transforming growth factor-β1,TGF-β1)蛋白表达量.切片脱蜡脱水,高压抗原修复,山羊血清封闭,37 ℃孵育30 min,分别滴加鼠抗CD68(1:100稀释)、鼠抗PCNA(1:100稀释)、兔抗MMP-2(1:100稀释)、兔抗TGF-β1(1:100稀释),4 ℃过夜,37 ℃复温30 min,滴加山羊抗兔FITC IgG(H+L)(1:200稀释)、羊抗兔IgG-HRP(1:200稀释)、羊抗鼠IgG-HRP(1:200稀释),37 ℃孵育120 min,PBS溶液冲洗,DAB显色,脱水,树胶封片,显微镜观察.每张切片随机选3个高倍视野观察相应的阳性细胞分布.判断标准:显微镜下观察并计数阳性细胞数,镜下胞质或胞核中有棕黄色颗粒者为阳性细胞,无棕黄色颗粒者为阴性.
1.7 统计学处理方法 所有数据均采用Graphpad prism统计软件分析.计量资料以表示,伤口愈合率结果采用配对t检验,各实验组间愈合率比较采用单因素方差分析,免疫组织化学结果分析采用秩和检验.P<0.05为差异有统计学意义.
2 结果
2.1 bFGF促进大鼠烧伤伤口愈合 在大鼠伤口部位放上比初始伤口面积稍大的由硬纸板剪成的正方形框,拍摄照片并进行图像分析,如图1所示,在21 d和28 d时,对照组的愈合率分别为65.19%±3.34%、88.77%±1.69%,实验组的愈合率:低剂量组分别为84.79%±2.43%、97.53%±0.69%,中剂量组分别为86.31%±2.19%、97.68%±0.94%,高剂量组分别是81.34%±2.81%、96.99%±1.17%,给予bFGF治疗的伤口的愈合速度明显比对照组的伤口愈合速度快(P<0.05).中剂量促伤口愈合效果相对较好,但是各实验组之间差异无统计学意义(P>0.05),所以在后面的病理分析中选择低剂量组作为实验组.

图1 4组创面在0、21、28 d的伤口愈合情况
2.2 Masson染色结果 Masson染色可将组织中胶原纤维染成绿色,如图2所示,在3 d时所有组别的皮肤上皮都深染坏死,层次增厚,表面有血痂,上皮下真皮纤维变性;与对照组比,实验组的真皮变性更加严重,并有空泡样的变性;在7、14 d时,实验组的真皮纤维比对照组有更多的水肿坏死,结构破坏,毛囊及腺体坏死变性固缩,并且坏死的组织也开始被清除;在21 d时,表面血痂剥脱,坏死组织被清除,组织重塑,胶原生成,实验组的皮肤胶原排列更加清晰,有新生血管形成;在28 d时,对照组的胶原纤维排列紊乱,而实验组的胶原排列致密清晰.
2.3 bFGF调节伤口中CD68的表达水平 在清除坏死组织的早期(3、7、14 d时),实验组中CD68表达量明显高于对照组(P<0.05);在组织的重塑后期(21 d时),实验组的CD68表达量低于对照组(P<0.05),见图3.

图2 造模后不同时间点的伤口组织切片Masson染色(X400)
2.4 bFGF影响伤口中TGF-β1的水平 实验组在给药14 d、21 d后,TGF-β1的表达量高于对照组(P<0.05),而28 d时TGF-β1的表达量下降(P<0.05),见图4.


图3 bFGF对伤口中CD68表达的影响
2.5 bFGF对伤口中PCNA水平的影响 在7、14和21 d时,实验组PCNA蛋白表达水平明显高于对照组(P<0.05);在28 d时实验组与对照组的PCNA蛋白表达量差异无统计学意义(P>0.05),见图5.
2.6 bFGF影响伤口中MMP-2的水平 MMP-2在创面愈合早期(14 d)表达较高,并且实验组表达要高于对照组(P<0.05).而在21 d和28 d时,MMP-2的表达逐渐降低,但实验组表达仍要高于对照组(P<0.05),见图6.
一旦自动制动手柄放置在此位置,列车管迅速减压到零,均衡风缸以常用制动速率减压到零,16CP模块响应列车管减压变化,迅速给作用管(16#管)充风到最大允许压力,BCCP模块响应作用管压力增加,给机车制动缸充风产生紧急制动作用;同时车辆副风缸给车辆制动缸充风,车辆制动机制动。
3 讨论
bFGF作为一种重要的促有丝分裂原,能够促进组织修复,诱导细胞外基质沉积,刺激结缔组织增生,加速上皮细胞移行增殖,现已证明许多生长因子在创面修复中具有重要作用[9-10],且已有用含bFGF的人造真皮用于烧伤创面修复等[11].然而,bFGF在大鼠II度烧伤伤口愈合的作用及其分子机制还未见报道.为此,我们构建了大鼠烧伤模型,考察不同剂量的bFGF对于伤口愈合的作用,并设置给予0.9%氯化钠溶液的空白对照组.在证实bFGF促创伤愈合的作用基础之上,采用Masson染色和免疫组织化学分析证实bFGF通过促进创伤中胶原蛋白的形成和炎症反应从而加速了这一烧伤愈合的过程.
烧伤伤口愈合是个复杂的过程.烧伤伤口中的一些印迹激活炎症细胞,而这些炎症细胞一旦激活,会释放炎症因子,并结合生长因子试图去清除引起伤口损伤的介质.随后,细胞因子和生长因子开始修复由于烧伤摧毁的表皮,使皮肤再上皮化,并触发受伤真皮层中的成纤维细胞增殖[12].炎症反应主要是清除受损的组织碎片.中性白细胞和巨噬细胞中的溶酶体,活性氧的代谢物,花生四烯酸类代谢物像白三烯类和前列腺素类在炎症过程中起着非常重要的作用.这些炎症介质也有能力引起内皮损伤和组织损伤,它们可能会加剧烧伤部位的损害[12].烧伤伤口愈合的另一个过程是血管新生,肉芽组织生成,细胞外基质蛋白合成,胶原蛋白存储和组织重塑.


图4 bFGF对伤口中TGF-β1表达的影响
研究表明,bFGF可以作用于巨噬细胞并促进巨噬细胞表达促重塑因子TGF-β1[13].外源性应用bFGF能够通过提高TGF-β1的分泌,进而协同其他生长因子对肌成纤维细胞形成和凋亡发挥作用,最终影响愈合的结局[14].通过CD68免疫组织化学染色表明,经bFGF治疗后显著的增加了烧伤修复早期3 d、7 d和14 d的巨噬细胞标记蛋白CD68.这表明在创伤修复炎症阶段早期,bFGF可以趋化炎症细胞像伤口部位聚集.而在烧伤修复后期bFGF治疗组的减少,这也表明炎症得到了控制,可以进入烧伤修复的下一阶段.再将组织切片进行TGF-β1免疫组织化学染色,创面14 d和21 d时,实验组TGF-β1的表达较对照组高.TGF-β1可以引起成纤维细胞中胶原的合成[15].这一结果意味着bFGF是通过增加伤口部位的TGF-β1的合成从而促进了胶原的产生.在体内不同微环境的影响下,巨噬细胞可以被极化为经典活化的M1型巨噬细胞或选择性活化的M2型巨噬细胞[16].M1型巨噬细胞在IFN-α、TNF-γ的诱导下生成,可分泌IL-1、IL-2等促进炎性细胞因子和趋化因子,参与杀伤病原体微生物,导致机体组织炎症和免疫损伤;而M2型巨噬细胞在IL-4、IL-13的诱导下生成,可分泌IL-10、TGF-β等抗炎性细胞因子,具有限制炎症反应、参与组织修复重塑的作用.在我们的研究中,伤口经bFGF治疗后早期炎症增加,可能这个时期的M1型巨噬细胞多,利于清除坏死细胞和组织,而在14 d、21 d时,实验组中TGF-β1表达较高,可能实验组中M1型巨噬细胞较早地进行M2型的转化,促进TGF-β1分泌有利于组织修复.所以,我们的研究表明bFGF可以适当的平衡巨噬细胞M1/M2亚型转化对于调节反应及加速损伤修复再生具有重要意义.
经研究发现,PCNA与细胞DNA合成关切,在细胞增殖过程中起重要调控作用.最近研究报道,PCNA亦可参与许多其他细胞重要活动,如细胞周期调控、细胞DNA损伤修复、细胞凋亡、染色体重组及DNA甲基化等.通过PCNA的免疫组化染色表明bFGF显著增加了伤口部位细胞增殖.有研究表明,PCNA、α-SMA以及IL-1α和胎儿皮肤创伤后无瘢痕愈合可能相关[17].并且,PCNA表达变化趋势和血浆IL-1α含量的变化趋势基本一致,都是先升后下降的过程,说明PCNA蛋白和IL-1α存在相关性[18].本研究结果与上述研究结果一致,PCNA和巨噬细胞的含量变化趋势一致.
MMPs是一组由效应细胞分泌、参与细胞外基质降解的蛋白酶,影响组织修复、重塑和瘢痕形成[19].MMPs是创伤早期清除坏死组织的重要物质,也是上皮细胞迁移覆盖创面所必需的.随着修复进程的延续,在组织愈合后期,MMPs主要定位于皮肤基底膜、血管内皮细胞和创伤深部皮肤附件上皮细胞中,另外成纤维细胞中也有表达[20].创面外用bFGF治疗14 d,21 d和28 d后,MMP-2的表达高于对照组.这表明bFGF可以促进MMP-2的表达,有利于坏死组织的及时清除,角质形成细胞迁移.综上所述,TGF-β1、PCNA和MMP-2的表达都与炎症因子存在着相关性,炎症阶段是伤口愈合的基础,为肉芽组织的形成和组织重塑做准备.


图5 bFGF对伤口中PCNA表达的影响
在本研究中,我们证明了bFGF可以促进烧伤创面的愈合.bFGF通过调节皮肤伤口中CD68、TGF-β1、PCNA和MMP-2的表达从而加速伤口再上皮化、肉芽组织的形成和胶原的产生.在以往关于bFGF对烧伤创面愈合的研究并不少.但在我们的研究中首次对烧伤创面愈合各个阶段中的相关因子进行了全面的研究.在今后的研究中我们还可以通多细胞层面对这几个蛋白的相关性作出更确切的研究.bFGF在临床上应用还需要大量的实验研究,例如最佳给药剂量、给药的时间间隔、治疗窗口和bFGF与其他因子在伤口中的协同作用等,这些都需要被进一步的探讨研究.
[1] NAKAJIMA Y, NAKANO Y, FUWANO S, et al. Effects of three types of Japanese honey on full-thickness wound in mice[J]. Evid Based Complement Alternat Med, 2013, 20(13): 504-537.
[2] SCHULTZ G S, DAVIDSON J M, KIRSNER R S, et al. Dynamic reciprocity in the wound microenvironmen[J]. Wound Repair Regen, 2011, 19(2): 134-148.
[3] LI J, CHEN J, KIRSNER R. Pathophysiology of acute wound healing[J]. Clin Dermatol, 2007, 25(1): 9-18.
[4] BRAUND R, HOOK S, MEDLICOTT N J. The role of topical growth factors in chronic wounds[J]. Curr Drug Deliv,2007, 4(3): 195-204.
[5] YANG S L, HAN R, LIU Y, et al. Negative pressure wound therapy is associated with up-regulation of bFGF and ERK1/2 in human diabetic foot wounds[J]. Wound Repair Regen,2014, 22(4): 548-554.
[6] WU J, ZHU J, HE C, et al. Comparative study of heparinpoloxamer hydrogel modified bFGF and aFGF for in vivo wound healing efficiency[J]. ACS Appl Mater Interfaces,2016, 8(29): 18710-18721.
[7] AKITA S, AKION K, HIRANO A. Basic fibroblast growth factor in scarless wound healing[J]. Adv Wound Care (New Rochelle), 2013, 2(2): 44-49.
[8] MEENA K, MOHAN A V, SHARATH B, et al. Effect of topical phenytoin on burn wound healing in rats[J]. Indian J Exp Biol, 2011, 49: 56-59.
[9] JOAO E C, CAMPOS A C, JOAO F D, et al. The influence of growth factors on skin wound healing in rats[J]. Braz J Otorhinolaryngol, 2016, 82(5): 512-521.
[10] WALMSLEY G G, MAAN Z N, WONG V W, et al. Scarless wound healing: chasing the holy grail[J]. Plast Reconstr Surg, 2015, 135(3): 907-917.
[11] 付小兵, 程飚, 盛志勇. 有关创伤修复与组织再生的现代认识[J]. 中国危重病急救医学, 2002, 14(2): 67-68.
[12] FERRARA N, GERBER H P, LECOUTER J. The biology of VEGF and its receptors[J]. Nat Med, 2003, 9(5): 669-676.

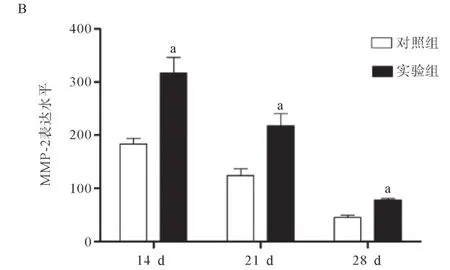
图6 bFGF对伤口中MMP-2表达的影响
[13] YUM H Y, CHO J Y, MILLER M, et al. Allergen-induced coexpression of bFGF an TGF-β1 by macrophages in a mouse model of airway remodeling: bFGF induces macrophage TGF-β1 expression in vitro[J]. Int Arch Allergy Immunol J, 2011, 155(1): 12-22.
[14] 陈佳, 罗成群. 碱性成纤维细胞生长因子(bFGF)与创伤愈合[J]. 中国烧伤创疡杂志, 2015, 17(1): 74-76.
[15] LI H, YANG L, ZHANG Y, et al. Kaempferol inhibits fibroblast collagen synthesis, proliferation and activation in hypertrophic scar via targeting TGF-β receptor type I[J].Biomed Pharmacother, 2016, 83: 967-974.
[16] LIU Y C, ZOU X B, CHAI Y F, et al. Diabetes induces stable intrinsic changes to myeloid cells that contributes to chronic inflammantion during wound healing in mice[J]. Dis Model Mech, 2013, 6(6): 1434-1447.
[17] CHANG Y, WU X Y. The role of c-Jun N-terminal kinases 1/2 in transforming growth factor beta 1-induced expression of connective tissue growth factor and scar formation in the cornea[J]. J Int Med Res, 2009, 37(3): 727-736.
[18] 宋雨健, 李世荣, 刘剑毅. CTGF, PCNA, IL-1α及α-SMA在人胎儿皮肤无瘢痕愈合中的作用[J]. 中国皮肤性病学杂志, 2016, 5(30): 456-459.
[19] KREJNER A, GRZELA T. Modulation of matrix metalloproteinases MMP-2 and MMP-9 activity by hydrofiberfoam hybrid dressing - relevant support in the treatment of chronic wounds[J]. Cent Eur J Immunol, 2015, 40(3): 391-394.
[20] LOBMANN R, ZEMLIN C, MOTZKAU M, et al. Expression of matrix metalloproteinases and growth factors in diabetic foot wounds treated with a protease absorbent dressing[J]. J Diabetes Complications, 2006, 20(5): 329-335.
(本文编辑:赵翠翠)
The healing function of basic fibroblast growth factor on the wound of second degree burns in rats
LIN Beibei, YU Yinfei.
Department of Pharmacy, the Eye Hospital of Wenzhou Medical University, Wenzhou,325027
Objective:To examine the effect of topical basic fibroblast growth factor (bFGF) on wound healing in a rat skin partial thickness burn wound model.Methods:Female Sprague-Dawley rats were anaesthetized with an intraperitoneal injection of 10% chloralic hydrate (3.5 mL/kg). Hairs on the rat dorsum were clipped and then two partial thickness burn skin flaps were cut per rat. The two wounds were separated by at least 1.5 cm of unwounded skin. The right-side wounds were treated with different doses of bFGF, while the left-side wounds
equal volumes of saline as controls. Wounded rats were randomly divided into three groups (fifteen rats per group) and they were treated with 125, 500 and 2 000 ng of bFGF in right wounds respectively. bFGF treatments were repeated under anesthesia every other day for 14 days. The tissues were harvested and detected with Masson stain and immunohistochemistry to observe the expression of CD68, MMP-2,PCNA and TGF-β1.Results:By quantitative assessment of wound healing, we found that bFGF treatment significantly accelerated the rate of burn wound healing. Masson staining show that bFGF promoted the formation of granulation tissue and collagen production of wound. Immunohistochemical staining showed that the levels of CD68, MMP-2, PCNA and TGF-β1were significantly regulat in bFGF-treated groups compared to control.Conclusion:These findings suggest that bFGF significantly accelerates the healing of partial thickness burn wound healing by regulating the expression of CD68, MMP-2, PCNA and TGF-β1in rats.
basic fibroblast growth factor; partial thickness burn wound; wound healing; rats
R966
A
10.3969/j.issn.2095-9400.2017.10.005
2017-02-20
浙江省医药卫生一般研究计划项目(2016KYB207).
林蓓蓓(1989-),女,浙江苍南人,药师,硕士.
郁引飞,主任药师,Email:wz88068866@163.com.

