宫颈癌组织miR- 218、Stat3表达变化及其临床意义
崔英
(青海红十字医院,西宁810000)
宫颈癌组织miR- 218、Stat3表达变化及其临床意义
崔英
(青海红十字医院,西宁810000)
目的探讨宫颈癌组织微小RNA- 218(miR- 218)和信号转导及转录活化因子3(Stat3)表达变化及其临床意义。方法选择宫颈癌患者96例(观察组),疑似宫颈癌但组织病理检查宫颈正常者58例(对照组),取两组宫颈组织,采用RT- PCR法检测miR- 218、Stat3 mRNA表达。分析宫颈癌组织miR- 218、Stat3 mRNA表达与患者临床病理参数的关系。结果观察组、对照组miR- 218 mRNA相对表达量分别为0.57±0.12、1.09±0.51,Stat3 mRNA相对表达量分别为0.56±0.15、0.21±0.06,两组比较P均<0.05。宫颈癌组织miR- 218 mRNA表达与Stat3 mRNA表达呈负相关关系(r=-0.719,P<0.05)。宫颈癌组织miR- 218 mRNA表达与临床分期、组织分化程度、淋巴结转移有关(P均<0.05),与患者年龄、病理类型、肿瘤直径、绝经状况及宫旁浸润无关(P均>0.05)。宫颈癌组织Stat3 mRNA表达与组织分化程度、淋巴结转移有关(P均<0.05),与患者年龄、病理类型、临床分期、肿瘤直径、绝经状况及宫旁浸润无关(P均>0.05)。结论宫颈癌组织miR- 218 mRNA表达下调,Stat3 mRNA表达上调;二者表达变化与宫颈癌的发生、发展有关。
宫颈癌;微小RNA- 218;信号转导及转录活化因子3;分化程度;淋巴结转移
宫颈癌是妇科常见的恶性肿瘤之一,近年来其发病率逐渐升高且有年轻化趋势[1,2]。宫颈癌的病程一般经历宫颈增生、原位癌、早期浸润癌和宫颈癌,超过50%的患者确诊时已进展为早期浸润癌,一旦发生浸润和转移,患者的生存率大大降低[3,4]。有研究发现,微小RNA- 218(miR- 218)在多种肿瘤组织中表达下降[5,6],但其在宫颈癌组织中的表达文献报道并不一致。信号转导及转录活化因子3(Stat3)在多种肿瘤组织中表达升高,主要参与肿瘤细胞的增殖、分化和凋亡[7],但Stat3在宫颈癌组织中的表达变化及其与患者临床病理参数的关系仍不明确。关于宫颈癌组织miR- 218、Stat3表达关系的研究甚少。2015年2月~2017年1月,本研究观察了宫颈癌组织miR- 218、Stat3 mRNA表达变化,并探讨其与患者临床病理参数的关系,旨在为宫颈癌的诊治提供思路。
1 资料与方法
1.1 临床资料 选择同期青海红十字医院收治的宫颈癌患者96例(观察组),均经术后组织病理检查明确诊断。排除合并其他类型肿瘤者,合并心、肝、肾等重要脏器病变者,术前接受任何抗肿瘤治疗者。患者年龄40~68(54.06±6.12)岁,病程1~3(2.02±0.36)年;绝经42例,未绝经54例;病理类型:鳞癌70例,腺癌26例;临床分期[8]:Ⅰ期32例,Ⅱ期40例,Ⅲ期24例;组织分化程度:低分化50例,中高分化46例;浸润深度≤1/2者56例,>1/2者40例;有淋巴结转移49例,无淋巴结转移47例;肿瘤直径≥4 cm者36例,<4 cm者60例;有宫旁浸润37例,无宫旁浸润59例。另选同期疑似宫颈癌,经组织病理检查宫颈正常者58例(对照组),年龄40~65(53.87±5.26)岁。两组年龄具有可比性。本研究经青海红十字医院医学伦理委员会批准,患者或其家属知情同意。
1.2 宫颈组织miR- 218、Stat3 mRNA表达检测 采用RT- PCR法[9,10]。严格按照TRIzol试剂说明书提取各组织总RNA。取宫颈癌组织和正常宫颈组织总RNA各1 μg,根据逆转录试剂盒说明进行逆转录。miR- 218茎环结构逆转录引物序列:5′- CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGA-CATGGTT- 3′;逆转录条件:16 ℃、30 min,42 ℃、30 min、75 ℃、15 min。逆转录完后进行PCR扩增。引物设计:miR- 218上游引物:5′- ACACTCCAGCTGGGTTGTGCTTGATCTAACCA- 3′,下游引物:5′- TGGTGTCGTGGAGTCG- 3′;Stat3上游引物:5′- AAGAGGCGGCAACAGATT- 3′,下游引物:5′- CGGTCTTGATGCCGAGGG- 3′;内参U6上游引物:5′- CTCGCTTCGGCAGCACA- 3′,下游引物:5′- AACGCTTCACGAATT-TGCGT- 3′。PCR反应体系按试剂盒说明配制。PCR反应条件:95 ℃预变性10 min,95 ℃ 15 s、60 ℃ 1 min共40个循环。以U6为内参,采用2-ΔΔCt法计算miR- 218、Stat3 mRNA相对表达量。比较两种组织miR- 218、Stat3 mRNA相对表达量,并分析二者与宫颈癌患者临床病理参数的关系。

2 结果
2.1 两组miR- 218、Stat3 mRNA表达比较 观察组、对照组miR- 218 mRNA相对表达量分别为0.57±0.12、1.09±0.51,Stat3 mRNA相对表达量分别为0.56±0.15、0.21±0.06,两组比较P均<0.05。
2.2 宫颈癌组织miR- 218、Stat3 mRNA表达的关系 Pearson相关分析显示,宫颈癌组织miR- 218 mRNA表达与Stat3 mRNA表达呈负相关关系(r=-0.719,P<0.05)。
2.3 宫颈癌组织miR- 218、Stat3 mRNA表达与患者临床病理参数的关系 宫颈癌组织miR- 218 mRNA表达与临床分期、组织分化程度、淋巴结转移有关(P均<0.05),与患者年龄、病理类型、肿瘤直径、绝经状况及宫旁浸润无关(P均>0.05)。宫颈癌组织Stat3 mRNA表达与组织分化程度、淋巴结转移有关(P均<0.05),与患者年龄、病理类型、临床分期、肿瘤直径、绝经状况及宫旁浸润无关(P均>0.05)。见表1。
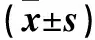
表1 宫颈癌组织miR- 218、Stat3 mRNA表达 与患者临床病理参数的关系
3 讨论
宫颈癌的诱发病因众多,其发生与染色体突变、人类乳头瘤病毒感染及单核苷酸多态性等关系甚为密切,特别是miRNA表达异常[11~13],如在乳腺癌、结肠癌、神经胶质瘤及肝癌等多种恶性肿瘤组织miR- 218表达降低[4,14]。
miRNA家族成员作为一类内源性非编码小分子RNA,由21~25个核苷酸组成[15]。单独miRNA可调控多个靶基因,而且单个靶基因受多个miRNA调节[16,17]。miR- 218是由STIL2和STIL3分别编码miR- 218- 1和miR- 218- 2而形成的成熟分子,两个编码基因分别位于4p15.31和6q35.1上[5]。本研究观察组宫颈癌组织miR- 218 mRNA表达明显低于对照组,提示miR- 218在宫颈癌的发生、发展过程中可能发挥抑癌基因作用,这与汤贝贝等[4]研究结论基本一致。本研究结果显示,宫颈癌组织miR- 218 mRNA表达与临床分期、组织分化程度、淋巴结转移具有相关性,提示miR- 218 mRNA表达降低可促进宫颈癌的发生、发展及转移,其机制可能为miR- 218能抑制靶基因翻译和(或)降解靶基因,与靶基因mRNA结合成相互关联的调控网络,从而调控mRNA表达[15]。
Stat家族由Stat1、Stat2、Stat3、Stat4、Stat5α、Stat5β和Stat6共7个转录因子组成,主要以失活形式存在于细胞质中,仅在正常组织中短暂表达,而在恶性肿瘤组织中多持续高表达[7,10]。Stat家族的主要功能是将细胞外的信号传送至细胞内。Stat3为Stat家族中的一员,被激活的Stat3可调控肿瘤细胞的生长、增殖及凋亡,是被公认的致癌基因[18,19]。Stat3作为受体信号的下游效应分子,还可调节胚胎发育及免疫反应等[11]。Stat3受多种外界因素的影响,可激活酪氨酸蛋白激酶1并形成二聚体,进入细胞核,增强其与Stat3 DNA靶基因的结合,从而激活靶基因的转录过程,最终完成信号转导途径[10,18]。本研究观察组宫颈癌组织Stat3 mRNA表达显著高于对照组,说明Stat3在宫颈癌组织中表达升高,同时宫颈癌组织Stat3 mRNA表达与组织分化程度及淋巴结转移具有相关性,提示Stat3可能参与肿瘤的发生、发展,分析原因可能是Stat3下游基因被激活后,细胞增殖周期发生变化,加速细胞上皮间质转化并阻滞细胞发生凋亡,逐渐诱导细胞发生癌变,肿瘤细胞通过躲避机制而抑制细胞凋亡[7,11]。相关分析发现,宫颈癌组织miR- 218 mRNA表达与Stat3 mRNA表达呈负相关关系,说明二者表达具有一定联系,但其具体机制尚需进一步研究。
综上所述,宫颈癌组织miR- 218 mRNA表达下调,Stat3 mRNA表达上调;二者表达变化与宫颈癌的发生、发展有关,但其具体机制尚需深入研究。
[1] 盖红霞.miR- 218下调与宫颈癌发生相关性的初步研究[J].中国现代医生,2012,50(27):28- 29,32.
[2] 石玉荣,刘健,贺伟,等.MiR- 218在宫颈癌组织中的表达及对HeLa细胞凋亡及转移的影响[J].四川大学学报(医学版),2016,47(5):697- 702.
[3] Zeng K, Zhang W, Hu X. Progress of research in miR- 218 and cervical cancer[J]. Chinese- German J Clin Oncol, 2013,12(8):399- 402.
[4] 汤贝贝,刘水逸,魏礼清,等.miR- 218表达水平与宫颈癌侵袭转移及预后的关系[J].广东医学,2015,36(14):2195- 2197.
[5] 龙倩,周航.MicroRNA- 218在肿瘤中的研究进展[J].大家健康(下旬版),2016,10(4):294- 295,298.
[6] Gao Y, Li P, Liu Z, et al. Expression levels of vascular endothelial cell growth factor and microRNA- 210 are increased in medulloblastoma and metastatic medulloblastoma[J]. Exp Ther Med, 2015,10(6):2138- 2144.
[7] 陈飞,程琪,王立波,等.STAT3和MDM2在宫颈腺癌组织中的表达及意义[J].中国妇幼保健,2014,29(19):3154- 3155.
[8] 李双,李雄,张媛,等.宫颈癌的手术-病理分期和评分系统的建立和验证[J].现代妇产科进展,2016,25(11):801- 807.
[9] 杨朝晖,周绮妮,曹学全,等.宫颈癌组织中miR- 218和Survivin的表达及相关性研究[J].中国卫生检验杂志,2016,26(19):2743- 2746.
[10] 杨朝晖,章辉,顾华敏,等.宫颈癌组织中miR- 21和Stat3的表达及相关性研究[J].浙江医学,2017,39(2):93- 96.
[11] 唐雅娟,韩萍,吴维光,等.STAT3基因反义寡核苷酸对人宫颈癌HeLa细胞增殖和凋亡的影响[J].蚌埠医学院学报,2013,38(3):264- 267.
[12] 陈军莹,姚德生,贺婵娟,等.宫颈鳞癌MicroRNA差异表达的研究[J].实用医学杂志,2014,30(1):83- 87.
[13] 邱瑜,黄建平,周勤仙,等.Hsa- miR- 218靶向调控 LASP1对宫颈癌 HeLa细胞生长的影响[J].中国病理生理杂志,2015,31(9):1572- 1577.
[14] He X, Dong Y, Wu CW, et al. MicroRNA- 218 inhibits cell cycle progression and promotes apoptosis in colon cancer by downregulating BMI1 polycomb ring finger oncogene[J]. Mol Med, 2013(18):1491- 1498.
[15] Martin JJ, Bujanda L, Banales JM. MicroRNAs and cholestatic liver diseases[J]. Curr Opin Gastroenterol, 2014,30(3):303- 309.
[16] 刘珍,张蔚,胡晓霞,等.microRNA- 218对宫颈癌细胞增殖和迁移的影响[J].中华肿瘤防治杂志,2015,22(20):1602- 1608.
[17] 刘立鹏,郭小芳,田智,等.微小核糖核酸在宫颈癌发病机制中的调节作用[J].实用预防医学,2010,17(11):2327- 2329.
[18] 方禛浩,谌錾,李妍静,等.NF- κB和STAT3对宫颈癌作用的研究进展[J].中国妇产科临床杂志,2013,14(1):81- 83.
[19] 祝宝让,杨武威.STAT3与肿瘤免疫逃逸的研究进展[J].中华临床医师杂志(电子版),2013,7(22):10220- 10222.
10.3969/j.issn.1002- 266X.2017.36.026
R737.33
B
1002- 266X(2017)36- 0079- 03
2017- 02- 05)

