尿毒症自体动静脉内瘘失功患者血浆sEPCR水平变化及意义
沈燕,陈冬梅,明志兵,袁莉
(1南通大学第二附属医院,江苏南通226001;2 南通大学附属医院)
尿毒症自体动静脉内瘘失功患者血浆sEPCR水平变化及意义
沈燕1,陈冬梅1,明志兵1,袁莉2
(1南通大学第二附属医院,江苏南通226001;2 南通大学附属医院)
目的探讨尿毒症自体动静脉内瘘(AVF)失功患者血浆可溶性内皮细胞蛋白C受体(sEPCR)水平变化及其临床意义。方法选择经桡动脉-头静脉吻合内瘘行规律血液透析治疗的尿毒症患者42例,其中内瘘失功21例(失功组)、内瘘通畅21例(通畅组);失功组均给予内瘘介入治疗,术后18例AVF通畅。失功组术前及术后2个月、通畅组于透析前分别检测血浆CRP、纤维蛋白原(FIB)、sEPCR水平及WBC计数,分析内瘘失功者血浆sEPCR水平与血浆CRP、FIB水平和WBC计数的关系。结果失功组术前血浆CRP、sEPCR水平均高于通畅组(P均<0.05),两组血浆FIB水平及WBC计数比较P均>0.05。失功组内瘘介入治疗成功者治疗后血浆CRP、sEPCR水平均低于治疗前(P均<0.05),治疗前后血浆FIB水平及WBC计数比较P均>0.05。失功组血浆sEPCR水平与血浆CRP水平呈正相关关系(r=0.715,P<0.05),与血浆FIB水平和WBC计数无相关性(P均>0.05)。结论尿毒症AVF失功者血浆sEPCR水平升高,其水平变化可能参与内瘘失功的形成;介导炎症反应、促进血栓形成可能是其作用机制。
尿毒症;血液透析;自体动静脉内瘘;可溶性内皮细胞蛋白C受体
血液透析是终末期肾病(ESRD)的肾脏替代疗法。自体动静脉内瘘(AVF)是目前进行血液透析最理想、最方便的长期血管通路,占血管通路的90%以上,其中桡动脉-头静脉吻合内瘘是AVF的首选[1]。但AVF长期使用易出现狭窄或闭塞,使内瘘失功的发生风险增加。据统计,使用AVF的前两年内瘘失功发生率为30%~40%[2],主要原因为静脉血栓形成。血管内皮细胞损伤是血栓形成的主要原因之一[3,4]。可溶性内皮细胞蛋白C受体(sEPCR)是血管内皮细胞损伤的分子生物学标志物之一[5~7]。本研究探讨尿毒症AVF失功者血浆sEPCR水平变化及其临床意义。
1 资料与方法
1.1 临床资料 选择2012年10月~2013年12月南通大学第二附属医院收治的尿毒症患者42例,男29例、女13例,年龄28~72(54.8±10.6)岁;实验室指标:Hb(110.5±14.7)g/L,PLT计数(208±97)×109/L,红细胞比容(21.6±5.9)%,白蛋白(40.4±5.5)g/L,TG(1.91±0.76)mmol/L,TC(4.39±0.86)mmol/L。所有患者经桡动脉-头静脉吻合内瘘行血液透析治疗,累积透析时间为0.5~8(4.2±3.2)年,透析频率3次/周、4 h/次;均给予促红细胞生成素(134±23)U/(kg·周)。排除合并肝病、局部或全身严重感染、肿瘤、严重心力衰竭、血容量不足、使用抗血小板等药物者。经内瘘处超声检查发现,内瘘失功(有血栓形成或血管狭窄)21例(失功组),其中血栓形成14例、血管狭窄7例;内瘘通畅21例(通畅组)。两组性别、年龄、透析时间及频率等均具有可比性。本研究经南通大学第二附属医院医学伦理委员会批准,患者均知情同意。
1.2 内瘘失功处理 内瘘失功者均予内瘘介入治疗。具体方法:于内瘘侧肱动脉顺行穿刺,通过导丝和短鞘管行DSA造影,明确血管狭窄及继发血栓情况;确定血栓长度后用带侧孔的溶栓导管注入10万U尿激酶,并留置导管及鞘管,继续注入尿激酶(2万U/h)维持溶栓。如在手术过程中发现有内瘘狭窄或溶栓24 h内内瘘未能溶通者需再次行造影复查,然后用冠状动脉球囊扩张导管(4 mm×15 mm)对瘘管狭窄处行血管成形,并维持溶栓24 h。待瘘管震颤增强,透析时血流量>200 mL/min时拔管。整个溶栓过程辅以低分子肝素钙抗凝,并监测PT、APTT。经治疗,18例AVF通畅,3例仍未通畅。
1.3 相关指标观察 失功组术前及术后2个月、通畅组于透析前分别取清晨空腹静脉血,离心分离血浆,采用全自动生化分析仪检测血浆CRP,全自动血凝分析仪检测血浆纤维蛋白原(FIB),ELΙSA法检测血浆sEPCR(试剂盒购自美国VSCNLΙFE公司),全血细胞分析仪计数WBC。分析失功组血浆sEPCR水平与血浆CRP、FIB水平及WBC计数的关系。

2 结果
2.1 两组血浆CRP、FIB、sEPCR水平及WBC计数比较 失功组术前血浆CRP、sEPCR水平均明显高于通畅组(P均<0.01),两组血浆FIB水平及WBC计数比较差异均无统计学意义(P均>0.05)。见表1。失功组内瘘介入治疗成功者治疗后血浆CRP、sEPCR水平均较治疗前明显降低(P均<0.01),治疗前后血浆FIB水平及WBC计数比较差异均无统计学意义(P均>0.05)。见表2。
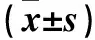
表1 两组血浆CRP、FIB、sEPCR水平 及WBC计数比较
注:与通畅组比较,*P<0.01。
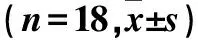
表2 失功组治疗成功者治疗前后血浆CRP、FIB、 sEPCR水平及WBC计数比较
注:与治疗前比较,*P<0.01。
2.2 失功组血浆sEPCR水平与血浆CRP、FIB水平及WBC计数的关系 失功组血浆sEPCR水平与血浆CRP水平呈正相关关系(r=0.715,P<0.05),与血浆FIB水平和WBC计数无相关性(P均>0.05)。
3 讨论
透析低血压、凝血功能异常、超滤量过多、护理不当、感染、自身血管条件差等是AVF内瘘失功的主要原因[8]。早期动静脉内瘘失功常发生在动静脉内瘘吻合手术结束24 h内或1~8周,主要原因为术者技术不足或自身解剖结构差异。晚期动静脉内瘘失功临床更常见,原因主要为血栓形成[9]。
尿毒症患者体内代谢紊乱,体内炎性蛋白及炎性细胞因子明显增加[10];同时,由于高容量负荷、滤过膜生物相容性差、透析液污染、通路感染等原因,机体长期处于微炎症状态。近年有学者提出,内瘘失功与微炎症状态相关[11,12]。CRP、FIB及WBC计数是反映炎症状态的经典指标[13]。CRP由炎性淋巴因子(IL- 6、IL- 1、TNF- α等)刺激肝脏和上皮细胞合成,是机体受到微生物入侵或组织损伤等炎性刺激时肝细胞合成的急性期蛋白,可作为评估急性时相反应最敏感的指标之一。FIB是肝脏合成的一种急性期蛋白,可参与炎症反应,并刺激肝脏不断合成FIB,使血液中FIB水平持续升高,导致体内凝血功能障碍,进而使血液黏稠度升高、血小板聚集,促进炎症部位形成血栓,并影响血管内皮修复[14]。炎症反应过程中,WBC从流动的血管中识别到炎性因子浸润部位,并与血管内皮细胞接触,黏附于血管内皮,最终影响血管内皮修复。本研究失功组血浆CRP水平较通畅组明显升高,说明失功者体内炎症反应状态明显加重;但未发现两组血浆FIB水平及WBC计数有统计学差异,可能与本研究样本量小及样本的个体差异等有关。
蛋白C系统是体内最重要的抗凝系统,可参与炎症反应过程[15]。蛋白C需与其受体结合后才能发挥抗凝作用,当机体发生炎症反应时,血管内皮细胞表面可溶性蛋白C受体(EPCR)大量脱落,成为sEPCR,使通过蛋白C抗凝途径的抗凝效果减弱。因此,sEPCR被认为是反映内皮损伤最敏感和特异性最强的指标之一[16,17]。此外,sEPCR与血栓形成及炎症反应均有关[5~7];sEPCR可作为判断是否有血栓形成的指标,且比FIB及D- 二聚体等常用反映凝血状态的传统指标更敏感。有研究发现,AVF血栓形成时患者血浆sEPCR水平明显升高,且高水平sEPCR患者AVF血栓形成率明显高于中低水平者,动态观察sEPCR水平变化有助于监测血管通路状态[17]。动静脉内瘘术前血浆sEPCR水平显著升高、血管B超检查发现血管条件不佳者,可考虑其他血管通路,如直接选择隧道型中心静脉置管或人造血管等[18]。本研究结果显示,失功组血浆sEPCR水平明显高于通畅组,与上述研究结果一致;内瘘再通后血浆sEPCR水平明显下降,可能与介入手术尿激酶溶栓及术后低分子肝素抗凝等导致机体凝血状态改变有关。失功组与通畅组及内瘘再通者手术前后血浆FIB水平变化不明显,提示sEPCR反映凝血状态可能比FIB更敏感。本研究失功组血浆sEPCR水平与血浆CRP水平呈正相关关系,提示二者可能存在一定内在联系,介导炎症反应可能是sEPCR的作用机制。
综上所述,尿毒症AVF失功者血浆sEPCR水平升高,其水平变化可能参与内瘘失功的形成;介导炎症反应、促进血栓形成可能是其作用机制。
[1] 崔立文,徐金升,俞奇瑶,等.自体动静脉内瘘失功及其影响因素的分析[J].河北医药,2011,33(5):672- 673.
[2] Park WY, Goodman RB, Steinberg KP, et al. Cytokine balance in the lungs of pateints with acute respiratory distress syndrome[J]. Am J Resp Crit Care Med, 2001,164(15):1896- 1903.
[3] 张子彦,张敏,柳惠荣.2型糖尿病患者血浆可溶性内皮细胞蛋白C受体和凝血酶激活的纤溶抑制物的变化及意义[J].苏州大学学报(医学版),2003,30(1):178- 179.
[4] Boomsma MM,Stearns- Kurosawa DJ,Stegeman CA,et al.Plasma levels of solube endothelial cell protein C receptor in patients with Wegener′s granulomatosis[J]. Clin Exp Immunol, 2002,128(1):187- 194
[5] Guitton C, Gérard N, Sébille V, et al. Early rise in circulating endothelial protein C receptor correlates with poor outcome in severe sepsis[J]. Intensive Care Med, 2011,37(6):950- 956.
[6] Saposnik B, Peynaud- Debayle E, Stepanian A, et al. Elevated soluble endothelial cell protein C receptor (sEPCR) levels in women with preeclampsia: a marker of endothelial activation/damage[J]. Thromb Res, 2012,129(2):152- 157
[7] Yin G, Jin X, Ming H, et al. Endothelial cell protein C receptor gene 6936A/G polymorphism is associated with venous thromboembolism[J]. Exp Ther Med, 2012,3(6):989- 992.
[8] Roy- Chaudhury P, Sukhatme VP, Cheung AK. Hemodialysis vascular access dysfunction: a cellular and molecular viewpoint [J]. J Am Soc Nephrol, 2006,17(4):1112- 1127.
[9] Medkouri G, Aghai R, Anabi A, et al. Analysis of vascular access in hemodialysis patients:a report from a dialysis unit in casablanca[J]. Saudi J Kindney Dis Transplant, 2006,17(4):516- 520.
[10] 于敏,王姣,史耀勋,等.慢性肾衰竭微炎症状态发生机制的研究进展[J].中华医院感染学杂志,2010,20(10):1498- 1500.
[11] 李立,王笑云,刘殿阁,等.维持性血液透析患者微炎症状态与血管通路失功能的相关研究[J].中国血液净化,2007,6(10):538.
[12] 王明哲,杨枫,于秀峙,等.血液透析患者动静脉内瘘晚期失功的临床分析[J].福建医药杂志,2013,35(2):16- 18.
[13] Ridker PM, Howard CP, Walter V, et al. Effects of interleukin- 1β inhibition with canakinumab on hemoglobin A1c, lipids, C- reactive protein, interleukin- 6, and fibrinogen: a phase Ⅱb randomized placebo controlled trial[J]. Circulation, 2012,126(23):2739- 2748.
[14] 潘秀贤,蔡焕荣,李兵.创伤性四肢骨折患者血液流变学及凝血指标的改变及其临床意义[J].海南医学,2010,21(9):104- 105.
[15] Toltl LJ, Austin RC, Liaw PC. Activated protein C modulates inflammation, apoptosis, and tissue factor procoagulant activity by regulating endoplasmic reticulum calcium depletion in blood monocytes[J]. J throm haemost, 2011,9(3):582- 590.
[16] Chao TH, Li YH, Tsai WC, et al. Elevation of the soluble thrombomodulin levels is associated with inflammation after percutaneous coronary interventionsl[J]. Clin Cardiol, 2004,27(7):407- 410.
[17] Esmon CT, Xu J, Gu JM, et al. Endothelial protein C receptor[J]. Thromb Haemost, 2000,275(17):1281- 1288.
[18] 许焱,黄雯,翟艳苓,等.动静脉内瘘血栓形成与可溶性内皮细胞蛋白C受体的关系[J].中华肾脏病杂志,2010,26(9):714- 715.
袁莉(E- mail: yuanlint@163.com)
10.3969/j.issn.1002- 266X.2017.36.028
R692.5
B
1002- 266X(2017)36- 0084- 03
2016- 01- 18)

