迷迭香酸对鼻咽癌细胞增殖、凋亡的影响及其作用机制
杨沛霖,高玲,林彩霞,王巍,许立拔,巫玲玲,蒋伟哲,焦爱军
(广西医科大学药学院,南宁530021)
·论著·
迷迭香酸对鼻咽癌细胞增殖、凋亡的影响及其作用机制
杨沛霖,高玲,林彩霞,王巍,许立拔,巫玲玲,蒋伟哲,焦爱军
(广西医科大学药学院,南宁530021)
目的探讨迷迭香酸对鼻咽癌CNE- 1细胞(以下称CNE- 1细胞)增殖、凋亡的影响及其可能的作用机制。方法体外培养CNE- 1细胞,取传3代对数生长期CNE- 1细胞,随机分为空白对照组及迷迭香酸10、20、30 μmol/L组,迷迭香酸各组分别加入含相应浓度迷迭香酸的培养液,空白对照组加入等量不含迷迭香酸的培养液。采用MTT法检测各组培养24、48、72 h时细胞增殖抑制率。迷迭香酸作用48 h时,其浓度变化与细胞增殖抑制率的线性关系较好,故选择迷迭香酸作用48 h进行后续实验。取各组作用48 h细胞,采用Hochest 33258染色法观察各组细胞形态变化,采用流式细胞仪检测各组细胞凋亡率,采用Western blotting法检测各组PTEN、PI3K/Akt/mTOR信号通路相关蛋白表达。结果各组作用48 h时,随着迷迭香酸浓度增加,细胞凋亡特征逐渐明显。迷迭香酸各组细胞凋亡率均高于空白对照组(P均<0.05),迷迭香酸各组间细胞凋亡率比较P均<0.05。与空白对照组比较,迷迭香酸各组PTEN蛋白表达逐渐上升,p- PI3K、p- Akt、p- mTOR蛋白表达逐渐降低,且随着迷迭香酸浓度增加,各蛋白表达变化越明显(P均<0.05)。而各组间PI3K、Akt、mTOR蛋白表达变化不明显(P均>0.05)。结论迷迭香酸能剂量依赖性地抑制CNE- 1细胞增殖并诱导其凋亡,其机制可能与调控PTEN、PI3K/Akt/mTOR信号通路有关。
鼻咽癌;迷迭香酸;细胞凋亡;细胞增殖;磷脂酰肌醇- 3- 激酶/蛋白激酶B/哺乳动物雷帕霉素靶蛋白信号通路
鼻咽癌是我国南部省份以及东南亚地区常见的恶性肿瘤之一。由于其原发部位隐蔽,早期不易被发现,60%以上患者确诊时已属中晚期,多伴有远处转移。放疗和化疗是鼻咽癌的主要治疗手段。但放疗引起的放射反应和化疗引起的毒副作用可严重影响治疗效果[1,2]。近年来中药辅助治疗鼻咽癌成为研究热点[3]。唇形科迷迭香属植物迷迭香的全草均可入药,具有健胃、发汗、安神、止痛之功效[4]。现代药理学研究证实,迷迭香酸是迷迭香的主要化学成分之一,是一种天然来源的多酚羟基化合物,其具有广泛的药理活性,如抗氧化、抗炎、抗菌、抗病毒等作用[5]。近年研究发现,迷迭香酸在治疗黑色素瘤时能清除自由基,增强X射线电离下黑色素瘤B16F10细胞损伤,发挥放疗增敏作用,而对正常细胞不仅无杀伤作用,还可能具有一定保护作用。牟宜双等[6]研究发现,迷迭香酸可通过下调直肠癌细胞中TYMS、TK1基因表达,增强5- 氟尿嘧啶(5- FU)对癌细胞的杀伤作用,而对正常细胞则不具有杀伤作用。2016年8月~2017年1月,本课题组观察了迷迭香酸对鼻咽癌CNE- 1细胞(以下简称CNE- 1细胞)增殖、凋亡的影响,现分析结果并探讨其可能的作用机制。
1 材料与方法
1.1 材料 人高分化CNE- 1细胞,由广西壮族自治区肿瘤防治研究所提供,本课题组液氮中保存。迷迭香酸,纯度>98%,购自成都曼思特生物科技有限公司。酶标仪,美国Thermo Fisher Scientific公司;倒置显微镜,日本Olympus公司;FACSCalibur流式细胞仪,美国BD公司。Hochest 33258染色液、ECL发光试剂盒、BCA蛋白浓度测定试剂盒,上海碧云天生物技术研究所;Annexin V- FITC/PI细胞凋亡检测试剂盒,上海美吉生物医药科技有限公司;Akt、p- Akt、PI3K、p- PI3K、β- actin一抗,美国Santa Cruz公司;PTEN、mTOR、p- mTOR一抗,美国Cell Signaling Technology公司;辣根过氧化物酶标记的二抗,北京中衫金桥生物技术有限公司。
1.2 细胞培养 将CNE- 1细胞从液氮中取出,迅速放入37 ℃水浴中,快速摇震1~2 min解冻,1 000 r/min离心5 min,去上清液。将剩余全部细胞接种于含10% FBS的RPMI 1640培养液,置于37 ℃、5% CO2细胞培养箱常规培养,每2天换液1次,待细胞融合80%~90%时,按1∶3传代。取传3代对数生长期细胞用于后续实验。
1.3 迷迭香酸最佳作用时间筛选 取传3代对数生长期CNE- 1细胞,0.25%胰酶消化计数,加入含10% FBS的RPMI 1640培养液稀释,接种于96孔板,每孔1×105个,置于37 ℃、5% CO2细胞培养箱中常规培养24 h。将细胞随机分为4组:空白对照组及迷迭香酸10、20、30 μmol/L组,每组设6个复孔。待细胞完全贴壁后,吸弃旧培养液,迷迭香酸各组分别加入含相应浓度迷迭香酸的培养液,空白对照组加入等量不含迷迭香酸的培养液。各组培养24、48、72 h,加入5 mg/mL的MTT 20 μL,孵育4 h,吸弃上清,加入DMSO 150 μL,37 ℃充分溶解,酶标仪490 nm波长处检测各孔的吸光度(A)值,计算细胞增殖抑制率。细胞增殖抑制率=(空白对照孔A490值-实验孔A490值)/空白对照孔A490值。实验重复3次,取平均值。结果显示,迷迭香酸对CNE- 1细胞具有增殖抑制作用,具有浓度-时间依赖性。见表1。迷迭香酸作用48 h时,其浓度变化与细胞增殖抑制率的线性关系较好,故本研究选择迷迭香酸作用48 h进行后续实验。
1.4 细胞分组干预及相关指标观察
1.4.1 细胞分组干预 取传3代对数生长期CNE- 1细胞,0.25%胰酶消化,加入含10% FBS的RPMI 1640培养液,接种于6孔板,每孔6×104个,置于37 ℃、5% CO2细胞培养箱中孵育24 h,吸弃旧培养液并更换新的细胞培养液。将细胞随机分为空白对照组及迷迭香酸10、20、30 μmol/L组,迷迭香酸各组分别加入含相应浓度迷迭香酸的培养液, 空白对照组加入等量不含迷迭香酸的培养液。各组继续培养48 h。
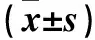
表1 各组不同作用时间细胞增殖抑制率比较
注:与空白对照组同时间点比较,*P<0.05;与迷迭香酸10 μmol/L组同时间点比较,#P<0.05;与迷迭香酸20 μmol/L组同时间点比较,△P<0.05;与同组作用24 h比较,▽P<0.05;与同组作用48 h比较,▼P<0.05。
1.4.2 相关指标观察
1.4.2.1 细胞形态变化 各组培养48 h,吸弃旧培养液,PBS洗涤2次,加入1 mL固定液固定30 min;弃去固定液,PBS洗涤3次,避光条件下加入1 mL Hoechst 33258染色液染色5 min;去除染色液,PBS浸洗3次,取出盖玻片,用抗荧光淬灭封片液封片,置于荧光显微镜下观察。实验重复3次。
1.4.2.2 细胞凋亡率 采用Annexin V- FITC/PI双染法。各组培养48 h,用不含EDTA的胰酶消化,1 500 r/min离心5 min,去上清液,用预冷的PBS重悬细胞,然后加入500 μL Binding Buffer悬浮细胞,再加入5 μL Annexin V- FITC,混匀后加入5 μL PI。室温避光反应5~15 min,1 h内上流式细胞仪检测。实验重复3次,取平均值。
1.4.2.3 PTEN、PI3K/Akt/mTOR信号通路相关蛋白表达 采用Western blotting法。各组培养48 h,收集细胞,加入含有蛋白酶抑制剂和磷酸酶抑制剂的RIPA裂解液,4 ℃充分裂解30 min,12 000×g离心30 min,取上清液,BCA法进行蛋白定量。取部分蛋白加入适量上样缓冲液,100 ℃水浴5 min,使蛋白充分变性。取蛋白样品30 μg行SDS- PAGE,120 V、28 mA电泳1.5 h;采用半干转膜法将蛋白转印至PVDF膜上,5%脱脂牛奶封闭2 h,分别加入PTEN(1∶500)、PI3K(1∶500)、p- PI3K(1∶400)、Akt(1∶500)、p- Akt(1∶400)、mTOR(1∶400)、p- mTOR(1∶400)和β- actin(1∶500)一抗,4 ℃孵育过夜;用含0.1% Tween- 20的TBS冲洗5 min×3次,加入辣根过氧化物酶标记的二抗(1∶1 000),室温孵育2 h,用TBST漂洗15 min×3次,ECL发光显影。采用Image J软件分析各蛋白电泳条带的灰度值。以β- actin为内参,以目的蛋白电泳条带灰度值/β- actin蛋白电泳条带灰度值作为目的蛋白相对表达量。

2 结果
2.1 各组细胞形态变化 空白对照组可见均匀的淡蓝色荧光,细胞体积大小一致,细胞核无明显凋亡特征。迷迭香酸10 μmol/L组作用48 h可见部分细胞染色质呈块状或颗粒状,聚集于细胞核周边;迷迭香酸20 μmol/L组作用48 h可见较多细胞内染色质分布不均,形成荧光斑点;迷迭香酸30 μmol/L组作用48 h可见细胞碎片及凋亡小体,具有明显的凋亡特征。迷迭香酸浓度越高,凋亡特征越明显。见插页Ⅰ图1。
2.2 各组细胞凋亡率比较 空白对照组及迷迭香酸10、20、30 μmol/L组作用48 h细胞凋亡率分别为(19.210±0.024)%、(39.780±0.038)%、(56.860±0.019)%、(68.480±0.041)%。迷迭香酸各组细胞凋亡率均高于空白对照组(P均<0.05),且迷迭香酸各组两两比较差异均有统计学意义(P均<0.05)。
2.3 各组作用48 h时PTEN、PI3K/Akt/mTOR信号通路相关蛋白表达比较 见表2。
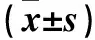
表2 各组作用48 h时PTEN、PI3K/Akt/mTOR信号通路相关蛋白相对表达量比较
注:与空白对照组比较,*P<0.05;与迷迭香酸10 μmol/L组比较,△P<0.05;与迷迭香酸20 μmol/L组比较,#P<0.05。
3 讨论
迷迭香酸是从唇形科迷迭香属植物迷迭香中提取的天然活性成分,除具有抗炎、抗氧化等[7]药理作用外,还具抗肿瘤作用[8]。研究发现,迷迭香酸对多种肿瘤具有抑制作用,如宫颈癌、黑色素瘤、卵巢癌、结直肠癌、乳腺癌等[9~11];其相关的作用机制亦有报道,如通过调节线粒体凋亡途径和死亡受体途径诱导细胞凋亡[12]、通过VEGF通路抑制肿瘤血管形成以及肿瘤细胞迁移和侵袭[13]。有研究还发现,迷迭香酸还具有放疗增敏作用,可增强X射线对黑色素瘤B16F10细胞的杀伤作用。但目前鲜见迷迭香酸辅助治疗鼻咽癌的报道。本研究结果显示,随着迷迭香酸浓度增加,CNE- 1细胞凋亡特征逐渐明显,细胞凋亡率逐渐升高。说明一定浓度的迷迭香酸可用于辅助治疗鼻咽癌。
PTEN位于人类第10号染色体上,在细胞周期调控及细胞增殖抑制中具有重要作用[14]。研究发现,PTEN蛋白异常表达与肿瘤细胞增殖、凋亡及侵袭和迁移等密切相关[15]。已有研究证实,PTEN是拮抗PI3K/Akt/mTOR信号通路的必要条件,PTEN通过将细胞膜上的PIP3去磷酸化生成PIP2,进而拮抗PI3K介导的细胞增殖、代谢和存活信号[16]。因此,抑制PTEN蛋白表达是抑制肿瘤生长的重要环节。Akt是位于PI3K下游的一个重要丝氨酸/苏氨酸蛋白激酶,是维持细胞生存和正常功能的关键信号分子。PI3K能特异性地催化磷脂酰肌醇- 3- 羟激酶磷酸化产生具有第二信使作用的磷酸化PIP3,磷酸化的PIP3可与细胞内含有PH结构域的信号蛋白Akt和磷酸肌醇依赖性蛋白激酶1(PDK1)结合,促使PDK1磷酸化Akt蛋白的Ser308,从而导致Akt活化;活化的Akt通过调控核糖体激酶p70s6k和真核起始因子4E结合蛋白1两条不同的下游通路,控制特定亚组mRNA的翻译,进而调节蛋白质合成,影响细胞增殖[17,18]。由此可见,PI3K/Akt/mTOR信号传导通路在肿瘤的发生、发展过程中亦具有重要作用。本研究结果显示,随着迷迭香酸浓度增加,PTEN蛋白表达逐渐升高,其下游的p- PI3K、p- Akt以及p- mTOR蛋白表达逐渐降低,而PI3K、Akt、mTOR蛋白表达变化不明显。提示迷迭香酸能在一定浓度范围内抑制CNE- 1细胞中PI3K/Akt/mTOR信号传导通路的过度活化,从而诱导CNE- 1细胞凋亡。
综上所述,迷迭香酸能剂量依赖性地抑制CNE- 1细胞增殖并诱导其凋亡;其机制可能与调控PTEN、PI3K/Akt/mTOR信号通路有关。
[1] 周启源,肖锋,王佳,等.放化疗综合治疗局部晚期鼻咽癌的研究进展[J].肿瘤药学,2015,5(5):332- 338.
[2] 邓鹏. 中药与鼻咽癌放射治疗研究进展[J].临床医药文献电子杂志,2016,3(59):11911- 11912.
[3] 景艳,唐安洲.中药在鼻咽癌综合治疗中的研究进展[J].实用医学杂志,2010,26(9):1487- 1489.
[4] 周慧灵,梁婉娴,徐道立,等.迷迭香活性提取物的药理作用研究进展[J].环球中医药,2015,8(12):1542- 1545.
[5] 张玉杰,徐文清,沈秀.迷迭香酸的提取分离及药理学新发现[J].中国新药杂志,2013,22(4):433- 437.
[6] 牟宜双,邓文龙,周黎明.迷迭香酸抗肿瘤作用研究进展[J].中药药理与临床,2015,31(1):266- 269.
[7] Bakota EL, Winkler- Moser JK, Berhow MA, et al. Antioxidant activity and sensory evaluating of a rosmarinic acid- enriched extract of Salvia officinalis[J]. J Food Sci, 2015,80(4):C711- C717.
[8] Rocha J, Eduardo- Figueira M, Barateiro A, et al. Anti- inflammatory effect of rosmarinic acid and an extract of Rosmarinus officinalis in rat models of local and systemic inflammationg[J]. Basic Clin Pharmacol Toxicol, 2015,116(5):398- 413.
[9] Tai J, Cheung S, Wu M, et al. Antiproliferation effect of rosemary (Rosmarinus officinalis) on human ovarian cancer cells in vitro[J]. Phytomedicine, 2012,19(5):436- 443.
[10] Xavier CP, Lima CF, Fernandes- Ferreira M, et al. Salvia fruticosa, Salvia officinalis and rosmarinic acid induce apoptosis and inhibit proliferation of human colorectal cell lines: the role in MAPK/ERK pathway[J]. Nutr Cancer, 2009,61(4):564- 571.
[11] Berdowska I, Zieliński B, Fecka I, et al. Cytotoxic impact of phenolics from Lamiaceae species on human breast cancer cells[J]. Food Chem, 2013,141(2):1313- 1321.
[12] Cheng AC, Lee MF, Tsai ML, et al. Rosmanol potently induces apoptosis through both the mitochondrial apoptotic pathway and death receptor pathway in human colon adenocarcinoma COLO 205 cells[J]. Food Chem Toxicol, 2011,49(2):485- 493.
[13] Ahamed MB, Aisha AF, Nassar ZD, et al. Cat′s whiskers tea (Orthosiphon stamineus) extract inhibits growth of colon tumor in nude mice and angiogenesis in endothelial cells via suppressing VEGFR phosphorylation[J]. Nutr Cancer, 2012,64(1):89- 99.
[14] Milella M, Falcone I, Conciatori F, et al. PTEN: multiple functions in human malignant tumors[J]. Front Oncol, 2015(5):24.
[15] Ocana A, Vera- Badillo F, Al- Mubarak M, et al. Activation of the PI3K/mTOR/AKT pathway and survival in solid tumors:systematic review and meta- analysis[J]. PLoS One, 2014,9(4):e95219.
[16] Tang JM, He QY, Guo RX, et al. Phosphorylated Akt overexpression and loss of PTEN expression in non- small cell lung cancer confers poor prognosis[J]. Lung Cancer, 2006,51(2):181- 191.
[17] Fayard E, Xue G, Parcellier A, et al. Protein kinase B (PKB/Akt), a key mediator of the PI3K signaling pathway[J]. Curr Top Microbiol Immunol, 2010(346):31- 56.
[18] 孙晓杰,黄常志.PI3K- Akt信号通路与肿瘤[J].世界华人消化杂志,2016,14(3):306- 311.
RosmarinicacidsuppressescellproliferationandinducesapoptosisofhumannasopharyngealcarcinomacelllineCNE- 1
YANGPeilin,GAOLing,LINCaixia,WANGWei,XULiba,WULingling,JIANGWeizhe,JIAOAijun
(PharmaceuticalCollegeofGuangxiMedicalUniversity,Nanning530021,China)
ObjectiveTo investigate the effects of rosmarinic acid (RA) on cell proliferation and apoptosis of human nasopharyngeal carcinoma cell line CNE- 1 and to identify its possible mechanism.MethodsThe human nasopharyngeal carcinoma cells line CNE- 1 were cultured in vitro and the cells of the third generation in the logarithmic phase were randomly divided into the blank control group and RA (10, 20, 30 μmol/L) treatment groups. The cells of the RA groups were cultured in nutrient solutions with different concentrations of RA, and cells in the blank control group were cultured in the same nutrient solution without RA. Each group was cultured for 24 h, 48 h, and 72 h, respectively. And then the cellular growth inhibition rate in each group was determined by MTT. After CNE- 1 cells were incubated with RA for 48 h, we found that the relationship between concentration changes of RA and the rate of cellular growth inhibition was better than others. Therefore, the following experiment was carried out after CNE- 1 cells were incubated with RA for 48 h. After that, the morphological changes of the cells were observed under a fluorescence microscope with Hoechst 33258 staining. The apoptosis rate was detected by using flow cytometry with Annexin V- FTIC/PI staining, and the protein expression of PTEN, PI3K/Akt/mTOR signaling pathway was detected by Western blotting, respectively.ResultsCompared with the blank control group, RA inhibited the proliferation of human nasopharyngeal carcinoma cell line CNE- 1 in a dose- and time- dependent manner (P<0.05). Cells showed typical apoptosis state change and the apoptosis rate showed the way of dose- dependent manner after treatment by RA. The apoptosis rate of each RA treatment group was significantly higher than that of the blank control group (allP<0.05). Meantime, there was significant difference in the apoptosis rate among the RA treatment groups (allP<0.05). Compared with the blank control group, the protein expression of PTEN was up- regulated while the expression of p- PI3K, p- Akt, and p- mTOR were down- regulated (allP<0.05), whereas the expression of PI3K, Akt, and mTOR were not significantly changed (allP>0.05).ConclusionRA could inhibit the cell proliferation and induce the apoptosis of human nasopharyngeal carcinoma cell line CNE- 1 with a dose- dependent manner by regulating the PI3K/Akt/mTOR signal transduction pathway.
rosmarinic acid; nasopharyngeal carcinoma; cell proliferation; apoptosis; mechanism; PI3K/Akt/mTOR signaling pathway
国家自然科学基金资助项目(81260511)。
杨沛霖(1991- ),男,硕士,主要研究方向为新药研究与开发。E- mail: 505489168@qq.com
蒋伟哲(1968- ),男,主任药师,主要研究方向为新药研究与开发。E- mail: 1263265243@qq.com 焦爱军(1967- ),女,副主任药师,主要研究方向为新药研究与开发。E- mail: 807249683@qq.com
10.3969/j.issn.1002- 266X.2017.36.001
R739.6
A
1002- 266X(2017)36- 0001- 04
2017- 03- 22)

