玫瑰香干红葡萄酒自然发酵过程中优势酵母分离鉴定及其应用潜力分析
阎贺静,时 月,刘 畅,赵琳琳
(1.河北科技师范学院食品科技学院,河北 昌黎 066600;2.国家粮食储备局武汉科学研究设计院,湖北 武汉 430079)
玫瑰香干红葡萄酒自然发酵过程中优势酵母分离鉴定及其应用潜力分析
阎贺静1,时 月1,刘 畅1,赵琳琳2
(1.河北科技师范学院食品科技学院,河北 昌黎 066600;2.国家粮食储备局武汉科学研究设计院,湖北 武汉 430079)
为酿造特色玫瑰香干红葡萄酒,开发本土发酵剂是目前重要发展方向。从昌黎产区玫瑰香干红葡萄酒自然发酵醪中共分离得到337 株酵母,通过WL(Wallerstein laboratory)鉴别培养基对其进行分类鉴定、计数,将其鉴别为7 大类,根据计数结果选取优势酵母接种至BIGGY(bismuth sulphite glucose glycine yeast)固体培养基,从中进一步筛选不产H2S酵母,进行分子鉴定,结果显示HBKS-Y1、HBKS-Y3为酿酒酵母,HBKS-Y 2为葡萄汁有孢汉逊酵母。考察3 株本土酵母酿造因子耐性,发现3 株酵母对乙醇、SO2、糖度均具有较高耐性,满足葡萄酒酿造要求;以商用活性干酵母FX10葡萄汁发酵为对照,考察3 株酵母对玫瑰香葡萄汁单菌、混菌发酵理化指标和香气成分的影响,3 株本土酵母单菌和混菌发酵各指标(例如:还原糖、酒精度、总酸、挥发酸、甘油和乙醛含量)均符合干红葡萄酒酿造标准。同时发现,与HBKS-Y2单菌发酵相比,3 株酵母混菌发酵总酸和挥发酸含量降低,对葡萄酒有益,且混菌发酵对葡萄酒其他理化指标没有不利影响。本土酵母发酵尤其是混菌发酵,表征玫瑰香品种香气的萜烯醇类物质含量明显高于活性干酵母发酵。以上结果表明,3 株本土酵母可以应用于玫瑰香干红葡萄酒的酿造,且3 株酵母混菌发酵对突出玫瑰香干红葡萄酒品种香气具有一定的应用潜力。
玫瑰香干红葡萄酒;本土酵母;分离;鉴定;酿造特性;混菌发酵
目前,与法国、意大利等葡萄酒产业发展历史悠久的国家相比,我国在葡萄酒酵母筛选鉴定及自主复合发酵剂研制等应用基础方面的研究相对薄弱,这使得我国目前生产葡萄酒所用的菌种主要依赖进口,导致葡萄酒同质化问题严重,这一直成为制约我国特色葡萄酒产业发展的关键问题。因此,大力发掘我国本土宝贵的酵母资源,是解决这一瓶颈的关键所在。昌黎是我国历史悠久的葡萄与葡萄酒产区,玫瑰香是昌黎产区重要的鲜食和酿酒两用葡萄品种。由玫瑰香酿造的玫瑰型葡萄酒口味清爽优雅,具有迷人的玫瑰香气,果味突出,具有明显的品种特征,受到广大消费者的喜爱。但是,近些年来由于缺乏产区酿酒酵母(Saccharomyces cerevisiae),玫瑰香干红葡萄酒的酿造多采用进口活性干酵母进行,导致玫瑰香干红葡萄酒风格单一,品种特色不突出。为了开发地域特色明显、品种特色突出的玫瑰香干红葡萄酒,筛选具有优良酿造特性的本土酵母是开发特色玫瑰香干红葡萄酒的重要途径。
葡萄酒酿造是一个由多种微生物参与的复杂生物化学过程,其中酵母菌的种类和含量对葡萄酒的风味特征有重要影响。我国葡萄种植面积广,各葡萄产区生态条件差异大,可生产不同种类和风味的酿酒葡萄。但我国有关葡萄酒酵母的研究和利用相对滞后,葡萄酒的酿造多依赖进口活性干酵母。活性干酵母虽发酵速率高、产品质量稳定,但容易造成葡萄酒口味趋同,导致我国葡萄酒同质化严重,地域和品种特色不突出[1]。传统的葡萄和葡萄酒产区,经过长时间的优胜略汰,含有大量适合本地气候、环境特点的本土酵母,结合葡萄品种特点,很易酿造出具有地域和品种特色的葡萄酒[2-3]。随着对本土酵母研究的深入,越来越多的研究证明了本土酵母在酿造地域和品种特色葡萄酒中的应用潜力[2,4]。因此,近些年来采用本土酵母作为发酵剂成为特色葡萄酒酿造新的发展方向和研究热点[5-6]。人们过去认为非酿酒酵母(non-Saccharomyces,NSC)会对葡萄酒的酿造带来不利影响,随着对NSC研究的深入,发现这种认识并不全面。近年来的许多研究发现,NSC对葡萄酒的风味和感官具有积极作用[7-9]。同时,NSC与S. cerevisiae混菌发酵还可以调节葡萄酒的风味[4-5,10]。例如:Metschnikowia pulcherrima和S. cerevisiae共同进行酒精发酵时具有明显的协同作用,促进了脂肪酸、酯和萜烯等多种芳香物质的形成[11];将Torulaspora delbrueckii与S. cerevisiae同时或依次接入葡萄醪中进行酒精发酵,提高了葡萄酒中酒精和具果香的酯类物质的含量,降低了乙酸的含量[11],这充分显示了混菌进行酒精发酵的优势。因此,许多学者建议在S. cerevisiae进行酒精发酵的同时,添加NSC进行混菌发酵,这样既避免了葡萄酒酸败的风险,同时又保留了自然发酵的优势[12]。因此,展开本土酵母资源的研究,开发S. cerevisiae和NSC混菌发酵剂是酿造特色葡萄酒的重要途径。目前,我国学者正开展大量研究挖掘本土酵母资源,对我国葡萄酒酿造酵母资源的多样性有了更深一步的了解[4,13-16]。但对这些酵母资源的开发与利用的研究还处于起步阶段,有关本土酵母的酿造特性和应用潜力的相关研究还较少。目前,国内已有研究者对昌黎产区本土酵母资源的多样性开展了研究[17-19],但对昌黎本土酵母资源的研究深度、开发和应用还远远不够,更鲜有从中分离适合玫瑰香干红葡萄酒酿造的本土酵母的相关研究报道。
本实验从玫瑰香干红葡萄酒自然发酵醪中分离纯化优势酵母,对玫瑰香葡萄汁进行单菌和混菌发酵,探讨所选本土酵母在玫瑰香干红葡萄酒酿造中的应用潜力,为特色玫瑰香干红葡萄酒酿造用优良酵母及混合发酵剂的开发提供参考。
1 材料与方法
1.1 材料与试剂
玫瑰香葡萄(Vitis vinifera L. cv. Muscat Hamburg),2014年10月份购自河北省秦皇岛市昌黎县葡萄沟。
商用活性干酵母FX10 法国Laffort公司;甘油和乙醛含量测定试剂盒 爱尔兰Megazyme公司。
1.2 仪器与设备
7890B-5977气相色谱-质谱联用仪 美国Agilent公司。
1.3 方法
1.3.1 玫瑰香葡萄自然发酵醪中酵母菌的分离、筛选和初步分类鉴定
玫瑰香葡萄除梗、破碎置于无菌容器,于室温进行自然发酵。分别于发酵前、中、后期取样,样品梯度稀释后涂布于酵母浸出物葡萄糖(yeast extract peptone dextrose,YPD)培养基,28 ℃培养2~3 d,从适宜稀释度平皿中挑取全部酵母菌落并进行计数、保藏。将保藏的酵母分别点种于WL(Wallerstein laboratory)鉴别培养基,于28 ℃培养5~7 d,观察记录菌落特征,对不同形态特征酵母进行分类、计数[20]。根据计数结果,选取其中优势酵母点种于BIGGY(bismuth sulphite glucose glycine yeast)固体培养基,28 ℃培养4~7 d,每天观察菌落颜色变化,根据颜色深浅判断菌株H2S产生能力,从中分离不产H2S酵母并保藏。判断标准:认为颜色依次从白色、奶油色、浅棕色、棕色、深棕色、黑色为由浅变深,颜色越深表明H2S产生能力越强[21]。
1.3.2 玫瑰香葡萄自然发酵醪中优势酵母的分子鉴定
将保藏菌种接种于斜面PDA培养基,培养2~3 d后挑取菌体至50 μL TaKara裂解缓冲液(Code No.9164),80 ℃变性15 m in,离心,取上清液为模板,选用TaKara试剂盒(Code No.RR178)对酵母26S rDNA扩增并测序。使用Takara试剂盒(Code No.9762)切胶回收目的片段,以Seq Forward为引物进行DNA测序,测序结果在NCBI数据库进行比对。
1.3.3 本土酵母生长曲线测定
将酵母菌接种于100 m L豆芽汁液体培养基,于28 ℃、180 r/m in摇床培养18 h,备用。将50 m L豆芽汁培养基分装至100 m L三角瓶中高压灭菌,接入2 m L测试菌液,28 ℃、180 r/m in恒温培养。以未接种培养基为空白,从0 h开始每4 h取样至稳定期,测样品600 nm波长处吸光度并绘制生长曲线。所有实验均设置3 个平行。
1.3.4 本土酵母酿造因子耐性分析
分别将10 μL测试菌接种至不同乙醇体积分数(10%、12%、14%和16%),不同SO2质量浓度(200、250 mg/L和300 mg/L),不同葡萄糖质量浓度(100、200、300、400、500 g/L和600 g/L)的YPD培养基中,28 ℃培养72 h,观察菌株生长情况,判断酵母对乙醇、SO2和糖的耐受性。所有实验均设置3 个平行。
1.3.5 葡萄汁发酵实验及理化指标测定
调整玫瑰香葡萄汁糖度为21%(质量分数),将活性干酵母FX 10、本土酵母单菌或3 株菌共同接种至灭菌葡萄汁,接种量为106个/m L,20 ℃条件下进行发酵。每隔24 h取样测理化指标,发酵液比重低于0.993时终止发酵。依据GB/T 15038—2006《葡萄酒、果酒通用分析方法》测定发酵液中还原糖、酒度、总酸、挥发酸含量,发酵液中甘油和乙醛含量均采用试剂盒测定。所有实验均设置3 个平行。
1.3.6 葡萄酒香气成分测定
葡萄汁发酵结束后取样,10 000 r/m in离心15 m in,取上清液冷冻贮藏备用。取5 m L酒样加入顶空瓶,同时加入1 g NaCl和10 μL 2-辛醇(内标),加盖密封,40 ℃恒温搅拌30 m in,将固相微萃取头插入顶空瓶静态吸附30 m in,将萃取头插入气相色谱进样口,250 ℃热解吸5 m in。气相色谱分离条件:HP-5ms石英弹性毛细管柱(30 m×0.25 mm,0.25 μm);载气He(99.99%),流速1.0 m L/m in,不分流;升温程序:起始温度为50 ℃,保持1 m in,以3 ℃/m in升至230 ℃,保持10 m in,再以5 ℃/m in升至250 ℃,保持3 min。质谱检测条件:电子电离源温度230 ℃,电压70 eV,接口温度250 ℃,四极杆温度150 ℃,质量扫描范围m/z 33~450。
1.4 数据处理
数据采用Excel 2007进行计算。本实验中检测结果用SPSS 19软件进行统计分析。
2 结果与分析
2.1 玫瑰香干红葡萄酒自然发酵醪中酵母菌的分离鉴定
通过平板分离,从玫瑰香干红葡萄酒自然发醪中共分离得到337 株本土酵母。根据菌落在WL培养基中的不同形态和颜色特征,将其初步鉴定为7 大类:S. cerevisiae(2 种)、葡萄汁有孢汉逊酵母(Hansen iaspora uvarum)、膜毕赤氏酵母、假丝酵母和粟酒裂殖酵母,其中一种酵母菌落形态特征文献中未提及,暂时未能鉴定。过量的H2S会使葡萄酒呈现臭鸡蛋味,因此葡萄酒酿造酵母的筛选应避免选用产H2S的酵母。根据WL培养基计数结果,将其中3种优势酵母分别点种于BIGGY固体培养基,根据菌落颜色的深浅筛选出3 株不产H2S酵母菌株,分别编号为HBKS-Y 1、HBKS-Y 2、HBKS-Y 3。对3 株酵母菌26S rDNA D1/D2区序列进行聚合酶链式反应扩增测序,并在NCBI数据库中进行比对(基因库接受号分别为LC002242.1、HM 627056.2和KM 055472.1),结果HBKS-Y1和HBKS-Y3被鉴定为S. cerevisiae,HBKS-Y2被鉴定为H. uvarum,此结果与WL培养基初步鉴定结果一致。
2.2 本土酵母HBKS-Y1、HBKS-Y2和HBKS-Y3的酿造特性
2.2.1 本土酵母HBKS-Y1、HBKS-Y2和HBKS-Y 3的生长曲线
生长曲线测定结果表明,3 株本土酵母菌生长趋势基本一致,都具有显著的延滞期、对数生长期、稳定期,没有衰亡期(图1),这与文献有关酵母生长曲线的报道一致[10]。HBKS-Y1、HBKS-Y3和HBKS-Y2的对数生长期分别出现在发酵的8~24 h和4~16 h。表明HBKS-Y2进入对数生长期较早,但持续时间较HBKS-Y 1、HBKS-Y 3短,同时HBKS-Y 2菌体数量较HBKS-Y 1和HBKS-Y3低,这一研究结果与Moreira等[11]关于H. uvarum的研究结果一致。
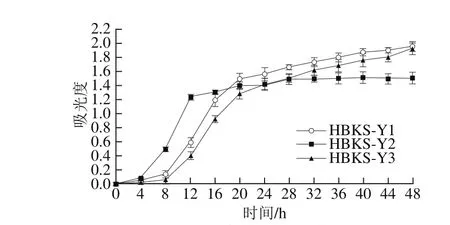
图1 3 株本土酵母生长曲线Fig. 1 Grow th curve of the indigenous yeasts
2.2.2 本土酵母HBKS-Y1、HBKS-Y2和HBKS-Y 3的酿造因子耐性分析
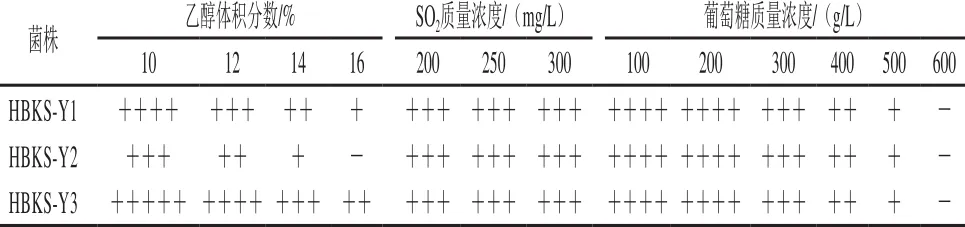
表1 3 株本土酵母酿造因子耐受性Table 1 Tolerance of the indigenous yeast strains
表1数据表明,HBKS-Y 1、HBKS-Y2和HBKS-Y3可分别耐受16%、14%和16%的乙醇溶液,均对酒精具有一定的耐受性,能满足葡萄酒正常发酵需求。在SO2质量浓度为200~300 mg/L时3 株菌均能生长,说明3 株酵母对SO2均具有一定的耐受性,能够在葡萄酒酿造SO2范围内正常发酵。3 株本土酵母均能耐受500 g/L以下的葡萄糖质量浓度,但不能耐受600 g/L的糖质量浓度。
2.2.3 本土酵母HBKS-Y1、HBKS-Y 2和HBKS-Y3发酵实验
HBKS-Y1、HBKS-Y2和HBKS-Y3单菌及3 株酵母混菌发酵均能在11 d内完成(图2)。发酵结束后,活性干酵母发酵残糖量最低,发酵最彻底(表2)。据报道,酒精发酵结束时残糖量若大于4 g/L则表明发酵不彻底,有酸败的危险[22]。HBKS-Y2单菌发酵速度相对较慢,残糖量高于4 g/L,有酸败危险;但与HBKS-Y 1、HBKS-Y 3混菌发酵后,发酵速度有所提升,残糖量降低(图2和表2),说明HBKS-Y 2不会延缓混菌发酵。发酵结束后,活性干酵母发酵酒度(乙醇体积分数)最高(12.869%),HBKS-Y 2产乙醇能力介于HBKS-Y 1和HBKS-Y3之间,混菌发酵对3 株菌产乙醇能力稍有影响。

图2 本土酵母发酵过程中还原糖含量Fig. 2 Change in reducing sugar content during w ine fermentation
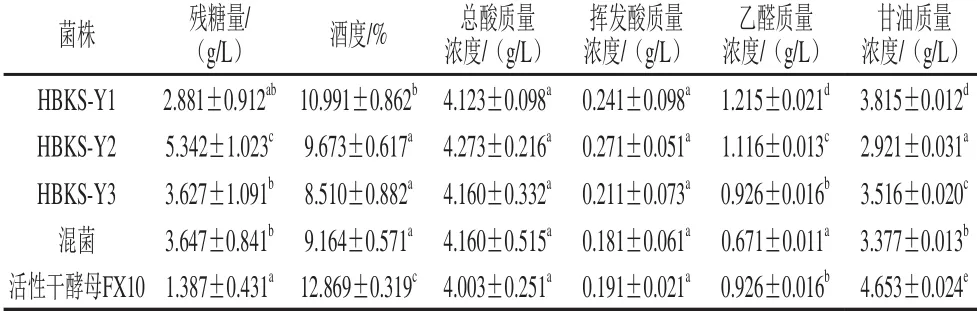
表2 本土酵母葡萄汁发酵实验结果Tab le 2 Physicochem ical properties of w ines fermented w ith the indigenous yeast strains
HBKS-Y2单菌发酵总酸质量浓度最高(4.273 g/L),活性干酵母发酵最低(4.003 g/L),混菌发酵对HBKS-Y 2产酸有抑制作用,有利于总酸含量的降低。GB 15037—2006《葡萄酒》中规定葡萄酒中总酸与总糖含量的差值不大于2.000 g/L即可,本实验所有发酵结果均符合此要求。各发酵形式挥发酸含量均保持在较低水平(表2),符合葡萄酒酿造国标要求,HBKS-Y2单菌发酵挥发酸质量浓度最高(0.271 g/L),混菌发酵可显著降低葡萄酒中挥发酸含量。混菌发酵乙醛含量最低,甘油含量仅次于活性干酵母发酵(表2),表明混菌发酵对乙醛和甘油的影响有益于葡萄酒感官和风味。
2.3 本土酵母HBKS-Y1、HBKS-Y2和HBKS-Y3发酵酒样香气成分
不同酵母对玫瑰香葡萄汁进行发酵,气相色谱-质谱检测和分析酒样香气成分。HBKS-Y 3单菌发酵香气成分种类最多(49 种),活性干酵母发酵次之(42 种),3 株本土酵母混菌发酵香气成分种类最少(28 种)。
酯类物质是葡萄酒最重要的香气成分,表3分别列出了不同发酵主要酯类物质及其含量。其中活性干酵母发酵酯类物质总量最高(168.500 mg/L),混菌发酵最低(43.641 mg/L),远低于各酵母单菌发酵,表明混菌发酵抑制了各酵母的产酯能力,这一点与文献报道H. uvarum可以增加葡萄酒中酯类物质含量的报道并不一致[5]。乙酸乙酯是葡萄酒中最重要和最常见的酯类物质,乙酸乙酯含量过高会使葡萄酒带有强烈的醋酸味,对葡萄酒风味不利。HBKS-Y 2发酵乙酸乙酯质量浓度最高(111.028 mg/L),远高于其他发酵形式,混菌发酵含量仅为HBKS-Y 2单菌发酵时的9.46%。表明混菌发酵抑制乙酸乙酯的形成,对葡萄酒的风味产生有益影响。
高级醇为葡萄酒重要香气成分,含量适当时赋予葡萄酒复杂感。表3列出了不同发酵产生的主要高级醇及其含量。HBKS-Y3发酵高级醇总量最高(379.12 mg/L),活性干酵母发酵次之(378.792 mg/L),HBKS-Y2发酵最低(248.33 mg/L)。混菌发酵高级醇总量为276.74 mg/L,远低于S. cerev isia e发酵,表明混菌发酵抑制了S. cerevisiae(HBKS-Y1和HBKS-Y3)高级醇的产生。

表3 不同本土酵母发酵葡萄酒样中主要香气成分含量Table 3 Aroma compounds identified in Muscat wines from different yeast fermentations
萜烯醇类物质是玫瑰香葡萄重要的品种香气。由表4可见,虽然活性干酵母发酵检测出的萜烯醇种类最多(6种),HBKS-Y1单菌发酵检测出的种类最少(4种),但混菌发酵萜烯醇类物质总量最高(416.525 μg/L),活性干酵母发酵总量最低(293.686 μg/L)。由此可见,本土酵母发酵尤其是混菌发酵最有利于提高葡萄酒中萜烯醇类物质的含量。

表4 不同本土酵母发酵葡萄酒样中萜类物质含量Tab le 4 Terpene concentrations in M uscat w ines from different indigenous yeasts fermentation
3 讨 论
3.1 NSC对葡萄酒酿造的影响
本实验从玫瑰香干红葡萄酒自然发酵醪中分离出2 株S. cerevisiae和1 株H. uvarum,为玫瑰香干红葡萄酒自然发酵过程中的优势酵母。参与葡萄酒酿造的酵母主要有两大类:S. cerevisiae和NSC。在葡萄酒酿造过程中,S. cerevisiae将糖转化为乙醇和CO2,是葡萄酒酿造的主要完成者。通常认为,发酵初期NSC占主导地位,随着发酵的进行S. cerevisiae迅速替代NSC直至酒精发酵结束[12]。过去认为,NSC通常会产生较高含量的挥发酸、乙醛等不良风味物质,同时还会引起葡萄酒的酸败,对葡萄酒酿造不利[23-24]。所以,现代化的葡萄酒酿造只使用单一活性干酵母作为葡萄酒发酵剂。随着对NSC研究的深入,发现许多NSC对葡萄酒的风味和感官具有积极作用[25-27]。因此,越来越多的研究关注NSC在葡萄酒酿造过程中的作用。
H. uvarum是葡萄酒自然发酵醪中最常见的NSC,同时也是各葡萄酒产区含量较高的NSC之一[4,16]。传统观点认为H. uvarum发酵效率低、发酵不彻底、不耐酒精,且生成较多的醋酸,是对葡萄酒质量不利的菌种[23]。有研究报道,尖端酵母(H. uvarum属于尖端酵母)与S. cerevisiae混菌发酵,会对S. cerevisiae生长繁殖不利,从而导致发酵延滞甚至酸败[23,28]。但有研究发现,H. uvarum与S. cerevisiae混菌发酵可以增加葡萄酒的香气复杂性,有利于葡萄酒的质量提高[5]。近些年来,由于较高的产酯能力及其对葡萄酒风味和质量的有利作用,H. uvarum越来越受研究者的关注[5,23]。
为筛选适合玫瑰香干红葡萄酒酿造发酵剂,本研究重点考察3 株酵母的葡萄酒酿造特性,并以商用活性干酵母FX10发酵为对照,初步探讨3 株本土酵母混菌发酵应用于玫瑰香干红葡萄酒酿造的可能性,及其对于突出玫瑰香干红葡萄酒品种香气的应用潜力。
3.2 本土酵母对葡萄酒酿造因子耐受性分析
在葡萄酒的酿造中,酵母酒精耐受性低可能会导致发酵缓慢甚至中止,因此具有较高酒精耐性是保证发酵顺利进行的前提条件。本研究考察的3 株酵母均对酒精具有一定的耐受性,可以满足葡萄酒的正常发酵需求。但S. cerevisiae HBKS-Y 1和HBKS-Y 3对乙醇耐受性高于HBKS-Y2,这一结果与一些文献中关于H. uvarum酒精耐受性低的报道一致[11,23]。在葡萄酒生产过程中,加入适量的SO2可以抑制有害微生物,同时可达到抗氧化、护色等作用。优良葡萄酒酵母需对SO2具有一定的耐受性。本实验获得的3 株菌对SO2具有一定的耐受性,能够在葡萄酒酿造SO2范围内正常发酵。葡萄自然发酵过程中存在的一些NSC,本身发酵能力差、不能单独完成酒精发酵,同时对乙醇、SO2的耐性低,这是导致NSC在酒精发酵过程中数量降低甚至消失的原因之一。但也有些研究提出酒精发酵时NSC的衰亡是S. cerevisiae本身引起的,而不是乙醇的作用[29-30];尤其是现在还分离到一些NSC,它们对酒精耐性远大于曾经报道的数据,更说明酒精并不是引起NSC衰亡的关键因素[31]。本实验所筛选到的HBKS-Y2,是玫瑰香干红葡萄酒自然发酵过程中的优势酵母,WL培养基计数结果表明,该菌存在于自然界过程中的各个时期,说明HBKS-Y 2对葡萄酒酿造因子具有一定的耐性,具有一定的应用潜力。
3.3 本土酵母混菌发酵对葡萄酒理化指标的影响
目前的一些研究发现,混菌发酵过程中酵母间会产生不利影响,例如:某些NSC分泌的中长链脂肪酸对S. cerev isiae有抑制作用[24]。同时,有研究表明S. cerevisiae代谢产物中某些蛋白或抗菌肽AMP可能是混菌发酵过程中导致NSC提前衰亡的主要原因[31-34]。以上研究说明,顺利完成混菌发酵并非易事,需对酵母间的交互作用进行有效控制。但需要确定混菌发酵过程中S. cerevisiae和NSC的交互作用机理,但目前尚无明确的研究结果。
本实验中3 株优势酵母单菌和混菌发酵结果发现,HBKS-Y 2与HBKS-Y 1、HBKS-Y 3混菌发酵相互之间没有不利影响,发酵液中酒精度、残糖量、总酸和挥发酸含量均在干红葡萄酒正常发酵范围之内(表2),表明3 株本土酵母单菌或混菌均能顺利完成酒精发酵。虽然HBKS-Y 2单菌发酵挥发酸含量较高,但与HBKS-Y 1、HBKS-Y 3混菌发酵后挥发酸总量降低显著,低于各单菌发酵。可见3 株本土酵母混菌发酵抑制了HBKS-Y2挥发酸物质的合成,对葡萄酒的风味起积极作用,这一结果与文献报道的混菌发酵过程中,H. uvarum不会引起挥发酸含量增高的结果一致[5,27]。作者分析认为,3 株菌来自于昌黎玫瑰香干红葡萄酒自然发酵醪,是经过长期优胜劣汰存活、适应相应环境的优势酵母,相互之间具有一定的适应性,这对酿造地域特色葡萄酒是非常有利的,是开发特色葡萄酒酿造发酵剂的优良资源。以上分析表明,从昌黎产区玫瑰香干红葡萄酒自然发酵醪中分离获得的葡H. uvarum具有优良的酿造特性,可与本土S. cerevisiae进行混菌发酵。
3.4 本土酵母混菌发酵对葡萄酒香气的影响
香气是葡萄酒产品风格和特征差异的重要方面。参与酒精发酵的酵母菌种类和数量对葡萄酒的香气最为重要。不同酵母的生理活性及代谢过程不同,对风味物质的影响不同。HBKS-Y1和HBKS-Y3单菌发酵酒样香气成分种类远多于HBKS-Y2单菌和混菌发酵,说明混菌发酵中3 株酵母间产生了交互作用,影响了某些香气成分的合成,这一研究结果与文献报道混菌发酵可增加葡萄酒风味的复杂性并不太一致[27,32],具体原因需进一步研究。
乙酸乙酯是葡萄酒中主要酯类物质,质量浓度为150~200 mg/L时会给葡萄酒带来强烈的醋酸味[30]。尖端酵母,尤其是K. apiculata发酵会产生较高含量的乙酸和乙酸乙酯已被广泛报道[5,35-37]。这是之所以一些研究者尽量避免使用尖端酵母作为葡萄酒发酵剂的主要原因之一。表3的数据表明,与HBKS-YI、HBKS-Y 3单菌发酵相比,HBKS-Y2单菌发酵确实产生了大量的乙酸乙酯,但与HBKS-Y1和HBKS-Y3混菌发酵后,乙酸乙酯含量显著降低,说明3 株本土酵母混菌发酵抑制了HBKS-Y 2乙酸乙酯的生成,对葡萄酒香气产生有益作用。
文献报道,葡萄酒中高级醇总量低于300 m g/L时赋予葡萄酒愉悦的香气,当其总量高于400 m g/L时对葡萄酒香气产生不利影响[38]。经检测,活性干酵母、HBKS-Y 1、HBKS-Y 3单菌发酵高级醇总量远高于HBKS-Y 2单菌发酵,3 株酵母混菌发酵后高级醇含量虽高于HBKS-Y 2单菌发酵,但是却远低于HBKS-Y 1、HBKS-Y 3和活性干酵母发酵,表明混菌发酵过程中,HBKS-Y 2的存在与S. cerevisiae产生了交互作用,抑制了高级醇生产,对于控制酒样中高级醇的含量产生了积极作用。此结果与M o reira等[11]报道的尖端酵母(H. guilliermondii和H. uvarum)与S. cerevisiae混菌发酵可以降低葡萄酒中高级醇含量的研究结果一致。
葡萄酒香气成分中,萜烯类物质含量虽低,但其嗅觉阈值低,气味活性很高,且呈香具叠加效应,因此萜烯类物质是葡萄酒中重要的呈香成分[39]。玫瑰香葡萄是玫瑰香型葡萄的代表品种,萜烯类物质是玫瑰香葡萄的主要品种香气物质,其中橙花醇、香叶醇、里哪醇、香茅醇、松油醇等萜烯醇是最主要的萜烯物质,该类物质含量越高葡萄酒的品种香气越突出。表4的数据表明,活性干酵母发酵萜烯醇类物质种类最多,但本土酵母混菌发酵酒样中萜烯醇总量却最高,HBKS-Y1和HBKS-Y2单菌发酵酒样中萜烯醇物质总量次之,而商用活性干酵母发酵萜烯醇含量最低。由此可见,酒精发酵选用菌种对葡萄品种香气的含量具有重要影响。以上分析表明,本土酵母尤其是混菌发酵有利于增加葡萄酒中萜烯醇类物质的含量,从而更有利于突出玫瑰香干红葡萄酒的品种香气。传统的葡萄和葡萄酒产区的本土酵母,经过长时间的优胜劣汰,适应了本土气候和环境,许多研究证明本土酵母更加有益于酿造品种特色突出的葡萄酒[2-3]。本研究结果也进一步验证了这一点。
此外,葡萄中的萜类物质以糖苷结合态形式存在,不具挥发性,不能呈现香气。酿酒过程中,S. cerevisiae和葡萄浆果内源糖苷酶可以催化部分结合态萜类物质,但葡萄酒高糖量、高酒精、低pH值等酿造条件,限制了内源糖苷酶的活性[40],葡萄酒酿造过程中结合态萜类物质的水解并不充分。新发酵生成的葡萄新酒中还存在大量的结合态香气糖苷。因此,在酿造过程中提高糖苷水解酶的活性,是突出葡萄酒品种香气的有效途径,尤其适用于萜烯类物质含量较高的麝香类葡萄品种的葡萄酒。近些年来,随着对NSC研究的深入,发现NSC较S. cerevisiae含有更多的糖苷水解酶,将其应用于葡萄酒的酿造,对于促进葡萄酒中结合态糖苷香气物质的水解,增加游离香气成分含量和种类起到积极促进作用[41-42]。表4数据表明,混菌发酵后萜烯醇类物质总量显著升高,很可能与HBKS-Y 2具有一定的糖苷水解酶活性有关。本课题组会进一步考察HBKS-Y 2的水解酶系、糖苷酶活性及其酿造因子耐性,以揭示该NSC对玫瑰香干红葡萄酒香气的影响机制,为葡萄酒香气的调控等相关研究提供参考数据。
4 结 论
本实验从昌黎玫瑰香干红葡萄酒自然发酵醪中分离获得3 株优势酵母,对其酿造特性及单菌、混菌发酵进行分析。发现,3 株本土酵母单菌和混菌发酵均符合干红葡萄酒酿造的标准;同时,与H. uvarum HBKS-Y2单菌发酵相比,混菌发酵降低总酸、挥发酸及乙酸乙酯含量;与S. cerevisiae HBKS-Y1和HBKS-Y3单菌发酵相比,混菌发酵酒样高级醇含量显著降低;虽然混菌发酵香气种类比活性干酵母发酵较少,但本土酵母发酵,无论单菌还是混菌发酵,表征玫瑰香葡萄品种香气的萜烯醇类物质总量均高于活性干酵母发酵。以上结果表明,3 株本土酵母混菌发酵,在玫瑰香干红葡萄酒酿造中具有一定的应用潜力,有助于突出玫瑰香干红葡萄酒的品种香气。
[1] 庞红勋, 崔艳, 刘金福, 等. 本土葡萄酒酵母的选育及发酵性能[J].食品研究与开发, 2010, 31(6): 169-173.
[2] HEARD G. Novel yeasts in w ine making looking to the future[J].Food Australia, 1999, 51(8): 347-352.
[3] SUZZI G, ARFELLI G, SCHIRONE M, et al. Effect of grape indigenous Saccharomyces cerevisiae strains on M ontepulciano d’ Abruzzo red w ine quality[J]. Food Research International, 2012,46(1): 22-29. DOI:10.1016/j.foodres.2011.10.046.
[4] SUN Y, GUO J J, LIU F B, et al. Identification of indigenous yeast flora isolated from the five w ine grape varieties harvested in Xiangning, China[J]. Antonie van Leeuwenhoek, 2014, 105(3): 533-540. DOI:10.1007/s10482-013-0105-0.
[5] MEDINA K, BOIDO E, FARIÜA L, et al. Increase flavour diversity of Chardonnay w ines by spontaneous fermentation and co-fermentation w ith Hanseniaspora vineae[J]. Food Chem istry, 2013, 141(3): 2513-2521. DOI:10.1016/j.foodchem.2013.04.056.
[6] CAPECE A, ROMANIELLO R, SIESTO G, et a1. Selection of indigenous Saccharomyces cerevisiae strains for N rod’Avola w ine and evaluation of selected starter implantation in pilot fermentation[J].International Journal of Food M icrobiology, 2010, 144(1): l87-192.DOI:10.1016/j.ijfoodm icro.2010.09009.
[7] MASSERA A, ASSOF M, STURM M E, et al. Selection o f indigenous Saccharomyces cerevisiae strains to ferment red musts at low temperature[J]. Annals of M icrobiology, 2012, 62(1): 367-380.DOI:10.1007/s13213-011-0271-0.
[8] 史学伟. 新疆石河子地区非酿酒酵母菌多样性及其对葡萄酒呈香效应研究[D]. 武汉: 华中农业大学, 2015: 51-67.
[9] GOBB I M, COM ITIN I F, DOM IZIO P, et al. Lachancea thermotolerances and Saccharomyces cerevisiae in simultaneous and sequential co-fermentation: a strategy to enhance acidity and improve the overall quality of w ine[J]. Food M icrobiology, 2013, 33(2): 271-281. DOI:10.1016/j.fm.2012.10.004.
[10] REGODÓDÓN J A, PÉREZ F, VALDÉS M, et al. A sim ple and effective procedure for selection of w ine yeast strains[J]. Food M icrobiology, 1997, 14(3): 247-254. DOI:10.1006/fm ic.1996.0091.
[11] MOREIRA N, MENDES F, DE PINHO P G, et al. Heavy sulphur com pounds, higher alcoho ls and esters p roduction p rofile o f Hanseniaspora uvarum and Hanseniaspora guilliermondii grow n as pure and m ixed cultures in grape must[J]. International Journal of Food M icrobio logy, 2008, 124(3): 231-238. DOI:10.1016/j.ijfoodmicro.2008.03.025.
[12] FLEET G H. Yeast interactions and w ine flavour[J]. International Journal of Food M icrobiology, 2003, 86(1/2): 11-22.
[13] 张强, 郭元, 韩德明. 酿酒酵母乙醇耐受性的研究进展[J]. 化工进展,2014, 33(1): 187-192.
[14] GREPPI A, RANTISOU K, PADONOU W, et al. Yeast dynam ics during spontaneous fermentation o f mawè and tchoukoutou,tw o traditional products from Benin[J]. International Journal of Food M icrobio logy, 2013, 165(2): 200-207. DOI:10.1016/j.ijfoodm icro.2013.05.004.
[15] FLEET G H. The m icrobiology of alcoholic beverages[M]//M icrobiology of Fermented Foods. Springer US, 1998: 217-262.
[16] JOLLY N P, AUGUSTYN O P H, PRETORIUS I S. The role and use of non-Saccharomyces yeasts in w ine production[J]. South A frican Journal of Enology and Viticulture, 2006, 27(1): 15-39.
[17] 凌云, 杨雪峰, 郭艾英, 等. 昌黎产区酿酒葡萄果表的酵母分离及发酵性能[J]. 食品科技, 2014, 39(12): 7-12.
[18] 蒋文鸿, 严斌, 陶永胜. 昌黎赤霞珠葡萄相关酿酒酵母的分离与筛选[J]. 食品工业科技, 2014, 35(12): 202-209.
[19] 杨美景. 河北省昌黎酿酒葡萄产区相关酵母菌分布规律研究[D]. 石家庄: 河北科技大学, 2011: 14-49.
[20] 薛军侠, 徐艳文, 杨莹, 等. WL培养基在酿酒酵母筛选中的应用[J].中国酿造, 2007, 26(9): 36-39.
[21] SIPICZKI M, POMANO P, LIPANI G, et al. Analysis of yeasts derived from natural fermentation in a Tokaj w inery[J]. Antonie van Leeuwenhoek, 2001, 79(1): 97-105.
[22] PÉREZ-COELLO M S, BRIONES PÉREZ A I, UBEDA IRANZO J F,et al. Characteristics of w ines fermented w ith different Saccharomyces cerevisiae strains isolated from the La M ancha region[J]. Food M icrobiology, 1999, 6(16): 563-573.
[23] MOREIRA N, PINA C, MENDES F, et al. Volatile compounds contribution of Hanseniaspora guilliermondii and Hanseniaspora uvarum during red wine vinifications[J]. Food Control, 2011, 22(5):662-667. DOI:10.1016/j.foodcont.2010.07.025.
[24] SW IEGERS J H, PRETORIUS I S. Yeast modulation of w ine flavor[J]. Advance App lied M icrobio logy, 2005, 57: 131-175.DOI:10.1016/S0065-2164(05)57005-9.
[25] CORDERO-BUESO G, ESTEVE-ZARZOSO B, CABELLOS J M, et al. Biotechnological potential of non-Saccharomyces yeasts isolated during spontaneous fermentation of Malvar (Vitis vinifera cv.L.)[J]. Europe Food Research Technology, 2013, 236(1): 193-207.DOI:10.1007/s00217-012-1874-9.
[26] ASSIS M O, SANTOS A P C, ROSA C A, et al. Impact of a non-Saccharomyces yeast isolated in the Equatorial region in the acceptance of wine aroma[J]. Food and Nutrition Sciences, 2014, 5(9):759-769. DOI:10.4236/fms.2014.59086.
[27] CIAN I M, COM ITIN I F, M ANNAZZU I, et al. Contro lled m ixed culture fermentation: a new perspective on the use of non-Saccharomyces yeasts in w inemaking[J]. FEMS Yeast Research, 2010,10(2): 123-133. DOI:10.1111/j.1567-1364.2009.00579.x.
[28] CIANI M, BECO L, COM ITINI F. Fermentation behaviour and metabolic interactions of multistarter w ine yeast fermentations[J].International Journal of Food M icrobiology, 2006, 108(2): 239-245.DOI:10.1016/j.ijfoodm icro.2005.11.012.
[29] SM ID E J, LACROIX C. M icrobe-m icrobe interactions in m ixed culture food fermentations[J]. Current Opinion in Biotechnology,2013, 24(2): 148-154. DOI:10.1016/j.copbio.2012.11.007.
[30] PÉREZ-NEVADO F, ALBERGARIA H, HOGG T, et al. Cellular death of two non-Saccharomyces w ine-related yeasts during m ixed fermentations w ith Saccharomyces cerevisiae[J]. International Journal of Food M icrobiology, 2006, 108(3): 336-345. DOI:10.1016/j.ijfoodm icro.2005.12.012.
[31] ALBERGARIA H, FRANCISCO D, GORI K, et al. Saccharomyces cerevisiae CCM I 885 secretes peptides that inhibit the grow th of some non-Saccharomyces wine-related strains[J]. Applied Microbiology Biotechnology, 2010, 86(3): 965-972. DOI:10.1007/s00253-009-2409-6.
[32] ANDORRÀ I, BERRADRE M, ESTEVE-ZARZOSO B, et al.Effect of m ixed culture fermentation on yeast populations and aroma pro file[J]. LWT-Food Science Techno logy, 2012, 49(1): 8-13.DOI:10.1016/j.lw t.2012.04.008.
[33] BRANCO P, FRANCISCO D, CHAMBON C, et al. Identification of novel GAPDH-derived antim icrobial peptides secreted by Saccharomyces cerevisiae and invo lved in w ine m icrobial interactions[J]. Applied M icrobiology Biotechnology, 2014, 98(2):843-853. DOI:10.1007/s00253-013-5411-y.
[34] SUN S, GONG H, JIANG X, et al. Selected non-Saccharomyces w ine yeasts in controlled multistarter fermentations with Saccharomyces cerevisiae on alcoholic fermentation behaviour and wine aroma of cherry wines[J]. Food M icrobiology, 2014, 44(6): 15-23. DOI:10.1016/j.fm.2010.12.001.
[35] HONG Y A, PARK H D. Role of non-Saccharomyces yeasts in Korean w ines produced from Campbell Eearly grapes: potential use of Hanseniaspora uvarum as a starter culture[J]. Food M icrobiology,2013, 34(1): 207-214. DOI:10.1016/j.fm.2012.12.011.
[36] ROJAS V, GIL J, PIÑAGA F, et al. Acetate ester formation in w ine by m ixed cultures in laboratory fermentations[J]. International Journal of Food M icrobiology, 2003, 86(1/2): 181-188.
[37] PLATA C, M ILLÁN C, MAURICIO J C, et al. Formation of ethyl acetate and isoam y l acetate by species of w ine yeasts[J]. Food M icrobiology, 2003, 20(2): 217-224.
[38] RAPP A, MANDERY H. W ine aroma[J]. Experientia, 1986, 42(8):873-884.
[39] 陶永胜, 彭传涛. 中国霞多丽干白葡萄酒香气特征与成分关联分析[J]. 农业机械学报, 2012, 43(3): 130-139. DOI:10.6041/j.issn.1000-1298.2012.03.025.
[40] LOSCOS N, HERNANDEZ P, CACHO J, et al. Release and formation of varietal aroma compounds during alcoholic fermentation from nonfloral grape odorless flavor precursors fractions[J]. Journal of Agricultural and Food Chem istry, 2007, 55(16): 6674-6684.DOI:10.1021/jf0702343.
[41] MATURANO Y P, ASSAF L A R, TORO M E, et al. Multi-enzyme production by pure and m ixed cultures of Saccharomyces and non-Saccharomyces yeasts during w ine fermentation[J]. International Journal of Food M icrobiology, 2012, 155(1/2): 43-50. DOI:10.1016/j.ijfoodm icro.2012.01.015.
[42] GAENSLY F, AGUSTINI B C, SILVA G A D, et al. Autochthonous yeasts w ith β-glucosidase activity increase resveratrol concentration during the alcoholic fermentation of Vitis labrusca grape must[J].Journal of Functional Foods, 2015, 19: 288-295. DOI:10.1016/j.jff.2015.09041.
Screening, Identification and Potential Use of Indigenous Yeasts from Muscat W ine Spontaneous Fermentation
YAN Hejing1, SHI Yue1, LIU Chang1, ZHAO Linlin2
(1. College of Food Science & Technology, Hebei Normal University of Science & Technology, Changli 066600, China;2. Wuhan Scientific Research & Design Institute, State Administration for Grain Reservation, Wuhan 430079, China)
Developing indigenous yeast strains is currently one of the most important trends in the production of featured Muscat w ine. In this work, 337 yeasts were isolated by using PDA medium from spontaneously fermented Muscat w ine,and then they were identified, counted and classified into seven groups by using Wallerstein laboratory (WL) solid medium.According to the results of yeast counting, the dominant strains were determined and then they were inoculated to bismuth sulphite glucose glycine yeast (BIGGY) agar to select yeast strains w ithout H2S production ability, and the selected strains were molecularly identified for further characterization of enological traits. The physicochemical indexes and volatile compounds of Muscat w ine fermented w ith these yeasts in mono-cultures or co-cultures were studied. Based on our experimental results, the potential of using these autochthonous yeast strains in Muscat w ine production were discussed.Out of 337 yeast strains, three were selected for less or no H2S production, which were cataloged as HBKS-Y1, HBKS-Y2 and HBKS-Y 3, and molecularly identified as Saccharomyces cerevisiae, Hanseniaspora uvarum and Saccharomyces cerevisiae, respectively. The alcohol, SO2and sugar tolerance of the 3 yeast strains were high and met the requirements of w ine vinification. When they were used to must fermentation either in mono- or co-culture, the physicochem ical indexes including reducing sugar, alcohol, total acids, volatile acids, glycerol and acetaldehyde contents were w ithin the range for dry red w ine. In mono-culture fermentation, HBKS-Y2 was a strong producer of total and volatile acids. When HBKS-Y2 was co-cultured w ith HBKS-Y 1 and HBKS-Y 3, a synergistic effect was observed, which resulted in a decrease in total acids content and a significant decrease in volatile acids content compared w ith single culture of HBKS-Y2 while havingno disadvantageous effects on the physicochem ical indexes of w ine. Furthermore, significantly higher contents of terpene alcohols, the characteristic aroma compounds of Muscat w ine, were produced by fermentation w ith indigenous yeasts especially in co-cultures compared w ith dry active yeast. These results suggest that HBKS-Y1, HBKS-Y2, and HBKS-Y3 can be used as a fermentation starter for Muscat w ine, and their co-culture has potential use in improving the variety-specific aroma of Muscat w ine.
Muscat w ine; indigenous yeast; screening; identification; enological characteristics; co-culture fermentation
2017-01-04
河北省教育厅项目(QN2014143);河北科技师范学院博士科研启动基金项目;秦皇岛市科学技术研究与发展计划项目(201101A176)
阎贺静(1978—),女,副教授,博士,主要从事酿造微生物学研究。E-mail:yhj2203yhj@163.com
10.7506/spkx1002-6630-201722018
TS262.6
A
1002-6630(2017)22-0117-08
阎贺静, 时月, 刘畅, 等. 玫瑰香干红葡萄酒自然发酵过程中优势酵母分离鉴定及其应用潜力分析[J]. 食品科学, 2017,38(22): 117-124. DOI:10.7506/spkx1002-6630-201722018. http://www.spkx.net.cn
YAN Hejing, SHI Yue, LIU Chang, et al. Screening, identification and potential use of indigenous yeasts from Muscat w ine spontaneous fermentation[J]. Food Science, 2017, 38(22): 117-124. (in Chinese w ith English abstract)
10.7506/spkx1002-6630-201722018. http://www.spkx.net.cn

