基于UPLC技术的吴茱萸定性定量一体化研究
樊小瑞 刘梓晗 冯伟红 刘晓谦 杨立新 王智民 李春

[摘要]采用UPLC建立吳茱萸指纹图谱和多成分同步测定方法。采用Waters Acquity BEH C18色谱柱(21 mm×50 mm,17 μm)色谱柱,02%甲酸乙腈02%甲酸水为流动相,梯度洗脱,检测波长320 nm。以去氢吴茱萸碱为参照峰,通过对29 批吴茱萸进行测定,建立了吴茱萸的UPLC指纹图谱,该指纹图谱可同时对24个共有峰进行检测,采用对照品对新绿原酸、绿原酸、隐绿原酸、金丝桃苷、异鼠李素3OβD芸香糖苷、去氢吴茱萸碱、吴茱萸碱、吴茱萸次碱、吴茱萸卡品碱和二氢吴茱萸卡品碱共10个色谱峰进行了指认。采用国家药典委员会“中药色谱指纹图谱相似度评价软件”2008A版进行相似度评价,29批药材中有19批药材相似度大于09。此外,采用同一色谱条件对吴茱萸中的9个成分进行了同步测定。所测定的9个成分新绿原酸、隐绿原酸、金丝桃苷、异鼠李素3OβD芸香糖苷、去氢吴茱萸碱、吴茱萸碱、吴茱萸次碱、吴茱萸卡品碱和二氢吴茱萸卡品碱分别在0000 46~0138, 0000 146~0175, 0000 412~0124, 0000 448~0134, 0000 452~0136, 0003 38~0169, 0000 44~0132, 0001 07~0128, 0001 71~0128 μg与各自峰面积积分值成良好线性关系,9种成分的平均加样回收率分别为1003%,1004%,1016%,9751%,1029%,1014%,1038%,1040%,9599%,RSD分别为24%,20%,30%,080%,19%,21%,11%,22%,24%。该文建立的UPLC方法在20 min内实现了对吴茱萸化学成分的全谱分离,与文献报道方法相比,该文在一个色谱条件下同时实现了吴茱萸指纹图谱测定和多成分同步测定,而且所建方法具有专属性强、分离度高、色谱峰纯度高、方法简单易行的特点,为吴茱萸药材同步进行定性和定量分析提供了依据。
[关键词]吴茱萸;指纹图谱;多成分同步测定;超高效液相色谱
[Abstract]An UPLC method was developed for the studies of fingerprint and quantification of multicomponents for Evodiae Fructus The chromatographic separation was performed on a C18 column (21 mm×50 mm,17 μm) with mobile phase of 02% formic acidacetonitrile and 02% formic acidwater in gradient mode, and the detection wavelength was set at 320 nm.Dehydroevodiamine was used as the reference peak, there were 24 common peaks in the fingerprint of 29 samples were detected, and among them 10 chromatographic peaks were identified with the reference substance and they were neochlorogenic acid, chlorogenic acid, cryptochlorogenic acid, hyperin, isorhamnetin3OβDrutinoside, dehydroevodiamine, evodiamine, rutaecarpine, evocarpine and dihydroevocarpine The fingerprint data was evaluated with similarity evaluation system for chromatographic fingerprint of traditional Chinese medicine (Version 2008A), and the similarity of 19 batches of Evodiae Fructus was greater than 09 in the 29 samples In addition, 9 components including neochlorogenic acid, chlorogenic acid, hyperin, isorhamnetin3OβDrutinoside, dehydroevodiamine, evodiamine, rutaecarpine, evocarpine and dihydroevocarpine were simultaneously determined at the same chromatographic conditions, whose peak area integral values showed good linear relationship at the range of 0000 460138, 0000 1460175, 0000 4120124, 0000 4480134, 0000 4520136, 0003 380169, 0000 440132, 0001 070128, 0001 710128, respectively Their average recoveries were 1003%, 1004%, 1016%, 9751%, 1029%, 1014%, 1038%, 1040%, 9599%, and RSD were 24%, 20%, 30%, 080%, 19%, 21%, 11%, 22%, 24%, respectively The established UPLC method not only realized the full separation of all chemical constituents of Evodiae Fructus within 20 minutes, but also achieved the chromatographic fingerprint determination and simultaneous multicomponents determination of Evodiae Fructus at the same chromatographic conditions Compared with other methods in literatures, the method has the following characteristics of strong specificity, good separation, high purity of chromatographic peaks, simplity and feasibility, which provides better means for the simultaneous qualitative and quantitative analysis of Evodiae Fructus.endprint
[Key words]Evodiae Fructus; chromatographic fingerprint; simulataneous multicomponent determination; UPLC
2015年版《中国药典》规定吴茱萸为芸香科Rutaceae植物吴茱萸Evodia rutaecarpa (Juss) Benth,石虎E rutaecarpa (Juss) Benth var officinalis (Dode) Huang 或疏毛吴茱萸E rutaecarpa (Juss) Benth var bodinieri (Dode) Huang的干燥近成熟果实,具有散寒止痛,降逆止呕,助阳止泻之功效,用于厥阴头痛,寒疝腹痛,寒湿脚气,经行腹痛,脘腹胀痛,呕吐吞酸,五更泄泻等的治疗[1]。现代药理研究表明其有镇痛、抗菌、降压、抗炎等作用,其主要化学成分有生物碱、萜类(柠檬苦素类)、黄酮、甾体、酚酸、木脂素、挥发油和多糖等[26]。2015年版《中国药典》规定按干燥品计算,吴茱萸中含吴茱萸碱和吴茱萸次碱的总量不得少于015%,柠檬苦素不得少于020%。近年来有大量吴茱萸质量控制的文章面世,研究热点主要集中在吴茱萸多成分同步测定和指纹图谱研究上[7],研究方法绝大多数采用HPLC,仅4篇文章用到UPLC方法[811],多成分测定的检测指标多是在吴茱萸碱、吴茱萸次碱和柠檬苦素的基础上增加几个喹诺酮类生物碱[1213]或黄酮和酚酸类成分[14],测定数目最多为7个成分同步测定;指纹图谱研究也是多采用HPLC方法,分析时间28~140 min不等,共有峰最多32个,指认色谱峰最多13个[1516]。但是,迄今为止所有文献报道的吴茱萸多成分同步测定和指纹图谱研究都没有融会贯通,基本是各自采用不同的方法进行,目前尚未见用同一色谱条件同时完成吴茱萸指纹图谱和多成分同步测定研究的文献报道。
因此,本文在优化UPLC分析方法的基础上,用同一色谱条件同时完成了吴茱萸药材指纹图谱和多成分含量测定研究,即一套方法可以同时进行吴茱萸药材的定性定量分析,这无疑会降低吴茱萸药材的检测成本,提高分析效率。
1材料
Waters Acquity UPLC HClass 超高效液相色谱仪,Empower3色谱工作站(美国,沃特世公司); XS205型1/10万分析天平(瑞士,梅特勒托利多仪器有限公司);8320型电热恒温水浴锅(北京长风仪器仪表公司)。
甲醇和乙腈均为HPLC级(美国Fisher公司),水为屈臣氏纯净水,甲酸为分析纯(国药集团化学试剂有限公司)。
吴茱萸碱(批号W012140801,纯度≥98%)、吴茱萸次碱(批号W013140801,纯度≥98%)、去氢吴茱萸碱(批号Q068150520)、异鼠李素3OβD芸香糖苷(批号S063150317)、绿原酸(批号L007140730)和金丝桃苷(批号J012140730),以上对照品均购自成都瑞芬思生物科技有限公司;吴茱萸卡品碱(批号160324xz)购自成都克洛玛生物科技有限公司;二氫吴茱萸卡品碱(批号SH03209)购自北京赛百草科技有限公司;新绿原酸(批号MUST13013001)和隐绿原酸(批号MUST13013002)购自成都曼思特生物科技有限公司。按HPLC面积归一化法计算,以上所有对照品含量均≥98%。
吴茱萸药材于201510~201610分别购买于全国各地药材市场,经中国中医科学院中药研究所李春研究员鉴定为吴茱萸Evodiae Fructus的干燥近成熟果实,29批吴茱萸药材信息见表1。
2方法与结果
21吴茱萸药材指纹图谱研究
211色谱条件色谱柱:Acquity UPLC BEH C18(21 mm×50 mm,17 μm);流动相02%甲酸乙腈(A) 02%甲酸水(B),梯度洗脱,洗脱程序见表2。检测波长320 nm;流速0613 mL·min-1;进样量05 μL,柱温30 ℃。
212供试品溶液的制备取本品粉末(过40目筛)约025 g,精密称定,置具塞锥形瓶中,精密加入甲醇50 mL,密塞,称重,加热回流提取1 h,取出,放冷,再称重,用甲醇补足失重,摇匀,滤过,取续滤液,即得。
213对照品溶液的制备分别取新绿原酸、绿原酸、隐绿原酸、金丝桃苷、异鼠李素3OβD芸香糖苷、去氢吴茱萸碱、吴茱萸碱、吴茱萸次碱、吴茱萸卡品碱、二氢吴茱萸卡品碱对照品适量,精密称定,加甲醇制成每1 mL含新绿原酸0115 mg、绿原酸0096 mg、隐绿原酸0146 mg、金丝桃苷0103 mg、异鼠李素3OβD芸香糖苷0112 mg、去氢吴茱萸碱0113 mg、吴茱萸碱0141 mg、吴茱萸次碱0110 mg、吴茱萸卡品碱0107 mg和二氢吴茱萸卡品碱0107 mg的混合溶液,即得1#混合对照品溶液。将1#混合对照品溶液分别稀释10倍、25倍和100倍,制备得2#、3#和4#混合对照品溶液。
214精密度试验取同一份吴茱萸药材(编号3)供试品溶液,按211项方法连续进样6次,记录UPLC图谱。以去氢吴茱萸碱为参照峰,分别计算各共有峰的相对保留时间和相对峰面积,并计算RSD。结果各共有峰相对保留时间的RSD均<20%,相对峰面积的RSD均<30%,测定结果符合中药指纹图谱的要求,表明仪器的精密度良好,见表3。
215稳定性试验取吴茱萸药材粉末(编号3)约025 g,按212项方法制备供试品溶液,分别于供试品溶液制备后的第0,2,4,6,12,14 h按211项方法进样,记录UPLC图谱。以去氢吴茱萸碱为参照峰,分别计算各共有峰的相对保留时间和相对峰面积,并计算RSD。结果各共有峰相对保留时间的RSD均<20%,相对峰面积的RSD均<30%,测定结果符合中药指纹图谱的要求,表明14 h内供试品溶液的稳定性良好,见表4。endprint
216重复性试验取吴茱萸药材粉末(编号3)约025 g,平行6份,分别按照212项方法制备供试品溶液,按211项方法进样,记录UPLC图谱。以去氢吴茱萸碱为参照峰,分别计算各共有峰的相对保留时间和相对峰面积,并计算RSD。结果各共有峰相对保留时间的RSD均<20%,相对峰面积的RSD均<30%,测定结果符合中药指纹图谱的要求,表明本方法的重复性良好,见表5。
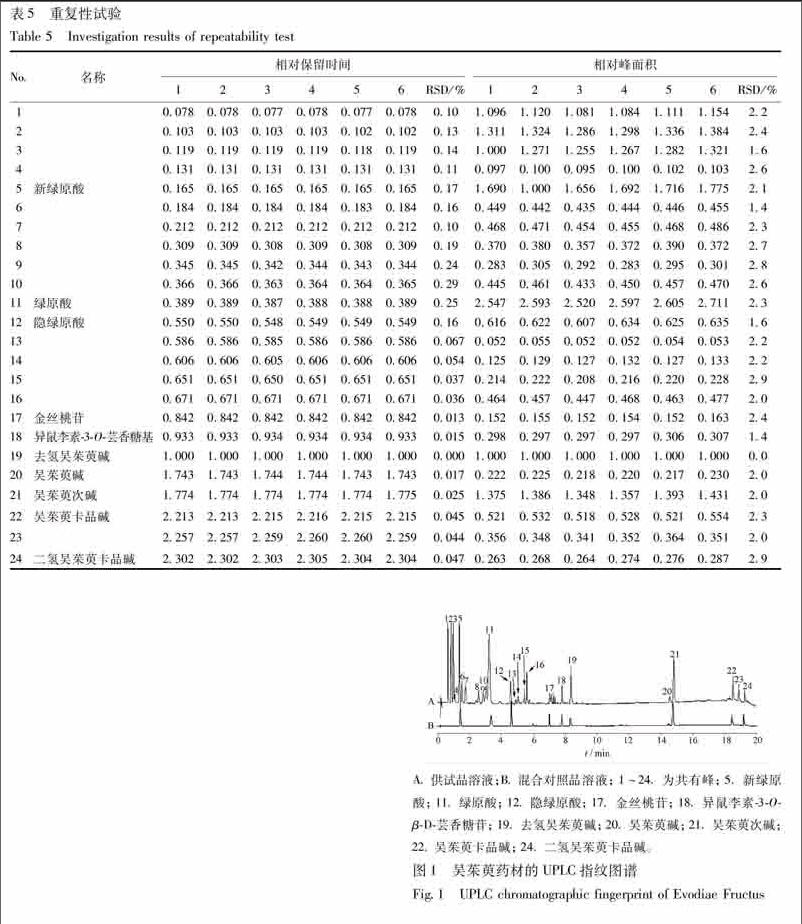
217指纹图谱的建立与共有峰的确定取29批吴茱萸药材,分别按212项方法制备供试品溶液,按211项确定的色谱条件进样,记录UPLC图谱。29批吴茱萸药材的指纹图谱中共获得24个共有峰,经与对照品比对,对其中10个共有峰进行了指认,按保留时间依次分别为:新绿原酸、绿原酸、隐绿原酸、金丝桃苷、异鼠李素3OβD芸香糖苷、去氢吴茱萸碱、吴茱萸碱、吴茱萸次碱、吴茱萸卡品碱和二氢吴茱萸卡品碱,见图1。218共有指纹峰的相对保留时间及相对峰面积本研究中鉴于去氢吴茱萸碱的相对含量较高,化学结构相对稳定、保留时间居中,且在本色谱分离中分离度、色谱峰纯度等方面均符合含量测定的要求,因此确定以去氢吴茱萸碱为参照峰(S),其余各共有峰的保留时间和峰面积与S峰的比值定义为其余各峰的相对保留时间和相对峰面积。按以上方法计算29个不同产地吴茱萸药材的24个共有色谱峰的相对保留时间和相对峰面积,见表6~7。
A供试品溶液;B混合对照品溶液; 1~24 为共有峰; 5 新绿原酸; 11 绿原酸; 12 隐绿原酸; 17 金丝桃苷; 18 异鼠李素3OβD芸香糖苷; 19 去氢吴茱萸碱; 20 吴茱萸碱; 21 吴茱萸次碱; 22吴茱萸卡品碱; 24 二氢吴茱萸卡品碱。
219相似度评价将所得到的29批吴茱萸药材UPLC色谱图AIA数据导入国家药典委员会“中药指
纹图谱评价系统”(2008版),通过软件分析得到吴茱萸药材的UPLC指纹图谱。结果显示:29批吴茱萸药材与对照特征图谱相似度在0712~0981,
平均相似度为0912,RSD为73%。29批药材中有19批药材相似度大于09,有8批药材相似度在08~09,还有2批药材相似度在07~08,表明建立的吴茱萸药材的UPLC指纹图谱较合理,见图2,表8。
22吴茱萸药材中9种成分的同步测定
221色谱条件同211项下。色谱图见图3。
222供试品溶液的制备同212项。
223对照品溶液的制备同213项。
224线性关系考察分别精密吸取213项下的1#~4#混合对照品溶液01,02,04,06,08,10,12 μL注入超高效液相色谱仪,平行2针,测定新绿原酸、隐绿原酸、金丝桃苷、异鼠李素3OβD芸香糖苷、去氢吴茱萸碱、吴茱萸碱、吴茱萸次碱、吴茱萸卡品碱和二氢吴茱萸卡品碱的峰面积。以测
得的峰面积和被测物的量(μg)进行线性回归,得到各个成分的回归方程以及线性范围,绘制标准曲线。其中隐绿原酸的线性范围下限为4#混标进样01 μL的量,吴茱萸堿的线性范围下限为3#混标进样06 μL的量,吴茱萸卡品碱的线性范围下限为2#混标进样01 μL的量,二氢吴茱萸卡品碱的线性范围下限为3#混标进样04 μL的量,其他待测成分的线性范围下限均为3#混标进样01 μL的量,而所
A供试品溶液;B混合对照品溶液; 1 新绿原酸; 2 隐绿原酸; 3 金丝桃苷; 4 异鼠李素3OβD芸香糖苷; 5去氢吴茱萸碱; 6吴茱萸碱; 7吴茱萸次碱; 8吴茱萸卡品碱; 9二氢吴茱萸卡品碱。
有待测成分线性范围的上限均为1#混标进样12 μL的量。取4#混合对照品溶液,进样测定,以S/N=3作为检测限,S/N=10作为定量限,结果见表9。
225精密度试验取同一份吴茱萸药材(编号3)供试品溶液,按211项方法连续进样6次,测定供试品溶液中新绿原酸、隐绿原酸、金丝桃苷、异鼠李素3OβD芸香糖苷、去氢吴茱萸碱、 吴茱萸碱、吴茱萸次碱、吴茱萸卡品碱和二氢吴茱萸卡品碱的峰面积,计算RSD。结果显示各成分峰面积的RSD
分别为29%,18%,14%,17%,27%,23%,29%,19%,28%。表明仪器精密度良好。
226稳定性试验取吴茱萸药材粉末(编号3)约025 g,精密称定,按212项方法制备供试品溶液,分别于供试品溶液制备后第0,2,4,6,12,14 h进样,测定供试品溶液中新绿原酸、隐绿原酸、金丝桃苷、异鼠李素3OβD芸香糖苷、去氢吴茱萸碱、吴茱萸碱、吴茱萸次碱、吴茱萸卡品碱和二氢吴茱萸卡品碱的峰面积,计算RSD。结果显示各成分峰面积的RSD分别为27%,22%,25%,20%,19%,10%,26%,18%,23%,表明供试品溶液制备后14 h内稳定性良好。
227重复性试验取吴茱萸药材粉末(编号3)约025 g,精密称定,按212项方法平行制备6份供试品溶液,分别测定供试品溶液中新绿原酸、隐绿原酸、金丝桃苷、异鼠李素3OβD芸香糖苷、去氢吴茱萸碱、吴茱萸碱、吴茱萸次碱、吴茱萸卡品碱和二氢吴茱萸卡品碱的峰面积,计算含量及RSD。结果测得吴茱萸药材中上述各成分的含量分别为675,285,120,312,828,988,277,454,260 mg·g-1,其RSD分别为23%,28%,27%,19%,27%,28%,23%,25%,25%,表明该方法的重复性良好。
228加样回收试验精密称取新绿原酸420 mg、隐绿原酸181 mg、金丝桃苷0780 mg、异鼠李素3OβD芸香糖苷192 mg、去氢吴茱萸碱526 mg、吴茱萸碱614 mg、吴茱萸次碱171 mg、吴茱萸卡品碱271 mg和二氢吴茱萸卡品碱171 mg,用甲醇溶解并定容至250 mL 量瓶中,摇匀,记作5#混合对照品溶液,备用。endprint
取同一来源的吴茱萸药材粉末(编号3)约0062 5 g,精密称定,分别按药材含量对照品大致1∶1的比例加入25 mL 5#混合对照品溶液,按212项方法平行制备6份供试品溶液,按211项方法测定供试品溶液中新绿原酸、隐绿原酸、金丝桃苷、异鼠李素3OβD芸香糖苷、去氢吴茱萸碱、吴茱萸碱、吴茱萸次碱、吴茱萸卡品碱和二氢吴茱萸卡品碱的峰面积,计算加样回收率及RSD。结果测得各成分加样回收率的平均值分别为1003%,1004%,1016%,9751%,1029%,1014%,1038%,1040%,9599%,RSD分别为24%,20%,30%,080%,19%,21%,11%,22%,24%,表明该方法的准确度良好,结果见表10。
229含量测定取29批吴茱萸药材,按212项方法制备供试品溶液,注入超高效液相色谱仪,按211项方法测定供试品溶液中新绿原酸、隐绿原酸、金丝桃苷、异鼠李素3OβD芸香糖苷、去氢吴茱萸碱、吴茱萸碱、吴茱萸次碱、吴茱萸卡品碱和二氢吴茱萸卡品碱的峰面积,并用外标一点法计算含量,见表11。
3讨论
本实验对提取溶剂进行了考察,比较了50%甲醇、甲醇、50%乙醇和95%乙醇的提取效果,结果显示甲醇提取效果最好,因此选择甲醇为提取溶剂。本实验采用 Waters 的PDA 检测器进行紫外区全波长扫描,结果在320 nm 波长下,色谱图基线噪音较低,特征峰响应较高,因此选择320 nm 作为本实验的检测波长。实验还考察了甲醇水,乙腈水,乙腈01%甲酸水和乙腈02%甲酸水4种不同的流动相系统,结果发现采用乙腈甲酸酸水流动相系统,各峰的分离度和峰纯度均较好,且基线平稳。因此最终采用02%甲酸乙腈02%甲酸水作为流动相组成。
本文在短短20 min内实现了对29批吴茱萸药材化学成分的轮廓分析,建立了指纹图谱,共选出24个共有峰,指认了其中10个共有峰,分别是新绿原酸、绿原酸、隐绿原酸、金丝桃苷、异鼠李素3OβD芸香糖苷、去氢吴茱萸碱、吴茱萸碱、吴茱萸次碱、吴茱萸卡品碱和二氢吴茱萸卡品碱,并且针对除绿原酸之外的其他9个成分进行了含量测定。与文献报道的吴茱萸的多成分含量测定和指纹图谱研究相比,在一个色谱条件下同时实现了吴茱萸样品的定性和定量分析,提高了分析效率,降低了检测成本,节约了对照品。该方法的建立为吴茱萸药材的质量控制提供了简便快捷的分析方法。
由于绿原酸在本文色谱条件下未达到基线分离,所以虽然指纹图谱中将绿原酸作为共有峰计入,但未进行含量测定。研究结果显示虽然1号药材指纹图谱与对照指纹图谱的相似度仅为0764,但其所含吴茱萸碱和吴茱萸次碱的含量却较高(二者的总含量达36%,远高于2015年版药典中二者含量不得低于015%的标准),那么到底应该如何评价吴茱萸药材的质量呢?作者认为至少应将指纹图谱和多成分含量测定结果结合起来进行考量才比较全面,单纯以某几个成分的总含量为考量依据可能并不合适。本文所建立的指纹图谱和多成份测定中包含了吴茱萸中含有的三大类主要成分(生物碱、酚酸和黄酮类成分),但令人遗憾的是本研究中未涉及到柠檬苦素类成分,主要原因在于柠檬苦素类成分是末端吸收,在320 nm波长下检测不到色谱峰。而柠檬苦素类是吴茱萸中的一大类有效成分,因此日后的工作中应在本文研究的基础上加入柠檬苦素类成分的测定。可采用添加对照品的方法进行相关成分的测定,这部分工作正在进行中。
[参考文献]
[1]中国药典一部[S]. 2015:171.
[2]杨志欣,孟永海,王秋红, 等. 吴茱萸药理作用及其物质基础研究概况[J]. 中华中医药学刊,2011 (11):2415.
[3]龚慕辛,王智民,张启伟, 等. 吴茱萸有效成分的药理研究进展[J]. 中药新药与临床药理,2009 (2):183.
[4]林晶晶,王静,沈涛 吴茱萸生物碱类对心血管的药理作用研究进展[J]. 中国临床研究,2015 (10):1392.
[5]张志仙,蒋美玲,王欣慧, 等. 吴茱萸碱的药理学研究进展[J]. 现代生物医学进展,2014 (21): 4189.
[6]张璐,冯育林,王跃生,等. 吴茱萸现代研究概况[J]. 江西中医学院学报, 2010, 22:78.
[7]魏娟,曾金祥,张寿文, 等. 吴茱萸质量控制与品质评价方法研究进展[J]. 中国现代中药,2013 (1):25.
[8]张红梅,李国,宋龙, 等. 贵州和浙江产吴茱萸指纹图谱分析及含量测定[J]. 中国实验方剂学杂志, 2014(17): 69.
[9]吴蔚苗,罗锦莹 UPLC法同时测定不同产地吴茱萸中绿原酸、吴茱萸碱、吴茱萸次碱的含量[J]. 中国药房,2016 (24):3446.
[10]张建锋,刘文,吴增光, 等. 黔产吴茱萸的UPLCMS/MS指纹图谱分析[J]. 贵州农业科学,2016(2):137.
[11]刘珊珊,周兴清,梁彩霞, 等. 吴茱萸水提取物化学成分研究[J]. 中国实验方剂学杂志,2016 (8):58.
[12]Zhang P, Pan B, Liao Q, et al Simultaneous quantification of limonin, two indolequinazoline alkaloids, and four quinolone alkaloids in Evodia rutaecarpa (Juss) Benth by HPLCDAD method[J]. J Anal Methods Chem, 2013, doi:101155/2013/827361.
[13]尹元元,閆利华,张启伟, 等. 吴茱萸及其习用品药材中7个成分的HPLC含量测定[J]. 中国中药杂志,2014,39 (14):2693.
[14]曾金祥,朱继孝,黄碧涛, 等. 吴茱萸中7种活性成分的含量测定[J]. 安徽农业科学, 2011 (26):15988.
[15]魏娟,曾金祥,毕莹, 等. 吴茱萸水溶性成分HPLC指纹图谱与化学模式识别研究[J]. 中草药, 2013 (23):3400.
[16]赵平,许海玉,许浚, 等. 吴茱萸药材的HPLC指纹图谱研究[J]. 中国中药杂志,2010,35 (23):3178.
[责任编辑丁广治]endprint

