楤木皂苷A在大鼠体内的组织分布研究
郭东艳 翟秉涛 吕杨 史亚军 范妤 王露 王媚


[摘要]楤木皂苷A为太白楤木中的主要活性成分之一。该文通过建立SD大鼠主要脏器中楤木皂苷A的LCMS/MS分析方法,同时口服灌胃楤木皂苷A 50 mg·kg-1,测定大鼠主要脏器(心、肝、脾、肺、肾、脑)中的楤木皂苷A含量,探讨体内的组织分布特征。结果显示楤木皂苷A在SD大鼠主要脏器中的方法学考察符合要求,口服灌胃楤木皂苷A 50 mg·kg-1,在心、肝、脾、肺、肾、脑组织均有分布且在1 h或2 h 时达到最大值。在给药后不同时间点楤木皂苷A的组织分布情况不同:给药20 min各组织含量:肝>心>脾>肺>肾>脑;给药1 h各组织含量:肝>脾>肾>肺>心>脑;给药2 h各组织含量:肝>肾>心>脾>肺>脑;给药4 h各组织含量:肾>肝>脾>心>肺>脑;给药8 h各组织含量:脾>心>肝>肾>肺>脑。提示楤木皂苷A主要分布于肝组织,这也与太白楤木常用于治疗肝脏疾病具有一定的相关性。另外,楤木皂苷A在脑组织中虽含量低但有明显分布,提示药物可能会透过血脑屏障,也为楤木皂苷A在脑组织的研究提供了依据。
[关键词]楤木皂苷A; 组织分布; HPLCMS/MS
[Abstract]Araloside A is one of the main active ingredients of Aralia taibaiensis In this study, HPLCMS/MS analysis method of araloside A in the main organs of SD rats was established At the same time, the content of araloside A in the main organs (heart, liver, spleen, lung, kidney, brain) after oral administration with araloside A (50 mg·kg-1) were determined to explore the tissue distribution characteristics of araloside A in vivo The results showed that the methodological study of araloside A in the main organs of SD rats met the requirements, araloside A distributed in heart, liver, spleen, lung, kidney and brain tissues reached peak at 1 h or 2 h after oral administration with 50 mg·kg-1The distributions of araloside A at different time points after administration were distinct as follows: the content of araloside A at 20 min:liver>heart>spleen>lung>kidney>brain; the content of araloside A at 1 h: liver>spleen>kidney>lung>heart>brain; the content of araloside A at 2 h: liver>kidney>heart>spleen>lung>brain; the content of araloside A at 4 h: kidney>liver>spleen>heart>lung>brain; the content of araloside A at 8 h: spleen>heart>liver>kidney>lung>brain Therefore, araloside A was mainly distributed in liver tissue, which had a certain correlation with the common use of Aralia taibaiensis in the treatment of hepatic disease In addition, araloside A shows a low content but an obvious distribution in brain tissues, which indicates that the drug can pass through bloodbrain barrier, and provides the basis for the study of araloside A in brain tissue
[Key words]araloside A; tissue distribution; HPLCMS/MS
楤木皂苷A(araloside A)為楤木属植物太白楤木Aralia taibaiensis的主要活性成分之一,含量约占太白楤木药材质量的12%,其化学结构见图1。具有抗溃疡、抗肿瘤、促纤溶、降血糖、抑制肾素活性等药理作用[15]。1961年,楤木皂苷A首次被前苏联学者Kochetkov N K等[6]从辽东楤木中分离得到,并运用化学法初步确定其结构。随后的几十年,有关楤木皂苷A的研究报道主要集中在药效方面,而相关的药代动力学研究仅有2篇报道,1篇是Iskenderov G B等[7]1991年发表,而另1篇Qi D等[8]以楤木皂苷A作为指标成分之一,对竹节参提取物进行药动学研究。众所周知,1个药物能否发挥药效,在一定程度上是由胃肠道的吸收和靶器官的浓度决定。药物口服吸收进入机体后,将通过循环系统转运至机体的各组织脏器中,药物分布的特征不仅与机体各部位的生理特征有关,而且与组织亲和力,化合物自身的理化因素等密切相关。这将使药物在体内各组织分布产生差异性,从而影响药物的治疗效果和药物的蓄积以及毒副作用[9]。课题组前期已对楤木皂苷A的体内吸收进行了相关研究。本文拟在前期研究基础上,探讨楤木皂苷A的组织分布特征,了解其在体内各主要器官的浓度,为药物的研究、开发及药物作用至靶器官或更理想的靶部位提供参考。endprint
1材料与方法
11仪器与试剂
岛津Nexera XR LC20AD 高效液相色谱仪(日本Shimadzu;Dgu20A3RDegassing Unit;SIL20AXRAutosampler;CTO20A Prominence Column Oven);AB Sciex Qtrap 4500型质谱仪(美国AB Sciex公司);GeneSpeed X1型微量离心机(香港基因有限公司);BT25s型电子分析天平(天美控股有限公司);miVac样品浓缩仪(英国GeneVac公司)。
楤木皂苷A(批号150916,纯度>98%,成都普菲德生物技术有限公司 );川续断皂苷Ⅵ(批号160211,纯度>98%,成都普菲德生物技术有限公司);甲醇和乙腈(Adamas Reagent,色谱级)。
健康的SD大鼠30只,雌雄各半,体质量(230±20) g,购于第四军医大学动物试验中心,动物合格号SCXK(军)20120007。
12色谱质谱条件
121色谱条件色谱柱采用Hypurity C18(46 mm×150 mm,5 μm);柱温35 ℃,流速08 mL·min-1,进样量5 μL,流动相A 01%甲酸水,B为乙腈,洗脱程序:0~6 min,35%~50% B;6~8 min,35% B;在203 nm波长下测定。
122质谱检测条件离子源采用ESI源;检测方式为负离子检测;采用MRM方式进行扫描;离子化电压-4 500 V,气帘气35 psi(1 psi=6895 kPa),离子源温度550 ℃,喷撞气Medium,喷雾气150 psi,辅助加热气250 psi。楤木皂苷A和内标的离子对及质谱参数,见表1。
13样品溶液的配制
楤木皂苷A储备液:精密称量楤木皂苷A 1 mg,用50%甲醇溶解,制成质量浓度约为1 000 mg·L-1的储备液。楤木皂苷A工作液:精密量取储备液5,10,25,50,100,250,500,1 000 μL于离心管中,加入50%甲醇配制成不同系列浓度工作液,使得楤木皂苷A的质量浓度为50~1万mg·L-1。川续断皂苷Ⅵ储配液:精密称量内标川续断皂苷Ⅵ 05 mg,用50%甲醇溶解,制成质量浓度约为50 mg·L-1的儲备液。川续断皂苷Ⅵ工作液:精密量取储备液适量于离心管中,加入50%甲醇,制成质量浓度约为2 mg·L-1的工作液。质量控制样品:精密量取楤木皂苷A 10 μL,添加川续断皂苷Ⅵ工作液10 μL于15 mL离心管内经浓缩仪干燥,再添加200 μL空白组织液,制得质量浓度约为5,500,4 000 mg·L-1的质量控制溶液。
14组织样品采集[1012]
清洁级雌雄各半的SD大鼠30只,给药前15 h禁食不禁水。以楤木皂苷A 50 mg·kg-1灌胃给药(给药体积为10 mL·kg-1),给药后分别在033,1,2,4,8 h处死,立即解剖采集心、肺、肝、脾、肾、脑;生理盐水洗净,置于-20 ℃冷冻保存。
15组织样品的处理[1315]
精密称取各组织05 g,用生理盐水洗净,2倍量蒸馏水匀浆,从中取200 μL组织液,添加10 μL的川续断皂苷Ⅵ,再添加乙腈600 μL涡旋2 min,13 000 r·min-1离心10 min后吸上清经浓缩仪干燥,200 μL色谱甲醇复溶残渣后过022 μm滤膜,吸5 μL进样分析。
16数据处理
采用Microsoft office Excel软件进行数据统计和处理。数据测定值采用均值±标准差表示。
2结果
21方法学考察[1618]
211专属性取空白肝脏、空白肝脏组织中添加楤木皂苷A(50 μg·L-1)和内标川续断皂苷Ⅵ(2 mg·L-1),实测肝脏组织样品(口服楤木皂苷A 2 h),按相应方法处理后进行分析,考察方法的特异性。结果表明,空白肝脏组织中没有物质干扰楤木皂苷A及川续断皂苷Ⅵ的测定,表明该方法的特异性良好,见图2。
212线性范围与定量下限精密吸取一定量的楤木皂苷A溶液,加入10 μL内标川续断皂苷Ⅵ溶液和200 μL空白组织液,配制成5,10,50,100,500,1 000,5 000 μg·L-1的楤木皂苷A标准添加组织样品,处理后进行加权(1/X2)计算,见表2。
最低检测限(LLOD)的S/N≥3;定量下限(LLOQ)的S/N≥10。取LLOQ浓度质控样品,按相应方法求出楤木皂苷A的浓度。
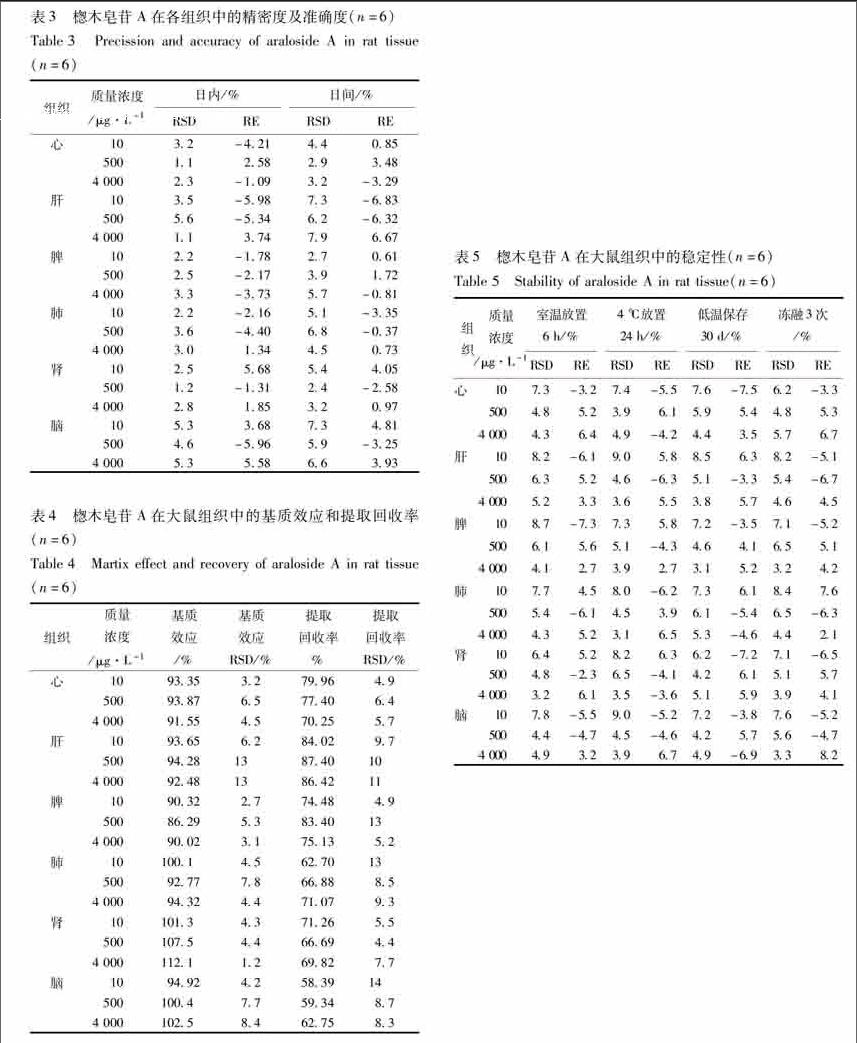
213精密度与准确度取3个不同浓度质控溶液,按相应方法求出楤木皂苷A的浓度。于1 d内测6次,3 d测3批,计算批内、批间 RSD(%)和RE(%),见表3。
214基质效应与提取回收率取空白组织液200 μL,先加入楤木皂苷A,再加入600 μL乙腈,涡旋离心后吸上清用浓缩仪干燥,取200 μL甲醇复溶残渣后过022 μm滤膜,吸5 μL进行分析,所得峰
A 空白肝组织匀浆液;B空白肝组织匀浆液加对照品及内标;C大鼠口服灌胃2 h后肝组织匀浆液;1楤木皂苷A;2川续断皂苷Ⅵ。
。
面积记为A。取空白组织液200 μL,先加入600 μL乙腈,涡旋离心后吸上清用浓缩仪干燥,再加入一定量楤木皂苷A,涡旋混匀2 min后过022 μm滤膜,吸5 μL进行分析得数据记为B。取用流动相配制的楤木皂苷A 50 μL,混合均匀,吸5 μL进行分析得数据记为C。楤木皂苷A的提取回收率=A/B×100%,基质效应=B/C×100%,见表4。
215稳定性①反复冻融:取3个不同浓度质控溶液,在-20 ℃和室温之间分别冻融 3 次,按相应endprint
方法算出楤木皂苷A的浓度,考察组织样品是否有影响;②进样室放置稳定性:取3个不同浓度质控样品,按相应方法在进样室放置6 h进样,考察组织样品是否受影响;③-20 ℃保存:取-20 ℃放置的3个不同浓度质控样品,在放置30 d后按相应方法在当天的标准曲线上求出楤木皂苷A的浓度,考察药物在组织中是否有影响;④4 ℃保存:取4 ℃保存的3个不同浓度质控样品,在放置24 h后按样品处理方法操作,在当天的标准曲线上算出楤木皂苷A的浓度,考察药物在组织中是否有影响,见表5。
22组织分布研究
SD大鼠口服给药楤木皂苷A(50 mg·kg-1),在各组织中的CT数据见表6。SD大鼠口服给药 50 mg·kg-1后,在心、肝、脾、肺、肾、脑组织均有分布且在1 h或2 h 时达到最大值。在给药后不同时间点楤木皂苷A的组织分布情况不同,给药033 h各组织含量:肝>心>脾>肺>肾>脑;给药1 h各组织含量:肝>脾>肾>肺>心>脑;给药2 h各组织含量:肝>肾>心>脾>肺>脑;给药4 h各组织含量:肾>肝>脾>心>肺>脑;给8 h各组织含量:脾>心>肝>肾>肺>脑。结果表明,楤木皂苷A在肝脏中的含量较其他组织高,在脑中的浓度相对较少。
3讨论
实验中组织样品的处理比较了甲醇、乙腈以及二者混合的沉淀效果,发现乙腈能够提供更高的回收率和更好的重现性,且组织匀浆液无其他物质干扰,而方法分析速度快,专属性好,操作简便,故最终选用色谱乙腈沉淀蛋白作为组织液的前处理方法。
本实验研究了口服灌胃楤木皂苷A后8 h内5个时间点的组织分布情况,包含组织分布的吸收、平衡和消除相。大鼠灌胃楤木皂苷A后,原型药物在不同组织的分布有着不同的速度与程度,脾、肺在给药1 h达峰,而心、肝、肾、脑在给药2 h达峰。口服后楤木皂苷A在肝脏中的药物浓度较高,提示与药物可能在肝脏中代谢有关;其次是肾脏,提示与药物主要在肾脏排泄相关,也可能与肝肾组织的血流大、循环好有关,因此楤木皂苷A的转运量也相应较大;接着依次为脾脏、心脏和肺。楤木皂苷A主要分布于肝脏,也与太白楤木常用于治疗肝脏疾病具有一定的相关性。另外,楤木皂苷A在脑组织中虽含量低但有明显分布,提示药物可能会透过血脑屏障,也为楤木皂苷A在脑组织的研究提供了依据。
[参考文献]
[1]Lee E B,Kim O J,Kang S S,et alAraloside A, an antiulcer constituent from the root bark of Aralia elata[J]. Biol Pharm Bull,2005,28(3): 523.
[2]Liu Y,Liu J F,Liu Z H,et alThe antitumor effects of araloside A extracted from the root bark of Aralia elata on human kidney cancer cell lines[J]. Afr J Pharm Pharm Sci,2011, 5(4): 462.
[3]洪良健楤木和太白楤木中抗糖尿病皂苷成分的研究[D]西安:第四軍医大学, 2012.
[4]钱丽娜竹节参中脂溶性成分的研究[D]武汉:武汉工业学院,2009.
[5]Saori T,Kazuyuki H,Mika H,et alInhibition of human rennin activity by saponins[J]. Biomed Res,2010, 31(2):155.
[6]Kochetkov N K,Khorlin A J,Vaskovsky V E,et alTriterpene saponins Triterpene saponins I saponins from Aralia manschuric[J]. Zhur Obschei Khim,1961,31:658.
[7]Iskenderov G BThe metabolism of araloside A [J]. Farmakol Toksikol, 1991, 54(6):33.
[8]Qi D, Yang X, Chen J, et al Determination of chikusetsusaponin V and chikusetsusaponin Ⅳ in rat plasma by liquid chromatographymass spectrometry and its application to a preliminary pharmacokinetic study[J]. Biomed Chromatogr, 2013,27(11):1568
[9]胡岚岚生物样本中钩藤碱的浓度测定及其动物体内药代动力学和组织分布研究[D]重庆:第三军医大学, 2013:74.
[10]Zhang R,Zhu H,Ding L,et al Determination of asperosaponin Ⅵ and its active metabolitehederagenin in rat tissues by LCMS/MS: application to a tissuedistribution study[J]. J Chromatogr B,2014,959: 22.
[11]Rachumallu R, Manisha B, Rajbir S,et al Plasma pharmacokine tics, bioavailability and tissue distribution ofagnuside following peroral and intravenous administration in miceusing liquid chromatography tandem mass spectrometry [J]. J Pharm Biomed Anal, 2016, 125: 154.endprint
[12]盖芸芸人参皂苷CK在大鼠体内的组织分布及排泄研究[D]烟台:烟台大学,2007:80.
[13]李国龙伴生物质对知母皂苷类成分体内过程的影响研究[D]咸阳:陕西中医药大学,2015:53.
[14]刘卓,欧阳辉,李志峰,等. α常春藤皂苷钠盐在大鼠体内药代动力学及组织分布研究[J]. 中国中药杂志,2016, 41(13):2543
[15]何凡,孙小玲,宿亚柳,等. 人参皂苷Rg3及其代谢产物在大鼠体内组织分布研究[J]. 中药药理与临床, 2015, 31(4):14
[16]Anu M, Bidur B, Lee M R,et al Determination of phenylbutyric acid and its metabolite phenylacetic acid in different tissues of mouse by liquid chromatogr amphy with tandem mass spectrometry and its application in drug tissue distribution[J]. J Chromatogr B,2012,903:118.
[17]Zheng Y L,Hu X J,Zhai Y,et al Pharmacokinetics and tissue distributio n study of camellianin A and its major metabolite in rats by liquid chromatography with tandem mass spectrometry[J]. J Chromatogr B,2015,997:200.
[18]Zheng Z X,Tang Y B,Lv H Y,et al Determination of meserine, a new candidate for Alzheimer′s disease in mice brain by liquid chromatographytandem mass spectrometry and its application to a pharmacokinetic and tissue distribution study[J]. Anal Bioanal Chem, 2014, 406:3451.
[責任编辑张燕]endprint

