欧盟传统草药药品法规疑难问题解析
瞿礼萍 张晓群 熊晏 王一涛 邹文俊

[摘要]欧盟在全球植物药市场的地位举足轻重,开展欧盟注册对中药国际化具有重要意义。回溯国内对中药欧盟注册法规的研究已有10余年,仍存部分认识偏差和研究不足。该文旨在系统分析国内欧盟草药药品法规的研究现状,并针对其中研究认识不足的主要方面,即,欧盟传统草药药品集中与分权的监管体系、传统草药的上市审批类别、欧盟草药专论和草药目录等,对2004/24/EC法令的疑难问题进行进一步解析,以期为中药欧盟注册提供参考。
[关键词]2004/24/EC法令; 上市审批程序; 草药专论和目录; 中药欧盟注册
[Abstract]Registration of Chinese patent medicine in European Union (EU) is of great significance to the internationalization of traditional Chinese medicine as EU market acts as an important position in the global botanical market In retrospect, the domestic studies on EU regulations of traditional herbal medicinal products have been conducted for more than 10 years, but there is still some cognitive bias and lack of research In this paper, a review of the relevant research progress and the main misunderstanding problems about Directive 2004/24/EC, like the centralized and decentralized supervision system of traditional herbal medicinal products in the EU, marketing authorization procedures for traditional herbal medicinal products, Community Herbal Monograph and List Entries, would be systematically analyzed, so as to provide reference for the registration of Chinese patent medicine in EU.
[Key words]Directive 2004/24/EC; marketing authorization procedures; Community Herbal Monograph and List Entries; EU registration for traditional Chinese medicine
我国自“九五”已经确立欧盟注册是中药国际化的重要方向,然而欧盟传统草药药品法令(2004/24/EC法令)颁布实施至今已有12年时间,仅有地奥心血康胶囊和天士力丹参胶囊2个中成药获得欧盟成员国的注册批准。回溯国内对欧盟传统草药药品相关法规的研究已有10余年,但是,由于欧盟法规自身完善进程等客观和其他主观原因,国内对欧盟传统草药法规尚存在部分认识偏差和研究不足。本文旨在系统分析国内对欧盟传统草药药品相关法规的研究现状,并针对其中的认识不足和研究薄弱环节,进一步解析2004/24/EC法令的疑难问题,以期为中药欧盟注册提供参考。
1国内欧盟传统草药药品法规研究现状分析
随着2004/24/EC这部轰动全球的传统草药药品法令的颁布实施,苏钢强等[1]率先编撰《欧盟草药药品注册指南》,对欧盟草药药品相关法令、审批程序与申请类别及注册申报资料要求等问题进行了系统介绍。同时,国内也掀起了对中药欧盟注册法规的研究热潮。对中国知识基础设施工程(China National Knowledge Infrastructure,CNKI)进行初步检索统计后发现,截至2017年3月,国内学者先后发表欧盟传统草药法规相关研究论文约40余篇。
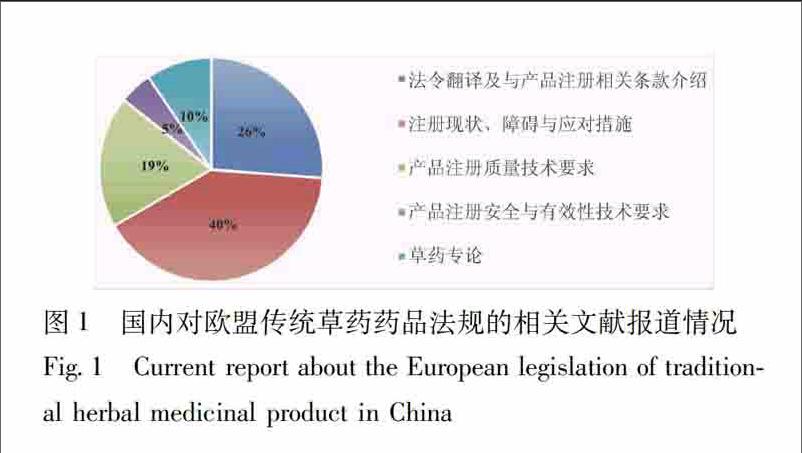
从具体内容看,现有研究文献可大致分为5类,见图1,一是2004/24/EC法令翻译及与传统草药药品注册相关条款的介绍;二是对产品注册的质量技术要求介绍;三是对产品注册的安全与有效性技术要求介绍;四是对中药欧盟注册或欧盟草药注册现状及中药注册的障碍与应对措施分析;五是欧盟草药专论相关报道。其中,前3类主要为针对2004/24/EC法令对传统草药的规定及产品注册相关技术要求(以质量方面为主)的研究分析,在所有发表文献的占比为50%,第4类占比40%;其余10%为草药专论相关论述,均由笔者所在课题组发表。
从文献报道时间看,国内对欧盟传统草药药品法规的相关研究,多集中在2004/24/EC法令颁布初期和法令规定的7年过渡期结束,即,2004年和2011年这2个时间点前后。其中,对欧盟传统草药药品注册规定和中药注册相关技术要求的研究多集中在2004/24/EC法令颁布初期(2004—2008年),主要涉及对欧盟传统草药概念、申报要求、相关技术指南等的阐述与分析;2009年以后,多为针对过渡期结束后中药产品应对欧盟新规策略的分析报道。
2歐盟传统草药药品法规疑难问题解析
随着欧盟法律的修订更新以及草药药品领域的技术发展,欧盟草药药品的监管法规一直处于不断发展与完善之中,单就草药药品有关指南的数量,即从2008年的十余个增至目前的数十个。欧盟于2005—2006年发布的草药药品质量、临床安全性与有效性评价等重要技术指南也都于近几年进行了修订。尽管国内对欧盟法规的研究数量较多,但从上述研究现状可见,国内对欧盟草药药品注册规定和技术要求的相关文献报道时间,多为2004/24/EC法令颁布初期,其研究分析大多系欧盟自身相关法规体系尚未完善的情况下开展,再加之其他多种因素,难免造成对法令中某些问题未能正确理解,亦存在研究薄弱环节,因而导致产生诸多疑难问题,主要涉及:对欧盟传统草药药品集中与分权的监管体系缺乏足够的理解和认识;对传统草药药品的上市审批程序存在一定认识偏差;对草药专论和草药目录存在认识不足。具体解析如下。endprint
21欧盟传统草药药品集中与分权的监管体系
与中国、美国、日本等国家不同,欧盟的药品监管具有集中与分权的独特特点,其监管部门包括欧盟层面的欧洲药品管理局(European Medicines Agency,EMA)和成员国层面的各国药品监管当局(National Competent Authorities,NCAs),其法规制定亦在欧盟和成员国2大层面均有所体现。目前国内欧盟传统草药法规的研究,主要集中在对传统草药药品在成员国注册相关技术要求及中药产品开展欧盟成员国注册的策略制定方面,且尚未完全认识到欧盟传统草药药品法令在欧盟层面的重要内容。
根据“欧盟药品管理法规集(EudraLex)”第二卷申请人须知中有关药品上市审批程序的规定,欧盟药品的审批程序包括集中程序(centralized procedure,CP)、分散程序(decentralized procedure,DCP)、互认可程序(mutual recognition procedure,MRP)及成员国程序(national procedure,NP)4种。其中,CP是针对整个欧盟市场的上市审批程序,由EMA负责审评;DCP与MRP针对欧盟2个或以上成员国市场,而NP则针对单一国家市场,它们均由各成员国NCAs负责审评,这亦是欧盟药品监管集中与分权并存的重要体现。深入理解2004/24/EC法令的具体内容可以发现,一方面,法令针对草药特殊性对传统草药药品的概念、申报资料和技术要求、标签与广告等产品注册的相关问题作出了具体规定。另一方面,法令亦明确指出传统草药药品不能采用由EMA负责审评的CP程序,只能通过由NCAs负责的NP,DCP和MRP程序上市,与此同时,首次在EMA设立草药药品委员会(Committee on Herbal Medicinal Products,HMPC),专门负责欧盟草药专论(Community Herbal Monographs,CHM)与草药目录(Community List Entries,CLE)的建立以及草药其他问题相关指南文件的制定,以发挥其在欧盟层面促进草药药品领域技术协调统一的作用。可以看出,2004/24/EC法令的核心内容实质亦可概括为成员国和欧盟层面2大部分。其中,传统草药药品在NCAs注册的相关规定是法令在成员国层面的内容,CHM和CLE则为欧盟层面主要内容,2个层面共同反映了欧盟在草药药品监管领域的集中与分权并存的重要特点。虽然欧盟不允许传统草药药品采用EMA负责的CP程序上市,但在某种程度上,CHM及CLE与CP程序非常类似,并对传统草药草药在成员国NCAs的注册具有重要作用。
22传统草药药品的上市审批程序
欧盟药品的上市审批途径包括了集中程序(CP)、分散程序(DCP)、互认可程序(MRP)及成员国程序(NP)4种。国内某些学者在分析欧盟药品上市程序时,将NP与MRP审批程序错误理解为下属于DCP的2种子类别[1],认为欧盟药品审批程序只有CP,MRP和NP 3种。具体到传统草药药品可采用的审批程序,认为除了MRP和NP程序,还可以通过CP程序使产品在整个欧盟市场上市,亦未能认识到传统草药采用互认可上市程序必须建立相应草药专论[2]。实则不然,系统分析2004/24/EC法令具体内容可以发现法令已指出传统草药药品不能采用由EMA负责审评的CP程序,只能通过由成员国NCAs负责的NP,DCP和MRP上市。法令第16b条指出,传统草药药品的上市申请必须提交至NCAs,而不是负责CP审评的EMA。同时,法令第16e(1)条进一步规定的简化注册应被拒绝的几种情况,也包括了申请未提交至NCAs的情形。可见,传统草药药品实际上并不能采用CP审批程序,而只能通过NP或DCP和MRP这3种审批程序上市。如果产品只希望在欧盟一个成员国上市,可直接采用NP程序;如果希望在多个成员国上市,则可采用DCP程序;同时,如果产品已在某一成员国上市,希望进一步进入其他欧盟成员国市场,则同样可采用MRP程序。但必须说明的是,对于MRP和DCP审批程序,2004/24/EC法令第16d(1)条明确指出此2种程序只适用于已建立相应CHM或CLE的传统草药药品,未建立者只能采用NP,即成员国程序上市。
23草药专论(CHM)与草药目录(CLE)
2004/24/EC法令是欧盟传统草药药品法规的核心,HMPC针对草药药品相关技术要求发布的指南文件均围绕法令所制定。鉴于上述22项的分析,2004/24/EC法令实质上主要包含了传统草药药品在成员国NCAs注册相关规定和欧盟CHM及CLE这2大层面的核心内容。根据本文对国内欧盟草藥药品法规研究现状的分析,针对传统草药在成员国的注册规定及相关技术要求已有较多报道,而CHM和CLE作为2004/24/EC法令在欧盟层面的重要内容,却少有关注,仅本课题组前期就CHM基本概念、评价情况、在欧盟草药药品注册中的作用等问题进行了相关论述[36],国内尚无CLE的相关报道。
231概念、作用及其关联性草药专论(CHM)是由HMPC根据2004/24/EC法令第16h(3)条,针对草药及相关制品的所有安全性、有效性相关资料,进行科学评价后制定的类指南性文件,其主体内容结构与产品特性摘要(summary of product characteristics,SPC)类似,包括药品名称、定性和定量组成(草药拉丁学名、植物学名、草药物质、草药提取物类型等)、制剂形式、临床特点(适应症、剂量、使用方法、禁忌症、特别警告、药物相互作用、怀孕或哺育期用药、对驾驶和操作机器的影响、不良反应、超剂量使用等)、药理学特点(药代动力学、药效学、临床前安全性数据等)、药学特点、专论撰写/修订时间等七方面内容[7]。HPMC对CHM的评价依据包括了2001/83/EC和2004/24/EC法令分别对固有应用(wellestablished medicinal use,WEU)和传统应用(traditional medicinal use,TU)草药的规定,因而CHM也包括固有应用和传统应用两种类别。根据法令规定,CHM建立后,欧盟各成员国在审评相应产品的上市申请时,应充分考虑其内容;当新的CHM建立后,已上市产品的上市许可持有人应考虑根据CHM内容与结论对产品注册申请资料进行修改。虽然CHM并无强制法律效力,但法令对CHM赋予的意义与作用,亦体现了CHM代表欧盟层面对草药安全与有效性科学评价结论的地位,CHM为欧盟成员国的草药药品上市审评奠定了重要基础,并对实现欧盟草药药品的技术协调统一发挥着重要作用。endprint
草药目录(CLE)则为2004/24/EC法令第16f(1)条首次提出,其主要内容包括草药名称、适应症、特定提取物类型和剂量、给药途径以及其他任何与草药安全使用有关的必要资料,在呈现形式上细分为13个方面,但从内容上与CHM类似,均反映了HMPC对草药安全与有效性(或传统应用)的科学评价结论。建立CLE的草药均同时建立相应CHM。与CHM不同的是,CLE只针对传统草药,只有传统应用的类别。此外,CLE不由HMPC发布,而由职能级别更高的欧盟委员会发布,具有强制法律效力。CLE建立后,成员国必须依据CLE内容审查相应产品的注册申请,且申请者不必再提供2004/24/EC法令第16c(1)(b),(c),(d)条中要求的药品上市许可批准相关资料、安全性综述与报告、传统应用证据等,审评部门也不得另行要求产品补充其他有关安全与有效性的资料或实验数据。CLE可被视为欧盟认定传统草药的金标准,一旦草药建立CLE,各成员国必须认可其安全性与传统应用。
CHM与CLE的区别与关联,见表1。
232草药专论(CHM)对现阶段传统草药药品注册更具现实意义草药目录(CLE)相较草药专论(CHM)具有更强法律效力,其对相关资料和数据的要求也更高,尤其是要求草药必须具有充分的遗传毒性研究数据。然而,事实上绝大多数草药均缺乏该项研究,难以满足CLE要求。亦正因如此,HMPC 2005年着手评价草药至今,仅建立了12个草药的CLE,见表2,这个数量对于欧盟评价草药的初衷,即,促进草药领域的技术协调统一所能发挥的作用极其有限。或许基于这个原因,欧盟在2014年进一步对CHM的重要性做出了进一步强调,指出“虽然欧盟并不从法律上强制要求成员国遵照CHM内容对相应产品进行上市批准,但考虑到CHM在欧盟草药技术协调及促进草药药品上市方面的重要作用,成员国做出任何不遵循CHM决定的情况均须给出充分合理的解释”[8]。与仅有12个草药CLE相对应的是,HMPC目前已建立并发布142个传统草药CHM。Wieland Peschel[9]对截至2012年12月31日CHM在欧盟各成员国获批单方传统草药药品注册申请中应用情况的统计结果表明,超过50%的注册申请应用了CHM,其中,不仅涉及申请者提出注册申请时
采用CHM作为申报资料,而且在相当数量的申请中,成员国药品主管部门在审评注册申请时亦参考了CHM的内容和结论。
因而,尽管CLE是欧盟传统草药的金标准,考虑到欧盟建立CLE的草药数量十分有限,而CHM具有相似的评价方式、结构内容,并與CLE共同作为促进欧盟草药药品技术协调统一的重要官方文件,笔者认为CHM在目前传统草药评价与注册审批的实际中发挥着更为重要的作用,更具有现实意义。
3结语
欧盟是全球最重要的植物药市场之一,开展中药欧盟注册对中药国际化意义重大。尽管国内业界对中药欧盟注册法规研究尤为关注,但由于欧盟传统草药药品法规体系自身完善进程等客观和其他主观因素,国内对此仍存部分认识偏差和研究不足,业内一度将欧盟草药专论概念与药典专论混淆。本文在系统分析国内欧盟传统草药药品法规研究现状的基础上,发现欧盟传统草药药品集中与分权的监管体系、传统草药允许采用的上市审批类别、草药专论(CHM)和草药目录(CLE)等问题,是国内存在的主要认识不足和研究薄弱环节。传统草药药品只能采用由成员国NCAs负责审评的NP,DCP和MRP这3种程序,而并不能通过由EMA负责审评的CP程序上市;CHM和CLE的评价建立程序与CP程序类似,代表着欧盟层面的科学评价结论,与传统草药药品在NCAs的注册规定,二者共同体现了欧盟药品监管集中与分权特点,并构成了2004/24/EC法令在欧盟与成员国2大层面的核心内容。
综合来看,国内对欧盟草药药品法规的研究认识不足实质上主要集中在2004/24/EC法令在欧盟层面的内容,即草药专论(CHM)和草药目录(CLE)。其中,CLE是欧盟传统草药药品对安全与有效性审评的金标准,CHM是草药药品NP程序申请和审评中的关键参考资料,是采用DCP和MRP程序注册的必须前提条件。二者均代表欧盟层面对草药的科学评价结论,为成员国NCAs对草药药品安全与有效性的具体审评提供了评价的统一参考标准与基础,并在草药药品的上市注册过程中发挥着重要推动作用。虽然CLE法定效力更强,与CHM均作为法令在欧盟层面核心内容的重中之重,考虑目前CHM对传统草药评价与产品注册审批更具现实意义,在中药欧盟药品注册研究过程中应当予以充分重视。
[参考文献]
[1]苏钢强, 李伯刚欧盟草药药品注册指南[M]北京:人民卫生出版社,2005.
[2]叶祖光,邹健强 欧洲药品注册的管理规定——兼论欧盟传统草药的简化申请[J]. 中药研究与信息,2005, 7(10):4.
[3]瞿礼萍, 施晴, 曾慧敏, 等. 深度解析草药专论对中药欧盟注册的价值与重要性[J]. 中草药,2017,48(9): 1916.
[4]邹文俊, 瞿礼萍, 叶祖光, 等. 欧盟传统草药专论述评[J]. 中国中药杂志,2011, 36(23): 3386.
[5]瞿礼萍, 王文珺, 周祯祥,等. 基于“欧盟草药专论”解析中药欧盟注册关键问题[J]. 中草药,2014, 45(24):3509.
[6]Qu L, Zou W, Zhou Z, et al NonEuropean traditional herbal medicines in Europe: a community herbal monograph perspective [J]. J Ethnopharmacol,2014, 156:107.
[7]European Medicines Agency Procedure for the preparation of community monographs for traditional medicinal herbal products [EB/OL]. (20070111)[20170804]. http://academygmpcomplianceorg/guidemgr/files/2013_EMA_COMM_MONPDF.
[8]European Medicines Agency Community Herbal Monographs [EB/OL]. (20140301) [20170804]. http://wwwemaeuropaeu/ema/indexjsp?curl=pages/regulation/document_listing/document_listing_000212jsp&mid=WC0b01ac058003380a .
[9]Wieland Peschel The use of community herbal monographs to facilitate registrations and authorizations of herbal medicinal products in the European Union 2004—2012[J]. J Ethnopharmacol,2014,158:471
[责任编辑孔晶晶]endprint

