欧盟草药专论现况及对中药在欧盟注册的影响
汪建芬,张中朋,王雨彤,许铭,李思茹,邹秦文,林瑞超*
(1.北京中医药大学 中药学院,北京 100102;2.中国医药保健品进出口商会,北京 100010;3.北京联馨药业有限公司,北京 102609)
·专论·
欧盟草药专论现况及对中药在欧盟注册的影响
汪建芬1,张中朋2,王雨彤1,许铭2,李思茹1,邹秦文3,林瑞超1*
(1.北京中医药大学 中药学院,北京100102;2.中国医药保健品进出口商会,北京100010;3.北京联馨药业有限公司,北京102609)
欧盟是传统植物药的重要市场,但是截至2016年,我国中成药只有两例在欧盟注册成功,中药在欧盟上市面临很多政策和技术壁垒,而植物药在欧盟注册的一个很重要的参考资料就是欧盟草药专论(CommunityHerbalMonograph,CHM)。本文就欧盟草药专论的数量、治疗领域、专论状态等进行分析,以期为我国中药企业注册提供帮助。
中药;欧盟草药专论;注册
欧盟是传统植物药的重要市场,我国的中药历史悠久,临床效果显著,但是截至2016年底,我国中成药只有两例在欧盟注册成功[1],中药进入国际主流市场的能力依然很薄弱,在欧盟注册植物药尤其是有传统使用历史的植物药时,欧盟草药专论能帮助减少实验量及缩短注册所用时间,提高注册的成功率,但是在已建立的专论中,由中国传统应用来源的植物药占比很小[2],长期下来,对于我国中药进入欧盟市场不利。本文通过对欧盟草药专论的数量、内容、治疗领域和建立流程等进行分析,帮助读者了解欧盟草药专论的现况及建立专论对中药在欧盟注册的影响。
1 欧盟专论背景介绍
1.1专论的主管部门及其职责
欧盟草药专论是其对草药安全性和有效性或传统应用观点的类似指南性质的官方文件[2]。主要负责欧盟草药专论的部门是是欧洲药品局(EuropeanMedicinesAgency,EMA)下属的欧盟草药药品委员会(CommitteeonHerbalMedicinalProducts,HMPC),HMPC是欧盟官方首次成立的专门对草药产品进行管理的有关部门。HMPC职责有:建立欧盟草药专论,包括草药原料和制剂的良好应用草药专论(well-establisheduse,WEU) 和/或传统应用草药专论(traditionaluse,TU) 这两类;起草用于传统草药产品的草药物质、制剂及其组合的欧盟列表[3]。
1.2专论包含的信息
一个欧盟草药专论(原名共同体草药专论)包含HMPC对作为药物使用的草药物质及其制剂安全性和有效性数据的科学观点。HMPC会评估所有可用的信息,包括非临床和临床数据,也包括在欧盟长期使用的经验。同时,欧盟草药专论提供了使用含有特定草药物质或制剂的药物的所有信息:草药产品用途;草药产品适用人群;有关的不良反应及与其他药物相互作用的安全数据[3-4]。
1.3专论的作用
2004/24/EC指令第16(h)条第二项明确指出,欧盟各成员国在审查传统草药药品注册(Traditionaluseregistration,TUR)时,应当充分考虑各方的意见。同时,在新的欧盟草药专论建立后,注册持有人要考虑是否需要对注册时申报资料提出修改,以符合专论中的信息。专论也可以作为申请人在申请销售许可时的参考材料(WEU的部分)和传统应用注册申请时的参考材料(TU的部分)[5]。
1.4专论建立流程及发表的文件
一个专论的建立需要经过6个阶段,分别是:指派起草者(R:Rapporteurassigned);征求科学资料(C:ongoingcallforscientificdata);草案讨论(D:Draftunderdiscussion);草案公布(P:Draftpublished);定稿前评价(PF:Assessmentclosetofinalisation(pre-final));最终意见采纳(F:Finalopinionadopted)。最终意见形成后,对于符合传统草药要求的,建立并发布CHM,不符合要求的发表公开申明(publicstatement)说明原因[6]。下面以人参举例,在HMPC对人参的资料进行评估后,2007年9月7日,人参被纳入优先评价名单(prioritylist),在指派了起草者后,于2011年4月15日到2011年7月15日这三个月内征求科学资料,2013年4月16日发布草案,2014年5月22日发布最终版专论。最终专论是以传统草药应用专论的形式发布[7]。
1.5专论的内容
专论通常分为7大部分,相较于WHO的草药专论较为简洁,以人参为例,包括:药品名称;组成成分定性和定量;剂型;临床应用;药理性质;特殊用法;修订日期。其中临床应用包括适应症、计量和给药方法、禁忌症、特别提示和使用注意、与其他药物相互作用、孕产和哺乳期、对驾驶或操纵机械的影响,不良反应、超剂量。药理作用包括:药效学、药代学、临床前安全数据[7]。
1.6欧盟草药目录
除了欧盟草药专论外,还有欧盟草药目录(EuropeanUnionlistentries)来补充草药物质的传统应用草药专论,与欧盟草药专论不同的地方是,目录对欧盟成员国的申请人和国家主管当局具有法律约束力。欧盟草药目录的草案由HMPC负责,但最终目录由欧洲委员会发布。目录的作用体现在当TUR的申请人在申请中可以证明他们所提出的产品和相关声称符合欧盟列表中的信息,申请者将不需要再提供其安全和传统使用的证据。同时,国家主管部门也不能要求额外的数据来评估产品的安全性和传统用途。目录是在药品的产品特性总结(summaryofproductcharacteristics,SmPC)基础上形成的[3]。
2 现有专论的情况
2.1按状态分类
截至2016年11月,根据专论的评估工作回顾,HMPC会定期对专论的建立工作情况进行整理[8],见表1。
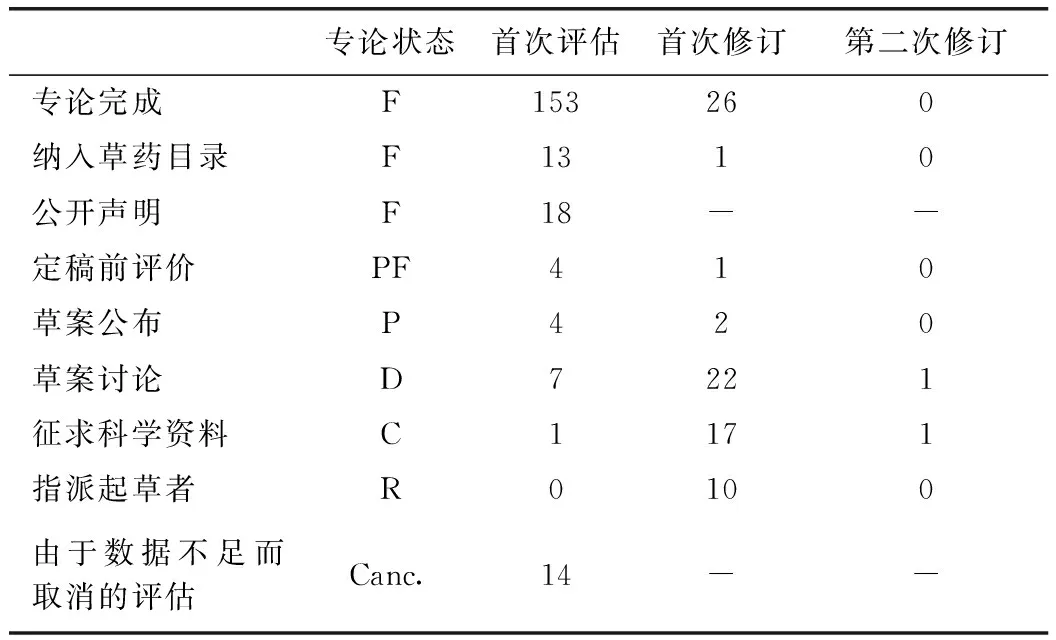
表1 欧盟草药专论状态分布表
已完成的专论总共有153个,纳入草药目录的有13个,因为各种原因未能形成专论而发表公开声明的有18个,因数据不足而取消的有14个,已完成的和未通过的比例约为10∶1,HMPC在专论的建立过程中要求极为严格。而欧盟草药专论也由于评估人员不足等因素,处于指派起草者、征求科学资料、草案讨论、草案公布、定稿前评价的专论数量都不多,相较于数量庞大的植物药,专论建立的整体进展较缓慢。
2.2治疗领域分类
所有已建立专论的植物药均有一个或一个以上的治疗领域,此外,还有一个治疗领域为循环系统的植物药的专论处于草案公布(P)状态,其他状态的专论则暂时未纳入植物药治疗领域的分类[9],见表2。
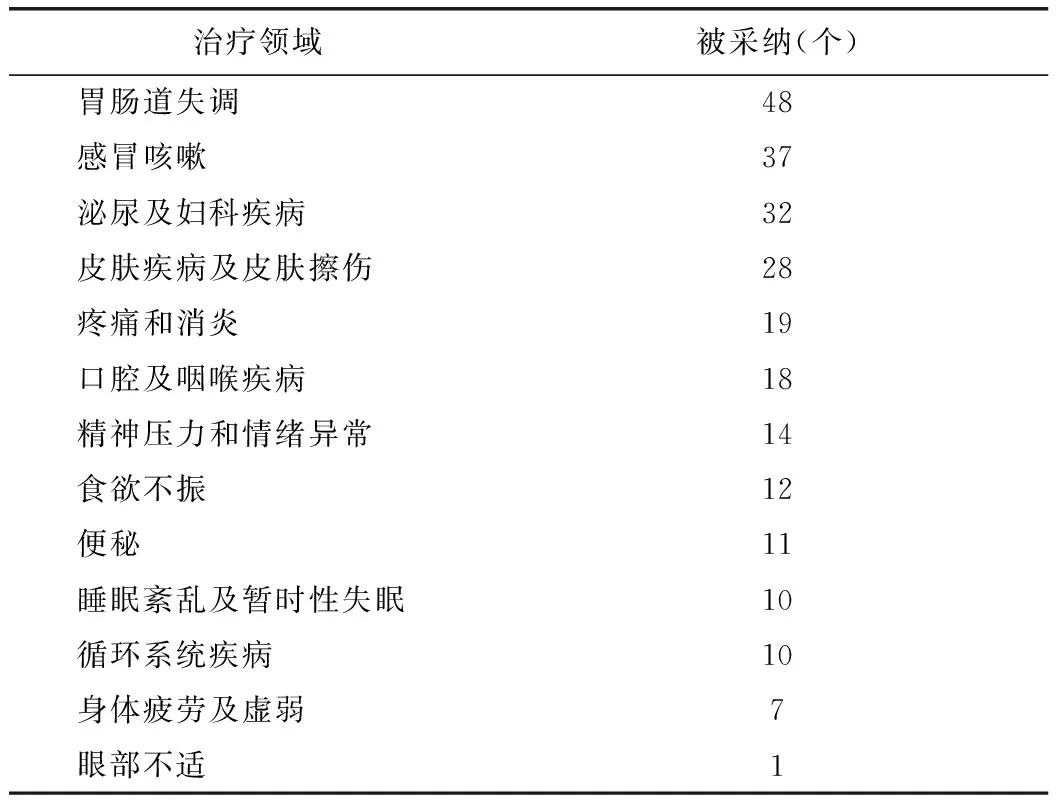
表2 欧盟草药专论的治疗领域分布
从表2能看出,在已有专论的植物药治疗领域分类中,有治疗胃肠道失调作用的植物药多达48种,治疗身体疲劳及虚弱的仅七种,产品的主要治疗领域集中在胃肠道失调、感冒咳嗽、泌尿及妇科疾病、皮肤疾病和皮肤擦伤这四大领域,有的草药也有两种及以上的治疗领域。
3 中药欧盟注册选择
3.1专论的起草者和审稿人分布
欧盟虽然是一体化程度较高,但是不同国家的起草者和审稿人对同一草药专论在理解上还是各有不同,表3是起草者和审稿人的国别分布[8]。
在第一次评估的起草人数量中,德国的是最多的,为28.5个,是第二名的近两倍,德国也是欧洲规模最大的草药市场,在中药注册时,德国的草药使用的偏好和常用草药药品的种类及其适应症也需要多考虑,德国也是传统植物药受理数量最多的国家[1],所以在我国中药企业进入欧盟市场时,德国是一个值得参考的重要风向标。
3.2已建立专论中有中国传统应用来源的植物药
在已建立专论的植物药中,有一小部分有中国传统应用来源,表4是已有专论的植物药中被《中华人民共和国药典》(2015年版)收录的中药[8]。
截至2016年11月,被《中华人民共和国药典》(2015年版)收录的总共有16例植物药,而在2013年11月前,仅仅只有10例,三年内增加了一半多,进展速度加快,新增的分别是辣椒、山楂叶、桉油、银杏叶、人参和萹蓄。这六种里,山楂叶、辣椒、桉油、人参和银杏叶也是使用广泛的植物药,其中尤以人参和银杏叶为代表。中国企业在申报时,可以从含有这些品种的中成药中选择,将会提高申报成功率。
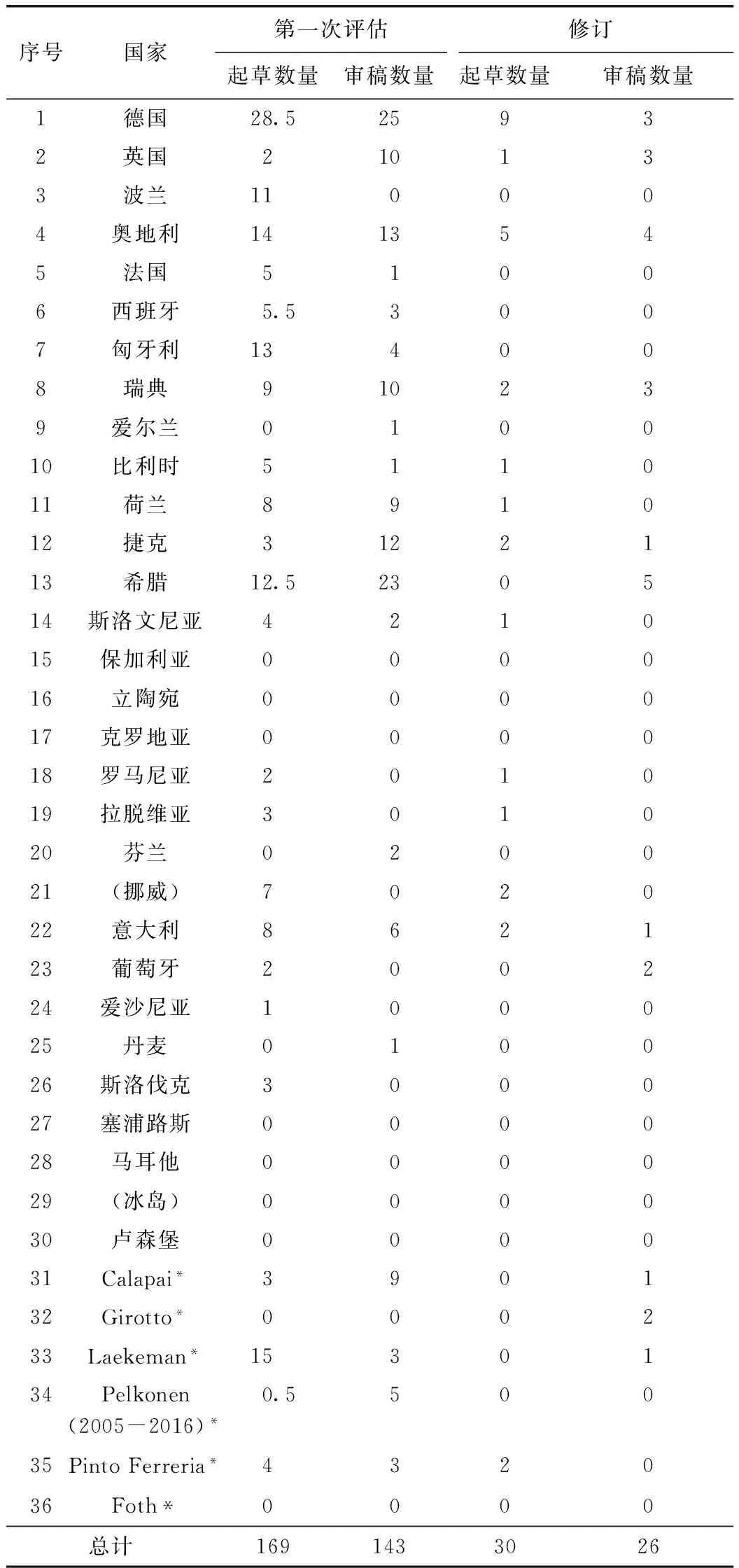
表3 欧盟草药专论的起草者和审稿人国别分布表
*注:最后6人是指派的专员(Co-Opt)。
3.3发布PS的植物药
因为种种原因,HMPC 对18种草药发布了PS,即认为这18种草药因为各种原因不满足建立专论的条件[8]。其中,洋葱、当归、丁香、白屈菜、积雪草这5种草药被《中华人民共和国药典》(2015年版)收载。在欧盟注册中成药时,尤其应该注意避免有上述中药的处方,见表5。
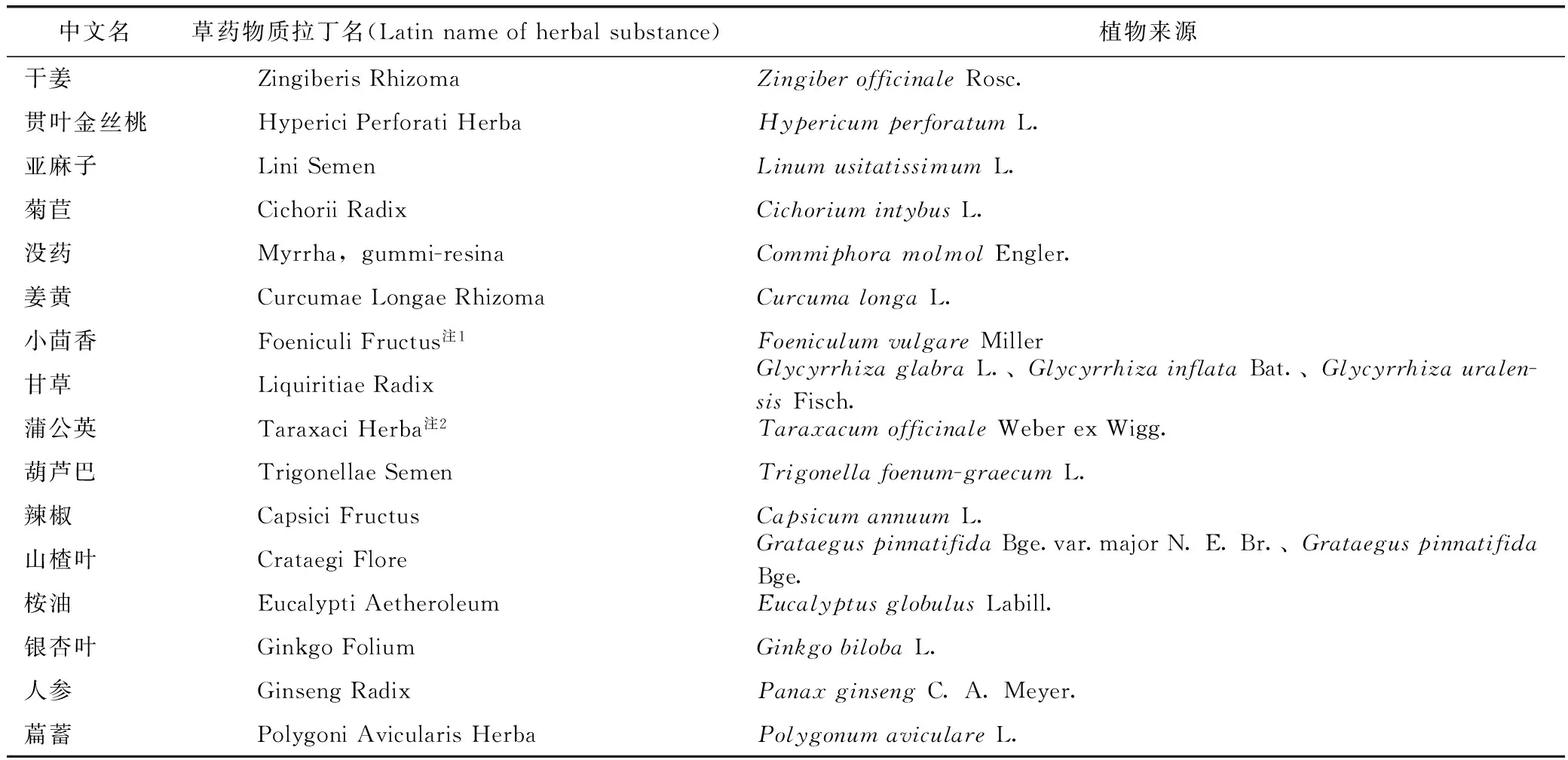
表4 已建立欧盟草药专论的且被《中华人民共和国药典》(2015 年版)收录的中药
注:1.小茴香在欧盟草药专论中的分类更细致;2.蒲公英在欧盟和我国药用部位不一致。

表5 发布PS的植物药
注:部分植物含中文名。
4 讨论
相较于欧盟的专论制度,我国虽然有《中华本草》这类由政府部门组织编撰的中药权威著作,也有《中药大辞典》等由学术界主编的使用范围广的著作,但是缺少一个介于药典和工具书之间的官方指导性文件,欧盟草药专论有着类似于药品原料备案目录的作用,植物药在建立专论后,其安全性就在整个欧盟被认可,传统草药专论中的植物药的传统使用历史也会被确认。欧盟草药专论虽然内容不多,但是在销售环节弥补了植物药临床应用、药理性质、特殊用法等官方解释,专论也是在动态变化,增强了公众对植物药的信赖度,有利于植物药的发展。
中国企业在向欧盟注册产品时,注意多利用已建立欧盟专论的中药品种,如人参、姜黄等,同时也要注意那些发表公开声明(PS)的中药品种,如当归,如果申报的产品含有当归成分,需要注意PS中专论不予建立的原因,并针对这些原因在准备申报资料时准备相应的足以证明产品安全性有效性的材料。
同时,我国政府部门、行业组织和企业应该多与欧盟方面沟通,在我国广泛的中药资源中,选取一些国际知名度高、药用历史悠久、基础研究充分、安全性有保障且临床作用突出的一些中药,并可以参照现有欧盟专论的治疗作用领域,如胃肠道失调、感冒咳嗽、泌尿及妇科疾病、皮肤疾病和皮肤擦伤,再根据欧盟市场的传统用药习惯,集中力量协助建立一批中药的欧盟草药专论。在这方面,我国的政府机构、行业组织和企业也做了不少工作。2011年10 月,中国医药保健品进出口商会和中国-欧盟世贸项目(二期)项目组共同承办了《欧盟传统草药注册程序指令》专题培训会,强调推动HMPC 建立“专论”或许是中药敲开欧盟大门的“敲门砖”[10];2013年6月,国家中医药管理局副局长在访问波兰,与欧盟药典委员会的专家就中草药专论列入欧盟药典问题进行了充分交流[11]。
根据现况,建议我国的相关行业组织进一步加强与欧盟当地中医药团体的交流。在欧盟,中医药从业人员和中医药团体数量均不少,而我国有关中医药的商学协会数量也在不断增多且研究领域在不断细化,通过中欧的中医药行业组织的交流对话,既能帮助欧盟的官员专家了解我国中药现况,也能为我国的中药企业走进欧盟打造一个对话的平台,这对中药纳入欧盟专论将起到很好的推进作用。
我国的中药在规范化种植和生产方面也亟需加强,仅有专论不足以使我国中药产品进入国际市场,对此,中药需要吸取欧盟在管理植物药的先进经验,并发掘和利用我国中药的特点和优势,使更多的中药进入欧盟市场。
[1] 汪建芬,张中朋,许铭,等.欧盟成员国传统植物药品注册情况进展[J].中国现代中药,2016,(12):1661-1665.
[2] 瞿礼萍,王文珺,周祯祥,等.基于“欧盟草药专论”解析中药欧盟注册关键问题[J].中草药,2014,45( 24) :3509-3514.
[3] Committee on Herbal Medicinal Products (HMPC).[EB/OL].[2017-2-25].http://www.ema.europa.eu/ema/index.jsp?curl=pages/about_us/general/general_content_000264.jsp&mid=WC0b01ac0580028e7c
[4] European Union monographs and list entries.[EB/OL].[2017-2-26].http://www.ema.europa.eu/ema/index.jsp?curl=pages/regulation/general/general_content_001132.jsp&mid=WC0b01ac0580033809
[5] The European Parliament and the Council of the EuropeanUnion. Directive 2004 /24 /EC of the European Parliamentand the Council of 31 March 2004 amending,as regardstraditional herbal medicinal products,Directive 2001 /83 /EC on the Community code relating to medicinal productsfor human use[J]. Official Journal of the European Union,2004,47( L-136) 85.
[6] COMMITTEE ON HERBAL MEDICINAL PRODUCTS (HMPC) [EB/OL].[2017-2-22].http://www.ema.europa.eu/docs/en_GB/document_library/Regulatory_and_procedural_guideline/2009/12/WC500016900.pdf
[7] Community herbal monograph on Panax ginsengC.A.Meyer,radix.[EB/OL].[2017-2-26].http://www.ema.europa.eu/docs/en_GB/document_library/Herbal_-_Community_herbal_monograph/2014/05/WC500167387.pdf
[8] Overview of assessment work-Priority list. [EB/OL].[2017-2-25].http://www.ema.europa.eu/docs/en_GB/document_library/Other/2009/12/WC500017724.pdf.
[9] Herbal medicines for human use. [EB/OL].[2017-2-26].http://www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/landing/herbal_search.jsp&mid=WC0b01ac058001fa1d.
[10] 王丹.“专论”或成中药进欧盟市场“敲门砖”[N]. 医药经济报,2011-10-26(011).
[11] 魏敏. 17种中草药专论列入欧盟药典[J]. 中医药管理杂志,2013,(06):606.
EUCommunityHerbalMonographandItsEffectonTCMRegistrationinEU
WANG Jianfen1,ZHANG Zhongpeng2,WANG Yutong1,XU Ming2,LI Siru1,ZOU Qinwen3,LIN Ruichao1*
(1.SchoolofChineseMateriaMedica,BeijingUniversityofChineseMedicine,Beijing100102,China;2.ChinaChamberofCommerceforImport&ExportofMedicines&HealthProducts,Beijing100010,China;3.BeijingLianxinPharmaceuticalCo.,Ltd,Beijing102609,China)
EU is an important market for traditional herbal medicine products.As of 2016,only two products of traditional Chinese medicine successfully registered in the EU.Listing of TCM in the EU faces many policy and technical barriers,and a very important reference for traditional herbal medicines registration in the EU is the Community Herbal Monograph (CHM).This paper analyzes the number,therapeutic areas,and the state of CHM and aims to provide some insight to Chinese TCM companies wishing to launch their finished products in EU.
Traditional Chinese medicine;Community Herbal Monograph;registration
] 林瑞超,教授,研究方向:中药品质评价;Tel:(010)84738653,E-mail:linrch307@sina.com
10.13313/j.issn.1673-4890.2017.5.003
2017-03-27)
*[

