尿微量清蛋白抗原再添加检测技术与前带检查研究分析*
张杰良,黄雪珍,莫和国,邓文成,梁映亮,徐灼均,徐 宁
(南方医科大学附属小榄医院检验科,广东中山 528415)
·经验交流· doi:10.3969/j.issn.1671-8348.2017.28.024
尿微量清蛋白抗原再添加检测技术与前带检查研究分析*
张杰良,黄雪珍△,莫和国,邓文成,梁映亮,徐灼均,徐 宁
(南方医科大学附属小榄医院检验科,广东中山 528415)
目的探讨尿微量清蛋白(mALB)抗原再添加检测与前带检查技术应用,识别并消除反应体系中存在的钩状效应。方法选择mALB浓度分别为3.03、1 152.20、2 031.20、3 539.60 mg/L的门诊患者随机新鲜尿液标本4份,选取浓度为3.03 mg/L与1 152.20 mg/L两份标本,按照不同的稀释比例,配制成系列稀释浓度标本12份,加上述两高值标本组成14份高低系列浓度标本;在全自动生化分析仪上设置前带检查报警参数,使用抗原再添加技术检测14份标本中mALB,观察并记录理论浓度值、反应过程吸光度值、实测浓度值与前带检查值;通过对出现前带报警前后标本浓度进行系列再稀释,查找出现前带报警的最低浓度值。结果系列稀释浓度标本中,低浓度标本1至标本5没有前带检查报警,而高浓度标本6至标本14都有前带检查报警,而出现前带检查报警的最低浓度值为360.74 mg/L。结论mALB检测方法对高浓度标本存在明显的钩状效应,应用抗原再添加检测与前带检查技术能够迅速、有效地识别反应体系中的钩状效应,并通过仪器自动稀释再检测功能正确测定标本浓度。
尿微量清蛋白;抗原再添加技术;前带检查;钩状效应
免疫浊度分析是利用抗原与相应抗体反应后形成免疫复合物,通过介质浊度产生的变化,定量检测标本中抗原或抗体浓度的方法,其在临床检验医学技术方面应用极为广泛,如免疫球蛋白、特种蛋白、补体、尿液蛋白等物质的检测;该方法是一种抗原抗体结合动态测定方法,具有敏感、特异、简便快速等特点,可用于自动化及大批量检测[1];然而,此方法对于低浓度标本的检测结果比较好,但对于高浓度标本可能会出现“钩状效应(Hook Effect)”[2],即由于抗原或抗体过量,使抗原抗体比例不合适而导致检测结果呈弱阳性或假阴性的现象。本研究应用抗原再添加检测与前带检查技术,通过对系列高低浓度的尿微量清蛋白(mALB)进行免疫比浊定量检测,研究分析不同浓度标本反应吸光度与实测浓度的变化,同时根据反应监测曲线形状与前带检查(Prozone Check)报警值,识别并消除反应体系中存在钩状效应。
1 材料与方法
1.1标本来源 选择门诊患者新鲜随机尿液4份,经检测,mALB浓度分别为3.03、1 152.20、2 031.20、3 539.60 mg/L。
1.2仪器与试剂 采用Roche Cobas C8000全自动生化分析仪进行样品检测;mALB检测试剂(R1、R2),mALB抗原过剩检测试剂(R3)及配套校准品与质控品均由Roche公司提供。
1.3方法
1.3.1检测原理 mALB采用的是抗原再添加的检测方法,即抗清蛋白抗体与样品中清蛋白反应产生抗原/抗体复合物并形成浊度,在抗体适当过量的情况下,吸光度随着浊度增加而增加,反应曲线方向上升;随后加入一定量稀释的清蛋白(抗原过剩检测试剂),如反应曲线方向继续上升,说明抗体过剩,如反应曲线方向转为下降,说明抗原过剩。根据反应监测曲线吸光度的前后变化可计算出标本mALB浓度与判断是否发生钩状效应。
1.3.2检测参数 mALB检测方法采用2点终点法,主/次波长为340 nm/700 nm,整个检测过程时间10 min,仪器共测定并记录38个吸光度点测定值并生成反应监测时间与吸光度反应曲线图;其中试剂R1、R2、R3添加时间分别于第0、8、19点;用于标本吸光度及浓度计算的为第6点吸光度(A6)与第14点吸光度(A14)值,而用于前带检查(PC)的吸光度为第18点吸光度(A18)与第26点吸光度(A26)值,前带检查(PC)吸光度区间下限为“-32 000”,上限为“700”,如果PC值落在上下限之间,则前带报警“>Proz”。以上所有检测参数由Roche公司提供。
1.3.3标本吸光度与前带检查值计算[3]标本吸光度:Ax=A14-dx×A6,dx=(Vsamp+VR1)/(Vsamp+VR1+VR2),Cx=b×[(a-Ax)/(Ax-d)]1/c;前带检查值:dx=(Vsamp+VR1+VR2)/(Vsamp+VR1+VR2+VR3),PC=A26-dx×A18。Ax为待测标本吸光度计算值,dx为稀释因子,Cx为待测标本浓度,Vsamp与VR1、VR2、VR3为反应过程样品与各试剂体积,a、b、c、d分别为mALB校准曲线参数(S1Abs,K,A,B),PC为前带检查值。本文Cx与PC由仪器自动计算并记录。
1.3.4系列稀释浓度标本配制与测定 按照以下稀释系列“1 L,0.95 L+0.05 H,0.9 L+0.1 H,0.8 L+0.2 H,0.7 L+0.3 H,0.6 L+0.4 H,0.5 L+0.5 H,0.4 L+0.6 H,0.3 L+0.7 H,0.2 L+0.8 H,0.1 L+0.9 H,1H”,用低浓度标本3.03 mg/L(L)对高浓度标本1 152.20 mg/L(H)进行稀释,将系列稀释浓度标本与浓度为2 031.20、3 539.60 mg/L两高值标本进行编号(标本1、标本2……标本14)并在仪器上检测,计算系列标本理论浓度,记录仪器反应过程吸光度值与实测浓度值。根据发生前带检查报警(>proz)前后(标本5与标本6)的标本浓度,再采用上述的低浓度标本(L)与高浓度标本(H)配制(标本5与标本6浓度区间)系列稀释浓度标本,稀释系列为(μL):345L+135H、345L+140H、345L+145H、345L+150H、345 L+155 H、345 L+160 H、345 L+165 H、345 L+175 H,标本编号:标本21、标本22……标本28。记录仪器反应过程吸光度值及实测浓度值。
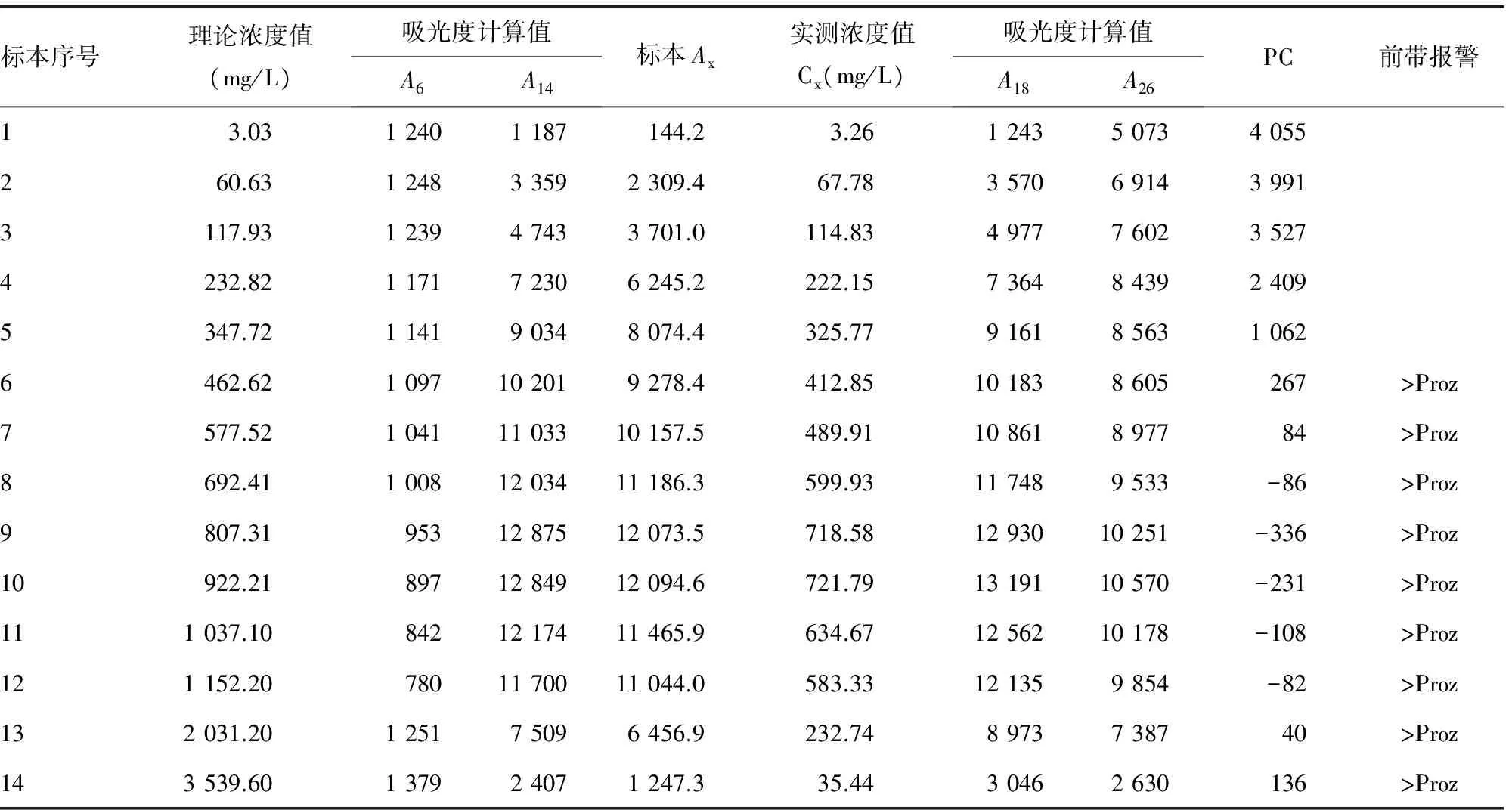
表1 mALB系列稀释标本浓度检测值与前带检查值表
2 结 果
2.1mALB系列稀释标本理论浓度值、吸光度值、实测浓度值及对应前带检查(PC)值结果 PC值在区间“-32 000,700”之内的,显示前带检查报警“>Proz”。见表1。
2.2前带报警前后再稀释系列标本浓度检测结果 标本21、标本22……标本28的检测浓度及对应的PC值分别为:327.39 mg/L(982)、337.28 mg/L (871)、345.24 mg/L (829)、355.52 mg/L (787)、360.74 mg/L (665,>Proz)、369.64 mg/L (394,>Proz)、375.00 mg/L (383,>Proz)与396.75 mg/L (141,>Proz)。

图1 mALB理论浓度值与吸光度计算值及实测浓度值关系变化图
2.3mALB系列稀释标本理论浓度值与吸光度计算值及实测浓度值的变化关系 mALB系列稀释标本理论浓度值与吸光度计算值及实测浓度值的变化关系见图1。随着标本mALB浓度(理论浓度)的增高,仪器测定吸光度值及Ax也在升高,一直到标本10(922.21 mg/L)达到峰值;此后的高浓度标本11(1 037.10 mg/L)至标本14(3 539.60 mg/L),测定吸光度值及Ax反而在下降,其中浓度最高的标本14下降最多,其吸光度计算值Ax只有1 247.3,介乎于低浓度标本1(3.03 mg/L)与标本2(60.63 mg/L)的Ax之间,呈明显的假性低值。mALB系列稀释标本反应过程吸光度变化较为典型的6个反应监测曲线见图2。反应曲线监测点6之前(标本与试剂1混合后),高低浓度标本吸光度变化相差不大;监测点14之前(标本与试剂1,2混合后)抗原与抗体反应形成免疫复合物,产生浊度,在一定范围内标本浓度越高,吸光度越高,通过监测点A6与A14吸光度变化可根据公式计算待检标本浓度。
3 讨 论
钩状效应是免疫比浊分析中很常见的现象,如肾病综合征患者尿液中mALB的检测(出现弱阳性或假阴性结果),能否正确识别与消除反应体系中存在的钩状效应,直接关系到待测标本结果准确性,进而影响临床诊断与治疗[4]。
根据表1和图1理论浓度、标本Ax与仪器记录的实测浓度Cx之间不成比例的变化关系可知,mALB检测方法对高剂量标本存在明显的钩状效应。表1与图1还显示,标本10的浓度值为系列稀释浓度拐点(标本吸光度与实测浓度由增长转向下降),从而可能会误认此标本浓度为出现钩状效应的拐点,但从PC值可知,标本6的浓度值(462.62 mg/L)已出现前带检查报警(>Proz),一直持续到标本14;也就是说,标本6到标本10之间虽然反应仍为正反应,但已出现钩状效应(理论浓度与实测浓度不成比例增加),而出现钩状效应的浓度点应是在标本5(347.72 mg/L)与标本6浓度之间。根据前带报警前后浓度再稀释系列标本检测结果,mALB检测方法出现前带检查报警的最低浓度值为360.74 mg/L,即标本浓度大于或等于此值的检测结果可能存在钩状效应。上述结果说明,通过在分析仪器设置前带检查参数可迅速、有效识别反应体系中存在的钩状效应[5]。需要注意的是,本实验所用的mALB检测试剂盒的使用说明书上注明的方法检测范围为3~400 mg/L,其上限值比本实验前带报警值要高。也就是说,检测值在达到方法检测范围上限前可能已存在钩状效应,因此对检测结果进行解释或进行方法性能验证时要注意鉴别。
通过图2可知,如反应体系中有抗体过剩,加入抗原过剩检测试剂(试剂3)后,浊度增加,吸光度继续上升;如反应体系中抗体已消耗完(抗原过量),加入抗原过剩检测试剂后,浊度增加不明显,甚至下降,导致吸光度下降,通过吸光度点A18与A26监测加入抗原过剩检测试剂前后吸光度变化,并计算前带检查值判断是否出现前带报警。从图2可直观看出,高低浓度标本反应监测曲线整体呈现明显不同变化,以标本2的反应曲线为参考曲线来看,随着标本浓度的增高,反应曲线向上移动,标本10的反应曲线达到最高点;此后,随着标本浓度继续升高,其反应监测曲线却向下移动,这种现象的出现是由于标本浓度越高,抗原抗体比例越失衡,反应完成率就越低造成的。标本14(3 539.60 mg/L)可能是由于反应一开始抗体就被消耗完成,抗原抗体比例严重失衡,各监测点吸光度均处于低水平,其整个反应监测曲线呈一低平曲线。由此可知,正确认识与理解反应监测曲线的吸光度前后变化特点,是鉴别钩状效应是否存在的基础[6]。
免疫比浊中高剂量钩状效应识别可以从检测系统的试剂、仪器、方法等各环节着手。有研究报道通过反应完成率设置仪器参数与试剂或样品二次添加观察时间反应进程曲线的变化,可有效识别反应体系中存在的钩状效应[6-7],但该方法无法给出直观明了的报警参数,并且操作繁琐,不容易理解。腾晓梅[8]通过对超过检测方法线性范围的标本进行手工稀释或仪器自动稀释再检测的方法能较好地识别钩状效应,但本文结果已表明,在标本浓度达到线性范围阶限前可能已存在钩状效应。上述学者文献结果显示,在全自动生化分析仪器上设置合适的检测参数对标本进行监测,是监测反应体系中钩状效应存在的有效方法,但都无法准确、直观快速地解决反应体系中钩状效应。本实验的mALB检测方法应用抗原再添加与前带检查技术,通过观察反应监测曲线的变化及反应过程有无前带检查报警,能够迅速、准确地测定标本中的mALB浓度,并能有效识别反应体系中存在的钩状效应。如识别反应体系存在有钩状效应,则可以通过仪器上的自动稀释功能对标本进行稀释重测或采用手工合理稀释后正确测定标本中分析物浓度。
高剂量钩状效应不仅存在于免疫比浊分析中,在电化学发光免疫[9]、酶免疫测定[10]等所有以抗原抗体反应为基础、以吸光度分析为手段的临床检验方法中也普遍存在。因此,作为临床实验室工作者应该高度重视抗原抗体检测中高剂量钩状效应对分析结果的影响,尽量识别并消除反应体系中存在的钩状效应,切实提高检测结果的准确性,为临床提供可靠的诊断数据。
[1]王兰兰,许化溪,欧启水,等.临床免疫学检验[M].北京:人民卫生出版社,2012:206-211.
[2]Cha KH,Sim YB,Chae H,et al.The analytical performance evaluation of FreeliteTMHuman Kappa Free and Human Lambda Free on the SPAPLUSTMimmunoturbidimetric analyzer[J].J Clin Lab Anal,2014,28(3):229-236.
[3]ROCHE.Cobas C8000 modular analyzer series COBI-CD Compendium of Background Information[M].Germany:Roche Diagnostics GmbH,2009:9-43.
[4]王妹,胡仁明.催乳素免疫测定法和钩状效应[J].国际内分泌代谢杂志,2009,29(2):95-97.
[5]Christopher RM,Peter MV,Catherine AH.A case of hook effect in the serum free light chain assay using the Olympus AU400e[J].Clin Biochemi,2009,42(1):121-124.
[6]刘忠民,高月亭,陈涛.自动生化分析仪自动识别免疫比浊分析中的钩状效应[J].现代临床医学生物工程学杂志,2000,6(4):252-254.
[7]刘忠民,高月亭,陈涛.抗原过量检查在全自动生化分析仪上的应用[J].广州医学院学报,2000,28(4):54-56.
[8]滕晓梅.免疫比浊法用于全自动生化分析仪中产生钩状效应的防范[J].国际检验医学杂志,2015,36(12):1649-1650.
[9]李慧,高致远.电化学发光免疫法检测甲胎蛋白出现钩状效应1例[J].检验医学,2012,27(9):706-707.
[10]吕朝辉,范玉林,马晓红,等.ELISA法检测HBsAb产生钩状效应2例临床分析[J].中国肝脏病杂志,2014,6(2):59-60.
广东省中山市医学科研基金资助项目(2016J154)。
张杰良(1982-),主管技师,本科,主要从事临床生化检验工作。△
,E-mail:769137702@qq.com。
R446.1
B
1671-8348(2017)28-3962-03
2017-04-18
2017-06-26)

