石生微生物研究进展
吴明辉, 章高森, 陈 拓, 刘光琇, 张 威
(1.中国科学院西北生态环境资源研究院 冰冻圈科学国家重点实验室,甘肃 兰州 730000;2.中国科学院大学,北京 100049;3.中国科学院西北生态环境资源研究院 沙漠与沙漠化重点实验室,甘肃 兰州 730000;4.甘肃省极端环境微生物资源与工程重点实验室,甘肃 兰州 730000)
石生微生物研究进展
吴明辉1,2,4, 章高森3,4*, 陈 拓1,4, 刘光琇3,4, 张 威3,4
(1.中国科学院西北生态环境资源研究院 冰冻圈科学国家重点实验室,甘肃 兰州 730000;2.中国科学院大学,北京 100049;3.中国科学院西北生态环境资源研究院 沙漠与沙漠化重点实验室,甘肃 兰州 730000;4.甘肃省极端环境微生物资源与工程重点实验室,甘肃 兰州 730000)
石生微生物是一类自养微生物支持下的在全球广泛分布、能较好适应极端自然条件的岩石生境微生物及微生物群落。石生生物的研究对极端环境生态适应机制、探索地外生命以及保护石质文物等方面都有重要指导作用,然而我国对石生微生物的研究罕有报道。本文从石生微生物的分类、分布、研究方法、生态适应等方面的研究进展进行综述,对石生微生物研究存在的问题进行探讨,为我国相关领域的研究提供参考。
石生微生物;岩石;蓝藻;极端环境;地外生命探索
石内生微生物最早被发现于以色列和加州沙漠的石灰岩、砂岩中[1],后来在南极也发现存在这类特殊生物并受到了广泛关注[2]。同一期间,科学家们开展了对火星表面的生命探测[3]。石生微生物的存在,尤其是在之前被认为无生命存在的南极干谷这一类火星环境中发现石生微生物群落,为地外生命探索提供了一个新的思路:外星生命有可能生活在石头里面。后来,人们陆续在火星陨石中发现构成生命的有机碳,似乎更加印证了火星是存在生命的。但这些陨石,也可能是火星化学反应所致,所以还需要进一步确认。这一发现不仅在一定程度上支持了地外生命的探索行动,还大力推动了全球范围内石生微生物研究的开展。近年来,有关石生微生物的多样性、群落组成以及适应岩石生存的生态机制研究已有很多,但是大多集中在国外,研究区域也相对固定,国内对其研究鲜有报道。本文综述了目前国外在石生微生物的分类、分布、生态适应等方面的研究进展,并提出了今后在石生微生物方面需要深入研究的几个问题。
1 石生微生物的种类与分布
石生微生物最早被定义为“存在于多孔的裸露岩石表层以下的生物群落”[4]。随后经过大量的野外研究发现,这类微生物不仅能在多孔的岩石内部定居,岩石裂缝、岩土界面也存在许多类似的微生物群落。所有这些生活在岩石内部或表面的微生物群落被统称为石生微生物(lithobiotic microorganisms)。根据石生微生物群落在岩石定殖(colonization)部位的不同,可分为石内生微生物(endolithic microorganism)、石表生微生物(epilithic microorganism)和石下生微生物(hypolithic microorganism)三大类。
1.1石内生微生物(Endolithicmicroorganism)
能够在岩石内部定殖和存活的微生物及微生物群落叫石内生微生物。狭义上讲,石生微生物就是指石内生微生物。石内生微生物对环境的适应范围很广,定殖的岩石种类丰富,群落结构大体类似,其生态系统的机理机制对其他石生微生物的研究具有借鉴意义。
根据微生物在岩石内部定殖部位的不同(图1),可分为石隙生、石隐生和石隧生微生物三个不同的群落类别(表1)。石隙生微生物定殖在花岗岩和砂岩等岩石的裂纹和裂隙中;石隐生微生物定殖在砂岩和盐岩的迎光面的内部,根据岩石透光性不同和晶体间孔径大小差别,一般位于岩石表面以下2 mm~10 cm处;石隧生微生物主动渗透到岩石内部,形成符合身体形状的隧道。

图1 石内生微生物示意图(改自Golubic et al.,1981)[5]Fig.1 Schematic diagram of endolithic microorganism (Modified after Golubic et al., 1981)[5]

中文名英文名定殖部位岩石类型群落主要成员石隙生微生物chasmoendolithicmicroorganism岩石的开放空间,例如裂纹、裂缝花岗岩、花岗闪长岩、沙漠漆、砂岩藻类、细菌、真菌、酵母石隐生微生物cryptoendolithicmicroorganism多孔岩石内部砂岩、石灰岩、盐岩、石膏、大理石、黑曜岩地衣、细菌、真菌石髓生微生物euendolithicmicroorganism岩石内部的“隧道”中、钻孔钙质岩石、贝壳、鲕粒、死珊瑚、砂岩藻类、细菌、真菌
石内生微生物已被发现在各种各样的环境中。例如:南极干谷[6-7]、洛斯沙漠[8-10]、中国贵州喀斯特地区[11]、意大利北部的温泉[12]、北大西洋东部的海底珊瑚山[13]等。
1.2石表生微生物(Epilithicmicroorganism)
定殖在岩石表面的微生物及微生物群落叫做石表生微生物。石表生微生物通常能很好地适应抵抗极端环境条件,如温度变化大, 极端干燥, 和强烈的太阳辐射[14]。它们有时是沙漠和高山地区唯一的定殖者。石表生微生物群落的典型代表是微生物膜(垫)(microbiofilm,mat),又可以表述为缔结在岩石表面,具有群体密度高(每毫升水化生物膜含有1010数量级上的细胞),黏质的细胞外聚合物(EPS)基质,以及广泛的物理、代谢和化学异质性等特征的微生物群落[15]。
石表生微生物定殖的生境类型多种多样,以河流和湖泊底栖居多。群落结构和表征因环境之间的巨大差异存在多样性的变化(表2)。相对来说,暴露在空气中的生物膜群落多样性要高于其他生境类型,主要的藻类包括绿藻门(Chlorophyta)、轮藻门(Charophyta),主要真菌为子囊菌门(Ascomycota)、担子菌门(Basidiomycota),细菌为酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、变形菌门(Proteobacteria)。对于其他生境来说,河流与湖泊沉积物中的主要藻类有所变化,主要为硅藻门(Diatom)、褐藻门(Ochrophyta),细菌的主要类型大同小异,其中以变形菌门最为常见,真菌在生物膜研究中不常报道。

表2 几种不同生境类型的石表生微生物类群
注:“-”表示未记录数据
1.3石下生微生物(Hypolithicmicroorganism)
定殖在岩石的底部或岩土界面的微生物及微生物群落称为石下生微生物。这类微生物群落在沙漠(戈壁)中比较常见。岩石的底部为微生物提供了一个可以保持湿度和避免高光强辐照保护区,使得石下生微生物免受极端干旱和光化学氧化胁迫的伤害[26-27]。从侧面观察,可以清晰看到界限分明的“环”在岩石的底部或薄的岩石周围(图2)。

图2 石下生微生物示意图(改自Cockell, C. S. et al.,2004)[28]Fig.2 Schematic diagram of hypolithic microorganism (Modified after Cockell, C. S. et al., 2004)[28]
石下生微生物定殖的岩石类型大体上具有相同的特征:透明或半透明。例如石英、石灰岩、石膏、碳酸盐岩等,这类岩石可以为光能自养微生物提供微弱的光能,进而支撑石下生微生物生态系统的形成。目前关于石下生微生物的报道已经有很多,例如: 南极韦斯特福尔山脉[29]、美国莫哈韦沙漠[27]、以色列内盖夫沙漠[30]、非洲纳米布沙漠[31]、中国沙漠[32]。
石下生微生物群落组成多样[33-34]。主要细菌为放线菌门、变形菌门、绿弯菌门(Chloroflexi)、拟杆菌门(Bacteroidetes)、酸杆菌门、疣微菌门(Verrucomicrobia),主要藻类包括蓝藻门(Cyanobacteria)、绿藻门,其中包含了色球藻目(Chroococcales)、颤藻目(Oscillatoriales)、念珠藻目(Nostocales)、宽球藻目(Pleurocapsales)、鞘丝藻属(Lyngbya)等几种常见类群。除此之外,苔藓和一些原生生物,例如囊虫泡总门(Alveolata)也参与群落组成。
2 石生微生物的研究意义
2.1石生微生物的生态学意义
广义上,石生生态系统附属于岩石圈(陆地表层)生态系统。它参与着岩石圈的物质循环过程,并且对气候系统具有重要的反馈作用。例如,生活在海底石生微生物被认为在碳循环和全球变暖中发挥作用,原因是微生物代谢产生的甲烷气体对气候存在潜在影响[35]。
石生微生物在全球分布广泛,而且只要有微生物存在的地方,就会存在以微生物酶促的生物化学反应。因此石生微生物对全球陆地的化学物质循环起着重要作用。同时,石生微生物也具有环境效益。例如,生物修复被污染的矿石和地下水,使水质得到改善。此外,石生微生物还可能负责生物矿化某些重要的经济矿石[36-37]。有关石生微生物参与到全球化学物质循环中的作用、对岩石圈中化学物质转化的贡献还有待进一步研究。
2.2石生微生物对地外生命探索的意义
现代科学研究表明,在地质和地貌类似于地球的星球上可能存在着生命迹象,也就是生命普遍存在于宇宙中[38]。在太阳系中,火星一直是离地球最近且最相似的星球,火星表面的砾石环境与地球寒旱地区的裸岩环境最为相似。很多证据表明,寒旱环境并不适合生物的生存。除了剧烈变化的日温度与寡营养外,高强度的辐射和极度匮乏的水资源都使得生命无时无刻不面临着死亡的挑战。然而,石生微生物的发现,正面证明了生物强大的生存能力。
荷兰科学家Lourens Baas Becking认为,微生物能到达任何一个它们觉得适合繁殖的地方[39]。在如此极端的环境下,岩石提供了适宜的居所。美国科学家Henry Sun提出,它们(石生微生物)不是喜欢待在这样一个又冷又干的地方,只是它们别无选择[40]。假设火星上曾经出现过生命,可想而知,火星微生物在星球变得干旱、强辐射的时候,寻求孤立的岩石微环境作为庇护,是它们最后的生存斗争[41-42]。
2.3石质文物的保护
石质文物是在历史发展过程中遗留下来,具有历史、艺术、科学价值的以天然石材为原材料加工制作的遗物。大到大型石雕石刻及石窟艺术品,小到石刀石斧等小型工具及石钟、石鼓艺术品,是不能再生的极为宝贵的资源[43-44]。然而,石生微生物的定殖不仅严重破环了文物的价值,而且给文物的保护和修复过程带来很大的阻碍,所以针对石生微生物展开文物保护的研究迫在眉睫。
对于石质文物中微生物的处理,根本目的就是杜绝微生物的侵染与扩散。首先考虑消灭发展最好的、破坏能力最强的微生物[45-46]。根据Ascaso的研究推测[47],最理想的方法就是在原位对微生物进行处理,借助显微技术对细胞及其超微结构的改变进行观察,还可以利用叶绿素的荧光检测互补技术揭示光合微生物的生理状态。但是这种方法直接用在文物上是不合适的,可以利用替代物,通过研究石内生微生物的建群过程和机理,为理解石质文物的生物侵蚀过程和机理提供重要线索,为制定防治方案提供更多依据。
3 石生微生物的研究进展
对于石生微生物,科学家一直在不断地发现并逐渐深入。由于实验条件的限制,早期的研究一直侧重于其群落结构和微生物多样性方面。最初的研究样品来自于南极的砂岩[4],研究表明微生物定殖形成独特的“地衣结构”[2]。这项研究发表在Science期刊上,对石生微生物的研究有重大意义:①蓝绿藻是石隐生生态系统的初级生产者;②初步阐明了石隐生微生物的定殖方式;③简要探讨了适应极端环境的机制。这三点也是现在绝大多数从事石生生命研究的焦点。
3.1石生微生物的定殖方式
岩石是构成地球岩石圈的主要成分,由一种或多种矿物组成,生物难以分解吸收其中的化学成分。因此,科学家对微生物在岩石的生存方式产生了极大的兴趣:①岩石的内部构造;②石生微生物在岩石内的原位分布。
对于结构十分致密的岩石来说,不存在探讨内部结构的价值。所以科学家将重点关注疏水多孔的砂岩[2,48]和一部分盐岩(石膏)[49-50]。砂岩和石膏都是由单晶体颗粒形成,利用X射线衍射(XRD)可以分析岩石的矿物组成与结构[49]。Wierzchos等[50]利用该技术对石膏的上表面(A)、内部(A′)、底面(A″)的孔隙大小进行了统计分析,发现石膏内部的孔隙明显比外表面的大(图3)。石膏内部恰恰是微生物定殖的主要部位,孔隙增大与微生物参与矿物质的溶解有关。

图3 X射线粉末衍射技术对石膏样品的孔径大小分析(改自Wierzchos, J. et al.,2015)[50]Fig.3 The analysis of pore size in gypsum sample by XRD (Modifiedafter Wierzchos, J. et al., 2015)[50]
利用测量不同位置的光合光量子通量密度(PPFR)的强度,可以对不同深度的蓝藻定殖位置进行假设。再结合环境因子的作用,便可以对石隐生和石下生微生物的原位分布做出模拟[50](图4)。可以看出,整个分布状态可以划分为6层,微生物的定殖部位受到水分、光强、UV辐射、蒸发率以及孔隙度的影响。
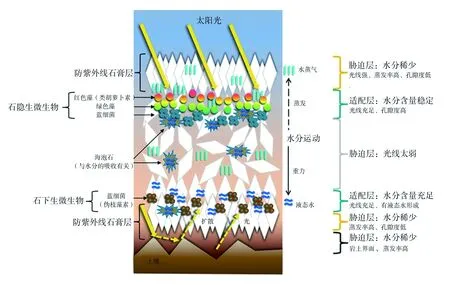
图4 阿塔卡玛沙漠石膏样品中石生微生物定殖亚微米级示意图(改自Wierzchos, J. et al.,2015)[50]Fig.4 The analysis of pore size in gypsum sample by XRD(Modified after Wierzchos, J. et al., 2015)[50]
石隐生微生物在砂岩中形成典型的“地衣结构”[2,51](图5),即深(黑)色层为藻类细胞被颜色较深的真菌(地衣共生菌)菌丝包围缠绕形成,白色层为松散的菌丝,绿色层主要为藻类细胞。
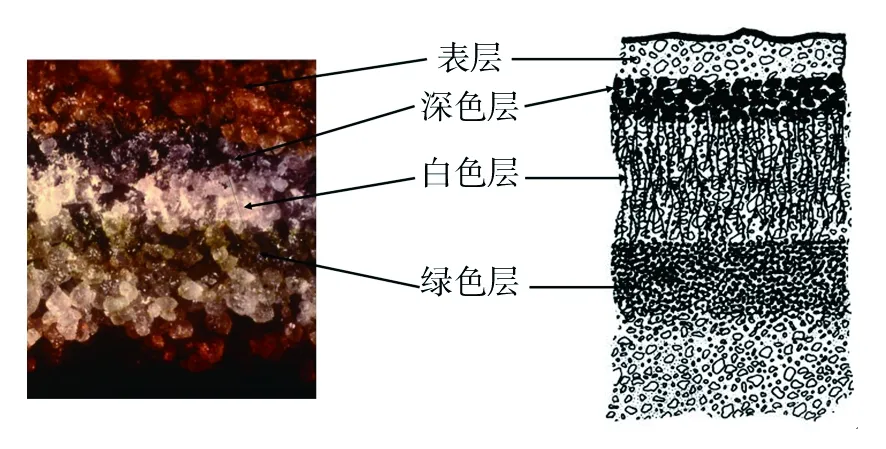
图5 南极干谷石隐生微生物定殖示意图(改自Friedmann, E. I.,1982;Edwards, H GM et al.,2004)[2,51]Fig.5 Schematic diagram of cryptoendolithic colonization from the Antarctic dry valley(Modified after Friedmann, E. I., 1982;Edwards, H GM et al., 2004)[2,51]
3.2石生微生物极端环境适应机制
石生微生物生存的环境条件多种多样,例如干旱、寒冷、高温、盐碱化、UV辐射、寡营养等。在长期的进化过程中,石生微生物形成了耐受各种极端条件的机制。这些机制除了微生物自我调节外,最重要的是岩石本身对微生物适应的帮助是巨大的。
3.2.1 水分:干燥 对于生存在荒漠中的石生微生物来说,水是异常珍贵的。大量的蒸腾和稀缺的降水导致生命体可利用的水资源十分稀少。对于石生微生物而言,有着独特的水分吸收方式和耐旱装置。在南极荒漠,雪的融化为生物提供唯一的水源[2,52-53]。在夏天,有少量的雪可以融化从而流入岩石中[54]。岩石基质和地衣结构在高湿度条件下可能会收集和浓缩水[55],紧密的地衣结构和岩石间隙通过物理机制(毛细作用)将融化的雪水或高湿度的水蒸气吸收进石头,此过程并非生物过程。疏松多孔的岩石基质就像水库一样,可以将融水储存起来[2],长达几天甚至数周。南极之外的荒漠,由于早晚温度发生急剧变化,使得一部分水分子凝结附着在石头表面形成露水[30,56],一部分水分子形成雾[57],对微生物而言,都是不可或缺的水资源。有研究表明,盐的潮解也是一种水的潜在来源[58]。例如,当空气相对湿度(RH)>75%时,水蒸气会在NaCl晶体周围凝结成水。当RH<75%(NaCl)的时候,盐岩也可以自发地在周围100 nm的空间内利用岩石颗粒形成的纳米多孔结构(nanoporous structure)的毛细凝聚作用获得液态水[59]。Wierzchos等[42]在室内做石生微生物的湿度控制实验,发现在RH>60%的时候,石膏(内生蓝细菌)会发生水分子自吸现象。所以,盐岩在获取液态水方面有着天然的结构优势,从而确保了石生微生物的正常生长。石生微生物的耐旱形式多种多样。有的细菌可以分裂产生一种特殊的球形细胞,度过多个周期的干湿循环或者长时间的干燥情况[60]。一些黑色的真菌[61]、南极绿藻(卵囊藻科)[62]和所有的蓝细菌[63]具有粗多糖鞘,可以用来保护细胞免受干燥伤害[64]。细菌的孢子(厚壁菌门的内孢子、放线菌的外生孢子)和厚壁孢子(蓝藻)是被记载最广泛地解释细菌脱水耐性的机制,还有报道固氮菌的囊肿和粘球菌的粘孢子也对干旱起抵抗作用[60]。另外,微生物可以合成一些调渗物质(osmoprotectants)来维持细胞活性。例如甜菜碱、蔗糖、海藻糖和四氢嘧啶等。Hershkovitz等[65]从内盖夫沙漠石生样品里分离出1株拟色球藻,可以在渗透胁迫下积累海藻糖和蔗糖。Garcia-Pichel等[66]研究表明, 丝状藻青菌在土壤湿润的条件下可以迁移到土壤表面,干燥的时候又会撤退到石头里,这也是微生物应对干旱自我调节的表现。
3.2.2 温度:低温 早期研究发现,南极洲石生微生物中真核藻类的生长温度上限在25 ℃左右[67]。后来发现从南极洲石内分离出来的蓝藻并不是嗜冷菌[68],虽然它们能在4~9 ℃的环境下生存,但是最适生长温度为20~30 ℃。Quesada等[69]推测菌群缺乏对极端低温的适应也许是一种优化调节,不仅仅是因为短短几个小时内温度会发生急剧变化,而且极端低温的环境对它们的生理压力也是巨大的,换来的只是高的死亡率。温度最高的夏天,微生物生长代谢也最活跃。-10~5 ℃之间的岩石温度并不适合微生物生长,但是从群落角度来看,岩石微生物光合固定产量最大,群落达到了最大的适应性[70]。也就是说,相比于单体物种来说,微生物群落拥有适应广泛温度变化的热制度(状况)[71]。最适温度以外的物种,通过调节初级生产者和消费者的比例(Rp/C)达到适应环境的目的。环境温度上升,群落的Rp/C值会升高。Friedmann等[71]在世界范围内的地衣群落内验证了这种猜想。在荒漠环境,细菌对干燥的耐受比对温度的适应更重要[60]。因为只有当岩石温度很低(20 ℃以下),限制细菌活动的水才有可能出现。石生微生物的耐低温形式也是多种多样。Finegold等[72]从南极洲一个石隐生微生物群落分析得到,细胞膜含有大量多不饱和脂肪酸。纯化得到的磷脂在-20 ℃依然保持液态,并具有不同寻常的水化功能。电子显微镜显示,膜脂质在温度低于-20 ℃时,没有形成典型的多层结构,而是形成液体晶体或无序流体状态,维护南极微生物的生存,甚至到-50 ℃。胞外多糖被认为是细胞外限制水分丧失和细胞内冰晶形成的有效物质[69,73]。一些蓝藻也会合成一些调渗物质,防止干燥和冷冻带来的渗透压伤害[74],如甜菜碱、甘油、海藻糖、甘露醇等相容性溶质[75-76]。一般情况下,冷环境中一个长期性的休眠也是微生物生存能力的体现[69]。南极地衣有其独特的适应方式。它通过改变生长模式,从密丝组织到单丝体,同时保留着恢复叶状体(密丝组织)的潜力,如果条件满足,随时可以恢复到密丝组织结构[2]。
3.2.3 光照: UV辐射、光抑制、光氧化 光量子对于石生微生物是有害的。暴露在阳光下的岩石会形成光抑制和细胞损伤、基因组损伤、光合色素漂白、光化学性能降低等[77-78]。除了岩石表层可以降低一些辐射外,石生微生物能合成“反射”紫外线的“屏幕”[64,79-80],例如真菌中的黑色素[61]、蓝细菌或藻类中的类胡萝卜素[81-83]和蓝细菌中的伪枝藻素[81-82,84-85]。其中,类胡萝卜素是吸收紫外辐射而提高细菌耐受性最多的一种色素。在高强度的辐射中生存下来的微生物的耐辐射能力会大大增强,可以达到13 kJ/m2[80]。多细胞聚集体外面形成一层“保护层”,防止过多的辐射渗透到内层细胞。微生物在岩石中定殖的位置和生物量与光合光子通量(PPF)及光合有效辐射(PAR)息息相关。研究表明,只有1%入射光可以穿透砂岩表层,在1.2~3.0 mm深度之间,每毫米就有70%~95%的损失[9]。而且,不同的石质对光合有效辐射的影响很大[30]。例如46.8%的透明燧石中藻类可以生长到 40 mm深,厚度范围为5 ~15 mm,而20.9%的不透明燧石只有30 mm深,厚度范围为5~10 mm。随着入射深度的增加,入射光谱逐渐向红光转变[53],这说明红光在燧石中的穿透力强于短波长的光,所以石生微生物即使在光线暗的情况下也能较好地吸收光能[30]。辐射对石生微生物大分子物质造成很大的光氧化损伤,包括DNA和蛋白质链的断裂等。Daly等[86]发现恐球菌纲和其他的耐辐射菌通过增加细胞内的锰离子浓度,进而降低活性氧浓度来对抗辐射或干燥带来的蛋白质氧化损伤。而且,恐球菌纲中的一些特殊蛋白与RecA 、RecFOR等蛋白相互作用对DNA的修复有很大帮助[87-88]。恐球菌纲还有一个高度浓缩的拟核,通过限制游离DNA末端的扩散可以高效地进行DNA修复[89-90]。石生微生物中的共球藻属,还可以调节类胡萝卜素与叶绿素比例增加,这也是一个适应防止光氧化损伤的过程[50,85]。
4 展 望
本文从石生微生物的分类分布、研究方法及生态适应等方面阐述了近年来国内外科学家在相关领域所取得的成就,解决了一些科学问题。但是还有很多问题需要进一步研究:①石生微生物生态系统的物质循环和能量流动研究较少;②石生微生物的建群机制还不明确;③石生微生物的遗传资源亟待开发。目前,对石生微生物的研究越来越多,研究人员以过去的研究为基础,应用现代分子生物学技术对石生微生物群落做进一步分析。随着各种方法学的进一步完善,人们将逐渐了解极端生态环境中微生物群体多样性及实际的生存状态,为石质文物生物退化的防治及地外生命的探索提供参考。
[1] Friedmann E I.Light and scanning electron microscopy of the endolithic desert algal habitat 1[J]. Phycologia, 1971, 10(4):411-428.
[2] Friedmann E I.Endolithic microorganisms in the antarctic cold desert[J]. Science, 1982, 215(4536):1045-1053.
[3] Margulis L, P Mazur, E S Barghoorn,et al.The Viking mission: Implications for life on Mars[J]. Journal of Molecular Evolution, 1979, 14(1-3):223-232.
[4] Friedmann E I,R Ocampo.Endolithic blue-green algae in the dry valleys: primary producers in the antarctic desert ecosystem[J]. Science, 1976, 193(4259):1247-1249.
[5] Eickmann B, W Bach, S Kiel,et al.Evidence for cryptoendolithic life in Devonian pillow basalts of Variscan orogens, Germany[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2009, 283(3-4):120-125.
[6] de la Torre J R, Goebel B M,Friedmann E I, et al.Microbial diversity of cryptoendolithic communities from the McMurdo Dry Valleys, Antarctica[J]. Appl Environ Microbiol, 2003, 69(7):3858-3867.
[7] Yung C C,Chan Y, Lacap D C,et al.Characterization of chasmoendolithic community in Miers Valley, McMurdo Dry Valleys, Antarctica[J]. Microb Ecol, 2014, 68(2):351-359.
[8] Nienow J A,McKay C P,Friedmann E I.The cryptoendolithic microbial environment in the Ross Desert of Antarctica: Mathematical models of the thermal regime[J]. Microb Ecol, 1988, 16(3):253-270.
[9] Nienow J A,McKay C P,Friedmann E I.The cryptoendolithic microbial environment in the Ross Desert of Antarctica: light in the photosynthetically active region[J]. Microb Ecol, 1988, 16:271-289.
[10] Wierzchos J,Ascaso C.Life, decay and fossilisation of endolithic microorganisms from the Ross Desert, Antarctica[J]. Polar Biology, 2001, 24(11):863-868.
[11] Tang Y,Lian B.Diversity of endolithic fungal communities in dolomite and limestone rocks from Nanjiang Canyon in Guizhou karst area, China[J]. Can J Microbiol, 2012, 58(6):685-693.
[12] Quemeneur M,Palvadeau A,Postec A,et al.Endolithic microbial communities in carbonate precipitates from serpentinite-hosted hyperalkaline springs of the Voltri Massif (Ligurian Alps, Northern Italy)[J]. Environ Sci Pollut Res Int, 2015, 22(18):13613-13624.
[13] Cavalazzi B,Westall F,Cady S L,et al.Potential fossil endoliths in vesicular pillow basalt, Coral Patch Seamount, eastern North Atlantic Ocean[J]. Astrobiology, 2011, 11(7):619-632.
[14] Cockell C S,McKay C P,Warren-Rhodes K,et al.Ultraviolet radiation-induced limitation to epilithic microbial growth in arid deserts--dosimetric experiments in the hyperarid core of the Atacama Desert[J]. J Photochem Photobiol B, 2008, 90(2):79-87.
[15] De Beer D,Stoodley P.Microbial Biofilms[J]. 2006:904-937.
[16] Wood S A,Depree C,Brown L,et al.Entrapped Sediments as a Source of Phosphorus in Epilithic Cyanobacterial Proliferations in Low Nutrient Rivers[J]. PLoS One, 2015,10(10):e0141063.

[18] Maruyama A,Shinohara K,Sakurai M,et al.Microhabitat variations in diatom composition and stable isotope ratios of the epilithic algae in Lake Malawi[J]. Hydrobiologia, 2014, 748(1):161-169.
[19] Giordani P,Rizzi G,Caselli A,et al.Fire affects the functional diversity of epilithic lichen communities[J]. Fungal Ecology, 2016, 20:49-55.
[20] Golubic S,Pietrini M,Ricci S.Euendolithic activity of the cyanobacterium Chroococcus lithophilus Erc. In biodeterioration of the Pyramid of Caius Cestius, Rome, Italy[J]. International Biodeterioration & Biodegradation, 2015, 100:7-16.
[21] McNamara C J,Perry T D t,Bearce K A,et al.Epilithic and endolithic bacterial communities in limestone from a Maya archaeological site[J]. Microb Ecol, 2006, 51(1):51-64.
[22] Stal L J,Paerl H W,Bebout B,et al.Heterocystous versus non-heterocystous cyanobacteria in microbial mats[J]. Nato Asi, 1994, 35:403-414.
[23] Hoshino Y,George S C.Cyanobacterial Inhabitation on Archean Rock Surfaces in the Pilbara Craton, Western Australia[J]. Astrobiology, 2015, 15(7):559-574.
[24] Elias R,Jaubet M L,Llanos E N,et al.Effect of the invader Boccardia proboscidea (Polychaeta: Spionidae) on richness, diversity and structure of SW Atlantic epilithic intertidal community[J]. Mar Pollut Bull, 2015, 91(2):530-536.
[25] Estrella Alcaman M,Fernandez C,Delgado A,et al.The cyanobacterium Mastigocladus fulfills the nitrogen demand of a terrestrial hot spring microbial mat[J]. ISME J, 2015, 9(10):2290-2303.
[26] Cameron R,Blank G,Gensel D,et al.Soil studies-Desert microflora. X. Soil properties of samples from the Chile Atacama Desert[J]. JPL Space Programs Summary, IV, 1965:37-35.
[27] Schlesinger W H,Mahall B E.Community Composition and Photosynthesis by Photoautotrophs under Quartz Pebbles, Southern Mojave Desert[J]. Ecology, 2003, 84(12):3222-3231.
[28] Cockell C S,Stokes M D.Ecology: widespread colonization by polar hypoliths[J]. Nature, 2004, 431(7007):414.
[29] Smith M C,Bowman J P,Scott F J,et al.Sublithic bacteria associated with Antarctic quartz stones[J]. Antarctic Science, 2000, 12(02):177-184.
[30] Berner T,Evenari M.The influence of temperature and light penetration on the abundance of the hypolithic algae in the Negev Desert of Israel[J]. Oecologia, 1978, 33(2):255-260.
[31] Büdel B,Lange O.Water Status of Green and Blue-green Phycobionts in Lichen Thalli after Hydration by Water Vapor Uptake: Do They Become Turgid?[J] Botanica acta, 1991, 104(5):361-366.
[32] Pointing S B,Warren-Rhodes K A,Lacap D C,et al.Hypolithic community shifts occur as a result of liquid water availability along environmental gradients in China's hot and cold hyperarid deserts[J]. Environ Microbiol, 2007, 9(2):414-424.
[33] Warren-Rhodes K A,Rhodes K L,Pointing S B,et al.Hypolithic cyanobacteria, dry limit of photosynthesis, and microbial ecology in the hyperarid Atacama Desert. Microb Ecol 52:389-398[J]. Microbial Ecology, 2006, 52(3):389-398.
[34] Lacap D C,Warren-Rhodes K A,McKay C P,et al.Cyanobacteria and chloroflexi-dominated hypolithic colonization of quartz at the hyper-arid core of the Atacama Desert, Chile[J]. Extremophiles, 2011, 15(1):31-38.
[35] Kunzig R.20,000 microbes under the sea[J]. Discover, 2004, 25(3):32-41.
[36] Gadd G M.Geomycology: biogeochemical transformations of rocks, minerals, metals and radionuclides by fungi, bioweathering and bioremediation[J]. Mycol Res, 2007, 111(Pt 1):3-49.
[37] Gadd G M.Metals, minerals and microbes: geomicrobiology and bioremediation[J]. Microbiology, 2010, 156(Pt 3):609-643.
[38] Preston L J,Johnson D,Cockell C S,et al.Fourier transform infrared spectral detection of life in polar subsurface environments and its application to Mars exploration[J]. Appl Spectrosc, 2015, 69(9):1059-1065.
[39] Baas-Becking L G M.Geobiologie of inleiding tot de milieukunde[M]. The Hague, the Netherlands: WP Van Stockum & Zoon, 1934.
[40] Dance A.Inner Workings: Endoliths hunker down and survive in extreme environments[J]. Proc Natl Acad Sci U S A, 2015, 112(8):2296.
[41] Friedmann E I.The Antarctic cold desert and the search for traces of life on Mars[J]. Adv Space Res, 1986, 6(12):265-268.
[42] Wierzchos J,Camara B, de Los Rios A,et al.Microbial colonization of Ca-sulfate crusts in the hyperarid core of the Atacama Desert: implications for the search for life on Mars[J]. Geobiology, 2011, 9(1):44-60.
[43] 闫斌.概述石质文物保护[J]. 东南文化, 2005,(1):90-92.
[44] 贾武莹.浅谈石质文物的保护[J]. 黑龙江史志, 2014,(5):163,165.
[45] De L R A,Ascaso C.Contributions of in situ microscopy to the current understanding of stone biodeterioration[J]. International Microbiology the Official Journal of the Spanish Society for Microbiology, 2005,8(3):181-188.
[46] Sterflinger K,Sert H.Biodeterioration of buildings and works of art-practical implications on restoration practice[J]. Heritage, weathering and conservation, 2006, 1:299-304.
[47] Loeb J M,Buck A S.In situ evaluation of the biodeteriorating action of microorganisms and the effects of biocides on carbonate rock of the Jeronimos Monastery (Lisbon)[J]. Critical Care Medicine, 2002, 49(1):1-12.
[48] Hallmann C,Friedenberger H,Hause-Reitner D ,et al.Depth profiles of microbial colonization in sandstones[J]. Geomicrobiology Journal, 2015, 32(3-4):365-379.
[49] Hughes K A,Lawley B.A novel Antarctic microbial endolithic community within gypsum crusts[J]. Environmental Microbiology, 2003,5(7):555-565.
[50] Wierzchos J,DiRuggiero J,Vitek P,et al.Adaptation strategies of endolithic chlorophototrophs to survive the hyperarid and extreme solar radiation environment of the Atacama Desert[J]. Front Microbiol, 2015, 6:934.
[51] Edwards H G,Wynn-Williams D D,Villar S E J.Biological modification of haematite in Antarctic cryptoendolithic communities[J]. Journal of Raman Spectroscopy, 2004, 35(6):470-474.
[52] Palmer R J, Jr.,Friedmann E I.Incorporation of inorganic carbon by Antarctic cryptoendolithic fungi[J]. Polarforschung, 1988, 58(2-3):189-191.
[53] Doran P T,Lyons W B,Mcknight D M.Life in Antarctic deserts and other cold dry environments: astrobiological analogues. 2010: Cambridge University Press.
[54] Mckay C P,Nienow J A,Meyer M A,et al.Continuous Nanoclimate Data (1985-1988) from the Ross Desert (Mcmurdo Dry Valleys) Cryptoendolithic Microbial Ecosystem[J]. Antarctic Meteorology & Climatology Studies Based on Automatic Weather Stations, 1993. 61. Edited by David H. Bromwich and Charles R. Stearns. Washington:201.
[55] Palmer R J, Jr.,Friedmann E I.Water relations and photosynthesis in the cryptoendolithic microbial habitat of hot and cold deserts[J]. Microb Ecol, 1990, 19(1):111-118.
[56] Friedmann E I,Galun M.Desert algae, lichens, and fungi[J]. Desert biology, 1974, 2:165-212.
[57] Büdel B,Darienko T,Deutschewitz K,et al.Southern African Biological Soil Crusts are Ubiquitous and Highly Diverse in Drylands, Being Restricted by Rainfall Frequency[J]. Microbial Ecology, 2009, 57(2):229-247.
[58] Robinson C K,Wierzchos J,Black C,et al.Microbial diversity and the presence of algae in halite endolithic communities are correlated to atmospheric moisture in the hyper-arid zone of the Atacama Desert[J]. Environ Microbiol, 2015, 17(2):299-315.
[59] Wierzchos J,Davila A F,Sanchez-Almazo I M,et al.Novel water source for endolithic life in the hyperarid core of the Atacama Desert[J]. Biogeosciences, 2012, 9(6):2275-2286.
[60] Heulin T,De Luca G,Barakat M,et al.Bacterial adaptation to hot and dry deserts[M]. Vienna: Springer, 2012: 69-85.
[61] Selbmann L,Hoog G S de,Mazzaglia A,et al.Fungi at the edge of life: cryptoendolithic black fungi from Antarctic desert[J]. Studies in Mycology, 2005, 51(51):1-32.
[62] Tschermak-Woess E,Friedmann E I.Hemichlorisantarctica, gen. et sp. nov. (Chlorococcales, Chlorophyta), a cryptoendolithic alga from Antarctica[J]. Phycologia, 1984, 23(4):443-454.
[63] Friedmann E I,Hua M,Ocampo-Friedmann R.Cryptoendolithic lichen and cyanobacterial communities of the Ross Desert, Antarctica[J]. Polarforschung, 1988, 58(2-3):251-259.
[64] Potts M.Desiccation tolerance of prokaryotes[J]. Microbiol Rev, 1994, 58(4):755-805.
[65] Hershkovitz N,Oren A,Cohen Y.Accumulation of trehalose and sucrose in cyanobacteria exposed to matric water stress[J]. Appl Environ Microbiol, 1991, 57(3):645-648.
[66] Garcia-Pichel F,Pringault O.Microbiology: Cyanobacteria track water in desert soils[J]. Nature, 2001, 413(6854):380-381.
[67] Ocampo-Friedmann R,Meyer M A,Chen M,et al.Temperature response of Antarctic cryptoendolithic photosynthetic microorganisms[J]. Polarforschung, 1988, 58(2-3):121-124.
[68] Vincent W F.Cyanobacterial dominance in the polar regions, in The ecology of cyanobacteria. 2002, Springer.321-340.
[69] Quesada A,Vincent W F.Cyanobacteria in the cryosphere: snow, ice and extreme cold, in Ecology of cyanobacteria II. 2012, Springer.387-399.
[70] Friedmann E I,Kappen L,Meyer M A,et al.Long-term productivity in the cryptoendolithic microbial community of the Ross Desert, Antarctica[J]. Microb Ecol, 1993, 25(1):51-69.
[71] Friedmann E I,Sun H J.Communities adjust their temperature optima by shifting producer-to-consumer ratio, shown in lichens as models: I. Hypothesis[J]. Microbial Ecology, 2005, 49(4):523-527.
[72] Finegold L,Singer M A,Federle T W,et al.Composition and thermal properties of membrane lipids in cryptoendolithic lichen microbiota from antarctica[J]. Appl Environ Microbiol, 1990, 56(4):1191-1194.
[73] Vincent W F.Cold tolerance in cyanobacteria and life in the cryosphere, in Algae and cyanobacteria in extreme environments. 2007, Springer.287-301.
[74] Fritsen C H. Ice-active substances associated with Antarctic freshwater and terrestrial photosynthetic organisms[J]. Antarctic Science, 2000, 12(4):418-424.
[75] Robinson C H.Cold adaptation in Arctic and Antarctic fungi[J]. New Phytologist, 2001, 151(2):341-353.
[76] Walker J J,Pace N R.Endolithic microbial ecosystems[J]. Annu. Rev. Microbiol., 2007, 61:331-347.
[77] Weber B,Wessels D C,Büdel B.Biology and ecology of cryptoendolithic cyanobacteria of a sandstone[J]. Algological Studies/Archiv für Hydrobiologie, Supplement Volumes, 1996:565-579.
[78] Hughes K A.Solar UV-B radiation, associated with ozone depletion, inhibits the Antarctic terrestrial microalga, Stichococcus bacillaris[J]. Polar Biology, 2006, 29(4):327-336.
[79] Wynn-Williams D,Edwards H,Newton E,et al.Pigmentation as a survival strategy for ancient and modern photosynthetic microbes under high ultraviolet stress on planetary surfaces[J]. International journal of Astrobiology, 2002, 1(1):39-49.
[80] Baque M,Viaggiu E,Scalzi G,et al.Endurance of the endolithic desert cyanobacterium Chroococcidiopsis under UVC radiation[J]. Extremophiles, 2013, 17(1):161-169.
[81] Villar S E J,Edwards H G,Cockell C S.Raman spectroscopy of endoliths from Antarctic cold desert environments[J]. Analyst, 2005, 130(2):156-162.
[82] Villar S E J,M Edwards H G,Worland M R.Comparative evaluation of Raman spectroscopy at different wavelengths for extremophile exemplars[J]. Origins of Life and Evolution of the Biosphere, 2005, 35(5):489-506.

[84] Wynn-Williams D,Edwards H,Garcia-Pichel F.Functional biomolecules of Antarctic stromatolitic and endolithic cyanobacterial communities[J]. European Journal of Phycology, 1999, 34(4):381-391.
[85] Erokhina L G,Shatilovich A V,Kaminskaia O P ,et al.Spectral properties of the green alga Trebouxia-a phycobiont of cryptoendolithic lichens in the high-latitude polar regions of Antarctica[J]. Mikrobiologiia, 2004, 73(4):498-503.
[86] Daly M J,Gaidamakova E K,Matrosova V Y,et al.Protein oxidation implicated as the primary determinant of bacterial radioresistance[J]. PLoS Biol, 2007, 5(4):e92.
[87] Tanaka M,Earl A M,Howell H A ,et al.Analysis of Deinococcus radiodurans's transcriptional response to ionizing radiation and desiccation reveals novel proteins that contribute to extreme radioresistance[J]. Genetics, 2004, 168(1):21-33.
[88] Bentchikou E,Servant P,Coste G,et al.A major role of the RecFOR pathway in DNA double-strand-break repair through ESDSA in Deinococcus radiodurans[J]. PLoS Genet, 2010, 6(1):e1000774-e1000774.
[89] Levin-Zaidman S,Englander J,Shimoni E,et al.Ringlike structure of the Deinococcus radiodurans genome: a key to radioresistance?[J] Science, 2003, 299(5604):254-256.
[90] Zimmerman J M,Battista J R.A ring-like nucleoid is not necessary for radioresistance in the Deinococcaceae[J]. BMC microbiology, 2005, 5(1):17.
AdvanceinLithophilousMicroorganisms
WU Ming-hui1,2,4, ZHANG Gao-sen3,4, CHEN Tuo1,4, LIU Guang-xiu3,4, ZHANG Wei3,4
(1.StateKeyLab.ofCryosph.Sci.,NWInst.ofEco-Environ′t&Res.,ChineseAcad.ofSci.,Lanzhou730000; 2.Uni.ofChineseAcad.ofSci.,Beijing101408; 3StateKeyLab.ofDesert&Desertif′n,NWInst.ofEco-Environ′t&Res.,CAS,Uni.ofChineseAcad.ofSci.,Lanzhou730000; 4.KeyLab.ofExtremeEnvironm′lMicrobialRes. &Engin.,GansuProv.,Lanzhou730000)
Lithophilous microorganisms (LM) are a sort of microbial communities living in, or on, the rocks with the support of autotrophic microbes. The capability to better adapt to extreme environments helps them distributed all over the globe. The study of lithophilous organisms significantly improved the understanding in ecological adaptive mechanisms of lives in extreme environments, extraterrestrial life detection, and protection of stone relics. Yet, the study of LM is rarely reported in China. Classification of LM, distribution, research methods and ecological adaptation and other aspects were reviewed in this paper, to discuss the existing problems of LM study and promote the researches in the related fields.
lithophilous microorganisms (LM); rock; cyanobacteria; extreme environment; extraterrestrial life detectio
国家自然科学基金项目(41271265,31570498)
吴明辉 男,硕士研究生。研究方向为微生物生态学。Tel:0931-4967583,E-mail:wuminghui15@mails.ucas.ac.cn
* 通讯作者。男,博士,助理研究员。研究方向为微生物生态学。Tel:0931-4967504,E-mail:gaosenzhang@hotmail.com
2016-07-13;
2016-09-06
Q938.1
A
1005-7021(2017)04-0064-010
10.3969/j.issn.1005-7021.2017.04.011
欢迎订阅《微生物学杂志》

