微生物组学及其应用研究进展
张超蕾, 周瑾洁, 姜莉莉,2, 王晓丽, 朱甲名, 权春善, 修志龙*
(1. 大连理工大学 生命科学与技术学院,辽宁 大连 116024;2. 营口理工学院 化学与材料工程系,辽宁 营口 115014;3.大连民族大学生命科学学院 生物技术与生物资源利用重点实验室,辽宁 大连 116600)
微生物组学及其应用研究进展
张超蕾1, 周瑾洁1, 姜莉莉1,2, 王晓丽1, 朱甲名1, 权春善3, 修志龙1*
(1. 大连理工大学 生命科学与技术学院,辽宁 大连 116024;2. 营口理工学院 化学与材料工程系,辽宁 营口 115014;3.大连民族大学生命科学学院 生物技术与生物资源利用重点实验室,辽宁 大连 116600)
随着高通量测序技术和生物信息学的发展,尤其是宏基因组在人类肠道微生物鉴定方面的应用,微生物组学应运而生。概述了微生物组的多样性及其在人体健康、农作物生长、畜牧业发展、环境治理、工业生物技术产品生产等方面的应用,并对微生物组学的研究方向和应用前景作了展望。
微生物组学;微生物菌群;医学;植物根际促生细菌;生物饲料添加剂;厌氧消化;工业生物技术
1 微生物组学简介
近几年随着微生物测序及人体肠道微生物与疾病之间关系研究的逐渐深入和扩展,微生物组学(Microbiomes)越来越受到国内外学者和企业界人士的关注,如美国科学家提出“联合微生物组计划(Unified Microbiome Initiative,UMI)”的建议[1],中、德、美三位科学家则呼吁在UMI基础上启动“国际微生物组计划(IMI)”[2],我国科技工作者强调精细挖掘微生物组(宏基因组)的信息[3]。在生命科学领域,微生物组学将与“精准医学”和“脑科学”共同成为21世纪上半叶最受瞩目的三大科学计划。微生物组学是揭示微生物多样性与人和生态稳定性之间关系的新兴学科,其研究成果将应用于工业、农业、水产和医药等领域(图1),为人类解决食品、环境、能源、健康等方面所面临的危机。
事实上人类在尚未了解微生物之前就广泛使用自然界中的微生物资源,如传统食品(奶酪、酸菜、酿酒、大酱等)的酿造,是多种微生物(如细菌和真菌)共同作用的结果;19世纪随着显微镜的发明和生理学的认识,巴斯德才创立了细菌学,逐渐有了灭菌的意识和主动利用单一微生物的方法。20世纪以来人们对微生物的形态结构、生理生化、遗传特性、基因操作等有了更为丰富的知识和技能,以微生物发酵为主的生物技术产业不断发展,发酵产品(如氨基酸、有机酸、抗生素、酶等)的数量和规模不断增长。与此同时,共培养(Co-culture)、混合培养(Mixed culture)和微生物菌群也得到新的认识和利用,利用产酸菌,如普通生酮基古龙酸菌(Ketogulonigeniumvulgare),俗称小菌和伴生菌巨大芽胞杆菌(Bacillusmegatherium),俗称大菌共培养,将L-山梨糖转化为维生素C前体2-酮基-L-古龙酸(2-keto-L-gulonic acid,2-KLG),其中小菌将L-山梨糖转化成2-KLG,大菌可缩短小菌的生长延迟期,促进小菌的生长和产酸[4]。微生物菌群(Microbial consortium)能够利用廉价复杂的基质,产物范围可控,并且培养过程通常不需灭菌操作,因此在环境修复、生物能源生产中表现出极强的优越性,如活性污泥处理废水、生物气生产等。可以预见,微生物组学的研究和应用将成为生命学科领域新的热点之一。

图1 微生物组学在工业、农业、健康和环境等领域的应用Fig.1 Application of microbiomes in industry, agriculture, healthy and environment
2 在医学方面的应用
肠道中正常菌群与宿主之间的相互作用构成了肠道微生态[5]。肠道微生态在辅助营养吸收、参与机体代谢、调节机体免疫等方面都起着重要作用(图2),同时也会对中枢神经系统造成影响[6]。
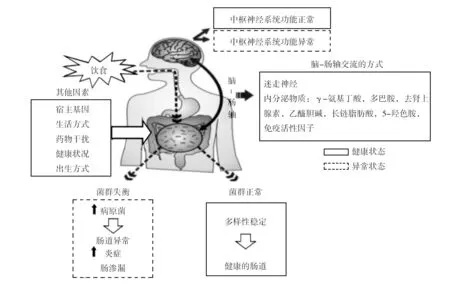
图2 肠道菌群对健康的影响Fig.2 The influences of enteric microorganisms on human health
2.1肠道微生态与疾病之间的关系
肠道微生态失调会引发肠道炎症性疾病,如溃疡性结肠炎、结直肠癌;还会引发代谢类疾病,如动脉粥样硬化、糖尿病、肥胖,肠道微生态的改变还会促使肝功能损伤[7]。溃疡性结肠炎是一种位于结肠和直肠的慢性非特异炎症性疾病,病变局限于大肠黏膜及黏膜下层,从溃疡性结肠炎患者体内可以发现高含量的变形杆菌和低含量的厚壁门菌、双歧杆菌和乳酸杆菌[8],革兰阴性菌硫酸盐还原菌也呈升高趋势,革兰阳性细菌呈现降低趋势。革兰阴性细菌数量的上升造成脂多糖含量增加,使菌群发生易位,因此在患者体内出现长期低水平炎症的现象[9]。
2.2肠道微生态与神经系统之间的关系
肠道系统可与中枢神经系统之间建立“脑-肠轴”实现双向信息传输与交流[10]。肠道中的微生物可以通过免疫、内分泌、迷走神经三种途径影响中枢神经,三者之间相互作用、相互协调形成了“菌群-肠-脑轴”[11]。肠道中存在多肽物质(神经肽、瘦素、促肾上腺皮质激素等)和神经信号物质(多巴胺、褪黑激素、乙酰胆碱、5-羟色胺),这些物质使“脑-肠轴”保持良好的信息交流[12]。菌群失衡会导致中枢神经系统紊乱,患上神经性疾病,如帕金森病、多发性硬化、自闭症等[13]。经研究发现儿童早期的肠道微生物菌群失调会引发自闭症,主要表现为注意力不集中,人际交往和语言发展障碍[14]。自闭症儿童的拟杆菌、放线菌和梭状芽胞杆菌的含量高于健康儿童,普氏菌属、粪球菌属和未分类的韦荣球菌科含量却低于正常发育儿童。给予自闭症儿童口服万古霉素,发现自闭症状有所改善,梭状芽胞杆菌的数量下降,可见梭状芽胞杆菌对自闭症有一定影响[15]。影响肠道微生态因素有很多,如肠道的生理环境、年龄、饮食、抗生素都会使肠道菌群的结构发生改变,菌群的改变会促使肠道炎症发生,改变肠道黏膜通透性,使有毒物质进入血液并对机体产生影响[16]。不良的环境和情绪可通过“脑-肠轴”影响胃肠道,长期的胃肠道疾病会导致神经异常。
生物信息学与高通量测序技术的快速发展使人们能更清楚地认识到肠道微生态的变化与其宿主之间的关系,肠道微生态失调容易引起各种疾病。新型抗菌药物和益生菌的开发,粪便微生物移植为疾病的治疗提供了新的思路[17],但宿主与其体内菌群之间的相互联系和作用仍有许多未解之谜,需要各领域的研究者相互合作应对这一挑战。
3 在农业方面的应用
3.1土壤中微生物与农作物生长的关系
土壤微生物是土壤生态的重要组成部分,微生物肥料是利用微生物参与土壤中有机质的分解与合成,释放养分供给植物营养以刺激植物的生长,同时还具有抑制病菌和改良土壤等功能[18],因此微生物具有药、肥双重作用。微生物肥料主要分为促生细菌剂、固氮菌接种剂和根瘤菌接种剂,其作用是通过微生物代谢影响植物生长与发育[19]。目前植物根际促生细菌(plant growth promoting rhizobacteria, PGPR)的研究和应用最多,是最有潜力的微生物肥料与微生物农药。PGPR是存在于根圈周围、能够通过自身代谢产生促进植物生长的营养物质,并具有抑制有害生物的有益菌[20]。PGPR的直接作用是通过菌群代谢产生促生长的营养物质(如生长素)直接供给植物,或者转变土壤中某些无效元素为植物可利用的有效元素(如固氮、解磷等);其间接作用是PGPR产生一些抗生素、抗菌肽物质,抑制根部病原菌生长,促进植物根系的生长发育,从而影响植物的长势和产量[21-22]。一些具有固氮、溶磷和解钾作用的微生物,如硅酸盐细菌已经被认定为 PGPR[23]。已鉴定的PGPR主要包括芽胞杆菌属(Bacillus)、短芽胞杆菌属(Brevibacillus)、假单胞菌属(Pseudomonas)、伯克霍尔德氏菌属(Burkholderia)、节杆菌属(Arthrobacter)、不动杆菌属(Acinetobacter)、农杆菌属(Agrobacterium)、纤维单胞菌属(Cellulomonas)、固氮螺菌属(Azospirillum)、慢生根瘤菌属(Bradyrhizobium)、弗兰克氏菌属(Frankia)、泛菌属(Pantoea)、根瘤菌属(Rhizobium)、沙雷氏菌属(Serratia)、链霉菌属(Streptomyces)、硫杆菌属(Thiobacillus)等[24]。混合微生物共同作用促进植物生长、抑制病原菌作用(图3)将是未来研究和应用的重点。
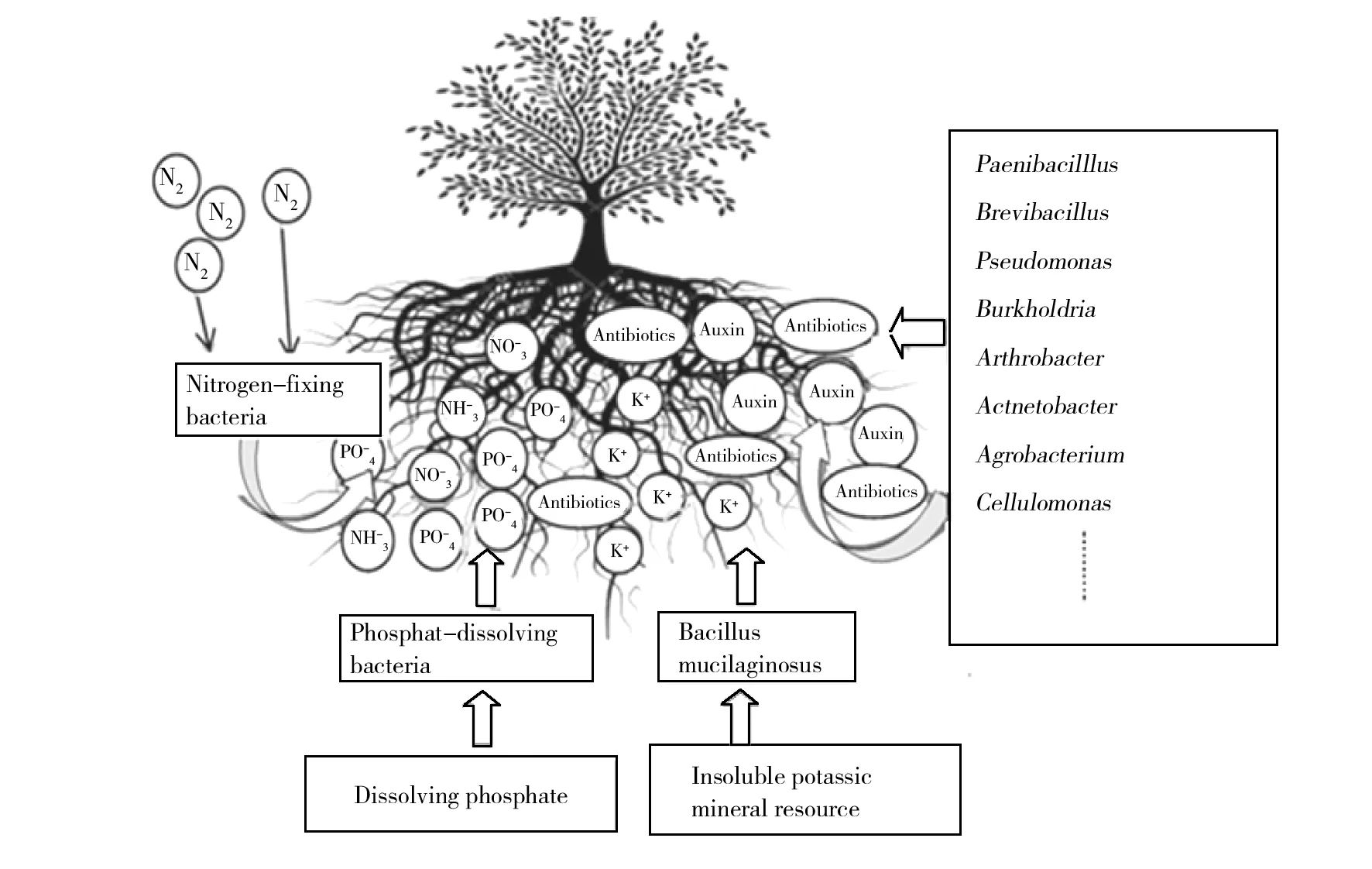
图3 混合微生物对植物的生长作用Fig.3 Effect of microbial consortia on plant growth
3.2生物饲料添加剂
早期饲料中添加低剂量的抗生素、激素及磺胺类药物以防治畜禽疾病、促进生长、提高产量,这些药物长期使用会破坏家禽肠道中益生微生物和病原微生物的生态平衡,并且残留在动物食品中给人类健康带来隐患。为提高动物食品的质量安全,生物饲料添加剂在畜牧养殖业逐渐被广泛应用。生物饲料添加剂又称为微生态制剂,一般是以农产品加工的副产物为原料,运用微生物培养或发酵技术进行单种或多种益生菌的液态或固态培养,制备出多功能的饲料添加剂[25]。用于微生态制剂的主要菌种有乳酸菌属:嗜酸性乳杆菌(Lactobacillusacidophilus)、短乳杆菌(Lactobacillusbrevis)、乳酸乳杆菌(Lactobacilluslactis)、植物乳杆菌(Lactobacillusplantarum)等;双歧杆菌属:动物双歧杆菌(Bifidobacteriumanimals)、嗜热双歧杆菌(Bifidobacteriumthermophilum);链球菌属:乳链球菌(Streptococcuslactis)、粪链球菌(Streptococcusfaecium)、中间型链球菌(Streptococcusintermendius);芽胞杆菌属:蜡样芽胞杆菌(Bacilluscereus)、芽胞乳杆菌(Lactobacillussporogens)、枯草芽胞杆菌(Bacillussubtilis);酵母菌属:球拟酵母(Torulopsis)、酿酒酵母(Saccharomycescerevisiae);曲霉属:黑曲霉(Aspergillusniger)、米曲霉(Aspergillusoryzae)以及丁酸梭菌(Clostridiumbutyricum)等[26]。
动物胃肠道的微生态系统中,宿主和微生物之间存在相互依存关系。宿主为微生物提供栖息的环境和养分,微生物菌群有益于动物消化吸收食物。益生菌剂能够维持动物肠道菌群平衡,抵抗病原微生物的侵入和定殖,增强动物的免疫功能,从而促进动物生长,防治疾病。目前对益生菌制剂作用机理研究有限,大多集中在微生态平衡理论,有以下几种学说:①优势菌群学说:正常情况下,动物肠道内的益生微生物和有害微生物菌群之间及微生物菌群与宿主之间保持稳定的平衡关系,在这个平衡体系中,具有益生作用的是厌氧或兼性厌氧菌群,其中乳杆菌和双歧杆菌是优势菌群,生长代谢产生有机酸、抗菌物质等阻止病原微生物的入侵和繁殖。有机酸能刺激肠道蠕动,增加机体将病原菌排出体外的能力[27]。②生物夺氧学说:该学说是针对芽胞杆菌和酵母菌制剂提出的。芽胞杆菌为好氧菌,当其芽胞进入消化道后,可迅速萌发成营养细胞并生长繁殖,因此消耗肠道内有限的氧气,造成局部厌氧环境,降低氧化还原电势,使病原菌因缺氧而生长受到限制,厌氧环境又促进厌氧益生菌的生长。酵母菌属于兼性厌氧菌,在有氧条件下进行好氧呼吸,为宿主提供营养[28]。 ③菌群屏障学说:饲喂益生菌剂后动物肠道内有益微生物增加,有益菌通过细胞表面的糖蛋白和磷壁酸与肠道黏膜上皮细胞相互作用,占据肠黏膜表面,形成一种天然屏障,从营养竞争、空间位阻等方面限制病原微生物的生存繁殖。有益菌中和或结合毒素物质,防止毒素和有害物质被宿主吸收,从而有助于肠道内建立正常的有益微生物区,排除或抑制潜在的病原菌[29]。
4 在环境/生态方面的应用
微生物降解是治理环境污染,尤其是降解人工合成的高分子污染物的有效途径[30]。由于污染物的结构复杂性及种类多样性,纯种微生物往往很难有效完成这一使命。混合微生物菌群具有丰富的种群多样性,包含降解各种有机质的酶系及代谢途径,各类微生物相互配合、互利共生,在生物降解过程中起到不可替代的作用。
厌氧消化(Anaerobic digestion, AD)是微生物菌群在环境治理中最经典的应用实例[31]。厌氧消化过程依赖富集的混合菌群,通过复杂的代谢网络,将高分子有机物逐步降解为甲烷及二氧化碳。该过程不仅可以消除污染,杀灭潜在病原体,更能将废弃物中蕴含的潜在能源转变为沼气,实现资源的循环利用[32]。厌氧消化广泛应用于城市及工业污水及固体废弃物处理,是目前重要的污染物处理手段[33-34]。厌氧消化主要分为四个阶段:水解、酸化、乙酸化及甲烷化(图4)。
首先,废弃物中的不溶性有机质及高分子污染物在水解菌分泌的胞外酶作用下分解为可溶性低分子有机物,如氨基酸、脂肪酸等;这些可溶性有机物在酸化过程中被产酸菌进一步降解为挥发性脂肪酸,并伴随氨气、二氧化碳、硫化氢等气体产生;在乙酸化过程中,挥发性脂肪酸被产乙酸菌转化为乙酸,并生成二氧化碳及氢气;最后进入甲烷化阶段,不同类型的甲烷菌或将乙酸分解为甲烷,或以二氧化碳为电子受体、氢气为电子供体合成甲烷[35]。在厌氧消化过程中,水解菌、产酸菌、产乙酸菌及产甲烷菌在活性污泥中稳定共存,不同微生物扮演不同的角色,相互协同、互利共生,共同完成降解废弃污染物的任务。相比于单一菌种,微生物混合菌群对于有机高分子污染物,如联苯[36]、偶氮染料[37-38]、多环芳烃[39]等具有更强的降解能力。
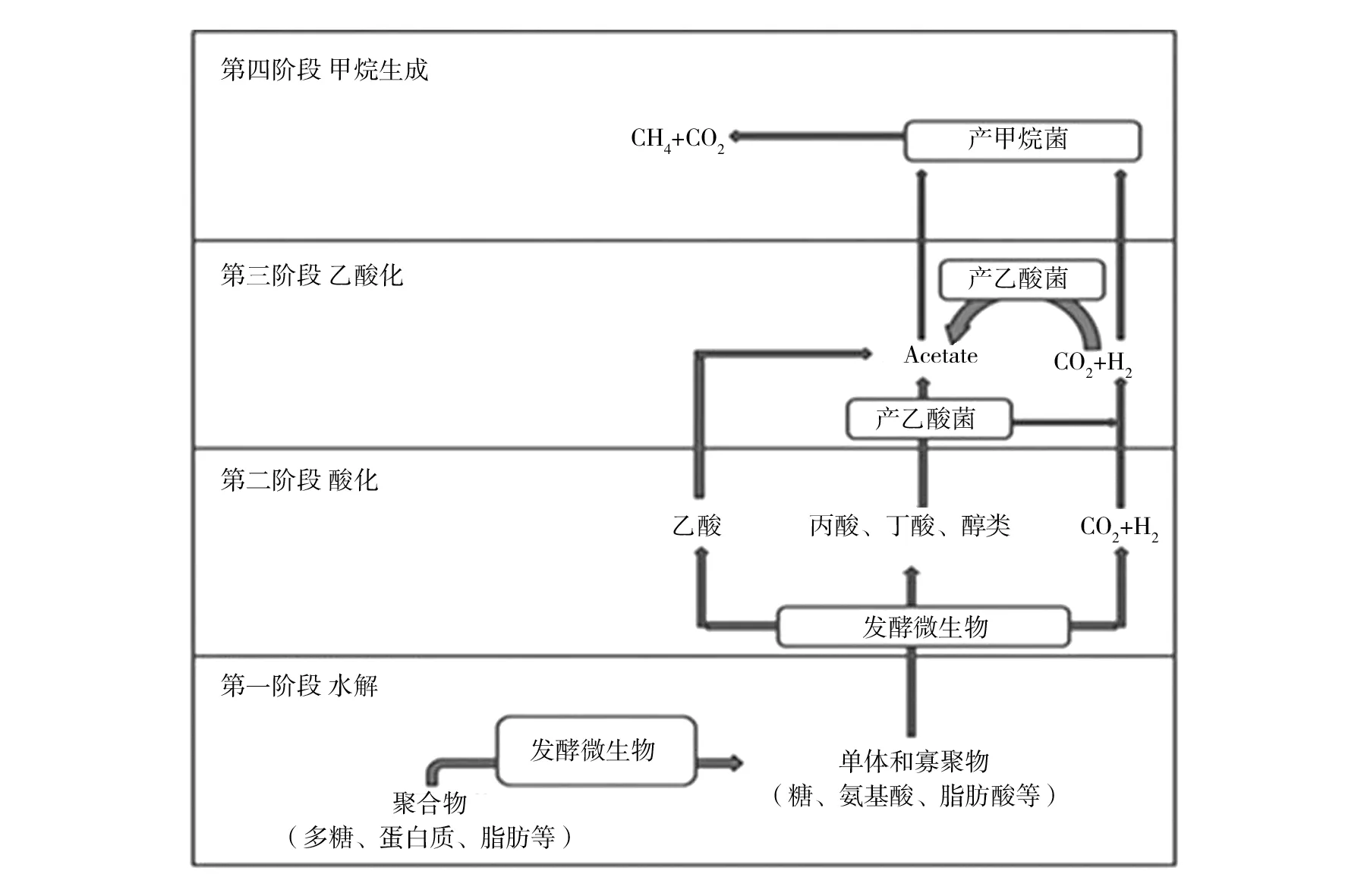
图4 厌氧消化过程的不同阶段及微生物作用Fig.4 Microbial functions at different stages in anaerobic digestion
微生物菌群在环境治理方面也存在代谢机理复杂、污染底物种类及浓度限制及污染物去除率有限等诸多局限,为此国内外学者在功能基因挖掘、菌群选择及驯化、降解工艺优化等方面做出了不懈努力,成效显著。研究表明微生物降解复杂有机质,尤其是异型生物质的基因一般存在于质粒、转座子等可移动元件上,功能微生物菌群内存在水平基因转移现象[40]。对于环境中存在的顽固污染物,原始微生物菌群往往降解能力有限,通过向原始混合菌群中添加带有降解特定污染物基因质粒的基因工程菌株或其他高效功能菌株,可扩展降解污染物范围,增强菌群降解能力[41-43]。在降解工艺中,固定化技术具有菌群细胞可循环利用、污染物降解效率高以及对温度及pH变化稳定性更强等优势,可显著提高微生物降解污染物能力及效率[44-45]。此外,将污染物处理与微生物燃料电池(Microbial fuel cell,MFC)结合,通过微生物菌群将废水的化学能转化为电能,也成为一条新兴的治理环境污染的可持续发展途径[46]。
5 在工业方面的应用
传统食品,如奶酪、酸菜、酿酒、大酱等生产中利用微生物菌群进行发酵已有上千年的历史,在生物能源(如生物气、生物氢气、燃料乙醇等)、生物基化学品 (如1,3-丙二醇)、生物材料 (如聚羟基脂肪酸酯) 等工业生物技术产品生产中微生物菌群也有相应的研究和应用。
厌氧条件下,微生物菌群可以将有机废弃物转化成各种生物质能源,如甲烷、氢气或乙醇等,菌群中有一些菌需要特殊的生长条件,它们很难通过传统的纯培养技术进行培养。已有研究利用嗜热微生物菌群在60 ℃下,以垃圾和废纸为基质发酵产生氢气和甲烷。尽管整个过程在不灭菌的条件下进行,但嗜热过程有效地降低了染菌的机率[47]。氢气作为一种理想的燃料[48],其生物法制备受到转化率低的制约,最大理论摩尔转化率为4 mol氢气/mol葡萄糖,但实际发酵过程的产率通常不超过2 mol氢气/mol葡萄糖[49]。乙醇被视为替代和节约汽油的最佳燃料,利用非粮食原料,如农业秸秆生产乙醇已成为研究热点。天然微生物菌群具有高效稳定降解纤维素的能力,而传统的酿酒酵母纯培养技术无法对其高效利用转化[50]。
微生物菌群发酵方式为生物基化学品生产过程中目标产物的分离纯化提供了新的解决思路。1,3-丙二醇 (1,3-PD) 作为聚对苯二甲酸丙二酯 (PTT) 和聚呋喃二甲酸丙二酯 (PTF) 的单体,市场需求量逐年增多。传统纯培养技术生产1,3-PD会产生醇类、有机酸等副产物,为目标产物的分离纯化带来了困难,增加了生产成本[51]。已有研究表明利用微生物菌群发酵生产1,3-PD不仅可以利用较为廉价的粗甘油作为原材料,同时还可以降解大部分副产物有机酸,显著降低原料和后期分离纯化的成本,从而受到人们越来越多的关注[52-53]。
在生物材料方面,聚羟基脂肪酸酯(Poly hydroxyalkanoates,PHA) 是微生物合成的一种细胞内聚酯,是一种天然的高分子生物材料,具有良好的生物相容性、生物可降解性和塑料的热加工性,已成为近年来生物材料领域最为活跃的研究热点。已有研究表明利用微生物菌群发酵法生产PHA可以克服纯培养技术的一些缺点,如生产过程中需要进行无菌操作、利用较高纯度的底物并对细菌进行无菌培养等,从而显著地降低了生产成本,增加了经济上的竞争力[54]。
6 展 望
微生物组学将在人体健康、农作物生长、家禽养殖、环境治理、工业化学品生产等方面发挥重要作用。平衡的肠道微生态有助于人体消化代谢食物,提供营养物质,减少有害菌对人体的侵害;同样道理,益生菌的补充对家禽畜牧业养殖也是有益的,有助于降低抗生素和激素的残留,提升肉、奶、蛋等动物食品的安全性。微生物菌剂替代化肥和农药同样可以在源头上解决食品安全的问题,改善农作物根系微生物菌群的分布是关键,既可以改善土壤,又可以降解残留的农药、吸附重金属。通过活性污泥中的微生物菌群降解人造高分子物质,并将其转化为甲烷、氢气等燃料。相似地可以利用微生物菌群转化廉价的非粮生物质原料生产能源、化学品和生物材料,有望降低成本,推动产业化进程。
微生物组学技术的快速发展使我们有可能了解特定条件下菌群丰度的动态变化,以及菌群与环境或宿主之间的相互作用与联系。但菌群内不同种微生物细胞之间的信号交流和群体效应,菌群的稳定性,未知和未培养微生物的作用,菌群与周围环境的相互作用方式等方面仍有许多机制尚未被了解和阐述,有待于生物学、信息学、医学、农学等不同领域的学者协同攻关,共同推动微生物组学的发展与进步。
[1] Alivisatos A P, Blaser M J, Brodie E L, et al. A unified initiative to harness Earth′s microbiomes[J].Science, 2015, 350(35): 507-508.
[2] Dubilier N, Mcfall-Ngai M, Zhao L P. Great a global microbiome effort: understanding how microbes affect health and the biosphere requires an international initiative[J].Nature,2015,526(75): 631-634.
[3] Wang J, Jia H. Metagenome-wide association studies: fine-mining the microbiome[J].Nature Reviews: Microbiology, 2016, 14(8): 508-522.
[4] 吕淑霞, 张云鹤, 白玲, 等. 维生素C前体2-酮基-L-古龙酸二步混菌发酵研究新进展[J].微生物学杂志, 2015, 35(3): 1-8.
[5] 白文元, 王娜. 肠道微生态对人类健康的影响[J]. 医学综述, 2015, 9(1): 811-813.
[6] 郭慧玲, 邵玉宇, 孟和毕力格, 等.肠道菌群与疾病关系的研究进展[J]. 微生物学通报, 2015, 42(2): 400-410.
[7] 岳意茹, 王俊平, 刘萍, 等. 肠道微生态与肠道免疫相互作用的研究进展[J]. 中华内科杂志, 2014, 12(1): 988-991.
[8] 廖博雅, 王莎莎, 张军东, 等. 肠道微生物在人类疾病中的作用[J]. 胃肠病学, 2015, 20(2):126-128.
[9] Sokol H, Seksik P, Furet J P, et al. Low counts ofFaecalibacteriumprausnitziiin colitis microbiota[J]. Inflammatory Bowel Disease, 2009, 15(8): 1183-1189.
[10] 刘萍, 罗本燕. 肠道微生态与中枢神经系统疾病的相关性[J]. 中国神经精神疾病杂志, 2016, 42(4): 251-254.
[11] 王文建, 郑跃杰. 肠道菌群与中枢神经系统相互作用及相关疾病[J]. 中国微生态学杂志, 2016, 28(2): 240-245.
[12] 仇艳光, 时兰春, 孙芳, 等. 肠道微生物菌群对脑及行为的影响[J]. 生命的化学, 2014, 30(4): 572-576.
[13] Lin W, Ren Z W, Liang W, et al. Application of metagenomics in the human gut microbiome[J].World Journal of Gastroenterology, 2015, 21(3): 803-814.
[14] Hsiao E Y, Mcbride S W, Hsien S, et al. Microbiota modulate behavioral and physiological abnormalities associated with neuro-developmental disorders[J]. Cell, 2013, 155(7): 1451-1463.
[15] Finegold S M. Therapy and epidemiology of autism-clostridial spores as key elements[J].Medical Hypotheses,2008, 70(3): 508-511.
[16] 杨云生, 王子凯. 肠道微生态的重要作用与研究展望[J]. 中国消化杂志, 2013, 33(12):803-805.
[17] Ghaisas S, Maher J, Kanthasamy A. Gut microbiome in health and disease: Linking the microbiome-gut-brain axis and environmental factors in the pathogenesis of systemic and neurodegenerative diseases[J]. Pharmacology & Therapy,2016, 158: 52-62.
[18] 张纪红. 微生物肥料资源在农业中的开发和利用[J]. 北京农业, 2011,(6): 84-84.
[19] 李英. 浅谈微生物肥料在农业生产中的应用[J]. 现代农业, 2010,(3): 18-19.
[20] 王岩, 黄波, 苏晓, 等. 植物根际促生细菌型生物肥料研究综述[J]. 山东林业科技, 2013, 43(3): 92-95.
[21] Kloepper J W, Lifshitz R, Zablotowicz R M. Free-living bacterial inocula for enhancing crop productivity[J]. Trends Biotechnology, 1989, 7(2): 39-44.
[22] Xia Y, Xu X, Lin Y, et al. Research process of mechanism of action of growth promoting rhizobacteria[J]. Agricultural Science & Technology, 2014, 8(1): 87-90.
[23] 孙亚凯. 功能性微生物菌株的筛选及组合菌群活性研究[D]. 天津:天津大学, 2006.
[24] Taghavi S D, Barac T, Greenberg B, et al. Horizontal gene transfer to endogenous endophytic bacteria from poplar improves phytoremediation of toluene[J]. Applied and Environmental Microbiology, 2005,71(12): 8500-8505.
[25] 刘燕,王静慧.微生态理论和我国动物微生态制剂研究现状[J]. 中国兽药杂志,2002,36(8):35-38.
[26] 徐丽华, 张华, 娄恺. 微生物资源学[M]. 北京:科学出版社, 2010:413-414.
[27] Ouwehand A C, Kirjavinen P V, Shortt C, et al. Probiotics: mechanisms and established effects[J]. International Dairy Journal, 1999, 9(1): 43-52.
[28] 胡东兴, 潘康成. 微生态制剂及其作用机理[J]. 中国饲料,2001, (3): 14-16.
[29] 洪坚平, 来航线. 应用微生物学[M]. 北京:中国林业出版社,2011:121-124.
[30] Mikeskova H, Novotny C, Svobodova K, Interspecific interactions in mixed microbial cultures in a biodegradation perspective[J]. Applied Microbiology and Biotechnology,2012, 95(4): 861-870.
[31] Henze M. Waste water treatment development[J]. Biological Wastewater Treatment, 2008: 1-7.
[32] Holm-Nielsen J B, Seadi T A, Oleskowicz-Popie I P. The Future of anaerobic digestion and biogas utilization[J]. Bioresour Technology, 2009, 100(22): 78-84.
[33] Mata-Alvarez J, Macé S, Llabrés P. Anaerobic digestion of organic solid wastes. An overview of research achievements and perspectives[J]. Bioresource Technology, 2000, 74(1): 13-16.
[34] Appels L, Baeyens J, Degrève J, et al. Principles and potential of the anaerobic digestion of waste-activated sludge[J]. Progress in Energy and Combustion Science, 2008, 34(6): 755-781.
[35] 李东, 孙永明, 张宇, 等. 城市生活垃圾厌氧消化处理技术的应用研究进展[J]. 生物质化学工程, 2008, 42(4): 43-50.
[36] Davison A D, Csellner H, Karuso P, et al. Synergistic growth of two members from a mixed microbial consortium growing on biphenyl[J]. FEMS Microbiology Ecology, 1994, 14(2):133-146.
[37] Khehra M S, Sniai H S, Chimini S S, et al. Decolorization of various azo dyes by bacterial consortium[J]. Dyes and Pigments, 2005, 67(1): 55-61.
[38] Khehra M S, Saini H S, Sharma D K, et al. Comparative studies on potential of consortium and constituent pure bacterial isolates to decolonize azo dyes[J]. Water Research, 2005, 39(20): 35-41.
[39] Jacques R J, Okeke B C, Bento F M,et al. Microbial consortium bioaugmentation of a polycyclic aromatic hydrocarbons contaminated soil[J]. Bioresource Technology, 2008, 99(7): 37-43.
[40] Top E M, Springae I D. The role of mobile genetic elements in bacterial adaptation to xenobiotic organic compounds[J]. Current Opinion in Biotechnology, 2003, 14(3): 262-269.
[41] Top E M, Springae I D, Boon N. Catabolic mobile genetic elements and their potential use in bioaugmentation of polluted soils and waters[J]. FEMS Microbiology Ecology, 2002, 42(2):199-208.
[42] Nzila A, Razzak S A, Zhu J. Bioaugmentation: An emerging strategy of Industrial wastewater treatment for reuse and discharge[J]. International Journal Environment Research Public Health, 2016, 13(9): 1-20.
[43] Fantroussi E I, Agathos S N. Is bioaugmentation a feasible strategy for pollutant removal and site remediation[J]. Current Opinion Microbiology, 2005, 8(3): 68-75.
[44] Lade H, Govindwar S, Paul D. Mineralization and detoxification of the carcinogenic azo dye congo red and real textile effluent by a Polyurethane Foam Immobilized Microbial Consortium in an Upflow Column Bioreactor[J]. International Journal Environment Research and Public Health, 2015, 12(6): 894-918.
[45] Wang J, Yang H, Lu H, et al. Aerobic biodegradation of nitrobenzene by a defined microbial consortium immobilized in polyurethane foam[J]. World Journal of Microbiology and Biotechnology, 2009, 25(5): 875-881.
[46] Miran W, Nawaz M, Lee D S, et al. Microbial community structure in a dual chamber microbial fuel cell fed with brewery waste for azo dye degradation and electricity generation[J]. Environment Scienceand Pollution Research, 2015, 22(17): 77-85.
[47] Ueno Y, Fukui H, Goto M. Operation of a two-stage fermentation process producing hydrogen and methane from organic waste[J]. Environment Science Technology, 2007, 41(4): 1413-1419.
[48] Li C L, Fang H H P. Fermentative hydrogen production from wastewater and solid wastes by mixed cultures[J]. Critical Review Environment Science Technology, 2007, 37(1): 1-39.
[49] Selembo P A, Perez J M, Lloyd W A, et al. Enhanced hydrogen and 1,3-propanediol production from glycerol by fermentation using mixed cultures[J]. Biotechnology and Bioengineering, 2009, 104(6): 1098-1106.
[50] Solomon K V, Haitjema C H, Henske J K, et al. Early-branching gut fungi possess a large, comprehensive array of biomass-degrading enzymes[J]. Science, 2016, 351(6278): 1192-1195.
[51] Xiu Z L, Zeng A P. Present state and perspective of downstream processing of biologically produced 1, 3-propanediol and 2, 3-butanediol[J]. Applied Microbiology and Biotechnology, 2008, 78(6): 917-926.
[52] Dietz D, Zeng A P. Efficient production of 1, 3-propanediol from fermentation of crude glycerol with mixed cultures in a simple medium[J]. Bioprocess and Biosystems Engineering, 2014, 37(2): 225-233.
[53] Szymanowska-Powalowska D, Piatkowska J, Leja K. Microbial purification of post fermentation medium after 1, 3-PD production from raw glycerol[J]. Biomedical Research International, 2013, 2013: 949107.
[54] Moita R, Freches A, Lemos P C. Crude glycerol as feedstock for polyhydroxy alkanoates production by mixed microbial cultures[J]. Water Research, 2014, 58: 9-20.
AdvancesinMicrobionomicsandItsApplications
ZHANG Chao-lei1, ZHOU Jin-jie1, JIANG Li-li1,2, WANG Xiao-li1, ZHU Jia-ming1,QUAN Chun-shan3, XIU Zhi-long1
(1.Schl.ofLifeSci. &Biotech.,DalianUni.ofTechnol.,Dalian116024; 2.Dept.ofChem.andMaterialsEngin.,YingkouInst.ofTechnol.,Yingkou115014; 3.KeyLab.ofBiotech. &Biores.Util.,DalianMinzuUni.,Dalian116600)
With the development of high throughput sequencing technology and bioinformatics, especially the application of metagenome in human intestinal microbial identification, microbionomics emerges as the times require. This paper summarizes the diversity of microbionome and its applications in human health, crop growth and development of animal husbandry, environmental management, and production of industrial biotech-products and other aspects. Moreover, the studies of microbionomics as well as their directions and application prospects in the future are forecasted.
microbionomics; microbial consortium; medicine; plant rhizobacteria growth promotion; biological feed additives; anaerobic digestion; industry biotechnology
生物技术与资源利用教育部重点实验室开放课题(KF2015006)
张超蕾 女,博士研究生。研究方向为肠道菌群。E-mail: zhangchaolei@dlut.edu.cn
* 通讯作者。男,博士,教授,博士生导师。 研究方向为微生物发酵与生物分离工程。Tel: 0411-84706369,E-mail: zhlxiu@dlut.edu.cn
2016-11-20;
2017-01-22
Q939.9
A
1005-7021(2017)04-0074-08
10.3969/j.issn.1005-7021.2017.04.012

