羟乙基乙二胺与单乙醇胺吸收低分压CO2降解
陆诗建,耿春香,李世霞,李欣泽,赵东亚,朱全民
1.中国石油大学(华东),山东 青岛 266580;
2.中国石化节能环保工程科技有限公司,山东 东营 257026
羟乙基乙二胺与单乙醇胺吸收低分压CO2降解
陆诗建1,2,耿春香1,李世霞1,2,李欣泽1,2,赵东亚1,朱全民1
1.中国石油大学(华东),山东 青岛 266580;
2.中国石化节能环保工程科技有限公司,山东 东营 257026
有机胺捕集燃煤烟气CO2过程中,吸收溶剂会发生降解。以探究醇胺吸收CO2过程中可能发生的降解机理为目的,选取乙醇胺(MEA)和N-(2-羟乙基)-乙二胺(AEEA),在吸收温度40 ℃,解吸温度120 ℃条件下,研究了质量分数同为10%的MEA和AEEA循环吸收和解吸性能。结果表明,AEEA 6次循环吸收负荷和吸收速率都优于MEA,AEEA再生温度都低于MEA,但AEEA循环再生速率和再生率不如MEA。第3次循环实验过程中,AEEA产生降解物 N-(2-羟乙基)-二乙烯三胺,MEA产生降解物AEEA,这两种降解产物都会提高再吸收负荷。
二氧化碳捕集 循环实验 降解 羟乙基乙二胺 单乙醇胺
化学吸收法是燃煤烟气CO2捕集法中较经济的捕集手段,其中,有机胺吸收法成为商业应用最为成熟的技术之一。以有机胺作为CO2吸收剂的研究已有50多年的历史,已有多种有机胺吸收剂在CO2捕集工业生产中得到应用[1]。醇胺因具有高水溶性和低蒸汽压等特点而成为应用最多的胺溶剂。三乙醇胺(TEA)是最早被用作CO2吸收剂的链烷醇胺,但该吸收剂存在吸收能力弱、反应速率小和稳定性差等缺点。乙醇胺[2](MEA)、二乙醇胺[3](DEA)、N-甲基二乙醇胺[4](MDEA)和N-(2-羟乙基)-乙二胺(AEEA),这4种链烷醇胺是现今商业应用最多的CO2吸收剂[5]。其中,MEA和AEEA易溶于水,反应速率快,可生产成本低廉,作为基础胺已成为研究最多、应用最广的醇胺[6]。有机胺法虽捕集率高但存在腐蚀、发泡和溶剂降解等问题。在实际工业应用过程中发现,胺溶液降解会造成溶剂损耗不断增大和吸收CO2效率持续降低[7,8]。据统计,因有机胺及其降解产物的逸散,每吨CO2可造成 0.01~0.8 kg溶剂的损失[9,10]。有机胺降解方式主要有氧化降解和热降解,氧化降解是指有机胺与O2发生的氧化还原反应;热降解是指在解吸塔、再沸器和热交换器等温度较高的区域发生的、不需要O2参与的降解。MEA在吸收塔中,在溶解的Fe3+和Mn2+的催化下会发生氧化降解[11,12]。
本工作以AEEA和MEA为对象,通过6次循环吸收和解吸实验,研究循环过程中二者在313 K时对CO2的吸收量、吸收速率以及在393 K时再生速率和再生率,并对两种单胺的降解情况进行研究,探讨降解机理。
1 实验部分
实验试剂羟乙基乙二胺和乙醇胺均为分析纯,由国药集团化学试剂有限公司生产;实验所用单胺与所有复配胺溶液总质量分数都为10%,用去离子水配制。采用模拟低分压电厂烟气,CO2体积分数为85%,O2体积分数为15%。CO2和O2均为分析纯(纯度大于99%)。
1.1 循环吸收实验
在搅拌反应釜内进行CO2循环吸收实验,该釜采用油浴加热的方式维持吸收液温度稳定。循环吸收实验装置示意如图1所示。
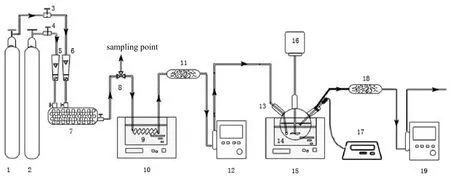
图1 循环吸收实验装置示意Fig.1 Schematic diagram of the experimental device for absorption
实验步骤:首先用去离子水配制800 mL实验所需胺溶液,复合胺溶液需根据两种胺所需质量分数比进行配制。将已配置新鲜胺溶液(或解吸后贫胺溶液)经进液口加入反应釜,设定搅拌器转速为180 r/min,循环油浴温度和水浴锅温度均为40 ℃,水浴锅用于预热混合气。然后用N2吹扫体系(防止空气干扰),待釜内胺溶液温度与油浴温度相同时,开启CO2(分析纯,99.9%)和O2(分析纯,99.9%)气瓶,同时开始计时,利用转子流量计控制CO2,N2和O2的流量比稳定为15∶80∶5,其中,CO2流量稳定在240 mL/min。CO2和O2在缓冲罐内混合后经螺旋玻璃管预热后以鼓泡形式进入反应釜。
采用智能电子皂膜流量计测量反应釜进口气体与出口气体(未被吸收的气体)流量,每隔5 min读取流量计示数并做记录,胺溶液吸收CO2量可根据进出气流量差与流量比计算得到。
待溶液吸收饱和后,雷磁pH计示数不再发生变化且进出气流量差值小于5 mL/min时,将饱和胺溶液即富液冷却至室温,取样5 mL,采用7890B-5977A GC-MSD型安捷伦气质联用仪对富液进行负载分析以及生成反应物分析,剩余富液进行解吸。
1.2 循环解吸实验
解吸实验通过直接加热法使富胺溶液脱去CO2重新生成贫胺溶液,再生过程采用恒温油浴锅加热,并利用电磁搅拌器进行搅拌,以保证溶液受热均匀及再生完全。循环解吸实验装置如图2所示。
实验步骤:将待再生的富液加入三口烧瓶内,连接冷凝管和温度计。设定搅拌速率为120 r/min,解吸温度120 ℃,同时打开电磁搅拌器和油浴锅,并开启秒表计时器。
出气连接电子智能皂膜流量计进行测量,用饱和Ca(OH)2溶液判断CO2出气,饱和Ca(OH)2溶液变浑,证明CO2开始析出,记录此时溶液温度及秒表时间示数。此后每隔5 min记录一次温度计示数及皂膜流量计示数并做记录。CO2出气排空。
待富胺溶液解吸完全后,即出气流量读数小于5 mL/min时,停止实验,待溶液冷却至室温,取样5 mL,采用7890B-5977A GC-MSD型安捷伦气质联用仪分析贫胺溶液负载及溶液中降解产物。
第1次解吸后贫胺溶液再用于第2次吸收实验,如此循环往复共进行6次吸收和解吸实验。对每次循环的贫、富液都用雷磁 pH计测量酸碱度。为弥补吸收、解吸过程中因取样及受热蒸发等损失的胺液,从第2次吸收实验开始前,需向贫胺溶液中补充新鲜胺溶液至800 mL,每次加入新鲜胺液体积均不足总胺体积的1/40,对实验影响可忽略不计。
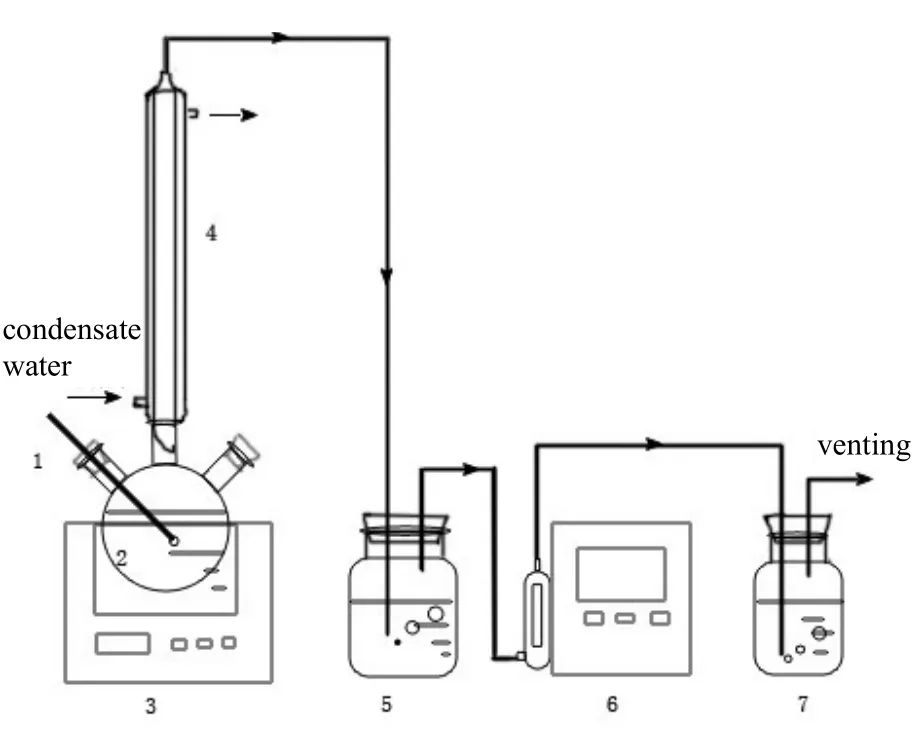
图2 循环解吸实验装置示意Fig.2 Schematic diagram of experimental device for desorption
2 结果与讨论
2.1 AEEA与MEA单胺初次吸收性能对比
质量分数均为10%的AEEA和MEA,在0.1 MPa,313 K条件下吸收CO2,初次吸收速率对比图与初次吸收负荷对比图分别如图3和4所示。
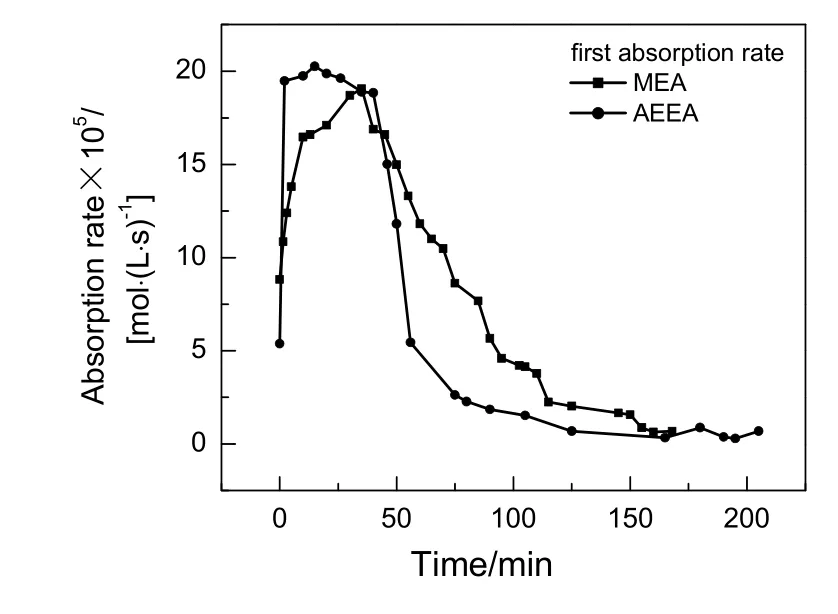
图3 AEEA与MEA初次吸收速率对比Fig.3 Comparison of the first absorption rate between AEEA and MEA
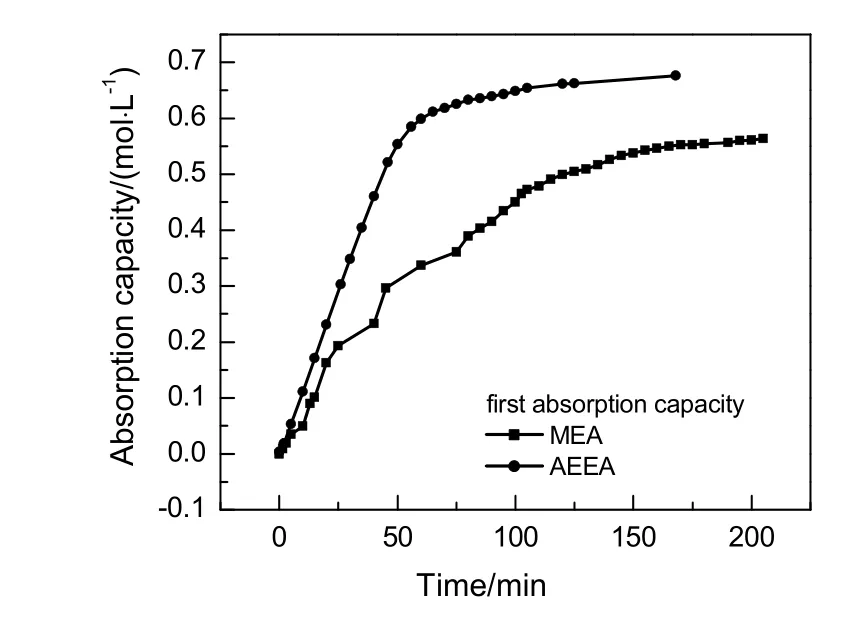
图4 AEEA与MEA初次累积吸收负荷对比Fig.4 Comparison of the first absorption capacity between AEEA and MEA
由图3可知,AEEA和MEA吸收速率随时间增加而呈先上升后下降的趋势,主要是因为反应开始时,胺溶液吸收CO2以化学反应为主,随着体系中 CO2含量增加,反应速率迅速加快,但随着溶液中吸收反应进行,溶液中有机胺被不断消耗,使化学吸收反应速率随之减缓,至溶液中有机胺分子与CO2完全反应后,吸收速率降至很低,此时吸收以物理吸收为主,吸收速率逐渐趋于平缓至吸收饱和。由图4可知,初始AEEA和MEA吸收负荷均随时间增加而增加,至65 min时二者吸收负荷基本相同,随后MEA吸收负荷渐趋平缓,AEEA吸收负荷则继续增加,最后在160 min逐渐趋于平缓。AEEA最终吸收负荷为0.676 mol/L,MEA最终吸收负荷为0.576 mol/L,AEEA初次吸收负荷略大于MEA。AEEA分子中存在一个仲胺基和1个伯胺基两个胺基,而MEA只有一个伯氨基,AEEA理论吸收量为每摩尔胺吸收CO21.0 mol,MEA理论吸收量为每摩尔胺吸收CO20.5 mol,AEEA分子量约为MEA的2倍,故同体积同质量分数的AEEA和MEA胺溶液,AEEA吸收负荷略高于MEA。
2.2 AEEA与MEA初次再生性能对比
质量分数均为10%的AEEA和MEA,在393 K,0.1 MPa条件下解吸再生,初次再生速率随时间变化趋势见图5。解吸再生以澄清石灰水变浑浊开始计时。由图可知,AEEA与MEA解吸再生速率随时间变化趋势基本一致,都呈先增加后下降,最终基本不变的趋势。AEEA再生速率明显低于MEA,AEEA和MEA最大解吸速率分别为1.836×10-4和 2.30×10-4mol/(L·S)。AEEA 解吸完全耗时明显大于MEA,说明AEEA相比MEA再生困难。
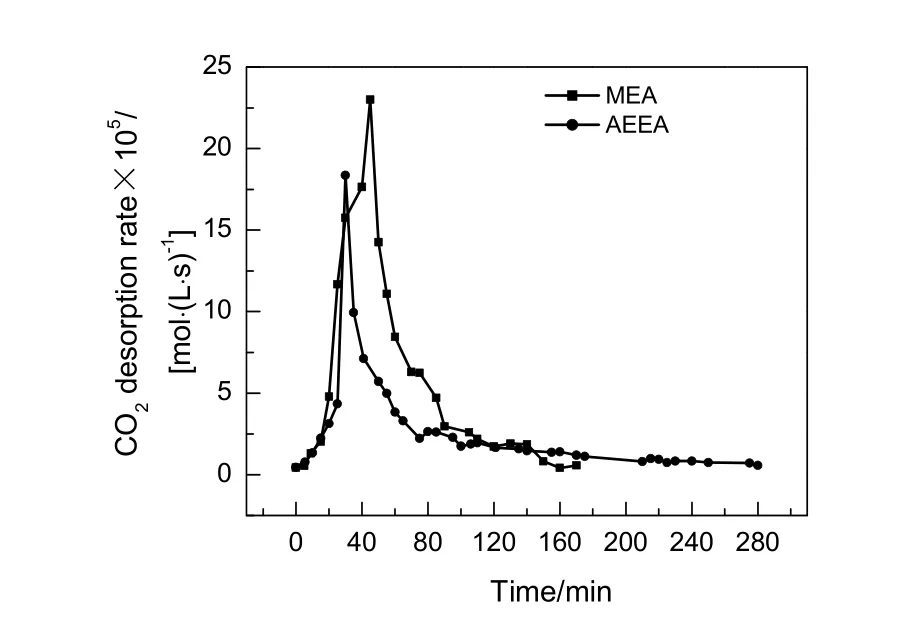
图5 AEEA与MEA初次再生速率随时间变化趋势对比Fig.5 Comparison of the first regeneration rate between AEEA and MEA with time
CO2饱和胺溶液即富液经再生后成为贫液,贫、富液中CO2负载差值与富液中CO2负载之比即为CO2再生率,AEEA初次再生率为72.3%,MEA再生率为86.8%,进一步说明AEEA再生困难。吸收剂不能完全再生是再生过程因高温降解生成热稳定性盐所致,MEA再生率高于AEEA是因为AEEA分子中具有2个胺基,胺基结构越多,再生越困难。
AEEA与MEA初次再生过程中温度情况见表1。由表可知,AEEA开始再生温度和恒沸温度都低于MEA,再生温度低,水蒸发相应减少,则再生能耗会下降,而工业CO2捕集工艺中,再生能耗占成本很大比例。因此,AEEA再生能耗低于MEA,具有更好的商业应用价值。

表1 AEEA和MEA溶液初次再生温度Table 1 Comparison of the first regeneration temperature between AEEA and MEA
2.3 AEEA与MEA循环吸收负荷与胺降解关系
质量分数同为10%的AEEA和MEA 6次循环吸收负荷随时间变化情况分别如图6和7所示。由图可知,6次循环AEEA与MEA吸收负荷都随时间增加而增加,最终渐趋于最大吸收负荷,至吸收饱和。其中,6次循环吸收负荷中属初次吸收负荷最大,说明AEEA(MEA)与CO2反应生成的相应氨基甲酸盐不会完全再生为AEEA(MEA)。AEEA与MEA前3次循环吸收负荷都随循环次数增加而减少,第4次吸收负荷陡然升高,与第2次吸收负荷基本一致,AEEA第4次吸收负荷甚至略大于第2次吸收负荷。该情况可以解释为:AEEA与MEA第4次循环贫胺溶液中胺浓度增加,因为AEEA与MEA不可能完全再生,导致溶液胺浓度增加可能是第3次解吸过程中降解生成新的胺,为验证猜测,分别对比AEEA和MEA第2次解吸后贫液与第3次解吸后贫液GC-MS色谱图,对比图见图8和9。
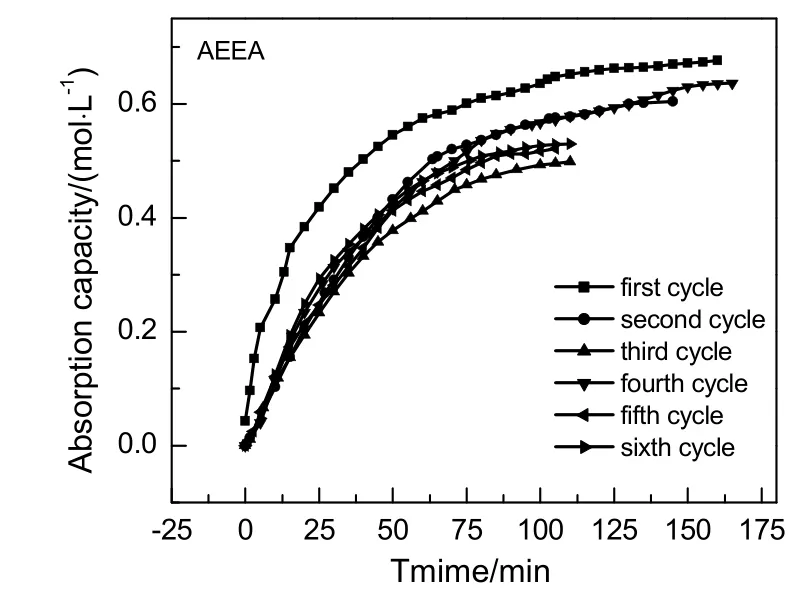
图6 AEEA 6次循环吸收负荷随时间变化Fig.6 Changes of AEEA 6 cycles absorption capacity with time
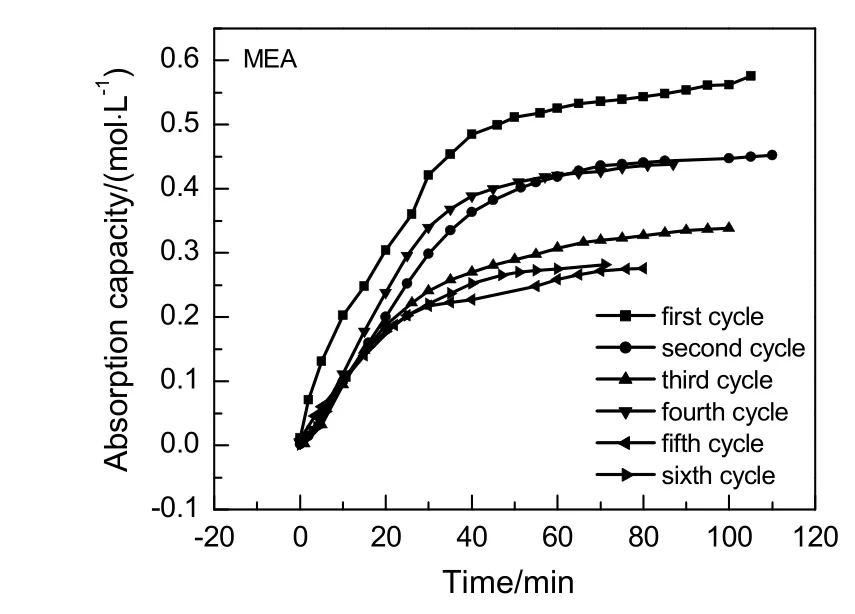
图7 MEA6次循环吸收负荷随时间变化Fig.7 Changes of MEA 6 cycles absorption capacity with time
对比图8的两谱图得出,AEEA第3次解吸过程出现N-(2-羟乙基)-二乙烯三胺,该胺分子含两个伯氨基和一个仲胺基,其理论负荷量为1 mol胺吸收1.5 mol CO2,促进第4次循环吸收负荷增加。AEEA降解生成该胺的反应途径如式(1)和(2)所示:AEEA与CO2反应生成2-恶唑烷酮,2-恶唑烷酮在高温条件下开环并与AEEA发生聚合反应生成新的产物即N-(2-羟乙基)-二乙烯三胺[8,9]。
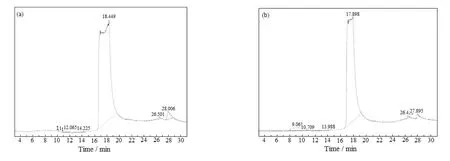
图8 第2次解吸(a)和第3次解吸(b)后AEEA贫液GC-MS图谱对比Fig.8 Comparison of GC-MS spectra of AEEA lean solution after second desorption(a) and third desorption(b)
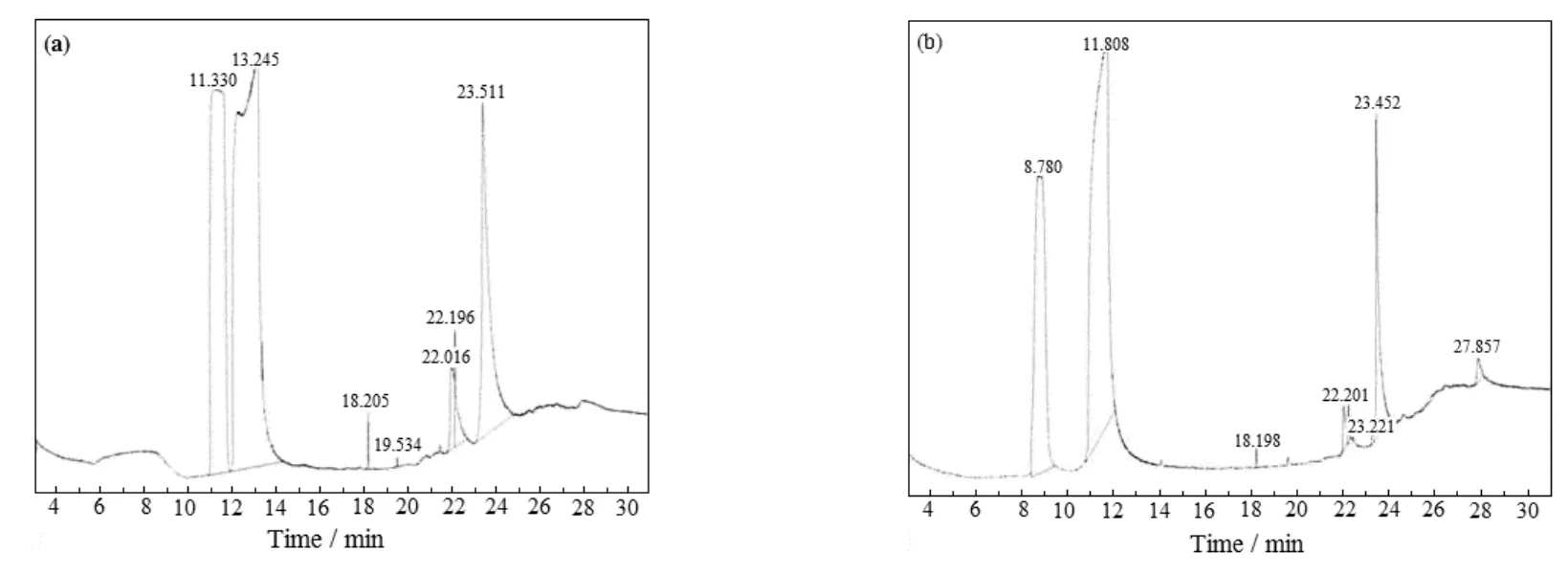
图9 第2次解吸(a) 和第3次解吸(b)后MEA贫液GC-MS图谱对比Fig.9 Comparison of GC-MS spectra of MEA lean solution after second desorption(a)and third desorption(b)
由图9两谱图对比得出,MEA第3次循环解吸后生成胺类物质AEEA。1 mol AEEA理论酸气负荷为1.0 mol CO2,从而促使第4次循环吸收中AEEA与MEA共同吸收CO2,导致吸收负荷增加。MEA降解生成AEEA可能反应途径如式(3)~(6)所示:MEA与CO2反应生成氨基甲酸盐,该盐通过缩合反应生成2-恶唑烷酮,2-恶唑烷酮继续与MEA反应生成1-(2-羟乙基)-咪唑啉酮(HEIA),HEIA可水解生成AEEA[10]。

质量分数同为10%的AEEA与MEA在相同实验条件下,6次循环CO2累积吸收负荷对比情况如图10。由图可知,AEEA每次循环吸收负荷均大于MEA,前3次吸收随循环次数增加,吸收负荷减少,是因为AEEA胺液吸收负荷受AEEA与CO2化学反应控制,MEA胺液吸收负荷受MEA与CO2化学反应控制;AEEA具有2个胺基,MEA只有1个胺基,所以吸收负荷AEEA大于MEA;后3次吸收,AEEA胺液吸收负荷受降解物N-(2-羟乙基)-二乙烯三胺与AEEA协同作用影响,MEA胺液吸收负荷受降解物AEEA与MEA协同作用影响,由于N-(2-羟乙基)-二乙烯三胺具有3个胺基,所以吸收能力从大到小依次为 N-(2-羟乙基)-二乙烯三胺,AEEA和MEA,因此后3次AEEA胺液吸收负荷大于MEA胺液吸收负荷。
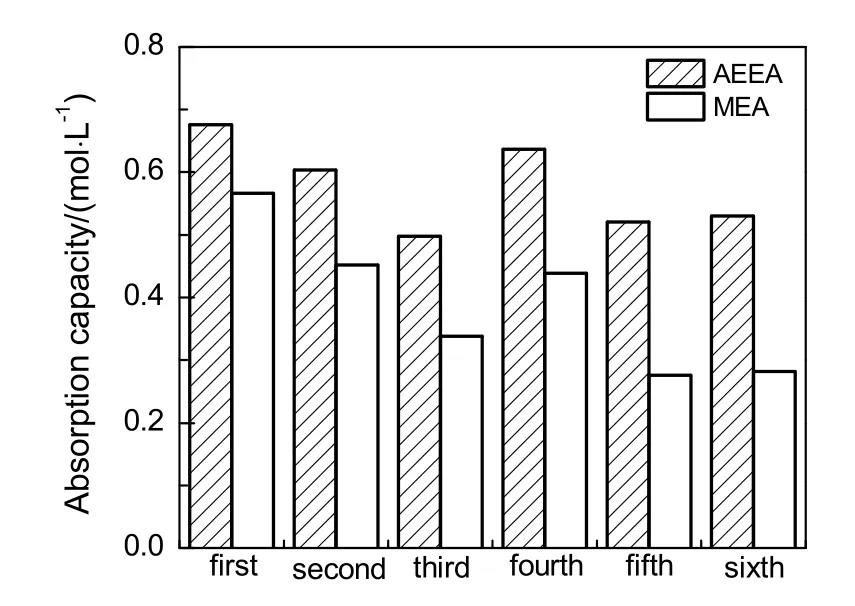
图10 AEEA与MEA 6次循环累积吸收负荷对比Fig.10 Comparison of 6 cycles cumulative absorption capacity between AEEA and MEA
2.4 AEEA与MEA循环吸收速率对比
质量分数同为10%的AEEA与MEA6次循环吸收速率随时间变化分别见图11和12。由图可看出,AEEA与MEA 6次循环吸收速率都呈先迅速增加后逐渐下降,最终趋于平缓的趋势。初次吸收,AEEA前15 min吸收速率快速增加,此时间段内溶液中CO2浓度低,液膜处CO2浓度高,传质阻力小,反应速率主要由化学反应速度影响,而随时间继续增加溶液中反应产物碳酸盐浓度上升,AEEA浓度不断降低,传质阻力逐渐增大,反应速率受物理吸收控制,吸收速率逐渐变缓,最终吸收速率趋近于0。因初次再生AEEA不能完全再生,导致后5次循环吸收速率都低于初次吸收速率。
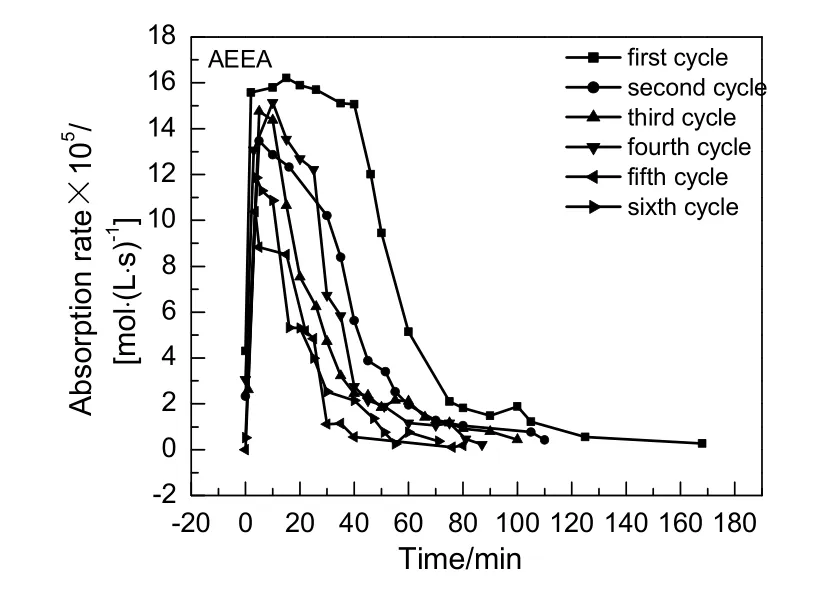
图11 AEEA 6次循环吸收速率随时间变化Fig.11 Changes of AEEA 6 cycles absorption rate with time
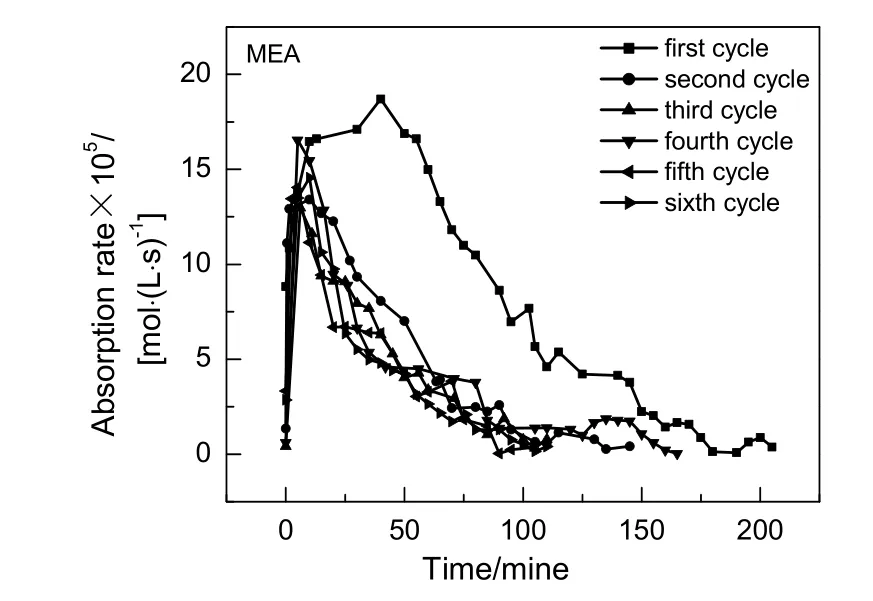
图12 MEA 6次循环吸收速率随时间变化Fig.12 Changes of MEA 6 cycles absorption rate with time
MEA后5次循环吸收反应前20 min内,吸收速率受化学反应速率影响快速增加,随后吸收速率受传质阻力影响随时间增加而呈逐渐下降,最终趋于0。MEA与AEEA吸收CO2机理相同,故吸收速率与时间变化趋势也相同,都是呈先增加后下降趋势,反应分为两段,上升段受化学反应控制,下降段物理吸收逐渐占据主导地位。
2.5 CO2再生速率对比
质量分数同为10%的AEEA与MEA在0.1 MPa和393 K条件下解吸,6次循环CO2再生速率随时间变化图分别见图13和14。从图13看出AEEA 6次循环再生速率随时间变化趋势相同,都呈先增加后下降再以极小的速率持续至再生完全的趋势。图中明显看出,后 5次再生比初次再生慢。图 14中显示MEA再生速率随时间变化趋势与AEEA相同,MEA前3次再生速率基本一致,后3次再生速率小于前3次再生速率。说明第3次再生过程中出现的降解产物对AEEA循环再生速率影响较大。
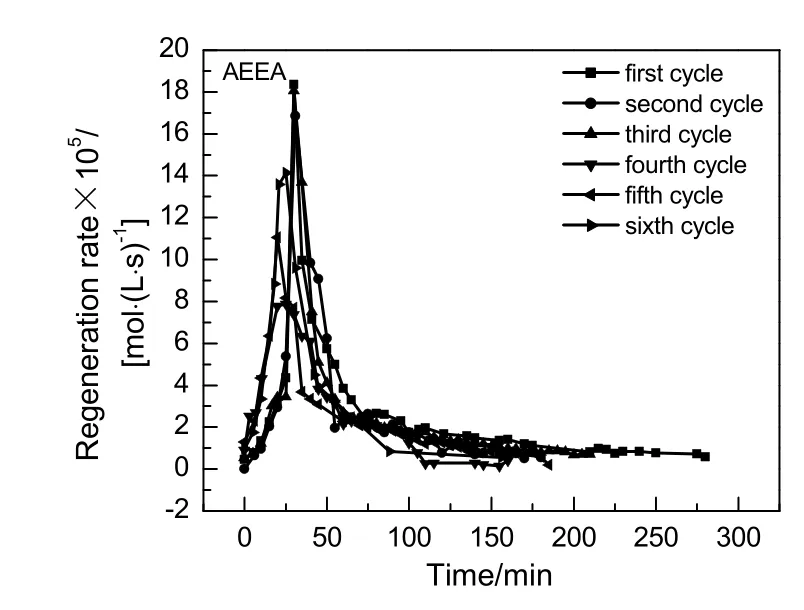
图13 AEEA 6次再生速率随时间变化Fig.13 Changes of AEEA 6 cycles regeneration rate with time
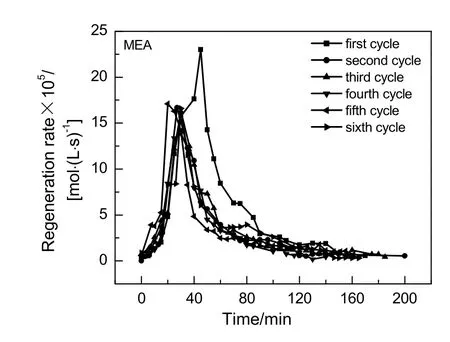
图14 MEA6次再生速率随时间变化Fig.14 Changes of MEA 6 cycles regeneration rate with time
2.6 CO2再生率及再生温度对比
质量分数同为10%的AEEA与MEA在0.1 MPa和393 K条件下解吸,6次循环CO2再生率变化对比见图15。由图可看出,6次再生率MEA均大于AEEA,AEEA再生能力比MEA差。主要是因为MEA分子只含一个伯胺基,与 CO2反应生成的氨基甲酸盐受热后易分解生成MEA和CO2,而AEEA不仅含一个伯胺基和一个仲胺基,其相对应的氨基甲酸盐受热分解再次生成AEEA过程相对困难,说明链烷醇胺再生率随分子结构中胺基数量增加而降低。

图15 AEEA与MEA6次循环胺再生率Fig.15 Comparison of 6 cycles amine regeneration rate between AEEA and MEA
因溶液再生能耗主要由水气蒸发所致,因此选择恒沸温度以衡量胺液再生温度,6次再生恒沸温度对比见表2。6次循环再生,AEEA恒沸温度都低于MEA,AEEA再生过程水汽蒸发略低,则再生能耗AEEA低于MEA。AEEA与MEA再生温度随循环次数增加基本呈递增趋势,造成这一现象的原因是溶液再生过程中会降解产生诸多热稳定性盐,导致溶液恒沸温度上升。但两种单胺溶液第3次再生温度略有下降,是因为MEA溶液第3次降解过程中产生AEEA,因AEEA再生温度低于MEA,所以MEA第3次再生温度下降,同理,AEEA第3次再生温度下降也受降解物新胺影响。
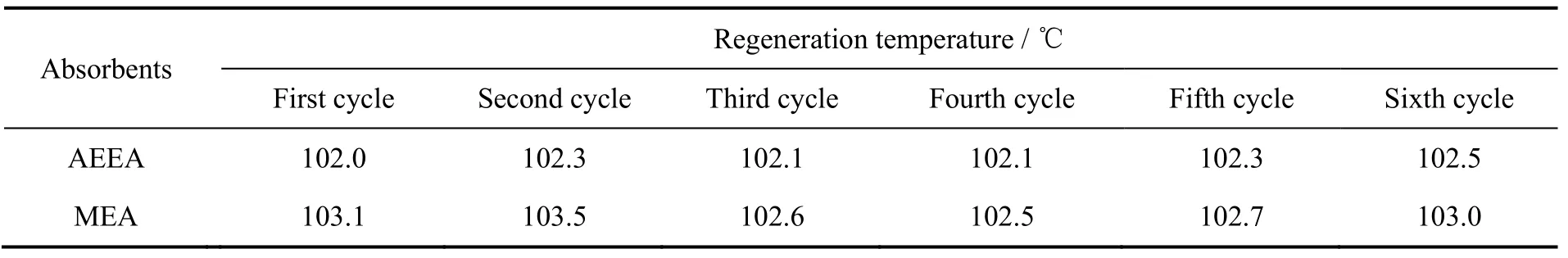
表2 溶液6次循环再生温度对比Table 2 Comparison of 6 cycle regeneration temperature between AEEA and MEA
3 结 论
a)AEEA初次吸收效果比MEA好,再生速率和再生率都不如MEA,但AEEA再生温度比MEA低,能耗低。6次循环吸收、解吸实验中AEEA循环吸收负荷和吸收速率都优于MEA,且AEEA再生温度都低于MEA,但AEEA循环再生速率和再生率不如MEA。
b)循环实验过程中,AEEA第3次再生过程中产生降解物N-(2-羟乙基)-二乙烯三胺,促进后续吸收;MEA第3次再生过程产生降解物AEEA,同样促进后续吸收。
[1]Rochelle G T.Amine scrubbing for CO2capture[J].Science, 2009, 325(5948): 1652-1654.
[2]Freeman S A, Davis J, Rochelle G T.Degradation of aqueous piperazine in carbon dioxide capture[J].Green Gas Control, 2010, 4: 756-761.
[3]Lepaumier H, Picq D, Carrette P L.Degradation study of new solvents for CO2capture in post-combustion[J].Energy Procedia, 2009, 1:893-900.
[4]Lowe A, Beasley B, Berly T.Carbon capture and storage(CCS) in Australia[M].Hester R, Harrison R M.Carbon Capture: Sequestration and Storage.UK: The Royal Society of Chemistry, 2009: 65-101.
[5]Kohl A L, Nielsen R.Gas purification[M].Houston: Gulf Publishing Company, 1997.
[6]Aaron D, Tsouris C.Separation of CO2from flue gas: a review[J].Separation Science and Technology, 2005, 40: 321-348.
[7]周 珊, 王淑娟, Rochelle G T, 等.CO2捕集过程中有机胺热降解的实验研究[J].清华大学学报(自然科学版), 2012, 52(1): 81-86.Zhou Shan, Wang Shujuan, Rochelle G T, et al. Experimental study on amine thermal degradation during CO2capture[J].J Tsinghua University(Science and Technology), 2012, 52(1): 81-86.
[8]Karl M, Wright R F, Berglen T F, et al.Worst case scenario study to assess the environmental impact of amine emissions from a CO2capture plant[J].International Journal of Greenhouse Gas Control, 2011, 5(3): 439-447.
[9]Sexton A J, Rochelle G T.Catalysts and inhibitors for oxidative degradation of monoethanolamine[J].International Journal of Greenhouse Gas Control, 2009, 3(6): 704-711.
[10]Yazvikova N V, Zelenskaya L G, Balyasnikova L V, et al.Mechanism of side reactions during removal of carbon dioxide from gases by treatment with monoethanolamine[J].Zhurnal Prikladnoi Khimii, 1975, 48(3): 674-676.
[11]Strazisar B R, Anderson R R, White C M.Degradation pathways for monoethanolamine in a CO2capture facility[J].Energy & Fuels,2003, 17(4): 1034-1039.
[12]Reza J, Trejo A.Degradation of aqueous solutions of alkanolamine blends at high temperature, under the presence of CO2and H2S[J].Chemical Engineering Communications, 2006, 193(1): 129-138.
Degradation of Hydroxyethyl Ethylenediamine and Monoethanolamine for CO2Absorption
Lu Shijian1,2, Geng Chunxiang1, Li Shixia1,2, Li Xinze1,2, Zhao Dongya1, Zhu Quanmin1
1.China University of Petroleum(East China), Qingdao 266580, China;
2.SINOPEC Energy and Environmental Engineering Co Ltd, Dongying 257026, China
The absorption solvent will be degraded when coal-fired flue gas CO2is captured by organic amines.Ethanolamine (MEA) and N-(2-hydroxyethyl) ethylenediamine (AEEA) were selected for the purpose of exploring the possible degradation mechanism of alcohol amine in the process of CO2absorption.The absorption and desorption properties of MEA and AEEA with mass fraction of 10% were studied under the conditions of the absorption temperature of 40 ℃, desorption temperature of 120 ℃.The results from six cycles showed that the absorption capacity and absorption rate of AEEA were better than those of MEA,and the regeneration temperature of AEEA was lower than that of MEA.However, the rate of cycle regeneration and regeneration rate of AEEA were not as good as that of MEA.During the third cycle of the experiment, AEEA produced the degradation product N-(2-hydroxyethyl)-diethylene triamine, MEA produced the degradation product AEEA, both of which improved the reabsorption load.
CO2capture; cyclic experiment; degradation; N-(2-hydroxyethyl) ethylenediamine; ethanolamine
TQ413
A
1001—7631 ( 2017 ) 04—0364—09
10.11730/j.issn.1001-7631.2017.04.0364.09
2017-04-11;
2017-08-01。
陆诗建(1984—),男,工程师。E-mail: lushijian88@163.com。

