ZrO2/TiO2催化剂上一步法合成乙二醇二甲醚
于清跃,孙 飞,朱新宝
1.南京科技职业学院化工与材料学院,江苏 南京 210048;
2.南京安鼎化工科技有限公司,江苏 南京 210048;
3.南京林业大学化学工程学院,江苏 南京 210037
ZrO2/TiO2催化剂上一步法合成乙二醇二甲醚
于清跃1,3,孙 飞2,朱新宝3
1.南京科技职业学院化工与材料学院,江苏 南京 210048;
2.南京安鼎化工科技有限公司,江苏 南京 210048;
3.南京林业大学化学工程学院,江苏 南京 210037
采用共沉淀法制备了ZrO2/TiO2催化剂,在固定床反应器上考察其催化二甲醚(DME)与环氧乙烷(EO)一步法合成乙二醇二甲醚(DMG)的性能,并采用 X射线衍射(XRD)、氮气吸附(BET)、氨气化学吸附和氨气傅立叶红外(NH3-FTIR)等对催化剂进行表征。结果表明,当ZrO2质量分数为25%时,催化剂呈现无定形态,最可几孔径分布为7.5 nm,NH3吸附酸量670 µmol/g,表面分布B酸与L酸。在反应温度80 ℃,压力0.6 MPa,DME与EO物质的量之比为3,气体空速(GHSV)为1 800.0 h-1的条件下,EO转化率100.0%,DMXG(乙二醇二甲醚、二乙二醇二甲醚和多乙二醇二甲醚)选择性 89.5%以上。催化剂连续使用 720 h,EO转化率99.7%,DMG选择性为71.7%。
环氧乙烷 二甲醚 乙二醇二甲醚 酸催化
乙二醇二甲醚是性能优越的非质子极性溶剂,广泛应用于化学工业以及医药抽提剂与有机中间体合成[1-3]。传统Williamson合成法生产的乙二醇二甲醚,是在乙醇钠相转移催化剂作用下制备的。该工艺由于反应路径长而副产物多,产品分离难,为获得纯净产品需要通过酸中和废弃碱液,整个过程会产生大量工业盐和废水,环境污染严重,且液体酸碱的使用对设备的耐腐蚀性要求高。随着产品升级的需要以及人们环境保护意识的提高,采用环境友好固体酸催化剂工艺成为迫切的需求。
酸性是影响固体酸催化剂性能的重要因素[4]。Aponte等[5]认为催化剂选择性与酸强度有关;于清跃等[6]认为B酸与L酸协同作用对提高转化率有显著作用。徐文娟[7]研究发现Lewis酸分子筛催化剂对乙二醇二甲醚合成具有较高选择性;顾建财[8]研究了活性炭改性及其负载三氟化硼乙醚催化合成乙二醇二甲醚,发现该催化剂初始活性好,但不能循环使用。ZrO2/TiO2催化剂具有较强的表面酸碱性、热稳定性和较大的比表面积,被广泛用于催化裂化[9]和环己酮肟Beckmann重排[10]等催化反应以及脱除氯氟烃[11]、加氢脱硫[12]与汽车尾气脱除氮氧化物[13]等催化脱除反应,具有较高的活性。
本工作采用共沉淀法制备ZrO2/TiO2催化剂,在固定床反应器上考察其二甲醚与环氧乙烷选择性醚化反应性能,探索了B酸与L酸协同作用对提高环氧乙烷转化率以及乙二醇二甲醚收率机理。研究了催化剂物化性质及反应条件等因素对催化剂反应活性的影响。
1 实验部分
1.1 催化剂制备
配制浓度为0.10 mol/L氧氯化锆水溶液和0.05 mol/L四氯化钛乙醇溶液,搅拌状态下滴加到质量分数为5.0%聚乙二醇水溶液中,通过滴加氨水调节pH值至8.0~9.0,得絮状沉淀。过滤、洗涤沉淀物至中性,室温下晾放,110 ℃干燥12 h,550 ℃焙烧5 h得ZrO2/TiO2复合氧化物。通过控制氧氯化锆溶液和四氯化钛乙醇溶液滴加量,制得不同配比的复合沉淀物xZrO2/TiO2,其中x为质量分数。
1.2 催化剂表征
催化剂的X射线衍射(XRD)表征在Bruker公司D8 ADVANCE型X射线衍射仪上进行,测试条件为Cu靶Kα线,管电压40 kV,管电流30 mA;样品的比表面积和孔径分布用ASAP 2020 M物理吸附仪在液氮温度(-196 ℃)下通过测定计算得到;NH3吸附量酸性表征在法国 Setarm公司Tian-Calvet型热流式量热仪测定样品氨吸附量,量热仪与Baratron电容式压力计测量压力和控制进样玻璃真空系统连接,石英量热池每次装样0.1 g,NH3在使用前经过冷冻、抽空与融化循环纯化后注入样品池,423 K测定吸附热,容量法测定吸附量,吸附热与吸附量比值无明显变化判定吸附饱和;氨气傅立叶红外(NH3-FTIR)在Thermo Nicolet公司NEXUS傅立叶红外光谱仪上原位进行;样品的透射电镜(TEM)表征在日本电子株式会社JEM 2100型透射电镜上进行。
1.3 催化剂活性评价
将催化剂粉末压片、研磨与过筛,取粒径380~500 μm(30~40目)的样品。量取5 mL石英砂,装入管式反应器,分别量取5 mL催化剂与石英砂,混合后装入反应管,再量取5 mL石英砂装入反应管。在一定温度下,于氮气气氛中还原活化催化剂,然后环氧乙烷与二甲醚在钢瓶自带压力作用下,从底部通过导管分别压入装有高氯酸镁干燥剂的汽化器,关闭汽化器入口阀门,汽化器在恒温90 ℃下汽化环氧乙烷与二甲醚,随后通过流量计计量进入预热器恒温气化,再进入反应器,在一定温度下进行环氧乙烷与二甲醚开环生成乙二醇二甲醚的反应。反应产物冷凝后,采用ThermoFinnigan公司的气相色谱仪和质谱(GC-MS)联用仪对冷凝产物组成进行定性分析,分析条件为弹性石英毛细管柱30 mm×0.32 mm×0.5 μm,柱温40 ℃,汽化温度260 ℃,检测器温度260 ℃。尾气组成采用山东鲁南分析仪器厂的SP-6800A气相色谱仪分析:色谱柱为15 m FFAP毛细管柱,检测器为氢火焰离子化检测器,柱温于65 ℃恒温2 min后,以25 ℃/min的速率上升至230 ℃,并保持2 min,采用面积归一法计算。
2 结果与讨论
2.1 晶体形态与孔分布
图1为不同样品的XRD图谱。由图可知,纯TiO2呈锐钛型,纯ZrO2呈单斜相,25%ZrO2/TiO2复合物氧化物中ZrO2和TiO2的特征峰消失,呈长程无序的无定型形态。
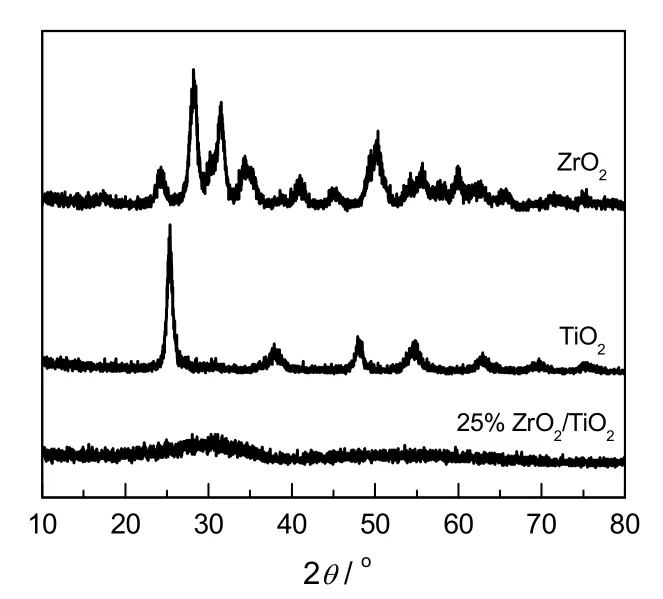
图1 样品的XRD图谱Fig.1 XRD patterns of samples
图 2为样品的孔径分布曲线图。纯 ZrO2和 TiO2样品由于颗粒的架构作用,使得形成的孔道形状不规则,表现为孔径分布更加宽泛。由图可知,ZrO2和TiO2的最可几孔径分布分别在10.8和12.6 nm,孔径与颗粒直径(10~15 nm,见图 4所示)相当,说明其孔道应为晶粒堆积孔;25%ZrO2/TiO2和75%ZrO2/TiO2最可几孔径分布分别在5.7和7.5 nm,孔径分布较窄。
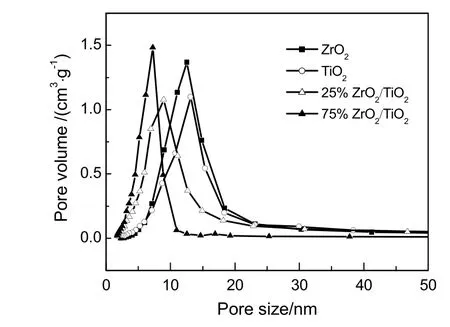
图2 样品的孔径分布Fig.2 Pores distribution of samples
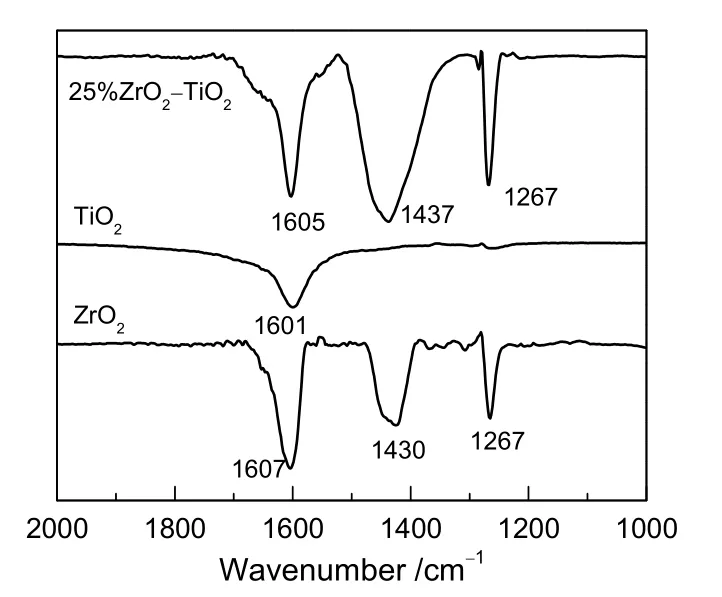
图3 样品的NH3-FTIR图谱Fig.3 NH3-FTIR spectra of samples
2.2 酸性质与活性
图3为样品的NH3-FTIR图谱。由图可知,TiO2在1 601 cm-1处有L酸透射峰;ZrO2在1 607和1 267 cm-1处有L酸透射峰,在1 429 cm-1处有B酸透射峰,表明ZrO2同时具有L酸和B酸;复合氧化物ZrO2/TiO2在1 605,1 437和1 267 cm-1处有透射峰,说明其具有L酸性和B酸性[4]。而相对于ZrO2,其在1 437 cm-1处透射峰面积增大,强度增强,说明ZrO2/TiO2的B酸量增大,这与文献[14]结果一致。
表1为不同样品比表面积、孔容以及氨气吸附量。由表可知,ZrO2与TiO2比表面积小于ZrO2/TiO2复合氧化物,ZrO2/TiO2中随着ZrO2含量的增加,xZrO2/TiO2的比表面积先增大后减小,当ZrO2的含量达到25%时,25%ZrO2/TiO2样品具有较大的比表面积、孔容以及NH3吸附量。表1数据显示,TiO2与ZrO2催化活性较低,ZrO2/TiO2复合氧化物催化活性较好。这是由于B酸与L酸的比例得到调节,总酸量增大,ZrO2/TiO2的环氧乙烷开环反应活性增高,其中25%ZrO2/TiO2催化剂活性较好,环氧乙烷转化率达到100%,产物乙二醇二甲醚的选择性为71.2%。
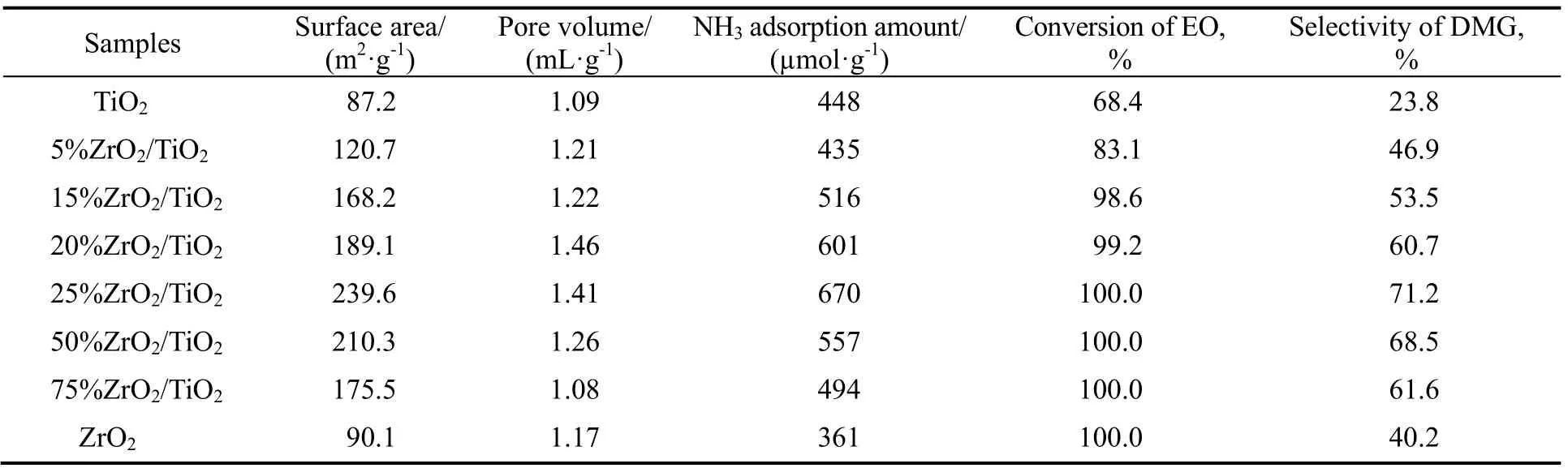
表1 试样的比表面积、孔体积、NH3吸附量与催化性能Table 1 Surface area, pore volume, NH3 adsorption amount and catalytic performance of samples
复合ZrO2/TiO2体系中,ZrO2与TiO2的强相互作用,抑制了晶体的长大,形成了规整孔道和分布均一的中孔孔径,孔容也有明显变化,有别于ZrO2和TiO2。由于晶粒堆积所形成的孔径分布宽泛的堆积孔道,使得ZrO2/TiO2比表面积显著提高,表面酸性活性中心数量增多,从而增大了NH3的吸附量,这与样品TEM表征结果(见图4)一致。

图4 样品的TEM照片Fig.4 TEM images of samples
2.3 催化剂活性
2.3.1 物料配比的影响
以25%ZrO2/TiO2为催化剂,在反应温度80 ℃,体系压力0.6 MPa,气时空速(GHSV)1 800 h-1的反应条件下,考察原料配比对反应性能的影响,结果如表2所示。由表可知,二甲醚与环氧乙烷物质的量之比较小时,环氧乙烷转化率偏低,主产物乙二醇二甲醚的选择性低,副产物1,4-二氧六环与多聚及异构产物含量高;随着二甲醚与环氧乙烷物质的量之比提高,环氧乙烷转化率提高,产物中乙二醇二甲醚的含量先增大后降低,自聚产物1,4-二氧六环、多聚物以及异构产物的含量显著降低。这是由于原料中环氧乙烷比例偏高时,反应产物中环氧乙烷异构二聚比例高,表现为1,4-二氧六环含量多;原料中环氧乙烷比例小时,环氧乙烷转化率高,异构产物少,更大比例环氧乙烷开环与二甲醚反应生成乙二醇二甲醚,同时连串反应也导致更多二乙二醇二甲醚以及多乙二醇二甲醚生成。因此,二甲醚与环氧乙烷物质的量之比为3:1较合适。
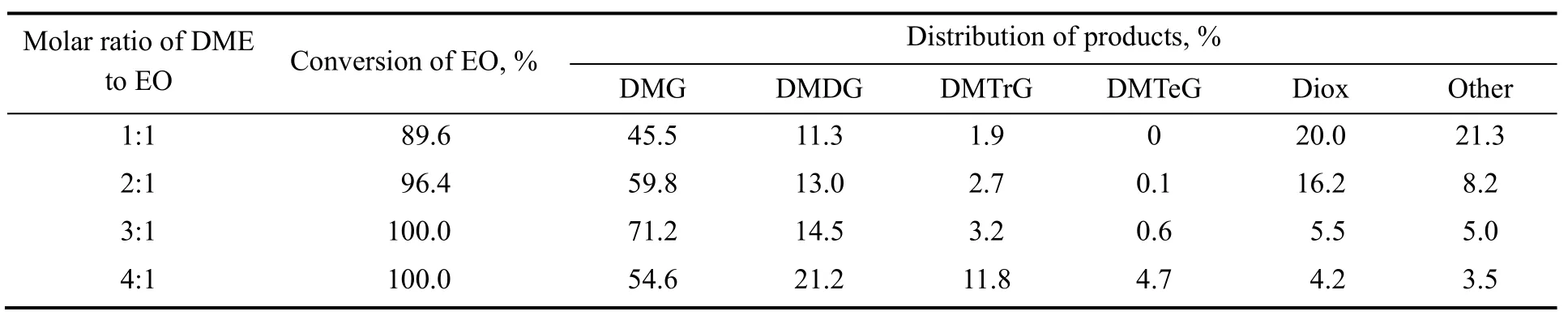
表2 原料配比对乙二醇二甲醚合成的影响Table 2 Effect of molar ratio of DME to EO on etherification of ethylene oxide with dimethyl ether
2.3.2 反应温度的影响
以25%ZrO2/TiO2为催化剂,在体系压力0.6 MPa,空速1 800 h-1的反应条件下,考察反应温度对乙二醇二甲醚合成的影响,结果见表 3。由表可知,随着反应温度的升高,EO的转化率逐渐增大,当温度达到 80 ℃时,其转化率达到 100%,而乙二醇二甲醚的选择性随着反应温度的升高先增加后减小,当反应温度为80 ℃时,DMG的转化率达到最大值,为71.2%。这是由于反应温度较低时,反应体系向环氧乙烷异构方向进行的程度大,异构产物多,表现为产物乙二醇二甲醚含量低;温度升高,反应体系向环氧乙烷开环插入二甲醚方向进行的程度大,表现为环氧乙烷转化率提高,产物中乙二醇二甲醚含量增大;反应温度继续升高,生成的乙二醇二甲醚继续与环氧乙烷进行开环连串反应,生产二乙二醇二甲醚与多乙二醇二甲醚,使得产物中乙二醇二甲醚含量降低,表现为乙二醇二甲醚的选择性下降。因此,反应温度为80 ℃较合适。
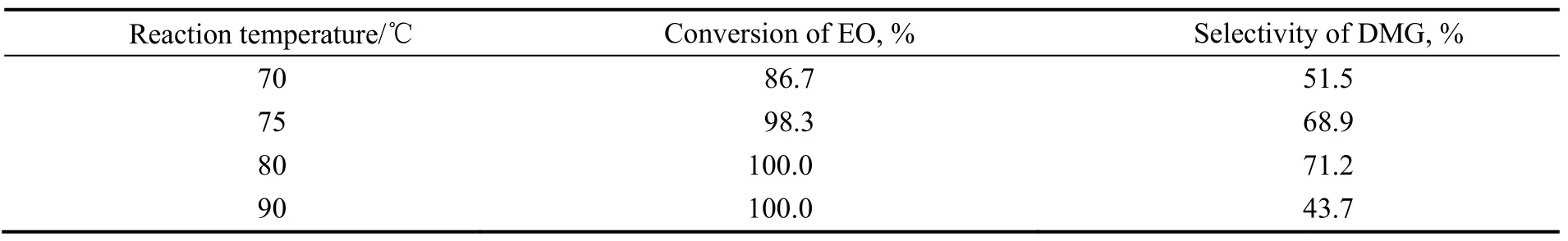
表3 温度对乙二醇二甲醚合成影响Table 3 Effect of reaction temperature on etherification of ethylene oxide with dimethyl ether
2.3.3 空速的影响
以25%ZrO2/TiO2为催化剂,在反应温度80 ℃,体系压力0.6 MPa的反应条件下,考察空速对乙二醇二甲醚合成的影响,结果如表4所示。由图可知,随着GHSV的增加,EO的转化率减小,DMG的选择性先变大后变小,当GHSV为1 800 h-1,DMG的选择性最大。这是由于空速高时,环氧乙烷与催化剂接触时间短,环氧乙烷转化率相对较低,使得尾气中含环氧乙烷,这对产物分离以及生产安全等不利;空速低时,环氧乙烷在催化剂表面停留时间长,环氧乙烷完全转化,但由于空速低,生成的乙二醇二甲醚继续与环氧乙烷进行连串反应,生成二乙二醇二甲醚以及多乙二醇二甲醚,使得产物中乙二醇二甲醚含量降低而使DMG的选择性低。因此,GHSV为1 800 h-1较合适。
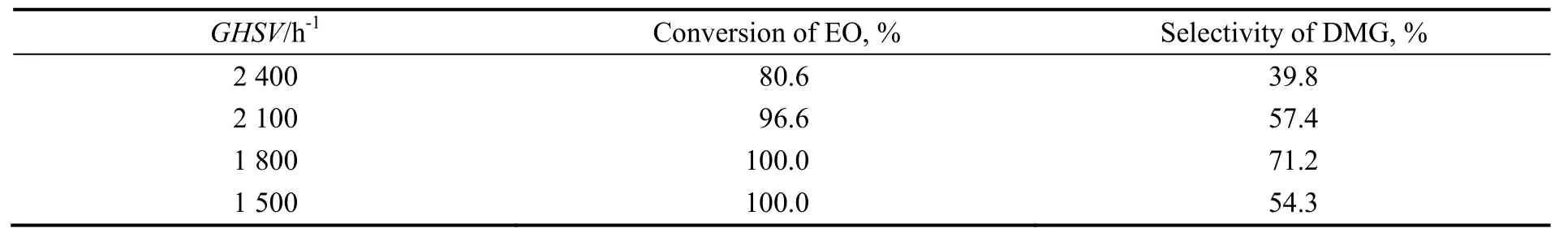
表4 空速对乙二醇二甲醚合成影响Table 4 Effect of GHSV on etherification of ethylene oxide with dimethyl ether
2.3.4 稳定性
以25%ZrO2/TiO2为催化剂,在反应温度80 ℃,体系压力0.6 MPa,空速1 800 h-1的反应条件下,考察乙二醇二甲醚合成随反应时间的变化情况,结果见表5。由表可知,反应120 h后,环氧乙烷转化率为100%,乙二醇二甲醚选择性为66.7%,反应720 h,环氧乙烷转化率维持在99.7%,产品乙二醇二甲醚选择性仍然达到71.7%,说明催化剂性能稳定。
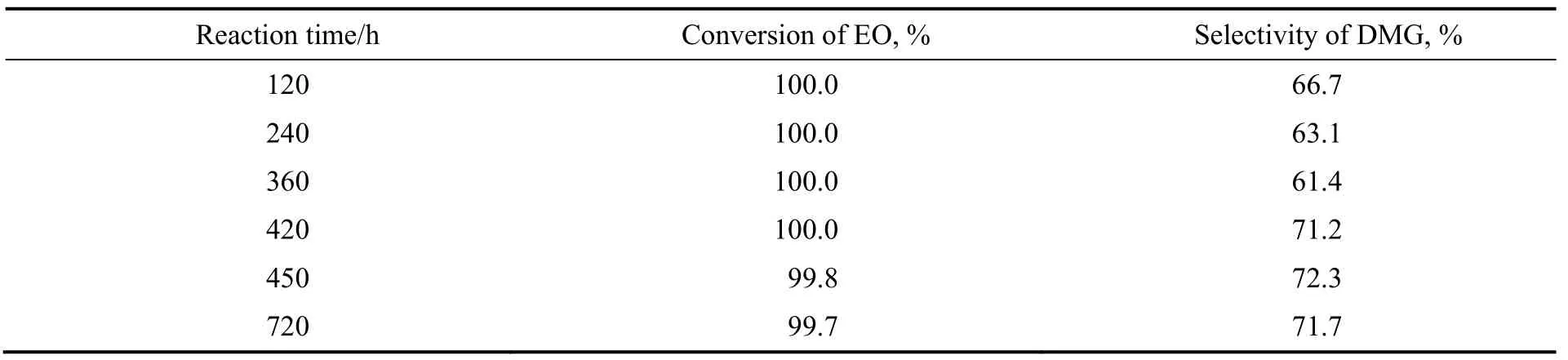
表5 乙二醇二甲醚合成随反应时间的变化情况Table 5 Changes of etherification of ethylene oxide with dimethyl ether with reaction time
2.4 主反应过程探讨
根据反应过程及产物分布,推测环氧乙烷与二甲醚在ZrO2/TiO2催化剂上合成乙二醇二甲醚过程如图5所示[15]。微量水分吸附到催化剂ZrO2/TiO2表面(R1),在催化剂活性中心极化成质子酸B酸(R2);环氧乙烷扩散并化学吸附到质子酸中心(R3),在质子酸的催化作用下开环(R4),形成碳正离子;二甲醚扩散到催化剂ZrO2/TiO2的表面(R5),与催化剂表面L酸中心空轨道共用二甲醚氧原子电子对(R6),二甲醚发生电子转移,在L酸作用下极化,碳氧建断裂(R7),与催化剂上B酸作用下形成的开环环氧乙烷正碳离子结合形成中间产物(R8);形成的中间产物脱出水分子,水分子回到催化剂表面,形成循环(R9);形成的中间过渡产物在脱出水分子后,形成乙二醇二甲醚产物(R10);产物乙二醇二甲醚在浓度推动力作用下,从催化剂内表面向催化剂外扩散,得到目标产物乙二醇二甲醚。为验证B酸与L酸在催化剂表面协同催化合成乙二醇二甲醚,进行如下实验:在色谱纯原料中加入迹量甲醇,甲醇在催化剂表面缩合生成二甲醚与水,生成的二甲醚对二甲醚总浓度贡献忽略不计,生成的微量水与催化剂表面酸中心作用从而调节催化剂表面酸性质。
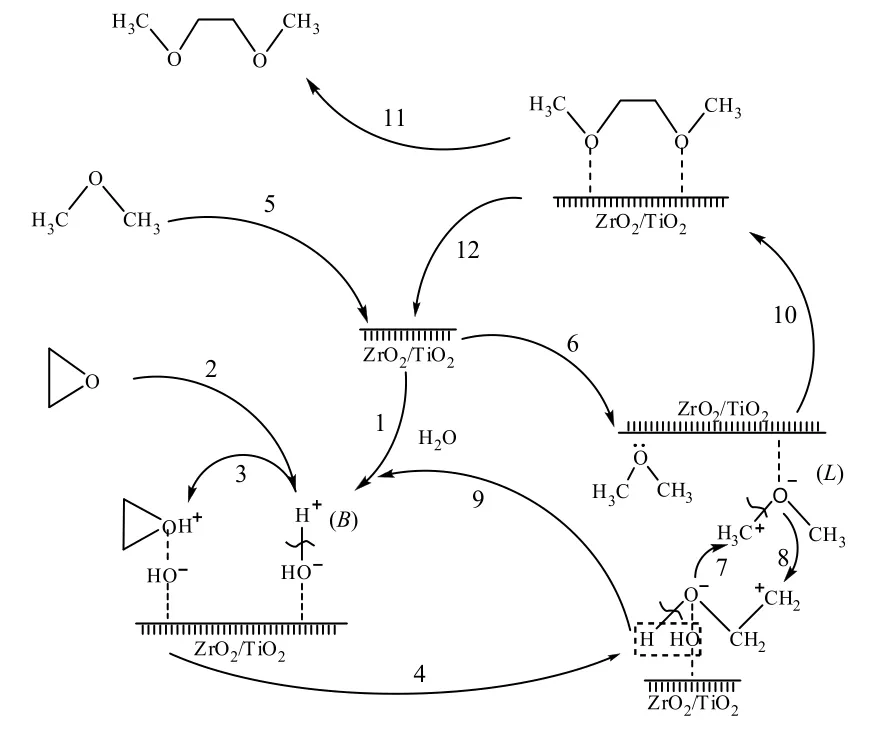
图5 环氧乙烷与二甲醚合成乙二醇二甲醚过程示意Fig.5 Diagram of synthesis of dimethoxyethane from ethylene and dimethyl ether
以25%ZrO2/TiO2为催化剂,在反应温度80 ℃,体系压力0.6 MPa,空速3 600 h-1,二甲醚与环氧乙烷物质的量之比为3:1,在原料中加入0.0,1.0和10.0 µL/L体积分量甲醇,在线检测产物中乙二醇二甲醚含量,验证催化剂表面主反应过程,结果如表6所示。由表可知,不加入甲醇,环氧乙烷转化率与乙二醇二甲醚收率均低;甲醇加入量少时,环氧乙烷转化率提高,乙二醇二甲醚收率提高的幅度更大;提高甲醇加入量,环氧乙烷转化率则出现降低,乙二醇二甲醚的收率降低的幅度大。原料中不加甲醇,由于催化剂自带B酸中心密度低,环氧乙烷在B酸中心吸附开环为控制过程(R3和R4),所以环氧乙烷开环速率慢而表现为转化率与收率低。原料中加入少量甲醇,甲醇缩合产生微量水在催化剂表面活性中心极化,形成与L酸中心密度匹配的B酸中心,环氧乙烷吸附开环速率(R3和R4)与二甲醚吸附极化断裂速率(R6)相当,因而表现为环氧乙烷转化率与乙二醇二甲醚收率高。甲醇量大,缩合生成二甲醚时产生的水分多,L酸中心转换为B酸的数量多,导致B酸与L酸中心密度失衡,二甲醚吸附极化断裂过程为控制步骤(R6),所以环氧乙烷转化率与乙二醇二甲醚收率低。推测的反应过程与上述实验现象吻合。
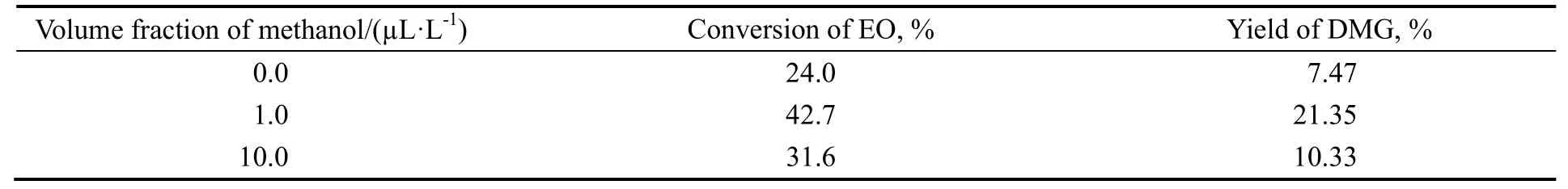
表6 微量甲醇对催化剂性能的影响Table 6 Effect of trace methanol on catalytic performance
3 结 论
采用共沉淀法制备复合催化剂ZrO2/TiO2,当ZrO2质量分数为25%,催化剂具有较好的活性,其最可几孔径分布为7.5 nm,NH3的吸附酸量为670 µmol/g,表面具有适宜的B酸与L酸分布,并通过微量水分的转移实现B酸与L酸的转换。在二甲醚与环氧乙烷物质的量之比为3,气时空速1 800 h-1,反应温度为80 ℃和压力为0.6 MPa的条件下,催化剂连续运行720 h,环氧乙烷转化率99.7%,乙二醇二甲醚选择性为71.7%。该催化剂表现出较高的低温活性和良好的稳定性,具有工业应用前景。
[1]Sun S, Xu Q, Lan G, et al.Solubility of dilute sulfur dioxide in binary mixtures of ethylene glycol and tetraethylene glycol dimethyl ether[J].Fluid Phase Equilibria, 2015, 394: 12-18.
[2]Lee B.Solubility of carbon dioxide in poly(ethylene glycol) dimethyl ether[J].Korean Chemical Engineering Research, 2017, 55(2): 230-236.
[3]刘云霞.聚合物电解液添加剂对锂硫电池性能的影响[J].电源技术, 2016, 40(6): 1194-1195.Liu Y X.Effect of polymer electrolyte additive on properties of Li-S cell[J].Chinese Journal of Power Sources, 2016, 40(6): 1194-1195.
[4]莫周胜, 秦玉才, 张晓彤, 等.环己烯对噻吩在CuY分子筛上吸附的影响机制[J].物理化学学报, 2017, 33(6): 1236-1241.Mo Zhousheng, Qin Yucai, Zhang Xiaotong, et al.Influencing mechanism of cyclohexene on thiophene adsorption over CuY zeolites[J].Acta Physico-Chimica Sinica, 2017, 33(6): 1236-1241.
[5]Aponte Y, Lasa H.The effect of Zn on offretite zeolite properties: acidic characterizations and NH3-TPD desorption models[J].Ind Eng Chem Res, 2017, 56(8): 1948-1960.
[6]于清跃, 王监宗, 于 荟, 等.ZrO2-TiO2复合催化剂制备及其催化合成柠檬酸三丁酯[J].过程工程学报, 2016, 16(5): 86-90.Yu Qingyue, Wang Jianzong, Yu Hui, et al.Preparation of ZrO2-TiO2composite catalyst and its function for synthesis of tributyl citrate[J].The Chinese Journal of Process Engineering, 2016, 16(5): 86-90.
[7]徐文娟.乙二醇二甲醚的合成工艺研究[D].南京: 南京林业大学化工学院, 2010.
[8]顾建财.乙二醇二甲醚绿色合成工艺研究[D].南京: 南京林业大学化工学院, 2012.
[9]Liu B, Wang Z, Zhu Q, et al.Performance of Pt/ZrO2-TiO2-Al2O3and coke deposition during methylcyclohexane catalytic cracking[J].Fuel, 2017, 200: 387-394.
[10]Yi J, Qin L, Li X, et al.Influence of adding Zr0.5Ti0.5O2on the performance of super critical cracking catalyst for RP-3[J].Acta Physico-chimica Sinica, 2013, 29(10): 2255-2262.
[11]Fan M, Hu S, Ren B, et al.Synthesis of nanocomposite ZrO2/TiO2prepared by different templates and photocatalytic properties for the photodegradation of rhodamine B[J].Powder Technol, 2013, 235: 27-32.
[12]Kaluza L.Activity of transition metal sulfides supported on Al2O3, TiO2and ZrO2in the parallel hydrodesulfurization of 1-benzothiophene and hydrogenation of 1-methyl-cyclohex-1-ene[J].Reaction Kinetics, Mechanisms and Catalysis, 2015, 114(2): 781-794.
[13]李 哲, 汪 莉, 贠 丽, 等.CrMnOx/TiO2-ZrO2低温选择催化还原NO的活性及抗毒性能[J].工程科学学报, 2015, 38(7): 1049-1056.Li Zhe, Wang Li, Yun Li, et al.Activity and antitoxic properties of Cr-MnOx/TiO2-ZrO2for low-temperature selective catalytic reduction of NO[J].Chinese Journal of Engineering, 2015, 38(7): 1049-1056.
[14]Yan M, Ding A, Zhuang Q, et al.On the acid-dealumination of USY zeolite: a solid state NMR investigation[J].J Mol Catal A, 2003,194: 153-167.
[15]于清跃.环氧乙烷醚化反应及CNT增强环氧树脂性能研究[D].南京: 南京林业大学化工学院, 2017.
One-Step Synthesis of Dimethoxyethane over ZrO2/TiO2Catalyst
Yu Qingyue1,3, Sun Fei2, Zhu Xinbao3
1.College of Chemical & Material Nanjing Polytechnic Institute, Nanjing 210048, China;
2.Nanjing Anding Chemical Science & Technology Ltd, Nanjing 210048, China;
3.College of Chemical Engineering Nanjing Forestry University, Nanjing 210037, China
The catalyst ZrO2/TiO2was prepared by co-precipitation method.The catalytic performance of the one-step synthesis of dimethoxyethane using dimethyl ether (DME) and ethylene oxide (EO) as raw material was investigated in the fixed bed reactor.The catalysts were characterized by X-ray diffraction(XRD), nitrogen physical adsorption (BET), ammonia chemical adsorption and ammonia Fourier transform infrared (NH3-FTIR).The results showed that when the mass fraction of ZrO2was 25%, the catalyst exhibited amorphous morphology, and the maximum pore size distribution was 7.5 nm, NH3adsorption acid content was 670 µmol/g, and the B acid and L acid distributed on its surface.Under the conditions of reaction temperature 80 ℃, reaction pressure 0.6 MPa, the mass ratio of DME to EO 3, gas hourly space velocity(GHSV) 1 800.0 h-1, conversion of EO was 100.0% and selectivity of DMXG (ethylene glycol dimethyl ether,diethylene glycol dimethyl ether, polyethylene glycol dimethyl ether) was above 89.5%.When the catalyst was continuously used for 720 h, the conversion of EO was 99.7 % and the selectivity of DMG was 71.7 %.
ethylene oxide; dimethyl ether; dimethoxyethane; acid catalysis
O643.38
A
1001—7631 ( 2017 ) 04—0312—07
10.11730/j.issn.1001-7631.2017.04.0312.07
2017-05-12;
2017-07-14。
于清跃(1970—),男,博士,副教授。E-mail: qingyueyunj@126.com。
江苏高校科研产业化项目(JHZD2012-15);江苏“青蓝工程”基金;江苏高校校长与骨干教师境外研修基金(2013)。

