PDZK1敲除对小鼠肝脏胆固醇代谢和胆囊结石形成影响的实验研究
焦龙 孙海东 陈超波 何川琦 王启晗 赵刚 韩天权 胡海 蒋兆彦
·论 著·(胆道外科专题)
PDZK1敲除对小鼠肝脏胆固醇代谢和胆囊结石形成影响的实验研究
焦龙 孙海东 陈超波 何川琦 王启晗 赵刚 韩天权 胡海 蒋兆彦
目的探讨敲除PDZK1(Postsynaptic density-95,disks-large,ZO-1-domain K1,PDZK1)基因对小鼠肝脏胆固醇代谢调节和胆囊结石形成的影响。方法雄性成年PDZK1基因敲除小鼠(PDZK1 knockout,KO组)和野生型小鼠(wild type,WT组),每组各10只,以成石饲料分别喂养4周,观察胆囊成石情况,并收集肝脏和胆囊组织。采用蛋白印迹法测定肝脏PDZK1和清道夫受体B族1型(scavenger receptor B type 1,SRB1)表达。采用胆总管插管收集肝胆汁,测定胆汁分泌率和胆汁胆固醇含量。采用试剂盒酶法测定胆囊胆汁成分并计算胆汁胆固醇饱和指数(cholesterol saturation index,CSI)。以实时定量PCR检测肝脏脂质代谢相关基因的mRNA表达。结果成石饲料喂养4周后,WT组小鼠全部成石(10/10),KO组小鼠则为40%(4/10)成石。两组小鼠肝胆汁分泌率差异无统计学意义,但KO组小鼠肝胆汁胆固醇含量显著降低(P<0.05),胆汁酸含量增加(P<0.05),且CSI降低(P<0.05)。KO组小鼠肝脏SRB1蛋白表达降低(P<0.05),甾醇氧-酰基转移酶基因1/2 mRNA表达降低(P<0.05),而肝型脂肪酸结合蛋白1和胆汁酸转运相关蛋白(ATP结合盒b11)表达则显著增加(P<0.05)。结论PDZK1影响SRB1在小鼠肝脏中表达,降低对高密度脂蛋白胆固醇摄取,减少胆汁胆固醇分泌,继而降低胆囊结石形成。
胆固醇结石; 肝脏; PDZK1; 清道夫受体B族1型
胆固醇结石病(胆石病)是一种常见病。在我国,其发病率逐年攀升。近期对上海地区的流行病学调查显示其发病率达到13%[1]。目前对于胆石病的有效治疗仍以手术为主。当前临床胆囊结石的类型主要为胆固醇结石,探索其发生的病理生理异常机制对于胆石病的防治具有重要意义。
从上世纪七八十年代以来的逐步研究显示,胆石病与胆汁胆固醇过饱和[2]继而胆固醇结晶形成并逐渐进展成结石有关。此外,胆汁成核异常[3]和胆囊收缩能力减弱[4]对于胆石形成具有促进作用。胆固醇过饱和被认为是胆石病发生的必要条件。肝脏是胆固醇代谢的重要器官,包括胆固醇合成、摄取血浆脂蛋白胆固醇以及向胆汁分泌排出胆固醇等过程。机体血浆中60%的高密度脂蛋白(high density lipoprotein,HDL)胆固醇(HDL-C)由肝脏摄取经胆道排泄清除[5]。多项研究结果显示,HDL-C是胆汁中胆固醇的主要来源[5]。清道夫受体B1型(scavenger receptor B type 1,SRB1)是肝细胞膜上的HDL受体,多在肝细胞的基底膜表达[6-8]。肝细胞SRB1表达增加可能是胆汁胆固醇过饱和及胆结石形成的重要机制[6-8]。我们测定胆石病病人肝脏组织发现SRB1蛋白表达增加,且与胆汁胆固醇含量相关[9],进一步证实了肝脏SRB1表达对胆石病发生的重要作用。SRB1在肝脏的表达受转录后调节,特别是其在肝细胞膜表面表达,由PDZ domain-containing 1(PDZK1)作为适配器蛋白调控完成。PDZK1的相对分子质量为70 000,因其序列中存在4个PDZ(取自具有类似结构的3个蛋白质:Pds95、Dlg和Zo-1的首字母缩写)蛋白作用区域而被命名[10-11]。PDZK1 通过与SRB1蛋白羧基端的特定序列相结合,与SRB1 相互作用,维持其在肝细胞膜表面的正常表达和受体摄取功能[12]。
我们先前的研究采用腺病毒载体使小鼠肝脏过表达PDZK1基因发现肝细胞膜SRB1蛋白表达上调;相反,干扰PDZK1则降低细胞膜上SRB1的表达[13],证实了PDZK1对于小鼠肝细胞膜SRB1表达的调节作用。在此基础上,本课题旨在研究成石饲料喂养对PDZK1基因敲除(knockout,KO)小鼠肝脏胆固醇代谢和胆汁胆固醇成分的调节作用及其对胆囊结石形成的影响。
材料与方法
一、实验动物及过程
PDZK1基因敲除小鼠采用杂合子×杂合子配种(PDZK1 +/-小鼠购于美国Jackson实验室)获得PDZK1 -/- 小鼠(KO)及其同胞对野生型(+/+,wild type,WT)雄性小鼠各10只(基因型鉴定见图1)。8周龄开始给予成石饲料(含1.25%胆固醇和0.5%胆酸,购自南通特洛非饲料科技有限公司)喂养4周。处死前,小鼠禁食过夜,不禁水。采用戊巴比妥(4.5 mg/100 g体重)腹腔注射麻醉,眶周静脉取血,离心取血清-80°C保存。采用腹部正中切口,暴露胆囊,观察有无结石,结扎胆囊管切除胆囊于液氮冻存。采集肝脏组织冻于-80 ℃保存至检测。
二、肝胆汁分泌率测定
WT 和KO组各5只小鼠在LD饲料喂养第28天行胆总管插管测定肝胆汁分泌率。术前禁食12 h,不禁水。采用戊巴比妥(4.5 mg/100 g体重)腹腔注射麻醉,固定于解剖台。采用腹部正中切口,暴露胆囊、胆总管,观察胆囊有无结石并结扎胆囊管。将胆总管下端用丝线结扎,用眼科剪在胆总管中段剪开一个小口,沿此切口小心地将导管插入胆总管中并结扎固定,用台灯照射保持小鼠体温。插管另一端连接0.5 ml EP管,采用重力作用收集1 h肝胆汁,计算胆汁分泌率[以μl·g-1(体重)·h-1表示],收集到的肝胆汁冻于-80 ℃保存至检测。
三、血清生化分析和胆汁脂质成分测定
血清总胆固醇(total cholesterol,TC)、三酰甘油(TG)、HDL-C和低密度脂蛋白(low density lipo-protein,LDL)胆固醇(LDL-C)以及丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)和碱性磷酸酶(AKP)均采用自动生化仪测定。
肝胆汁和胆囊胆汁中胆固醇含量采用胆固醇试剂盒(德国罗氏公司)测定。胆囊胆汁胆汁酸含量和磷脂含量经甲醇稀释后分别采用胆汁酸试剂盒(上海执诚生物科技有限公司)和磷脂试剂盒(北京伊普瑞斯公司,WAKO 296-63801)测定。采用Carey表计算胆囊胆汁胆固醇饱和指数(cholesterol saturation index,CSI)[14]。
四、蛋白印迹法
提取小鼠肝脏总蛋白,采用BCA蛋白浓度测定试剂盒测定蛋白浓度。每个样品50μg蛋白经10%的聚丙烯酰氨凝胶电泳分离、转膜后,采用5%的牛血清白蛋白封闭2 h,分别以一抗(SRB1,PDZK1抗体:英国Abcam公司;内参GAPDH:美国Proteintech公司)4 ℃过夜,洗膜后再用二抗(LI-COR公司)孵育2 h。采用蛋白印迹成像仪扫描成像。蛋白表达量采用灰度扫描测定,以GAPDH作为上样内参,计算目标蛋白相对表达量。
五、实时定量PCR
50 mg小鼠肝脏组织采用Trizol试剂(美国Life Technologies公司)提取总RNA。1 μg RNA采用逆转录试剂盒(美国Applied Biosystems公司,No.4368814)合成cDNA后用去离子水稀释10倍。采用ABI 7900定量PCR仪进行目的基因检测,以GAPDH作为内参。采用Delta CT法计算目的基因的相对表达量。
六、统计学分析
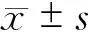
结 果
一、胆囊成石情况
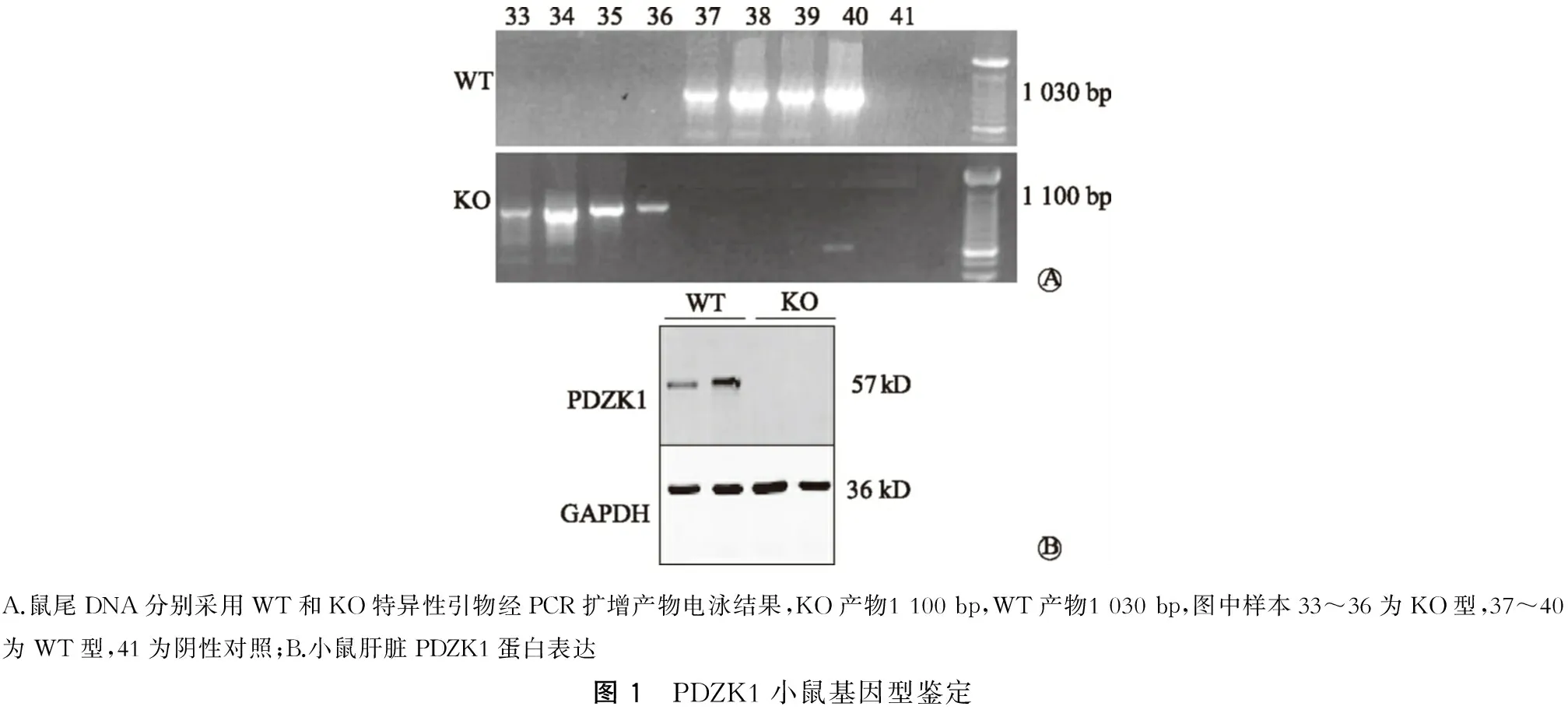
成石饲料喂养4周,WT小鼠全部成石,成石率100%(10/10),而KO小鼠仅4只成石,成石率40%(4/10)(图2)。
二、血脂及肝功能改变
如表1所示,PDZK1 KO小鼠血清TC和HDL-C明显高于WT小鼠(P<0.05),LDL-C、TG含量两组间差异无统计学意义。肝功能指标ALT、AST和AKP两组间差异均无统计学意义。
三、肝脏SRB1蛋白表达
KO小鼠,肝脏无PDZK1表达(图1B),进一步确认了PDZK1表达丧失。KO小鼠肝脏SRB1蛋白表达也较WT小鼠显著降低,P<0.05(图3)。
A.鼠尾DNA分别采用WT和KO特异性引物经PCR扩增产物电泳结果,KO产物1100bp,WT产物1030bp,图中样本33~36为KO型,37~40为WT型,41为阴性对照;B.小鼠肝脏PDZK1蛋白表达图1 PDZK1小鼠基因型鉴定
A.WT;B.KO图2 成石饲料喂养4周WT和KO小鼠胆囊结石情况比较

表1 两组小鼠血脂含量及肝功能比较

A.WesternBlot图;B.两组间SRB1蛋白相对表达量;经LD喂养4周后,PDZK1KO肝脏SRB1蛋白相对表达量显著低于WT组,两组比较*P<0.05图3 肝脏SRB1蛋白表达比较
四、胆汁脂质含量比较
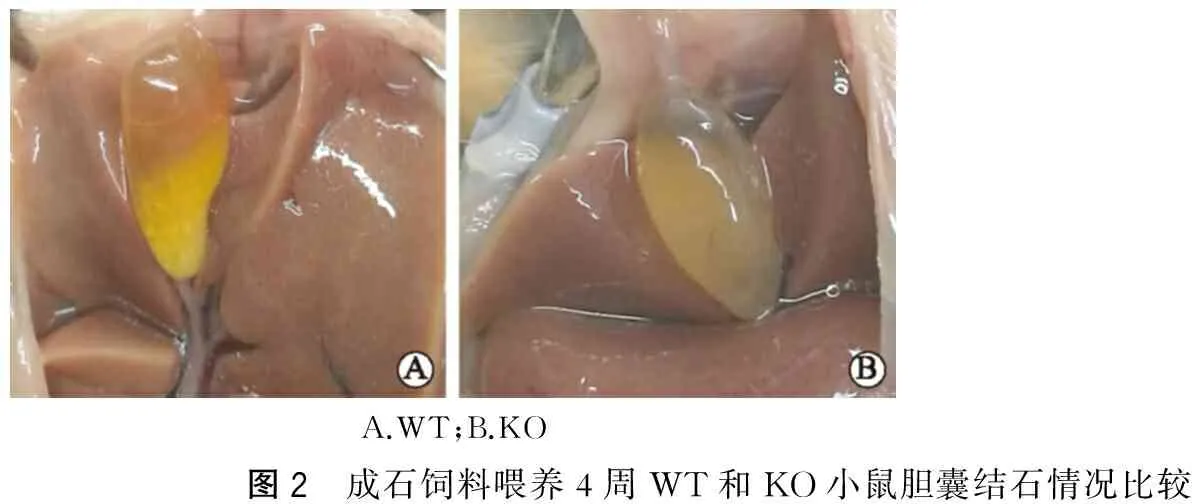
1 h肝脏胆汁分泌率在KO组为(2.82±0.57)μl·g-1·h-1,WT组为(3.80±0.49) μl·g-1·h-1,二者差异无统计学意义,P>0.05(图4A)。但肝胆汁胆固醇含量在 KO小鼠为(3.64±1.11) mmol·g-1·h-1,显著低于WT小鼠的(10.93±2.51) mmol·g-1·h-1,P<0.05(图4B),提示KO小鼠肝脏向胆汁中分泌胆固醇量降低。
WT小鼠胆囊胆汁中胆固醇含量(百分比)显著高于KO小鼠,P<0.05;胆汁酸含量则KO小鼠明显高于WT小鼠,P<0.05;磷脂含量在两组间无明显差异(图4C)。WT小鼠胆汁CSI显著高于KO小鼠,P<0.05(图4D)。
A.肝胆汁分泌率;B.肝胆汁胆固醇含量;C.胆囊胆汁成分;D.胆固醇饱和指数;两组比较*P<0.05图4 PDZK1WT和KO小鼠肝胆汁分泌率及胆汁脂质含量
五、肝脏脂质代谢相关基因的表达差异
甾醇氧-酰基转移酶1和2(sterol O-acyl transferase,Soat1/2)在内质网上表达,其作用是将细胞内游离胆固醇合成为胆固醇酯,两者基因表达在WT小鼠均显著高于KO小鼠,P<0.05(图5)。KO小鼠SRB1表达较WT小鼠降低,P<0.05。KO小鼠,Fabp1表达则显著升高,P<0.05,胆汁酸转运蛋白ATP结合盒B11(ATP binding cassette B11,Abcb11)也较WT小鼠明显升高(P<0.05)。其他基因如胆小管侧膜胆固醇转运蛋白Abcg5/g8、低密度脂蛋白受体(LDL receptor,LDL-R)、胆汁酸合成限速酶--胆固醇7α羟化酶(cholesterol 7α-hydroxylase,Cyp7α1)以及磷脂转运蛋白Abcb4等基因表达在两组小鼠间无明显差异。
讨 论
本研究发现:①PDZK1基因敲除小鼠,肝脏SRB1蛋白表达降低(图3),导致血浆HDL-C含量升高(表1);②成石饲料喂养下,PDZK1基因敲除小鼠,肝脏向胆汁分泌胆固醇减少(图4),胆囊胆汁胆固醇含量和CSI降低(图4),成石率减少(图2)。
SRB1是第1个在分子水平上被确认的高密度脂蛋白受体,具有509个氨基酸,是完整的跨膜糖蛋白,主要在肝脏、胃肠道和产固醇类器官表达[15]。SRB1在HDL携带外周组织胆固醇向肝脏转运并经胆道排泄过程中发挥重要作用,该过程也被称为“胆固醇逆向转运”[16]。SRB1在高尔基体合成后转运到肝细胞膜表达,需要配体连接蛋白 PDZK1参与[17]。PDZK1由519个氨基酸组成,除了肝细胞,在肾、胰腺、肝、胃肠道和肾上腺皮质上皮细胞以及内皮细胞[18]均有表达。PDZK1通过对SRB1的调节作用影响其对HDL代谢。我们之前采用腺病毒RNA干扰研究发现,干扰小鼠PDZK1基因表达可使肝细胞膜SRB1蛋白表达显著降低[13]。在PDZK1敲除小鼠,肝脏SRB1蛋白表达则特异性的下降95%,小肠SRB1蛋白表达也降低约50%[19]。本研究结果也进一步证实了上述发现(图3)。Fuchs等[20]报道,普通小鼠成石饲料喂养,肝脏SRB1表达增加。我们发现,成石饲料无法上调PDZK1 KO小鼠肝脏SRB1表达,其SRB1相对表达量较WT降低约93.35%(0.05比0.79)。这可能是由于丧失PDZK1基因使得SRB1蛋白无法在细胞膜表达而被降解所致;另一方面PDZK1可能具有抵抗SRB1被蛋白降解的作用[19]。而在其他产类固醇激素组织,SRB1蛋白表达水平则不受影响,说明PDZK1的调控作用具有组织特异性(尤其是肝脏)[15]。由于缺失PDZK1所致肝脏细胞膜SRB1表达降低,导致HDL与SRB1结合减少,影响了肝细胞对血浆HDL-C摄入,所以血浆HDL-C含量增加[21],我们的观察结果与之一致(表1)。PDZK1对肝脏SRB1的特异性调节影响HDL的表达作用就好像常染色体隐性遗传高胆固醇血症主要受LDL受体激动的调节[19]。
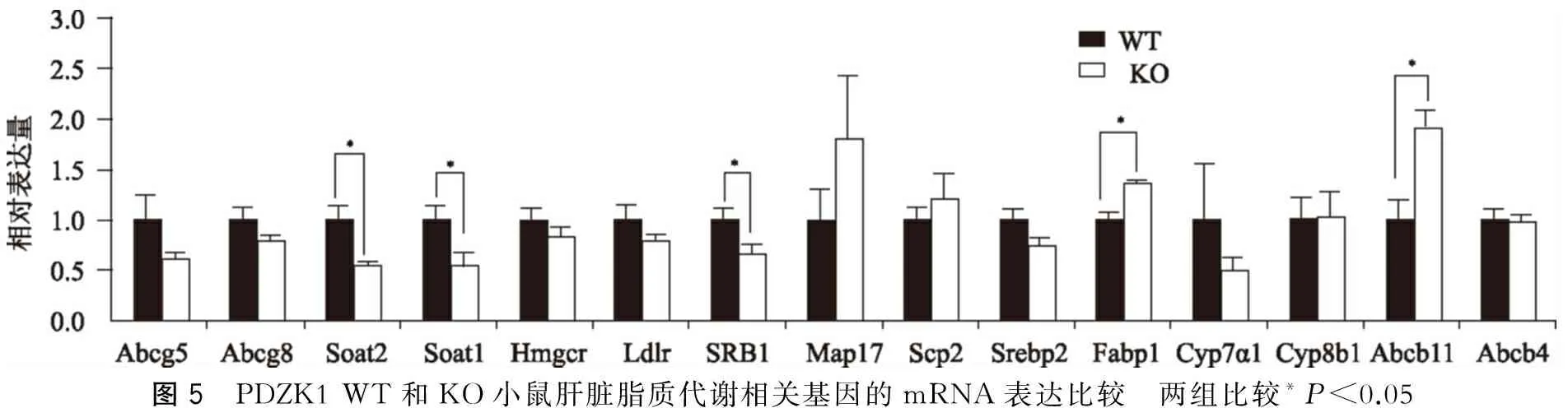
图5 PDZK1WT和KO小鼠肝脏脂质代谢相关基因的mRNA表达比较 两组比较*P<0.05
胆囊结石形成与胆汁胆固醇过饱和密切相关,而导致后者的原因主要是肝脏摄入过多外源性胆固醇并经胆小管侧膜胆固醇转运蛋白ABCG5/G8分泌到胆汁中有关。ABCG5/G8促进向胆汁中胆固醇分泌及其导致胆石形成在小鼠[22-24]以及人体[9]均有报道证实。此外,多项研究显示,胆汁中胆固醇主要来源于血浆HDL-C。Schwartz等[25]最早报道,HDL来源的胆固醇优先分泌到人胆汁中。更多的小鼠实验进一步证实,当肝脏HDL受体SRB1缺失,胆汁胆固醇含量会降低[7];相反,Kozarsky等[6]证实,过表达SRB1则降低血浆HDL含量,并升高胆汁胆固醇含量。这些研究均表明,SRB1在肝细胞表面表达及其对血浆HDL-C摄取的功能是调节胆汁胆固醇的重要因素。PDZK1作为目前发现调节SRB1在肝细胞表面表达的重要蛋白,其对于HDL和胆汁胆固醇代谢也具有重要作用。有趣的是,我们发现,敲除小鼠PDZK1,抑制肝细胞SRB1表达,具有降低肝脏向胆汁分泌胆固醇的作用,进而使胆囊胆汁胆固醇饱和度降低(图4),并减少结石的形成(图2)。丧失PDZK1并不改变肝细胞胆小管侧膜胆固醇转运蛋白Abcg5/g8的表达,这说明KO小鼠肝胆汁胆固醇含量降低源于肝细胞经HDL-C摄取降低,而非肝细胞向胆管分泌降低所致。该研究结果也再次证实了HDL-C在参与胆石形成中的重要作用。
然而,敲除PDZK1并未完全抑制小鼠结石形成,这可能与下列因素有关:①肝细胞表面SRB1表达并未完全丧失,残存的受体仍具有部分HDL摄入功能。②经其他受体途径摄入的胆固醇如Ldlr进入肝细胞并被导向胆汁分泌。我们的结果显示两个基因型小鼠肝脏Ldlr表达量是相似的。③PDZK1敲除并不改变小鼠胆汁胆汁酸分泌,胆汁酸通过其亲脂性与磷脂形成的混合微粒对细胞膜上胆固醇的直接溶解作用进入胆汁也具有部分代偿作用。上述途径可能在一定程度上替代了PDZK1敲除的影响。这与SRB1敲除小鼠无法抑制结石形成的结果比较类似[26]。
综上所述,本研究结果表明,PDZK1通过影响肝脏SRB1表达,具有调节血浆HDL代谢和胆汁胆固醇含量的作用。敲除PDZK1基因在一定程度上能减少小鼠结石形成。
1 蒋兆彦,吴健,韩天权,等.胆固醇结石病防治研究的再发展.外科理论与实践,2015,20:108-111.
2 Admirand WH,Small DM.The physicochemical basis of cholesterol gallstone formation in man.J Clin Invest,1968,47:1043-1052.DOI:10.1172/JCI105794.
3 Holan KR,Holzbach RT,Hermann RE,et al.Nucleation time:a key factor in the pathogenesis of cholesterol gallstone disease.Gastroenterology,1979,77:611-617.
4 Miyasaka K,Takata Y,Funakoshi A.Association of cholecystokinin A receptor gene polymorphism with cholelithiasis and the molecular mechanisms of this polymorphism.J Gastroenterol,2002,37:102-106.
5 Trigatti B,Rigotti A,Krieger M.The role of the high density lipoprotein receptor SR-BI in cholesterol metabolism.Curr Opin Lipidol,2000,11:123-131.
6 Kozarsky KF,Donahee MH,Rigotti A,et al.Overexpression of the HDL receptor SR-BI alters plasma HDL and bile cholesterol levels.Nature,1997,387:414-417.DOI:10.1038/387414a0.
7 Fluiter K,van der Westhuijzen DR,van Berkel TJ.In vivo regulation of scavenger receptor BI and the selective uptake of high density lipoprotein cholesteryl esters in rat liver parenchymal and Kupffer cells.J Biol Chem,1998,273:8434-8438.
8 Mardones P,Quinones V,Amigo L,et al.Hepatic cholesterol and bile acid metabolism and intestinal cholesterol absorption in scavenger receptor class B type I-deficient mice.J Lipid Res,2001,42:170-180.
9 Jiang ZY,Parini P,Eggertsen G,et al.Increased expression of LXR alpha,ABCG5,ABCG8,and SR-BI in the liver from normolipidemic,nonobese Chinese gallstone patients.J Lipid Res,2008,49:464-472.DOI:10.1194/jlr.M700295-JLR200.
10Silver DL.A carboxyl-terminal PDZ-interacting domain of scavenger receptor B,type I is essential for cell surface expression in liver.J Biol Chem,2002,277:34042-34047.DOI:10.1074/jbc.M206584200.
11Silver DL,Tall AR.The cellular biology of scavenger receptor class B type I.Curr Opin Lipidol,2001,12:497-504.
12Ikemoto M,Arai H,Feng D,et al.Identification of a PDZ-domain-containing protein that interacts with the scavenger receptor class B type I.Proc Natl Acad Sci U S A,2000,97:6538-6543.DOI:10.1073/pnas.100114397.
13蔡强,吴健,蔡劬,等.PDZK1对成石喂养小鼠肝脏SRB1调节作用的研究.外科理论与实践,2015,20:412-417.
14Carey MC.Critical tables for calculating the cholesterol saturation of native bile.J Lipid Res,1978,19:945-955.
15Rigotti A,Miettinen H,Krieger M.The role of the high-density lipoprotein receptor SR-BI in the lipid metabolism of endocrine and other tissues.Endocr Rev,2003,24:357-387.DOI:10.1210/er.2001-0037.
16Glomset JA,Nichols AV,Norum KR,et al.Plasma lipoproteins in familial lecithin:cholesterol acyltransferase deficiency Furthe studies of very low and low density lipoprotein abnormalities.J Clin Invest,1973,52:1078-1092.DOI:10.1172/JCI107273.
17Trigatti BL.SR-B1 and PDZK1:partners in HDL regulation.Curr Opin Lipidol,2017,28:201-208.DOI:10.1097/MOL.0000000000000396.
18Kocher O,Krieger M.Role of the adaptor protein PDZK1 in controlling the HDL receptor SR-BI.Curr Opin Lipidol,2009,20:236-241.DOI:10.1097/MOL.0b013e32832aee82.
19Kocher O,Yesilaltay A,Cirovic C,et al.Targeted disruption of the PDZK1 gene in mice causes tissue-specific depletion of the high density lipoprotein receptor scavenger receptor class B type I and altered lipoprotein metabolism.J Biol Chem,2003,278:52820-52825.DOI:10.1074/jbc.M310482200.
20Fuchs M,Ivandic B,Müller O,et al.Biliary cholesterol hypersecretion in gallstone-susceptible mice is associated with hepatic up-regulation of the high-density lipoprotein receptor SRBI.Hepatology,2001,33:1451-1459.DOI:10.1053/jhep.2001.24373.
21Cohen JC,Kimmel M,Polanski A,et al.Molecular mechanisms of autosomal recessive hypercholesterolemia.Curr Opin Lipidol,2003,14:121-127.DOI:10.1097/01.mol.0000064044.68936.6a.
22Wittenburg H,Carey MC.Biliary cholesterol secretion by the twinned sterol half-transporters ABCG5 and ABCG8.J Clin Invest,2002,110:605-609.DOI:10.1172/JCI16548.
23Yu L,Hammer RE,Li-Hawkins J,et al.Disruption of Abcg5 and Abcg8 in mice reveals their crucial role in biliary cholesterol secretion.Proc Natl Acad Sci U S A,2002,99:16237- 16242.DOI:10.1073/pnas.252582399.
24Yu L,Li-Hawkins J,Hammer RE,et al.Overexpression of ABCG5 and ABCG8 promotes biliary cholesterol secretion and reduces fractional absorption of dietary cholesterol.J Clin Invest,2002,110:671-680.DOI:10.1172/JCI16001.
25Schwartz CC,Halloran LG,Vlahcevic ZR,et al.Preferential utilization of free cholesterol from high-density lipoproteins for biliary cholesterol secretion in man.Science,1978,200:62.
26Wang DQ,Carey MC.Susceptibility to murine cholesterol gallstone formation is not affected by partial disruption of the HDL receptor SR-BI.Biochim Biophys Acta,2002,1583:141-150.
EffectofPDZK1knockoutonhepaticcholesterolmetabolismandgallstoneformationinmice
JiaoLong*,SunHaidong,ChenChaobo,HeChuanqi,WangQihan,ZhaoGang,HanTianquan,HuHai,JiangZhaoyan.
*CenterofGallbladderDisease,ShanghaiEastHospital,InstituteofGallstoneDisease,TongjiUniversitySchoolofMedicine,Shanghai200120,China
JiangZhaoyan,Email:zhaoyanjiang@gmail.com;HuHai,Email:huhailc@sina.com
ObjectivePostsynaptic density-95,disks-large,ZO-1-domain K1 (PDZK1) is an adaptor which plays an important role in the expression of scavenger receptor B type 1 (SRB1) on the membrane of hepatocytes.This study aimed to investigate the influence of PDZK1 knockout (KO) on hepatic cholesterol metabolism and formation of gallstone in mice.MethodsAdult male PDZK1 KO and wild type (WT) mice (n=10/group) were fed on lithogenic diet (containing 1.25% cholesterol and 0.5% cholic acid) for 4 weeks.Liver and gallbladder were harvested.The expression of PDZK1 and SRB1 proteins was detected by Western blotting.Hepatic bile secretion rate and cholesterol content were measured by common bile duct cannulation for 1 h.Hepatic cholesterol and biliary composition were assayed by enzymatic kits and cholesterol saturation index (CSI) was calculated.The expression levels of hepatic genes involved in lipid metabolism were examined by quantitative real-time PCR.ResultsGallstone formed in all WT mice (100%,10/10) and 40% (4/10) in PDZK1 KO mice.No significant difference existed in the hepatic bile secretion rate between two groups.Cholesterol content in hepatic bile was lower in KO mice than in WT mice (P<0.05).As compared with WT mice,PDZK1 KO mice had decreased biliary cholesterol content (P<0.05),but increased bile acids (P<0.05).CSI was also lower in PDZK1 KO mice as well.Loss of PDZK1 decreased hepatic SRB1 protein expression (P<0.05).Hepatic mRNA expression of Soat1/2 was significantly lower in KO mice (P<0.05),while liver-type fatty acid binding protein 1 (L-Fabp1) and ATP binding cassette b11 (Abcb11) were significantly higher (P<0.05).ConclusionsOur results showed PDZK1 deficiency interfered with the expression of SRB1 on the membrane of hepatocytes,reduced uptake of cholesterol from high density lipoprotein and lower biliary cholesterol content,which might protect gallstone formation.
Cholesterol gallstone disease; Liver; Postsynaptic density-95,disks-large,ZO-1-domain K1; Scavenger receptor B type 1
国家自然科学基金(81570574;81570577;81070367)
200120 上海,同济大学附属上海市东方医院胆石病中心 同济大学医学院胆石病研究所(焦龙、何川琦、王启晗、赵刚、胡海、蒋兆彦);上海交通大学医学院附属瑞金医院外科 上海消化外科研究所(孙海东、韩天权);江苏省无锡市锡山人民医院(陈超波)
蒋兆彦,Email:zhaoyanjiang@gmail.com;胡海,Email:huhailc@sina.com
R657.4+2
A
10.3969/j.issn.1003-5591.2017.05.004
2017-06-12)

