胰岛素样生长因子ⅡmRNA结合蛋白3对胆囊癌迁移侵袭的影响
靳云鹏 包润发 胡云平 刘颖斌
·论 著·(胆道外科专题)
胰岛素样生长因子ⅡmRNA结合蛋白3对胆囊癌迁移侵袭的影响
靳云鹏 包润发 胡云平 刘颖斌
目的探究胰岛素样生长因子Ⅱ(insulin-like growth factor Ⅱ,IGF-Ⅱ)mRNA结合蛋白3(IGF2BP3)对胆囊癌迁移侵袭的作用。方法应用实时定量PCR(qRT-PCR)法检测23份胆囊癌组织和23份癌旁组织中IGF2BP3的表达水平;在胆囊癌细胞中利用小干扰RNA(siRNA)敲减目的基因IGF2BP3;Transwell迁移实验与带胶Transwell侵袭实验检测敲减IGF2BP3后对胆囊癌细胞迁移侵袭能力的影响;细胞免疫荧光法检测敲减IGF2BP3后上皮细胞间充质转化(epithelial mesenchymal transition ,EMT)相关蛋白表达水平变化。结果IGF2BP3在胆囊癌组织中高表达(P<0.05);与正常胆管上皮细胞比较,5株胆囊癌细胞系中IGF2BP3高表达;敲减IGF2BP3后,胆囊癌细胞系的迁移侵袭能力明显降低(P<0.0001);敲减IGF2BP3后EMT相关蛋白表达水平下调。结论IGF2BP3通过促进EMT,从而促进胆囊癌侵袭转移。
胆囊癌; 胰岛素样生长因子ⅡmRNA结合蛋白3; 上皮细胞间充质转化
胆囊癌是最常见的胆道系统恶性肿瘤,我国胆囊癌发病率约占同期胆道疾病的0.4%~3.8%,发病率居消化道肿瘤第7位[1-8],美国监测、流行病学和结果数据库(SEER)显示胆囊癌发病率约为2.5/10万[9]。虽然胆囊癌发病率低,但其早期诊断困难,肿瘤进展快,恶性程度高,早期易发生转移,所以其预后较差,5年生存率低于5%[10-11]。胆囊癌对放化疗不敏感[12],手术切除为其唯一有效的治疗方法[13],但其早期症状不典型,病人就诊时多处于中晚期,多发生了远处转移,失去了手术治疗的机会[14-15]。基于胆囊的毗邻及淋巴、血流引流等解剖特点,胆囊癌侵袭转移途径主要包括肝脏转移、经淋巴神经途径转移、胆管侵犯转移、邻近脏器的侵犯和腹腔播散转移、远处转移等途径[16]。而肿瘤的发生发展及其侵袭转移的过程,被认为是由于基因的改变而引起的,癌基因的突变及抑癌基因的失活在胆囊癌发生发展的过程中发挥了重要作用。因此研究肿瘤发生发展的基因层面,不仅有利于我们了解肿瘤发生发展过程中的分子结构基础,有利于胆囊癌的预防和早期诊断,同时也为以后的靶向治疗寻找可靠的分子靶点。
胰岛素样生长因子ⅡmRNA结合蛋白3(insulin-like growth factor 2 mRNA binding protein 3,IGF2BP3或IMP3)是胰岛素样生长因子ⅡmRNA结合蛋白家族中的一员。IGF2BP3在胰腺癌中最先被发现[17],研究发现其在多种癌症组织中高表达,如宫颈癌、肝癌、肺癌、结肠癌[18-20]等。IGF2BP3在癌组织中的高表达可能预示其在肿瘤发生过程中起到癌基因的作用。进一步研究发现IGF2BP3是IGFⅡmRNA的翻译激活子,通过依赖IGFⅡ而促进白血病细胞的增生。同时在多种癌症中,高表达的IGF2BP3也提示不良的预后。随着研究的深入,IGF2BP3在胃癌、结肠癌中被认为是一种特异的肿瘤标志物。因此其有助于肿瘤的筛查及早期诊断,是潜在的靶向治疗的“靶”。目前尚无IGF2BP3与胆囊癌的报道,本文主要研究IGF2BP3对胆囊癌迁移侵袭的作用。
材料与方法
一、材料及试剂
本文研究所涉及的胆囊癌组织(23份)及其癌旁组织(23份)均取自2012年1月至2013年12月入住我院的胆囊癌病人,其术后病理均证实为胆囊癌。本次实验均告知病人,并取得书面知情同意书。人正常胆管上皮细胞系HIBEC及人胆囊癌细胞系GBC-SD、SGC996、OCUG-1、EHGB-1购自中科院上海细胞研究所,NOZ购于日本大阪健康科学研究资源库。
二、细胞培养
人胆囊癌细胞株NOZ培养于含10%胎牛血清(Gibco)及1%青霉素/链霉素双抗(Gibco)的Williams’(Gibco)培养液中,人正常胆管上皮细胞系HIBEC、人胆囊癌细胞株GBC-SD、EHGB-1、OCUG-1于含10%胎牛血清及1%青霉素/链霉素双抗的DMEM高糖培养液(Gibco)中培养,SGC996培养于含10%胎牛血清及1%青霉素/链霉素双抗的1640培养液(Gibco)中。胆囊癌细胞及正常胆管上皮细胞常规培养于含5%二氧化碳、37 ℃、饱和湿度的培养箱中。
三、细胞转染
取对数生长期的胆囊癌细胞,经胰酶消化后接种至6孔板中,当细胞长至60%时,用opti-MEM分别孵育Lipofectamine2000(Invitrogen)及小干扰RNA(siRNA),静置5 min后将两者混合孵育20 min,将混合物加入6孔板中,6 h后换液,转染48 h提取RNA或进行相应的细胞试验。
四、RNA提取和定量PCR
TRIzol(Invitrogen)法提取组织及细胞总RNA,按照逆转录试剂盒说明书(Takara)将1 μg总RNA逆转录为cDNA,实时定量PCR(qRT-PCR)检测IGF2BP3在临床标本及各胆囊癌细胞系中的表达情况以及siRNA的敲减效率,GAPDH为内参。
五、Transwell小室迁移及侵袭实验
迁移实验用 Corning公司的0.8 μm孔径的 Transwell小室,侵袭实验用BD公司的0.8 μm孔径的铺胶 Transwell 侵袭小室,实验前将铺胶Transwell侵袭小室(BD)水化2 h。收集转染的细胞,胰酶消化重悬计数,调整浓度至1×105/ml,Transwell小室(Corning)及铺胶Transwell侵袭小室的上室加入200 μl细胞悬液,下室加入600 μl完全培养基。培养箱中培养24 h后取出,吸去上室及下室培养基,磷酸盐缓冲液(PBS)轻轻清洗,4%多聚甲醛固定15 min,0.1%结晶紫染色20 min,PBS清洗3遍,棉签擦去未穿过细胞,100倍光学显微镜下计数穿过细胞数,随机选取5个视野,所得5个数值取平均值用于统计。
六、细胞免疫荧光
收集转染后细胞,胰酶消化重悬,铺于24孔板中,待细胞贴壁后,吸去培养基,PBS清洗一次,4%多聚甲醛固定10 min,0.3%聚乙二醇辛基苯基醚(Triton X-100;Sigma)冰上破膜10 min,PBS清洗3遍,1%牛血清白蛋白(BSA)封闭液室温封闭1 h,一抗4°过夜,PBS清洗3遍,荧光二抗避光室温孵育1 h,PBS清洗3遍,DAPI染色液室温染色5 min,荧光显微镜拍照。
七、统计学方法
结 果
一、IGF2BP3在胆囊癌组织标本中的表达水平
首先,提取23对胆囊癌病人的癌与癌旁冰冻组织的总RNA,并逆转录成cDNA,qRT-PCR检测临床标本中IGF2BP3的mRNA水平,结果如图1所示,胆囊癌组织中IGF2BP3的表达量是癌旁组织的2.38倍,且差异具有统计学意义(P<0.05)。

图1 qRT-PCR检测23对胆囊癌和癌旁样本中IGF2BP3的表达情况
二、IGF2BP3在胆囊癌细胞系中的表达水平
收集对数生长期的胆囊癌细胞系NOZ、GBC-SD、SGC996、EHGB-1、OCUG-1细胞及正常胆管上皮细胞系HIBEC,提取细胞总RNA,逆转录为cDNA后,qRT-PCR检测IGF2BP3在各细胞系中的表达水平。结果如图2所示,以正常胆管上皮细胞HIBEC为参照,标准化后,HIBEC细胞IGF2BP3相对表达量为(1.000±0.056),NOZ细胞IGF2BP3相对表达量为(141.910±5.202),GBC-SD细胞IGF2BP3相对表达量为(258.032±8.590),SGC996细胞IGF2BP3相对表达量为(222.758±0.815),EHGB-1细胞IGF2BP3相对表达量为(180.140±8.141),OCUG-1细胞IGF2BP3相对表达量为(928.253±26.213),与正常胆管上皮细胞HIBEC比较,IGF2BP3在5株胆囊癌细胞中高表达,且在OCUG-1、GBC-SD中表达量相对较高。所以后续实验我们选取这两株胆囊癌细胞系进行相应的敲减实验。
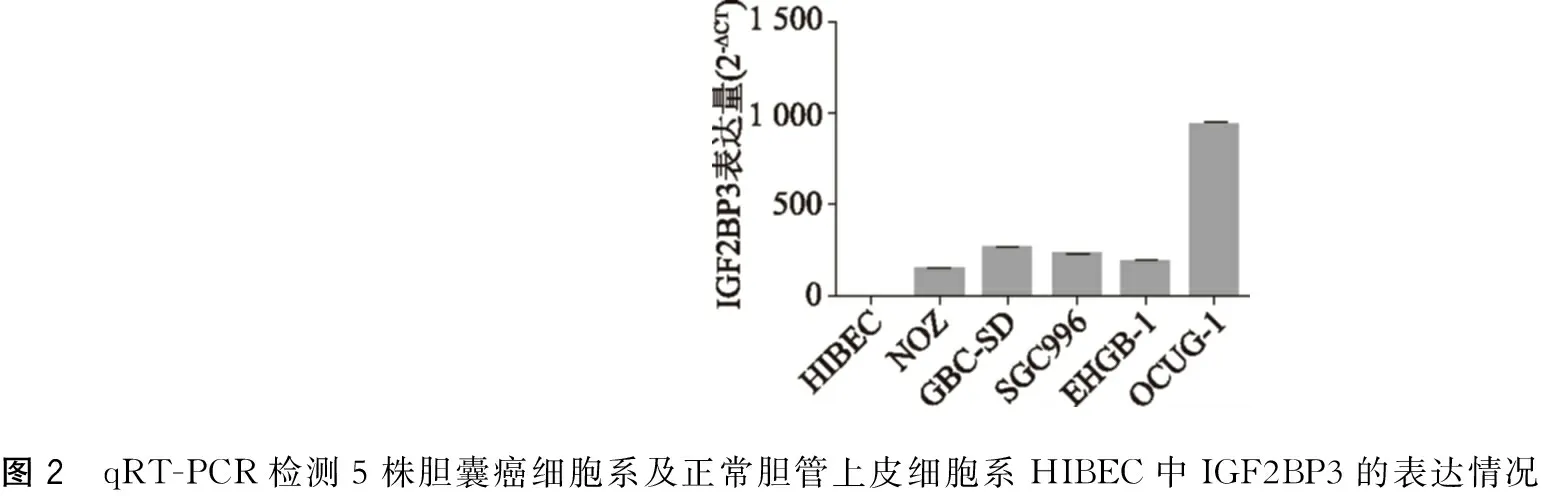
图2 qRT-PCR检测5株胆囊癌细胞系及正常胆管上皮细胞系HIBEC中IGF2BP3的表达情况
三、OCUG-1、GBC-SD细胞转染IGF2BP3 siRNA后敲减效率验证
将构建的3个干扰序列(siRNA1、siRNA2、siRNA3)及其对照序列(siNC)分别转染入 OCUG-1和GBC-SD细胞中,在转染48 h后提取细胞的总RNA,qRT-PCR 检验其敲减效率。结果如图3、图4所示:siRNA1、siRNA2和siRNA3均可有效敲减IGF2BP3的mRNA水平,但siRNA3在两株细胞系中敲减效率最高,达67.4%和90.2%,故将其用于后续实验。

**P<0.01,***P<0.001图3 OCUG-1转染siRNA后IGF2BP3mRNA水平变化
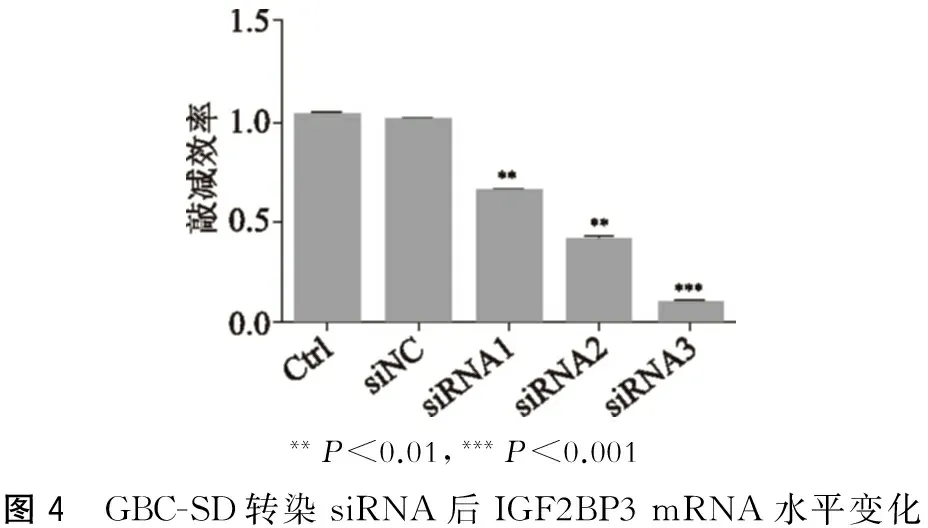
**P<0.01,***P<0.001图4 GBC-SD转染siRNA后IGF2BP3mRNA水平变化
四、敲减IGF2BP3后对细胞迁移侵袭能力影响
肿瘤细胞运动能力是影响其转移能力的因素之一,而不预铺基质胶Transwell迁移实验是目前最常用的检测细胞体外运动能力的方法之一[21]。如图5、图6所示,IGF2BP3-siRNA 组迁移到滤膜下表面的OCUG-1和GBC-SD细胞显著少于siNC组(均P<0.001),提示敲减IGF2BP3后胆囊癌细胞的迁移能力明显降低。预铺基质胶的 Transwell侵袭实验是模拟肿瘤细胞穿透基底膜的过程,在这个过程中除了细胞的运动能力外,肿瘤细胞分泌基质金属蛋白酶等降解基质胶才能顺利侵袭到膜下层,因此,在一定时间后,侵袭到膜下表面的细胞数越多则说明细胞的侵袭能力越强。如图5、图6所示,IGF2BP3-siRNA 组侵袭到滤膜下表面的OCUG-1和GBC-SD细胞显著少于siNC组(OCUG-1:P<0.001,GBC-SD:P<0.001),提示敲减IGF2BP3后胆囊癌细胞的侵袭能力明显降低。
五、敲减IGF2BP3后对上皮细胞间充质转化(epithelial mesenchymal transition,EMT)相关蛋白E-cadherin、N-cadherin蛋白水平影响

图5 迁移侵袭实验检测敲减IGF2BP3对OCUG-1细胞体外运动能力的影响(结晶紫染色,×100,***P<0.001)
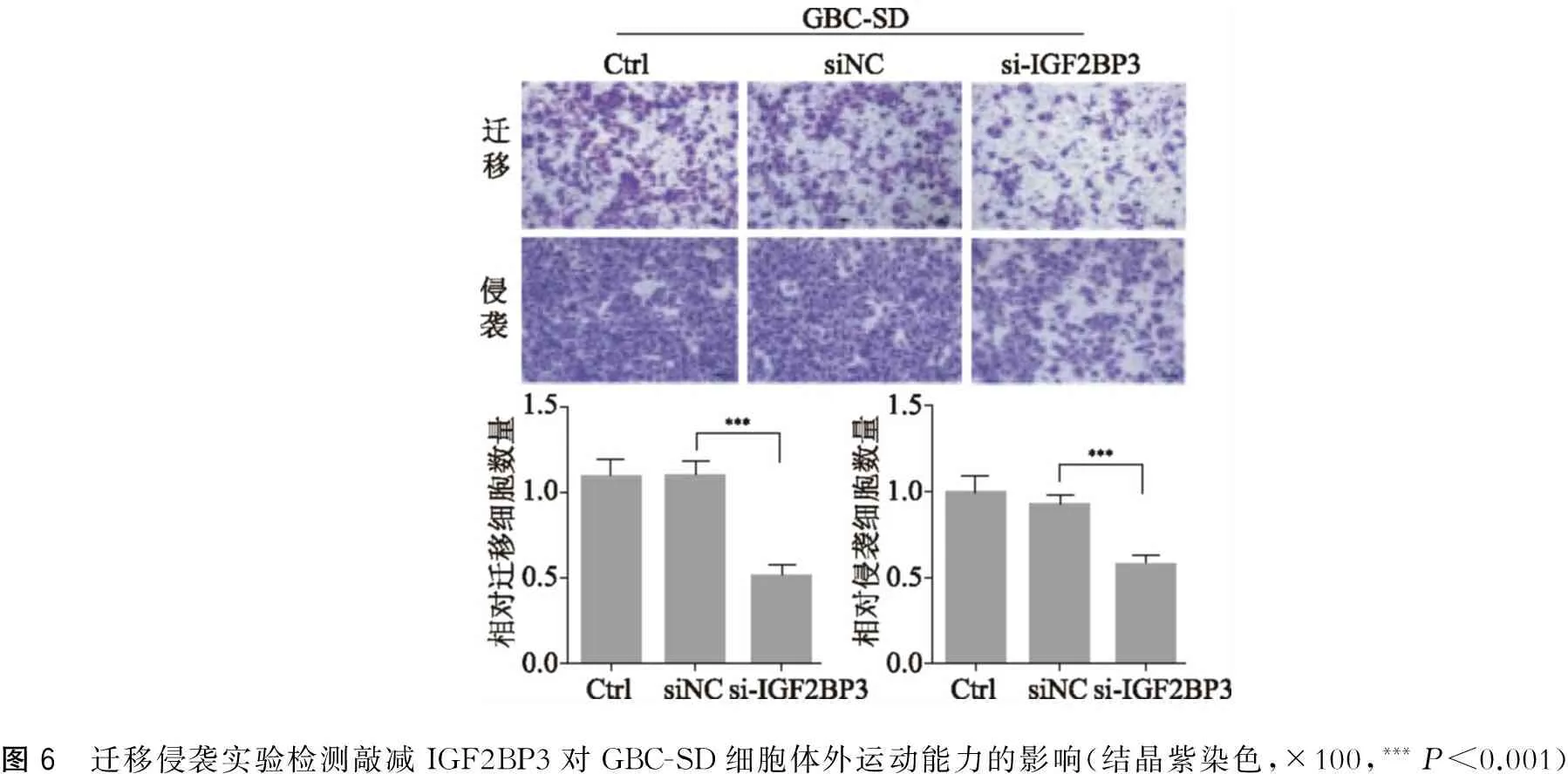
图6 迁移侵袭实验检测敲减IGF2BP3对GBC-SD细胞体外运动能力的影响(结晶紫染色,×100,***P<0.001)
如图7、图8免疫荧光结果显示,E-cadherin表达于细胞膜和细胞质内,大部分以细胞膜为主;N-cadherin表达于细胞膜和细胞质内,大部分以细胞质为主;敲减IGF2BP3后,GBC-SD细胞E-cadherin蛋白水平表达上调,N-cadherin蛋白水平表达下调。
讨 论
胆囊癌具有早期诊断困难、侵袭性高、手术切除率低、预后差等特点,对于无法手术切除以及术后复发的病人,有效的辅助治疗就显得格外重要,然而,胆囊癌对放化疗等常规肿瘤辅助治疗不敏感,因此寻找有效的治疗靶点对于改善胆囊癌病人的预后具有重要意义。IGF2BP3是胰岛素样生长因子ⅡmRNA结合蛋白家族中的一员,该家族被证实在RNA定位、转移及稳定性中发挥重要作用。该基因编码的蛋白对于肿瘤的发生发展具有重要作用。研究表明IGF2BP3在多种癌组织中高表达,并且与预后相关,在胃癌、结肠癌中被认为是一种特异的肿瘤标志物。已有研究表明,IGF2BP3主要通过激活mRNA从而促进肿瘤细胞的增殖;在乳腺癌细胞中,IGF2BP3可以增强肿瘤细胞的耐药性[22];同时也有文献报道,IGF2BP3可以稳定CD44、HMGA2 mRNA从而发挥癌基因的作用。研究还发现,IGF2BP3通过促进EIF4E-BP2 mRNA的降解从而调控癌基因eIF4E的表达[23]。
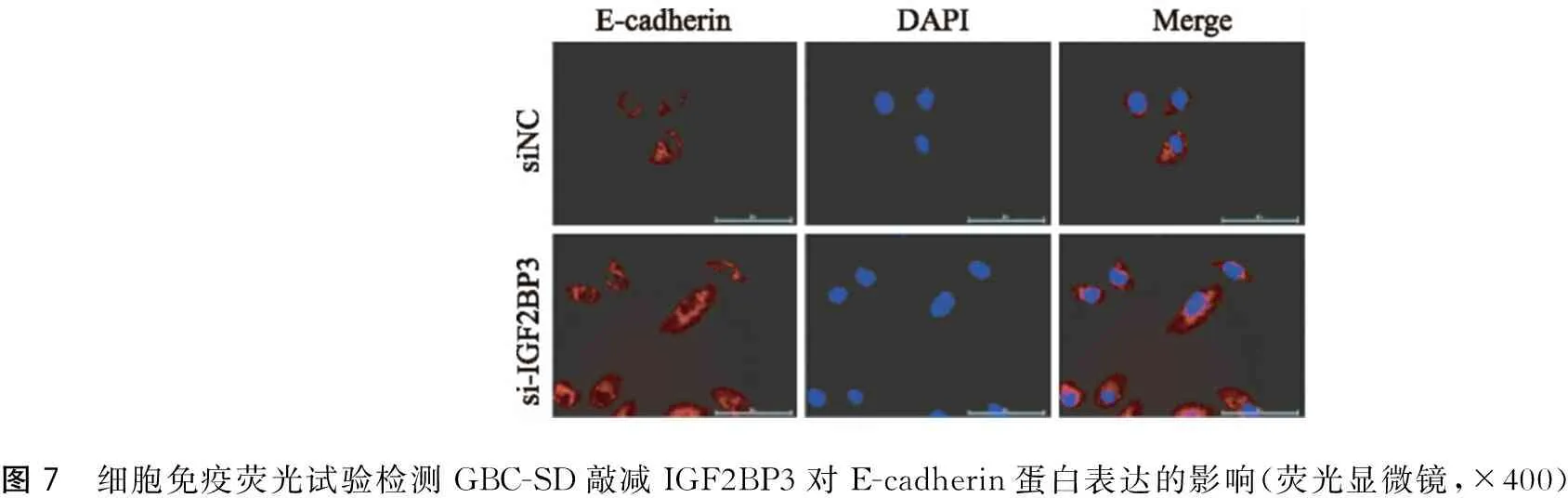
图7 细胞免疫荧光试验检测GBC-SD敲减IGF2BP3对E-cadherin蛋白表达的影响(荧光显微镜,×400)
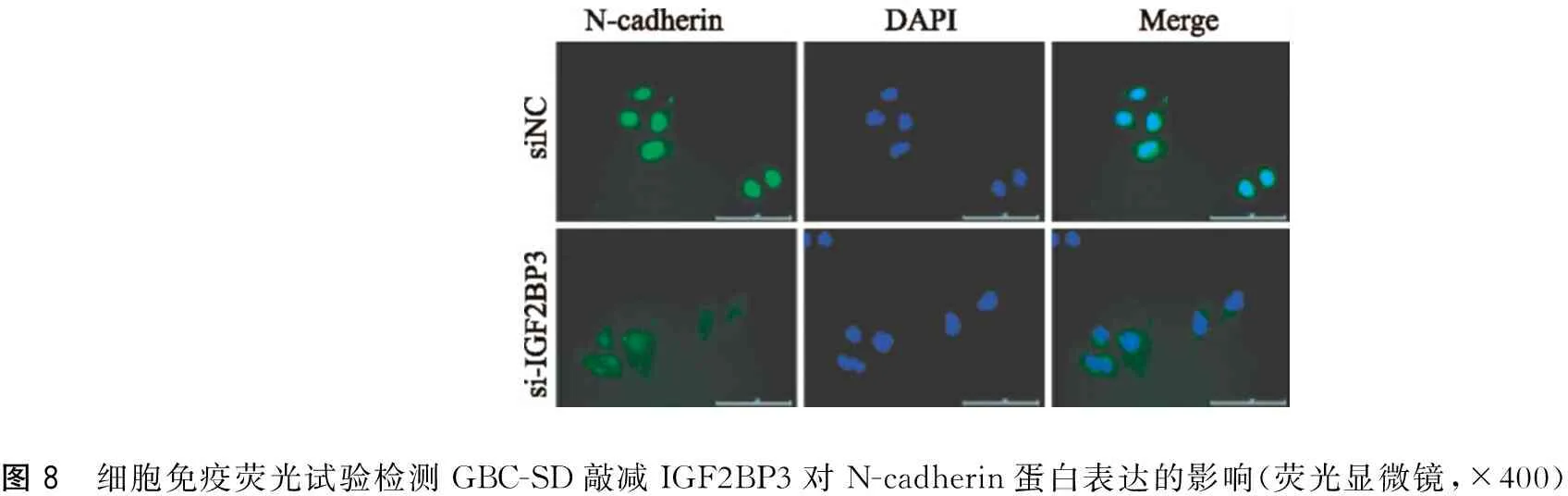
图8 细胞免疫荧光试验检测GBC-SD敲减IGF2BP3对N-cadherin蛋白表达的影响(荧光显微镜,×400)
本项研究显示,在23对胆囊癌与癌旁组织标本中,IGF2BP3在癌组织中高表达,提示其在胆囊癌中可能发挥癌基因的作用。已有研究表明高表达的IGF2BP3与癌症的侵袭转移密切相关。所以本文针对其在胆囊癌侵袭转移过程中发挥的作用进行相应研究。EMT是肿瘤侵袭转移过程中的关键步骤。EMT是指上皮细胞在胚胎发生或病理情况下转化为具有间充质特性的间充质细胞的过程[19]。主要的特征为E-cadherin表达减少、N-cadherin表达增加、细胞角蛋白细胞骨架转化为波形蛋白(Vimentin)为主的细胞骨架及形态上具有间充质细胞的特征等。E-cadherin高表达于上皮细胞,主要发挥同源细胞间的黏附作用,在EMT过程中,表达降低;与其相反,N-cadherin在EMT中表达升高。通过EMT,上皮细胞失去了细胞极性,失去与基底膜的连接,获得了较高的迁移与侵袭、抗凋亡和降解细胞外基质的能力等[24-30]。本研究通过敲减IGF2BP3,研究其在EMT过程中发挥的作用。Transwell迁移实验和预铺基质胶的 Transwell侵袭实验发现,敲减IGF2BP3后,胆囊癌细胞的迁移和侵袭能力明显降低。同时EMT相应蛋白的细胞免疫荧光实验证实,敲减IGF2BP3后E-cadherin表达升高,N-cadherin表达降低。证实IGF2BP3在胆囊中可以促进EMT发生,从而影响胆囊癌的侵袭能力。本实验只证实IGF2BP3可促进EMT发生,具体的机制仍需进一步研究。该研究为胆囊癌的发生发展分子机制增添了新的认识,同时也为胆囊癌的早期诊断及靶向治疗提供了潜在靶点。
1 Hundal R,Shaffer EA.Gallbladder cancer:epidemiology and outcome.Clin Epidemiol,2014,6:99-109.DOI:10.2147/CLEP.S37357.eCollection 2014.
2 Zhang YJ,Liu SB,Wang L,et al.A novel PI3K/AKT signaling axis mediates Nectin-4-induced gallbladder cancer cell proliferation,metastasis and tumor growth.Cancer Lett,2016,375:179-189.DOI:10.1016/j.canlet.2016.02.049.
3 Li ZZ,Chen YY,Wang XA,et al.LASP-1 induces proliferation,metastasis and cell cycle arrest at the G2/M phase in gallbladder cancer by down-regulating S100P via the PI3K/AKT pathway.Cancer Lett,2016,372:239-250.DOI:10.1016/j.canlet.2016.01.008.
4 Hueman MT,Vollmer CM Jr,Pawlik TM.Evolving treatment strategies for gallbladder cancer.Ann Surg Oncol,2009,16:2101-2115.DOI:10.1245/s10434-009-0538-x.
5 Shu YJ,Bao RF,Jiang L,et al.MicroRNA-29c-5p suppresses gallbladder carcinoma progression by directly targeting CPEB4 and inhibiting the MAPK pathway.Cell Death Differ,2017,24:445-457.DOI:10.1038/cdd.2016.146.
6 Cao Y,Liu XY,Lu W,et al.Fibronectin promotes cell proliferation and invasion through mTOR signaling pathway activation in gallbladder cancer.Cancer Lett,2015,360:141-150.DOI:10.1016/j.canlet.2015.01.041.
7 Li ML,Lu JH,Zhang F,et al.Yes-associated protein 1(YAP1) promotes human gallbladder tumor growth via activation of the AXL/MAPK pathway.Cancer Lett,2014,355:201-209.DOI:10.1016/j.canlet.2014.08.036.
8 邹声泉,张林.全国胆囊癌临床流行病学调查报告.中国实用外科杂志,2000,20:43-46.
9 Gourgiotis S,Kocher HM,Solaini L,et al.Gallbladder cancer.Am J Surg,2008,196:252-264.DOI:10.1016/j.amjsurg.2007.11.011.
10Shu YJ,Weng H,Ye YY,et al.SPOCK1 as a potential cancer prognostic marker promotes the proliferation and metastasis of gallbladder cancer cells by activating the PI3K/AKT pathway.Mol Cancer,2015,14:12.DOI:10.1186/s12943-014-0276-y.
11Li Maolan,Zhang Zhou,Li Xiaoguang et al.Whole-exome and targeted gene sequencing of gallbladder carcinoma identifies recurrent mutations in the ErbB pathway.Nat Genet,2014,46:872-876.DOI:10.1038/ng.3030.
12杨倞,冯飞灵,周海华,等.胆囊癌术后辅助性放疗的疗效分析.中华肿瘤杂志,2013,35:534-539.DOI:10.3760/cma.j.issn.0253-3766.2013.07.013.
13董家鸿,王剑明,曾建平.胆囊癌诊断和治疗指南(2015版).临床肝胆病杂志,2016,32:411-419.DOI:10.3760/cma.j.issn.1673-9752.2015.11.001.
14Wu XS,Shi LB,Li ML,et al.Evaluation of two inflammation-based prognostic scores in patients with resectable gallbladder carcinoma.Ann Surg Oncol,2014,21:449-457.DOI:10.1245/s10434-013-3292-z.
15Shu YJ,Weng H,Bao RF,et al.Clinical and prognostic significance of preoperative plasma hyperfibrinogenemia in gallbladder cancer patients following surgical resection:a retrospective and in vitro study.BMC Cancer,2014,14:566.DOI:10.1186/1471-2407-14-566.
16陈亚进.胆囊的解剖学特点及胆囊癌浸润转移途径.中国实用外科杂志,2011,31:207-209.
17Müeller-Pillasch F,Lacher U,Wallrapp C,et al.Cloning of a gene highly overexpressed in cancer coding for a novel KH-domain containing protein.Oncogene,1997,14:2729-2733.DOI:10.1038/sj.onc.1201110.
18Bell JL,Wächter K,Mühleck B,et al.Insulin-like growth factor 2 mRNA-binding proteins (IGF2BPs):post-transcriptional drivers of cancer progression?.Cell Mol Life Sci,2013,70:2657-2675.DOI:10.1007/s00018-012-1186-z.
19Wei QZ,Yan JH,Fu B,et al.IMP3 expression is associated with poor survival in cervical squamous cell carcinoma.Hum.Pathol,2014,45:2218-2224.DOI:10.1016/j.humpath.2014.07.006.
20Findeis-Hosey JJ,Yang Q,Spaulding BO,et al.IMP3 expression is correlated with histologic grade of lung adenocarcinoma.Hum.Pathol,2010,41:477-484.DOI:10.1016/j.humpath.2009.10.004.
21Lin W,Jiang L,Chen YL,et al.Vascular endothelial growth factor-D promotes growth,lymphangiogenesis and lymphatic metastasis in gallbladder cancer.Cancer Lett,2012,314:127-136.DOI:10.1016/j.canlet.2011.09.004.
22Liu YL,Yu CH,Wu YG,et al.CD44+fibroblasts increases breast cancer cell survival and drug resistance via IGF2BP3-CD44-IGF2 signalling.J Cell Mol Med,2017,21:1978-1988.DOI:10.1111/jcmm.13118.
23Mizutani R,Imamachi N,Suzuki Y,et al.Oncofetal protein IGF2BP3 facilitates the activity of proto-oncogene protein eIF4E through the destabilization of EIF4E-BP2 mRNA.Oncogene,2016,35:3495-3502.DOI:10.1038/onc.2015.410.
24Huang L,Wu RL,Xu AM.Epithelial-mesenchymal transition in gastric cancer.Am J Transl Res,2015,7:2141-5218.
25张红晨,张勇,刘颖斌,等.EGFR信号通路与胆囊癌靶向治疗.外科理论与实践,2015,20:172-174.DOI:10.3872/j.issn.1007-385X.2017.04.019.
26Wells A,Yates C,Shepard CR.E-cadherin as an indicator of mesenchymal to epithelial reverting transitions during the metastatic seeding of disseminated carcinomas.Clin Exp Metastasis,2008,25:621-628.DOI:10.1007/s10585-008-9167-1.
27Mao XY,Li QQ,Gao YF,et al.Gap junction as an intercellular glue:Emerging roles in cancer EMT and metastasis.Cancer Lett,2016,381:133-137.DOI:10.1016/j.canlet.2016.07.037.
28Park SJ,Choi YS,Lee S,et al.BIX02189 inhibits TGF-β1-induced lung cancer cell metastasis by directly targeting TGF-β type I receptor.Cancer Lett,2016,381:314-322.DOI:10.1016/j.canlet.2016.08.010.
29Zhan HX,Wang Y,Li C,et al.LincRNA-ROR promotes invasion,metastasis and tumor growth in pancreatic cancer through activating ZEB1 pathway.Cancer Lett,2016,374:261-271.DOI:10.1016/j.canlet.2016.02.018.
30Qureshi R,Arora H,Rizvi MA.EMT in cervical cancer:its role in tumour progression and response to therapy.Cancer Lett,2015,356(2 Pt B):321-331.DOI:10.1016/j.canlet.2014.09.021.
Effectofinsulin-likegrowthfactor2mRNAbindingprotein3 (IGF2BP3)onmigrationandinvasionofgallbladdercancer
JinYunpeng,BaoRunfa,HuYunping,LiuYingbin.
DepartmentofGeneralSurgeryandLaboratoryofGeneralSurgery,XinhuaHospital,AffiliatedtoShanghaiJiaoTongUniversitySchoolofMedicine,Shanghai200092,China
LiuYingbin,Email:liuyingbin@xinhuamed.com.cn
ObjectiveTo investigate the effect of insulin-like growth factor Ⅱ mRNA binding protein 3 (IGF2BP3) on migration and invasion of gallbladder carcinoma.MethodsThe expression of IGF2BP3 in gallbladder carcinoma and adjacent tissues was detected by real-time quantitative PCR (qRT-PCR).As compared with the normal bile duct epithelial cells,the expression of IGF2BP3 in 5 strains of gallbladder cancer cell lines was significantly up-regulated.The effect of IGF2BP3 on migration and invasion of gallbladder carcinoma cells was detected by Transwell migration assays. Immunofluorescence assay was used to detect the expression of the epithelial mesenchymal transition (EMT)-related proteins.ResultsThe relative expression level of IGF2BP3 was significantly higher in tumor tissues than in their non-cancerous counterparts.After knocking down the expression of IGF2BP3,the migration and invasion ability in 5 strains of gallbladder carcinoma cell lines was significantly reduced.The expression level of EMT-related proteins was down-regulated after knocking down the expression of IGF2BP3.ConclusionsIGF2BP3 promotes the migration and invasion of gallbladder carcinoma by induction of EMT.
Gallbladder carcinoma; Insulin-like growth factor Ⅱ mRNA binding protein 3; Epithelial mesenchymal transition
200092 上海,上海交通大学医学院附属新华医院普外科 上海交通大学医学院胆道疾病研究所
刘颖斌,Email:liuyingbin@xinhuamed.com.cn
R735.8
A
10.3969/j.issn.1003-5591.2017.05.003
2017-08-03)

