PEG-rhG-CSF对以顺铂为基础联合化疗所致骨髓抑制的预防作用
宋君利 陈明达 艾建中 张 超 贾敬好
PEG-rhG-CSF对以顺铂为基础联合化疗所致骨髓抑制的预防作用
宋君利 陈明达 艾建中 张 超 贾敬好
目的探讨PEG-rhG-CSF预防晚期癌症患者以顺铂为基础的联合化疗所致骨髓抑制的效果及其不良反应。方法选择92例晚期癌症患者,按随机数字法分为对照组46例和观察组46例。2组患者均采用以顺铂为基础的联合化疗方案,化疗开始后常规监测血常规。在前一周期化疗过程中出现Ⅰ度及以上骨髓抑制并及时处理后,在下一周期化疗用药结束48 h后观察组予PEG-rhG-CSF皮下注射,5 μg·kg/次/周期,隔天化验血常规1次,如果骨髓抑制继续加重达Ⅳ度则补充rhG-CSF皮下注射 5 μg·kg/次/天;对照组则予rhG-CSF皮下注射,5 μg·kg/次/天。2组患者均在中性粒细胞绝对值≥2.0×109和(或)白细胞计数≥4.0×109时停用rhG-CSF。治疗过程中如果出现粒细胞减少性发热则2组患者均按照诊疗常规予抗生素防治感染。详细记录用药后患者的不良反应。结果观察组患者的中性粒细胞减少的发生率(43.48%)明显低于对照组(63.04%)(P<0.05)。观察组患者恶心11例(23.91%)、白细胞下降18例(39.13%)、胃肠道反应16例(34.78%)及肾毒性16例(34.78%)等,不良反应发生率明显低于对照组[恶心17例(36.95%)、白细胞下降29例(63.04%)、胃肠道反应23例(50.00%)及肾毒性19例(41.30%)](P<0.05)。结论PEG-rhG-CSF可有效减轻以顺铂为基础联合化疗所致骨髓抑制的程度,不良反应轻微,具有良好的应用前景。
PEG-rhG-CSF;晚期癌症患者;中性粒细胞减少;白细胞减少
(ThePracticalJournalofCancer,2017,32:1725~1727)
失去手术机会的进展期和已经出现远处转移的晚期恶性肿瘤患者应当采用以化疗为主的综合治疗来控制肿瘤进展,但是,化疗药物所致骨髓抑制可造成后续化疗延期,甚至药物减量、化疗中断,同时加大患者免疫功能下降、继发感染的风险[1],影响患者的生活质量。目前,rhG-CSF(重组人粒细胞刺激因子)是临床上应用最广泛的纠正骨髓抑制的细胞因子,需要多次用药才能达到治疗效果;PEG-rhG-CSF(聚乙二醇化重组人粒细胞刺激因子)是将rhG-CSF经过甲氧基聚乙二醇化学修饰的制剂[2]。但是,PEG-rhG-CSF在化疗过程中对患者不良反应发生的影响有待进一步探究。为了探究PEG-rhG-CSF在以顺铂为基础的联合化疗过程中的效果,我院对92例晚期癌症患者进行了临床试验,现报告如下。
1 资料与方法
1.1 一般资料
选择2015年6月至2016年12月期间我院收治的92例晚期癌症患者,并按随机数字法分为对照组和观察组。观察组46例患者,男女各23例,年龄为36~78岁,平均年龄为(43.11±5.81)岁;患病类型为食管癌13例,非小细胞肺癌22例,乳腺癌11例;对照组46例患者,男性24例,女性22例;年龄为35~79岁,平均年龄为(42.87±5.47)岁;患病类型为食管癌12例,非小细胞肺癌21例,乳腺癌13例。本次研究均征求了患者本人及其家人同意,符合医院伦理会的相关规定。参试患者按照癌症的分期标准[3]符合癌症Ⅳ期。2组患者在年龄、性别比例及患病类型方面无统计学差异(P>0.05)。排除标准: 1个月内接受放射治疗的患者;骨髓受侵或造血干细胞移植的患者;有难以控制的感染患者;哺乳期或怀孕期妇女;对PEG-rhG-CSF过敏的患者。
1.2 方法
2组患者均采用以顺铂为基础的联合化疗方案,化疗开始后常规监测血常规,在前一周期化疗过程中出现Ⅰ度及以上骨髓抑制并及时处理后,在下一周期化疗用药结束48 h后观察组予PEG-rhG-CSF皮下注射,5 μg/kg/次/周期,隔天化验血常规一次,如果骨髓抑制继续加重达Ⅳ度则补充rhG-CSF皮下注射 5 μg/kg/次/天;对照组则予rhG-CSF皮下注射,5 μg/kg/次/天。2组患者均在中性粒细胞绝对值≥2.0×109和(或)白细胞计数≥4.0×109时停用rhG-CSF。治疗过程中如果出现粒细胞减少性发热则2组患者均按照诊疗常规予抗生素防治感染。
以顺铂为基础的联合化疗方案:顺铂40 mg/m2,多西他赛40 mg/m2,表阿霉素35 mg/m2静脉滴注,1次/2周,4周为1个疗程。患者在治疗期间,给予地塞米松、西咪替丁及盐酸托烷司琼保护胃黏膜和防止呕吐,并进行水化保护肾功能。
1.3 观察指标
患者用药期间,定期进行血常规检查,1次/2天;详细记录用药后患者的PEG-rhG-CSF、rhG-CSF的不良反应,如,肾毒性、恶心及胃肠道反应。白细胞减少、中性粒细胞减少程度参照通用不良事件术语标准3.0版,分析患者的骨髓抑制情况。
1.4 统计学分析
2 结果
2.1 对比2组患者药物使用率
观察组患者化疗后ANC<1.5×109、ANC<0.5×109及抗生素使用率明显低于对照组,差异有统计学意义(P<0.05)。见表1。
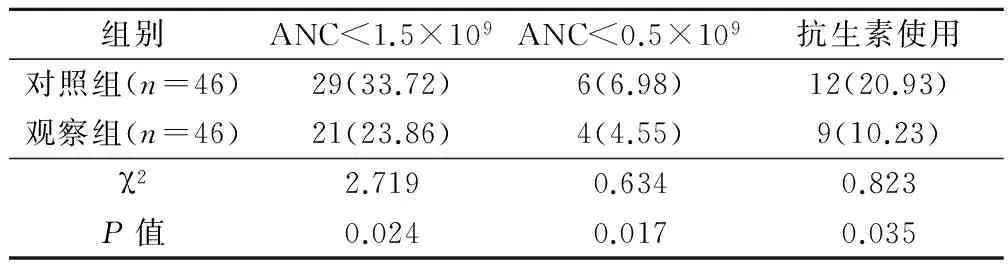
表1 2组患者药物使用(例,%)
2.2 对比2组患者中性粒细胞减少症发生率
观察组患者的中性粒细胞减少的发生率(43.48%)明显低于对照组(63.04%),差异有统计学意义(P<0.05)。见表2。
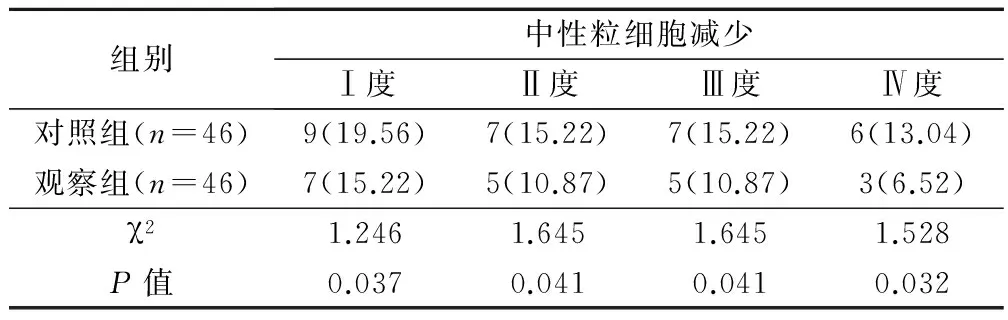
表2 2组患者中性粒细胞减少症发生率的比较(例,%)
2.3 对比2组患者治疗后的不良反应发生情况
观察组患者恶心11例(23.91%)、白细胞下降18例(39.13%)、胃肠道反应16例(34.78%)及肾毒性16例(34.78%),明显低于对照组(P<0.05)。见表3。
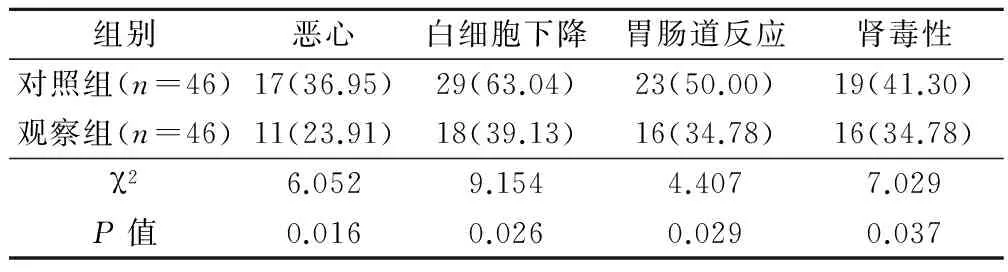
表3 2组患者治疗后不良反应情况比较(例,%)
3 讨论
恶性肿瘤的诊治强调早期发现、早期诊断、早期治疗,但是临床上相当数量的患者确诊肿瘤时已为局部晚期或者出现远处转移。目前,临床上常采用化疗或与手术、放疗联合应用控制肿瘤进展、延长生存时间[4]。但是化疗药物的骨髓毒性影响了化疗的顺利进行,并不同程度地影响了患者的生存质量。恶性肿瘤患者进行化疗时使用药物可导致骨髓抑制,常见的是中性粒细胞与白细胞减少[5];且中性粒细胞和白细胞数下降程度与持续时间及继发性感染呈正相关关系[6]。
晚期患者化疗后出现骨髓抑制采用rhG-CSF(重组人粒细胞刺激因子)进行辅助治疗,如果出现粒细胞减少性发热,需要联合应用常规抗生素以避免出现严重感染,该类药物可干预患者骨髓中的中性粒细胞,促进其分化、增殖等,将正常中性粒细胞的成熟时间由5 d缩短为1 d,加速成熟的中性粒细胞释放进入外周血,从而增强中性粒细胞的吞噬功能[7]。但该药物的半衰期短,临床应用时需要多次用药[8]。PEG-rhG-CSF(聚乙二醇化重组人粒细胞刺激因子)与rhG- CSF 比较,经聚乙二醇修饰后的PEG-rhG-CSF 在具有相似的疗效和安全性的同时,还具有半衰期长和血药浓度自我调节的特性[9]。对于晚期癌症患者,PEG-rhG-CSF可缓解患者在化疗过程中所引发的中性粒细胞及白细胞减少的症状,减少了患者在治疗过程中所经历的疼痛,并在较短时间内改善晚期癌症患者的临床症状,降低不良反应[10]。
研究显示,对晚期癌症患者化疗后给予PEG-rhG-CSF治疗的ANC<1.5×109、ANC<0.5×109及抗生素使用率明显低于采用rhG-CSF化疗后的患者。对晚期癌症患者化疗后给予PEG-rhG-CSF治疗的中性粒细胞减少的发生率(43.48%)明显低于采用化疗后给予rhG-CSF治疗的患者的中性粒细胞减少的发生率(63.04%);晚期癌症患者化疗给予PEG-rhG-CSF不良反应发生如恶心、白细胞下降、胃肠道反应及肾毒性明显低于化疗后给予rhG-CSF的患者。
综上所述,PEG-rhG-CSF对晚期癌症患者以顺铂为基础联合化疗所致的骨髓抑制,可明显提升患者化疗后中性粒细胞和白细胞的恢复,降低患者不良反应发生率,从而提高患者的PEG-rhG-CSF 单次用药在达到与rhG-CSF类似的治疗效果的同时减少了患者反复接受rhG-CSF 注射的痛苦,提高了化疗耐受性,具有具有良好的应用前景。
[1] 徐校成,吕颖颖,徐佳灵.晚期非小细胞肺癌患者化疗对免疫功能的影响〔J〕.中华医院感染学杂志,2015,25(6):1312-1314.
[2] 张喜平,张 翔,杨红健,等.多种口服升白药物治疗化疗相关白细胞减少症的实验研究〔J〕.中国临床药理学与治疗学,2015,20(3):246-251.
[3] Tiwari K,Wavdhane M,Haque S,et al.A sensitive WST-8-based bioassay for PEGylated granulocyte colony stimulating factor using the NFS-60 cell line〔J〕.Pharm Biol,2015,53(6):849-854.
[4] 吴凤鹏,吴凤云,王 军,等.PEG-rhG-CSF对Ⅲ度中性粒细胞减少患者粒细胞增殖状况的研究〔J〕.中国新药杂志,2014,23(9):1066-1069.
[5] 黄振步.健脾益肾法对肿瘤放化疗白细胞减少症患者血清黏附分子ICAM-1、VCAM-1以及免疫功能的影响研究〔J〕.中华中医药学刊,2016,34(5):1274-1277.
[6] Shin KH,Lim KS,Lee H,et al.An assessment of the pharmacokinetics,pharmacodynamics,and tolerability of GCPGC,a novelpegylated granulocyte colony-stimulating factor(G-CSF),in healthy subjects〔J〕.Invest New Drugs,2014,32(4):636-643.
[7] 窦昊颖,张盼盼,高晓宁,等.当归补血汤加味治疗白细胞减少症疗效的Meta分析〔J〕.辽宁中医杂志,2016,43(9):1807-1811.
[8] 王淑梅,孙路路,杨 平,等.大剂量甲氨蝶呤注射剂化疗导致急性淋巴细胞白血病患儿白细胞减少的危险因素分析〔J〕.中国临床药理学杂志,2016,32(20):1905-1907.
[9] Xu B,Tian F,Yu J,et al.A multicenter,randomized,controlled,phase Ⅲ clinical study of PEG-rhG-CSF for preventing chemotherapy-induced neutropenia in patients with breast cancer and non-small cell lung cancer〔J〕.Zhonghua Zhong Liu Za Zhi,2016,38(1):23-27.
[10] 高 天,刘佳勇,樊征夫,等.软组织肉瘤化疗聚乙二醇化重组人粒细胞集落刺激因子预防中性粒细胞减少临床观察〔J〕.中华肿瘤防治杂志,2015,22(16):1313-1317.
ThePreventiveEffectofPEG-rhG-CSFonMyelosuppressionInducedbyCombinationChemotherapyBasedonCisplatin
SONGJunli,CHENMingda,AIJianzhong,etal.
TangshanPeople’sHospital,Tangshan,063000
ObjectiveTo discuss the efficacy and adverse reactions of PEG-rhG-CSF in the prevention of bone marrow suppression induced by cisplatin based chemotherapy in patients with advanced cancer.Methods92 cases of advanced cancer patients were randomly divided into the control group(n=46) and the observation group(n=46).The 2 groups were treated with combined chemotherapy with cisplatin based chemotherapy,the blood routine monitoring after the start of chemotherapy,Ⅰ and higher degree of bone marrow suppression and timely treatment with the process of one cycle of chemotherapy after 48 h at the end of the last cycle of chemotherapy after the observation group were given subcutaneous injection of PEG-rhG-CSF,5 μg·kg/once/cycle,the blood routine once,if continue to increase the degree of bone marrow suppression at Ⅳ replenishment of subcutaneous injection of rhG-CSF 5 μg·kg/once/day,the control group was treated with subcutaneous injection of rhG-CSF,5 μg·kg/once/day.The 2 groups of patients were in absolute neutrophil value more than 2×109and /or white blood cell count over 4×109disabled rhG-CSF.In the course of treatment,if there was a reduction in febrile neutropenia,the 2 groups were given antibiotics to prevent infection.The adverse reactions of patients were recorded.ResultsThe incidence of the patients in the observation group(43.48%) was lower than that of the control group (63.04%)(P<0.05);The observation group with nausea 11(23.91%),leukopenia 18(39.13%),gastrointestinal reaction 16(34.78%) and nephrotoxicity 16(34.78%) were significantly lower than that of the control group nausea 17(36.95%) neutropenia 29(63.04%),gastrointestinal reactions 23(50.00%) and nephrotoxicity 19(41.30%) (P<0.05).ConclusionPEG-rhG-CSF effectively reduced the degree of myelosuppression caused by cisplatin combined chemotherapy,with slight adverse reactions,and had a good prospect of application.
PEG-rhG-CSF;Advanced cancer patients;Neutrophil reduction;Leukocyte reduction
063000 河北省唐山市人民医院(宋君利,陈明达,张 超,贾敬好);063000 河北省唐山市工人医院(艾建中)
10.3969/j.issn.1001-5930.2017.10.048
R730.53
A
1001-5930(2017)10-1725-03
2017-04-24
2017-06-20)
(编辑甘艳)

