ARHI基因对人胰腺癌组织血管生成的影响
胡珊珊 杨 红 丁 辉 李修岭 钱家鸣
ARHI基因对人胰腺癌组织血管生成的影响
胡珊珊 杨 红 丁 辉 李修岭 钱家鸣
目的探讨ARHI基因与胰腺癌组织血管密度和临床病理的相关性。方法收集23例胰腺癌石蜡标本作为实验组,27例正常胰腺石蜡标本作为对照组。然后采用免疫组化方法检测两组标本ARHI、CD34蛋白表达情况;分析ARHI、CD34蛋白表达与胰腺癌的关系;分析ARHI与MVD的相关性。结果对照组和实验组标本中ARHI阳性率分别为88.9%(24/27)、21.7%(5/23),实验组标本中ARHI基因表达下降,两组比较差异具有统计学意义(P<0.05);对照组MVD值显著低于实验组,差异具有统计学意义(P<0.05); ARHI表达与胰腺癌分化程度呈负相关(P<0.05),其中肿瘤分化程度越低,ARHI表达缺失概率越大;实验组标本中CD34阳性表达较高,多数具有管腔结构,且MVD值明显高于对照组标本,差异具有统计学意义(P<0.001);胰腺癌组织中,MVD与ARHI的表达无相关性(P>0.05);而所有统计病例中,ARHI阴性者比阳性者的MVD值高,且MVD与ARHI的表达呈负相关(P<0.001)。结论ARHI可能通过抑制胰腺癌微血管的生成进而抑制胰腺癌生长。
胰腺癌;肿瘤血管生成;微血管密度
(ThePracticalJournalofCancer,2017,32:1613~1616)
胰腺癌是恶性程度最高的肿瘤之一[1],在我国,胰腺癌的发病率和死亡率也逐年上升,由于早期检出率低,一半胰腺癌患者确诊时已全身转移[2];由于缺少有效的治疗手段,胰腺癌患者存活率较低[3]。Yu等[4]于1999年发现在人类心、脑、胰腺等组织均可以表达母源性抑癌印迹基因ARHI(aplasia ras homologue member I)。然而和正常组织相比,胰腺癌组织中表达降低,揭示了ARHI基因可能与肿瘤发生、发展相关[5]。研究发现肿瘤新生血管的形成直接影响着其生长和转移,因此此次研究我们通过观察ARHI基因是否影响胰腺癌微血管密度、及其与胰腺癌分化程度、临床分期相关性,旨在为ARHI影响胰腺癌生长、转移相关机制提供理论支持。
1 材料与方法
1.1 研究对象
收集我院2013年4月至2016年11月行Whipple手术并病理诊断均为胰腺导管腺癌的23例胰腺癌石蜡标本(临床病理资料完整)作为实验组;27例正常胰腺石蜡标本作为对照组。其中实验组男性10例,女性13例;年龄37~76岁,平均年龄(60.61±9.99)岁,两组石蜡标本均制成4 μm大小的切片;对照组男性13例,女性14例,年龄37~79岁,平均年龄(60.44±9.79岁)。两组标本的性别分布以及年龄分布比较,差异不具有统计学意义(P>0.05)。
1.2 主要试剂与方法
ARHI抗体(美国百奇生物公司),CD34抗体、二步法免疫组化检测试剂盒(均购自北京中杉金桥生物技术有限公司)。免疫组化步骤:将患者的石蜡切片进行常规的脱蜡、PBS清洗3次;抗原修复;3%H2O2室温封闭10 min;4 ℃孵育一抗过夜,同时孵育PBS代替一抗作为阴性对照;孵育二抗室温60 min,PBS清洗3次;苏木精复染2 min,盐酸酒精分化,PBS清洗3次;脱水、漂洗、透明;最后封片。
1.3 结果判定
ARHI判断标准:光镜下随机观察10个高倍镜(400倍)视野,每个视野计数细胞100个,阳性为出现棕黄色颗粒,计算平均值为最终结果[4]。其中阴性(-):阳性细胞数在0~10%;阳性(+):阳性细胞数在10%~50%;强阳性(++):阳性细胞数超过50%。根据Weidner等[2]的标准判断微血管密度(MVD):低倍镜下确定密度最高肿瘤内血管区域,然后换高倍镜(×200)观察最高数目5个视野的微血管数目,然后以平均值为最终结果。其中镜下为棕黄或棕褐色的内皮细胞、细胞丛以及不相连分支结构作为一个微血管,排除血管壁>50 μm的血管。
1.4 统计学分析
应用SPSS 19.0对数据进行分析;计量资料用t检验;计数资料用卡方χ2检验或Fisher确切概率法检验;等级变量采用Spearman相关分析,以P<0.05具有统计学意义。
2 结果
2.1 ARHI在胰腺癌组织中的表达情况
ARHI阳性均匀的棕褐或棕黄色颗粒,主要在细胞质内,少数胞核呈棕黄色。ARHI蛋白也在正常胰腺组织导管以及腺泡细胞中表达;然而大部分胰腺癌组织不表达ARHI蛋白。对照组和实验组标本中ARHI阳性率分别为88.9%(24/27)、21.7%(5/23),实验组标本中ARHI基因表达下降,两组数据比较差异具有统计学意义(P<0.05),见表1。
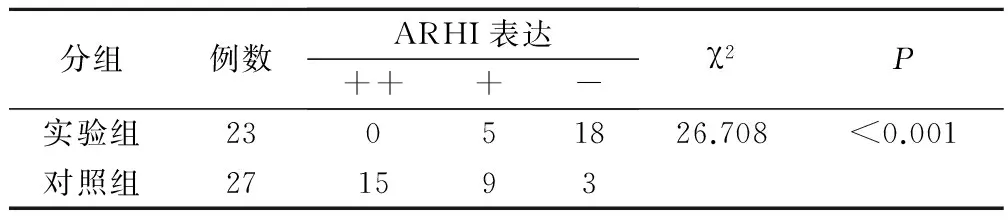
表1 两组标本ARHI蛋白表达情况比较/例
2.2 MVD计数
实验组标本中MVD值(43.47±6.44)明显高于对照组(27.84±2.01),差异具有统计学意义(P<0.001)。
2.3 ARHI蛋白表达和胰腺癌的关系
统计结果显示,ARHI的表达与胰腺癌分化程度呈负相关(P<0.05),即肿瘤分化程度越低,ARHI表达缺失概率越大,见表2。
2.4 MVD与胰腺癌临床病理特征的关系
观察MVD与胰腺癌临床病理因素的关系发现:胰腺癌中微血管密度(MVD)与年龄、饮酒史、血清CA199、CA242水平、肿瘤大小、分化程度、临床分期、血管浸润以及淋巴结转移相关(P<0.001);其中年龄≤60岁、饮酒、血清CA199高表达、CA242水平低表达,临床分期越晚、分化程度越低、肿瘤直径越大、出现淋巴结转移、无血管浸润的患者MVD更高,见表3。
2.5 ARHI的表达与MVD的关系
在胰腺癌组织中,MVD值ARHI阴性者(45.03±6.35)比阳性者(40.07±5.95)高,但MVD与ARHI的表达无相关性(P>0.05,t=1.563);而所有统计病例中,MVD值ARHI阴性者(42.75±6.94)比阳性者(31.57±6.13)高,且MVD与ARHI的表达呈负相关(P<0.001,Z=-4.472)。
3 讨论
胰腺癌作为恶性程度最高的肿瘤,临床上由于早期胰腺癌难以诊断,造成患者发病为时已晚引起死亡。调查发现胰腺癌5年内存活率不足10%,因此分析胰腺癌发病的相关机制对于患者的及时治疗意义重大。
血管生成作为肿瘤生长、转移的关键因素,肿瘤组织的新生血管可为肿瘤细胞提供充足的营养,为肿瘤细胞增殖、浸润、转移提供有利条件。自1971年Folkman[6]第一次提出新生血管可以为肿瘤的生长提供条件,人们越来越关注实体瘤血管形成,因此抑制肿瘤新生血管生成可以作为抑制肿瘤生长的重要靶点。
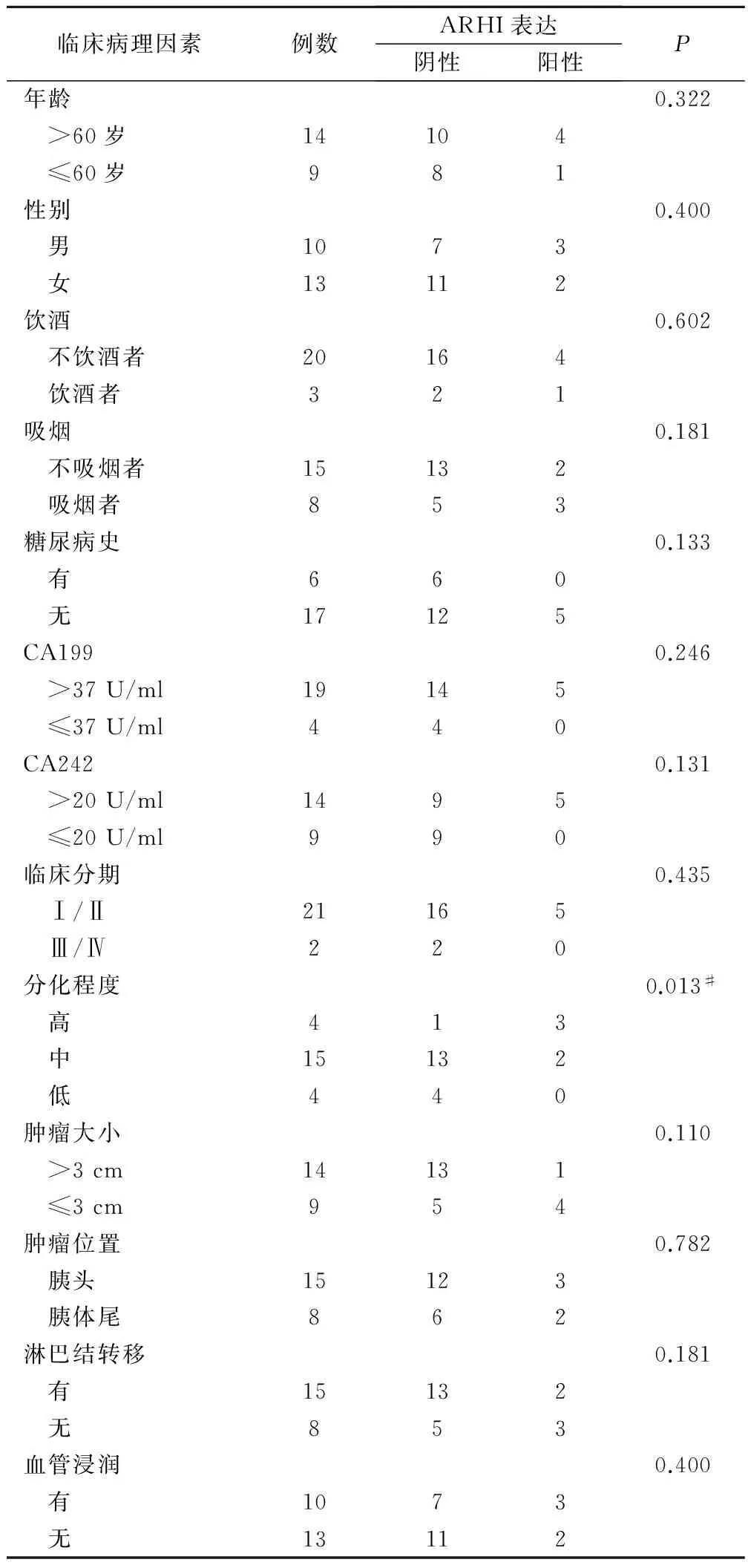
表2 ARHI蛋白表达与胰腺癌临床病理的关系/例
注:除分化程度外其他项目均采用Fisher确切概率法,#为采用χ2检验,χ2=7.806。
母源性印迹基因ARHI可多种组织中表达,研究发现其在乳腺癌、胰腺癌等组织中表达下降,说明其可能具有抑制肿瘤的作用。目前研究发现ARHI可以通
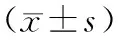
表3 MVD与胰腺癌临床病理特征的关系
注:a为与高分化组相比,b为与中分化组相比。
过母源性印迹来抑制肿瘤细胞生长,控制细胞周期[7],调节血管生成[8]。其中甲基化异常[9-10]、杂合性丢失[11]以及组蛋白的乙酰化[12]有关可能是导致ARHI的失活的原因。然而人们并未完全清楚ARHI如何影响肿瘤血管生成、调控胰腺癌微环境。本实验通过在人胰腺癌组织学水平分析ARHI基因对新生血管生成及相关机制的影响,并阐述新生血管对肿瘤发展的影响,为靶向治疗胰腺癌提供理论依据。
此次研究结果显示,对照组和实验组标本中ARHI阳性率分别为88.9%(24/27)、21.7%(5/23),实验组标本中ARHI基因表达下降,两组数据比较差异具有统计学意义(P<0.05),这说明了ARHI蛋白在胰腺癌中的表达出现了明显的下降趋势。分析前期研究结果我们发现,ARHI蛋白在46例胰腺癌组织中有29例表达缺失,缺失率为63.0%;而39例正常胰腺组织中仅3例表达缺失,缺失率仅为7.7%(3/39),差异具有统计学意义(P<0.05)。此外,我们还发现ARHI的表达和胰腺癌分化程度呈负相关性(P<0.05)。这说明了ARHI基因可以抑制胰腺癌分化,进一步说明ARHI基因可以起到抑癌基因的作用。而ARHI的表达与年龄、性别以及临床分期等因素无相关性,其原因可能是参与此次研究的样本数不足,后面可扩大样本深入研究。
MVD作为肿瘤血管新生的标志,可以通过CD31、CD34来标记血管内皮细胞。本实验发现实验组标本中CD34阳性表达较多,多数具有管腔结构,且MVD值明显高于对照组标本,差异具有统计学意义(P<0.001),说明血管生成可能促进胰腺癌的发生发展。胰腺癌中年龄越小者、饮酒者、分化程度差、CA199分泌多、临床分期晚、发生淋巴结转移以及瘤直径大的患者MVD值越高。其原因可能是正常组织无法为胰腺大量供血,而肿瘤组织含大量血管可为其提供营养,有利于胰腺癌生长、转移。此外,分化程度低易引起组织缺氧,导致HIF-1α表达上升,促使血管生成。
在胰腺癌组织中,MVD与ARHI的表达无相关性(P>0.05);而所有统计病例中,ARHI阴性者比阳性者的MVD值高,且MVD与ARHI的表达呈负相关(P<0.001)。这提示我们肿瘤组织的新生血管形成以及细胞增殖的机制复杂,容易受到其微环境中其他因子的影响,只有通过大量样本数据统计分析才能解决这个问题。
综上所述,ARHI基因可以抑制胰腺癌新生血管形成以及癌细胞的生长,这对于研究肿瘤发生、发展意义重大,为临床上胰腺癌患者的靶向治疗提供理论依据。
[1] Siegel R,Naishadham D,Jemal A.Cancer statistics,2013〔J〕.CA Cancer J Clin,2013,63(1):11-30.
[2] Vincent A,Herman J,Schulick R,et al.Pancreatic cancer〔J〕. Lancet,2011,378(9791):607-620.
[3] Stathis A,Moore M J.Advanced pancreatic carcinoma:current treatment and future challenges〔J〕.Nat Rev Clin Oncol,2010,7(3):163-172.
[4] Yu Y,Xu F,Peng H,et al.NOEY2 (ARHI),an imprinted putative tumor suppressor gene in ovarian and breast carcinomas〔J〕.Proc Natl Acad Sci USA,1999,96(1):214-219.
[5] Hisatomi H,Nagao K,Wakita K,et al.ARHI/NOEY2 inactivation may be important in breast tumor pathogenesis〔J〕.Oncology,2002,62(2):136-140.
[6] Folkman J,Hochberg M.Self-regulation of growth in three dimensions〔J〕.J Exp Med,1973,138(4):745-753.
[7] Lu X,Qian J,Yu Y,et al.Expression of the tumor suppressor ARHI inhibits the growth of pancreatic cancer cells by inducing G1 cell cycle arrest〔J〕.Oncol Rep,2009,22(3):635 -640.
[8] Zhao X,Li J,Zhuo J,et al.Reexpression of ARHI inhibits tumor growth and angiogenesis and impairs the mTOR/VEGF pathway in hepatocellular carcinoma〔J〕.Biochem Biophys Res Commun,2010,403(3):417-421.
[9] Yuan J,Luo RZ,Fujii S,et al.Aberrant methylation and silencing of ARHI,an imprinted tumor suppressor gene in which the function is lost in breast cancers〔J〕.Cancer Res,2003,63(14):4174-4180.
[10] Peng H,Xu F,Pershad R,et al.ARHI is the center of allelic deletion on chromosome 1p31 in ovarian and breast cancers〔J〕.Int J Cancer,2000,86(5):690-694.
[11] Yang H,Lu X,Qian J,et al.Imprinted tumor suppressor gene ARHI induces apoptosis correlated with changes in DNA methylation in pancreatic cancer cells〔J〕.Mol Med Rep,2010,3(4):581-587.
[12] Yu Y,Fujii S,Yuan J,et al.Epigenetic regulation of ARHI in breast and ovarian cancer cells〔J〕.Ann N Y Acad Sci,2003,983(1):268-277.
TheEffectofARHIonTumorAngiogenesisinPancreaticCancer
HUShanshan,YANGHong,DINGHui,etal.
People'sHospitalofZhengzhouUniversity,Zhengzhou,450003
ObjectiveTo analyze the correlation between ARHI gene and vascular density and clinicopathological features of pancreatic cancer.Methods23 paraffin specimens of pancreatic cancer were collected as the experimental group,27 normal pancreatic paraffin specimens were collected as the control group.Immunohistochemical method was used to detect the expression of ARHI and CD34 protein in the 2 groups.The relationship between the expression of ARHI and CD34 protein in pancreatic cancer and the correlation between ARHI and MVD.The MVD group was significantly lower than that of the control group,the difference was statistically significant (P<0.05);the expression of ARHI was negatively associated with the differentiation of pancreatic cancer (P<0.05),wherein the lower the degree of tumor differentiation,the greater the probability of loss of ARHI expression.ResultsThe positive rates of ARHI in the control group and the experimental group were 88.9%(24/27) and 21.7%(5/23),the expression of ARHI gene in experimental group decreased,the difference between the 2 groups was statistically significant (P<0.05).In the experimental group,the positive expression of CD34 was more,most of them had the lumen structure,and the MVD value was significantly higher than that of the control group,the difference was statistically significant (P<0.001).There was no correlation between the expression of MVD and ARHI in pancreatic cancer tissues (P>0.05).In all the cases,the MVD value of the ARHI negative patients was higher than that of the positive ones,and the expression of MVD was negatively correlated with the expression of ARHI (P<0.001).ConclusionARHI may suppress the growth of pancreatic cancer through the microvessel angiogenesis.
Pancreatic carcinoma;Tumor angiogenesis;MVD
450003 郑州大学人民医院(胡珊珊,丁 辉,李修岭);100032 北京协和医院(杨 红,钱家鸣)
钱家鸣
10.3969/j.issn.1001-5930.2017.10.014
R735.9
A
1001-5930(2017)10-1613-04
2017-03-08
2017-06-12)
(编辑吴小红)

