紫花苜蓿保卫细胞原生质体的制备
安 杰,尤 章,曹玉曼,任鹏辉,刘金隆,杨培志
(西北农林科技大学动物科技学院,陕西 杨凌 712100)
紫花苜蓿保卫细胞原生质体的制备
安 杰,尤 章,曹玉曼,任鹏辉,刘金隆,杨培志
(西北农林科技大学动物科技学院,陕西 杨凌 712100)
为了获得紫花苜蓿(Medicagosativa)保卫细胞原生质体,并为后续的紫花苜蓿保卫细胞原生质体的相关研究奠定基础,本研究探索了适合紫花苜蓿保卫细胞的提取方法。利用研磨和匀浆机处理的方式获得表皮条,将获得的表皮条再通过两步酶解法去除残留的叶肉细胞和细胞壁,并经多次过滤和离心获得保卫细胞原生质体。最后统计原生质体数目并用FDA染色检测保卫细胞原生质体活性。结果表明,本研究成功分离并获得了高活性的紫花苜蓿保卫细胞原生质体。每5片成熟叶获得1 000个保卫细胞原生质体,经FDA染色后在荧光下显示活性保卫细胞原生质体占90%以上。
紫花苜蓿;保卫细胞;原生质体制备;两步法酶解;研磨;FDA染色
紫花苜蓿(Medicagosativa)是具有高营养价值的多年生优质豆科牧草[1-2],在我国西北地区有大面积的种植,但是西北干旱少雨的气候使其产量受到严重的影响[3-4]。气孔是植物叶片控制水分蒸腾、CO2进入以及抵抗不良环境的重要器官[5]。在双子叶植物中气孔的开闭由两个肾型的保卫细胞调控。获得纯净、高活力的保卫细胞原生质体,再利用膜片钳[6]、转录组测序[7]等方法研究保卫细胞的干旱响应信号通路,可为紫花苜蓿的抗旱遗传改良提供重要理论依据。
保卫细胞是研究气孔运动过程中信号传导、离子转运等的模式试验材料[7],获得高纯度,高活性的保卫细胞是后续研究的重中之重。提取保卫细胞原生质体的方法在蚕豆(Viciafaba)[8]、洋葱(Alliumcepa)[8]、拟南芥(Arabidopsisthaliana)[9]、烟草(Nicotianaglauca)[10]、玉米(Zeamays)[11]等植物中已有相关报道,但在紫花苜蓿保卫细胞原生质体的提取上仍是空白。对于不同的植物材料获得保卫细胞原生质体的方式不尽相同。获得表皮的方式主要有匀浆机打碎[9]和撕取表皮[12-13]等。酶解的方式有一步酶解法[14]和两步酶解法[15]。酶液的配制也多种多样,第1步酶解多用Cellulysin、Cellulase R-10,第2步酶解多用Cellulase RS、Cellulase R-10,此外细胞壁中还含有果胶、半纤维素,所以常在酶液中加入果胶酶和离析酶[16-32]。在保卫细胞原生质体纯化上使用的尼龙网的孔径也因保卫细胞大小不同而不同,一般为5~30 μm不等[16-21]。
由于紫花苜蓿表皮不易撕取、成熟叶片的纤维素含量较高、保卫细胞体积较小,因此获取紫花苜蓿保卫细胞原生质体较为困难。目前,国内外对紫花苜蓿保卫细胞原生质体提取的方法鲜有报道,所以很有必要摸索适合紫花苜蓿保卫细胞提取的适宜条件,为紫花苜蓿的气孔运动调控机理研究奠定基础。
本研究在借鉴拟南芥[11]、烟草[12]及蚕豆[17]保卫细胞原生质体的提取的基础上,开展紫花苜蓿保卫细胞提取的研究。旨在探索出适合紫花苜蓿保卫细胞原生质体的提取方法,获得纯度高、活性强的紫花苜蓿保卫细胞原生质体。
1 材料与方法
1.1试验材料
1.1.1供试材料 供试的紫花苜蓿品种为雷达克之星,购于北京克劳沃种业科技有限公司。
1.1.2紫花苜蓿的培养 紫花苜蓿种子经75%酒精消毒15 s,用蒸馏水冲洗5次后,5%次氯酸钠消毒5 min并用蒸馏水冲洗干净。将种子均匀摆放在铺有滤纸的培养皿上,放在人工培养间培养。生长条件:光/暗周期为16 h/8 h,光源为荧光灯,光强96 μmol·(m2·s)-1,温度25 ℃,湿度50%。在人工培养间培养5 d后将萌发均匀健壮的幼苗移栽至装有营养土的花盆中,并将花盆摆放在温室(光/暗周期为16 h/8 h,光强216 μmol·(m2·s)-1,昼/夜温度30/25 ℃,湿度50%)中。在幼苗生长期间定期浇水,待60 d后,选取紫花苜蓿成熟叶片做为试验材料。
1.2试剂
1.2.1基础溶液 5 mmol·L-1MES,0.55 mol·L-1山梨醇,0.5 mmol·L-1CaCl2,0.5 mmol·L-1MgCl2,0.5 mmol·L-1抗坏血酸,10 μmol·L-1KH2PO4,并用Tris-HCl调至pH 5.8。配置好的基础溶液置于4 ℃可保存30 d。
1.2.2酶液Ⅰ 在55 %基础溶液(基础溶液∶水55∶45) 加入0.1%PVP-40,0.25%BSA,0.1% Macerozyme- R-10,1.0% Cellulase R-10(Yakuh Honsha Co.,Tokyo,Japan)。酶液Ⅰ现用现配,配制好的酶液Ⅰ用滤膜(孔径0.22 μm)除菌后置于4 ℃ 可保存3~7 d。
1.2.3酶液Ⅱ 在基础溶液中加入0.25% BSA,1.1% Onozuka RS(Yakuh Honsha Co.,Tokyo,Japan),0.03% Pectolyase Y-23 (Yakuh Honsha Co.,Tokyo,Japan)。将配制好的酶液Ⅱ用HCl将pH调至3.5保持5 min后用Tris-HCl将pH调回 5.8 以消除其中的蛋白酶。酶液Ⅱ现用现配,配制好的酶液Ⅱ用滤膜(孔径0.22 μm)除菌后置于4 ℃保存3~7 d。
1.2.4荧光素双醋酸酯(Fluorescein Diacetate,FDA)染液 用丙酮配制 10 mmol·L-1FDA母液,工作液浓度为2.5 μmol·L-1,-20 ℃避光保存。
1.3方法
1.3.1紫花苜蓿叶片表皮的获得 因为苜蓿表皮和叶肉细胞黏连紧密不易撕取,所以分别采取研磨和匀浆机处理法获得表皮。
研磨法获得表皮:摘取紫花苜蓿成熟的叶片3~5片用手术刀去除各个小叶的主叶脉。将去掉主脉的小叶放入研钵中加入蒸馏水研磨(不加石英砂),待大部分叶肉细胞破碎用74 μm尼龙网过滤并用蒸馏水冲洗剩余碎表皮条。观察剩余碎表皮条中是否还存在大块叶肉,若有则用镊子挑出并再次研磨过滤,直到最终获得的碎表皮条中无明显深绿色组织。
匀浆机处理获得表皮:因匀浆机需要大量叶片才能达到匀浆效果,故操作时向匀浆机中加入去除主叶脉的50片紫花苜蓿小叶并加入500 mL蒸馏水,12 000 r·min-1研磨两次,每次研磨30 s。将研磨后的碎表皮条用 74 μm尼龙网过滤并用蒸馏水反复冲洗剩余碎表皮条,若有大块未打碎的表皮条用镊子挑出并弃掉。
1.3.2第1步酶解 参照Zhu等[15]少量提取的方法并略有改动。将碎表皮条放入10 mL烧杯中并加入2 mL的酶液Ⅰ。用锡箔纸将烧杯包裹并放入28 ℃摇床中,120 r·min-1摇床震荡1 h。震荡1 h后用注射器向烧杯中注入2 mL基础溶液,再在同样条件下震荡5 min。震荡结束后用74 μm尼龙网过滤收集表皮条,并用基础溶液冲洗。
1.3.3第2步酶解 将上述表皮条转移到新的10 mL烧杯中并加入2 mL酶液Ⅱ。用锡箔纸将烧杯包裹并放入20 ℃摇床中,50 r·min-1摇床震荡2 h后,每30 min做一次镜检,直到大部分保卫细胞细胞壁酶解原生质体变为圆形即可停止酶解。用胶头滴管轻轻吹吸酶解液数次,以利于保卫细胞的释放。
1.3.4收集原生质体 将上述酶解液用孔径10 μm尼龙网过滤并用15 mL离心管收集滤液,接着用10 mL基础溶液冲洗滤网上的碎表皮,使粘连的保卫细胞进一步释放出来,用同一个离心管收集滤液。将离心管放入离心机在 200 r·min-1下离心5 min,快速倒去上清液,用300~500 μL基础溶液重新悬浮沉淀,再重复3~4次上述步骤以去除杂质。最终用200 μL基础溶液悬浮原生质体,并抽取20 μL镜检统计悬浮液中所有保卫细胞数量,重复3次,最后计算其平均值并乘以10即为提取保卫细胞原生质体数量的粗略估计值。
1.3.5保卫细胞原生质体活性检测 取原生质体提取液滴于载玻片上,将配制好的FDA母液稀释至终浓度2.5 μmol·L-1,在室温下孵育5 min后在 488 nm荧光下检测原生质体活性。
2 结果与分析
2.1研磨与匀浆机获得其皮及提取的原生质体效果对比
研磨方法获得的表皮(图1A)比匀浆机获得的表皮(图1B)含更少的叶肉细胞。通过研磨方式最终获得的保卫细胞原生质体中只有少量叶肉细胞的叶绿体残渣(图2A),而通过匀浆机处理最终获得的保卫细胞原生质体中混有完整的叶肉细胞(如箭头所示)以及叶绿体残渣(图2B)。

图1 研磨与匀浆机处理获得的表皮对比Fig. 1 Comparison of epidermis obtained by grinding and blending
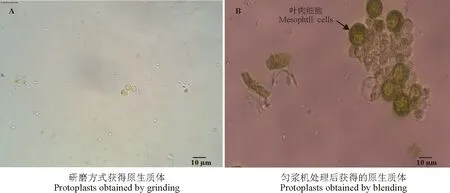
图2 研磨与匀浆机处理获得的原生质体对比Fig. 2 Comparison of protoplasts obtained by grinding and blending
2.2保卫细胞提取
在酶解开始前可以清晰地看到表皮细胞的细胞壁,并且表皮连有少量残余的叶肉细胞(图3A)。在第1步酶解后,表皮细胞的细胞壁开始降解并开始变得模糊,保卫细胞的轮廓开始变得明显,同时粘连的叶肉细胞变少(图3B)。第2步酶解2 h后保卫细胞原生质体开始膨胀,有的保卫细胞原生质体从气孔位置脱离出来,表皮细胞细胞壁进一步模糊(图3C)。第2步酶解2 h后每半小时镜检一次直到50%保卫细胞的细胞壁消失而变圆即可停止酶解进行纯化(图3D)。纯化后的基础溶液中基本没有表皮细胞和叶片上的绒毛,仅有少量附着在保卫细胞原生质体上的叶肉细胞叶绿体,以及一些酶解后的残渣和大量的保卫细胞原生质体(图3E)。按1.3.4的方法将所得保卫细胞原生质体进行计数,每5片成熟叶片可获得1 000个以上的保卫细胞原生质体(表1)。经过FDA染色后,高活性的保卫细胞原生质体在488 nm的激发光下发出绿色荧光,同时保卫细胞的叶绿体在此波长下可发出红色荧光,最终获得的保卫细胞原生质体均发出绿色荧光,并可以看见保卫细胞叶绿体所发出的红光(图3F),经统计活性保卫细胞原生质体在90 %以上(表1)。
3 讨论与结论
要获得尽可能只含保卫细胞的叶片表皮是保卫细胞原生质体制备的关键步骤,除了研磨法和匀浆法外,本研究在提取紫花苜蓿保卫细胞初期时曾经尝试通过撕取紫花苜蓿表皮获得表皮条,但效果不理想。经对效比后发现,在获得表皮的纯净度方面,研磨法较匀浆法果更佳。但在需要大量原生质体时,研磨方式过于费时费力,所以可采用匀浆机操作获得大量表皮,但最终纯度会受到影响。

图3 保卫细胞原生质体提取Fig. 3 Isolation of the guard cell protoplasts

表1 每5片成熟叶可获得原生质体数和有活性保卫细胞原生质体数Table 1 Number of guard cell protoplasts(GCP) and viable guard cell protoplasts for every 5 leaves
基础溶液有采用山梨醇和甘露醇两种调节渗透压的配制方法。本研究推荐采用山梨醇,因为甘露醇会在水分蒸发后结晶影响后续试验和镜检观察。酶液的配制因植物材料不同也不尽相同[22-28]。本研究参考Zhu等[15]提取蚕豆保卫细胞的方法获得了较好的效果。此外在酶解过程中最好时常取少量酶解中的表皮进行镜检,检查保卫细胞是否完整,若某一步镜检发现保卫细胞大量破裂应停止酶解,找出原因再重新进行试验。
此外,在离心纯化后的基础溶液中会有少量叶肉细胞,这是由于一些叶肉细胞原生质体稍大于保卫细胞原生质体,并且尼龙网规格并不标准导致过滤不够充分造成的。同时,也会有少量叶绿体的污染,这是因为叶肉细胞原生质体破裂后叶绿体会进入酶解液中[15],并且叶绿体体积小于保卫细胞原生质体体积,因此,并不会被尼龙网筛掉。但叶绿体RNA并没有PolyA结构,所以少量的叶绿体存在并不影响后续的RNA-seq、膜片钳等试验。
FDA染色后,在488 nm下高活性的原生质体会呈绿色,活性一般的会呈黄色,没有活性的原生质体因膜结构不完整而会呈红色。本研究所获得的有活性的原生质体占所有原生质体90%以上,该结果与前人研究结果相似[29-30]。此外,本研究中每5片成熟的紫花苜蓿可获得保卫细胞原生质体1 000个以上,Zhu等[15]在拟南芥的研究中每4~6片单叶可获得200~300个保卫细胞原生质体,而Kruse等[17]可以在每片蚕豆叶片中提取9 000个保卫细胞原生质体。这可能是由于植物材料、气孔的密度等不同和叶片大小不一样导致获得的原生质体在数量上存在较大差异[31-32]。
同时,本研究仍存在一些不足,需进一步改进。比如获得的保卫细胞原生质体中仍混有叶肉细胞、少量叶绿体、酶解后的碎渣等杂质,这是因为其体积比保卫细胞原生质体要小。在今后的研究中还需探索出适合紫花苜蓿保卫细胞原生质体纯化的密度梯度离心条件以及采用孔径精度更高的尼龙网。
本研究首次摸索出适合紫花苜蓿保卫细胞原生质体的提取方法,获得的了高活性的保卫细胞原生质体,可为后续的膜片钳、保卫细胞RNA测序等相关研究提供可靠的试验材料。
References:
[1] 张晓娜,宋书红,陈志飞,张莹,杨云贵.紫花苜蓿叶、茎产量及品质动态.草业科学,2016,33(4):713-721.
Zhang X N,Song S H,Chen Z F,Zhang Y,Yang Y G.Effects of growth stage on yield and quality of leaf and stem.Pratacultural Science,2016,33(4):713-721.(in Chinese)
[2] 孙建平,张志华,董宽虎.晋北地区不同紫花苜蓿品种生产性能比较.草业科学,2016,33(11):2300-2305.
Sun J P,Zhang Z H,Dong K H.Production performance comparison of different alfalfa varieties in north Shanxi.Pratacultural Science,2016,33(11):2300-2305.(in Chinese)
[3] Ma Q L,Kang J M,Long R C,Cui Y J,Zhang T J,Xiong J B,Yang Q C,Sun Y.Proteomic analysis of salt and osmotic-drought stress in alfalfa seedlings.Journal of Integrative Agriculture,2016,10(15):2266-2278.
[4] 宋兴阳,王琦,李富春,胡广荣,张登奎,张恩和,刘青林,王鹤龄.覆盖材料和沟垄比对土壤水分和紫花苜蓿干草产量的影响.生态学报,2017,37(3):1-12.
Song X Y,Wang Q,Li F C,Hu G R,Zhang D K,Zhang E H,Liu Q L,Wang H L.Effect of mulching materials and furrow-to-ridge rations on soil moisture and alfalfa forageyield.Acta Ecologica Sinica,2017,37(3):1-12.(in Chinese)
[5] Caspar C,Julie E.Gray stomatal closure:The old guard takes up the SLAC.Current Biology,2015,25(7):271-273.
[6] Fairley Grenot K A,Assmann S M.Comparison of K+channel activation and deactivation in guard cells from a dicotyledon (ViciafabaL.) and a graminaceous monocotyledon (Zeamays).Planta,1993,189(3):410-419.
[7] Nisita O,Shweta P,Maeli M.Guard cell purification and RNA isolation suitable for high throughput transcriptional analysis of cell type responses to biotic stresses.Molecular Plant Microbe Interactions,2013,26(8):844-849.
[8] Schnabl H,Bornman C H,Ziegler H.Studies on isolated starch containing (Viciafaba) and starch deficient (Alliumcepa) guard cell protoplasts.Planta,1978,143(1):33-39.
[9] Pandey S,Wang X S,Coursol S A,Assmann S M.Preparation and applications ofArabidopsisthalianaguard cell protoplasts.New Phytologist,2002,153(3):517-526.
[10] Cupples W,Lee J,Tallman G.Division of guard cell protoplasts ofNicotianaglauca(Graham) in liquid cultures.Plant,Cell & Environment,1991,14(7):691-697.
[11] Fairley Grenot K A,Assmann S M.Whole cell K+current across the plasma membrane of guard cells from a grass:Zeamays.Planta,1992,186(2):282-293.
[12] Schroeder J I,Hedrich R,Fernandez J M.Potassium selective single channels in guard cell protoplasts ofViciafaba.Nature,1984,312:361-362.
[13] Sahgal P,Martinez G V,Roberts C,Tallman G.Regeneration of plants from cultured guard cell protoplasts ofNicotianaglauca(Graham).Plant Science,1994,97(2):199-208.
[14] 向明惠,余叔文.分离,净化保卫细胞原生质体方法介绍.植物生理学通讯,1989(2):71-73.
Xiang M H,Yu S W.Separation and purification of guard cell protoplast.Plant Physiology Communications,1989(2):71-73.(in Chinese)
[15] Zhu M M,Jeon B W,Geng S S,Yu Y Q,Kelly B,Chen S X,Assmann S M.Preparation of epidermal peels and guard cell protoplasts for cellular,electrophysiological,and omics assays of guard cell function.Methods in Molecular Biology,2016,1363:89-121.
[16] Wang F,Jia J J,Wang Y,Wang W X,Chen Y L,Liu T,Shang Z L.Hyperpolization activated Ca2+,channels in guard cell plasma membrane are involved in extracellular ATP promoted stomatal opening inViciafaba.Journal of Plant Physiology,2014,171(14):1241-1247.
[17] Kruse T,Tallman G,Zeiger E.Isolation of guard cell protoplasts from mechanically prepared epidermis ofViciafabaleaves.Plant Physiology,1989,90(4):1382-1386.
[18] 梁芸,孙宁,魏凤菊.大量提取拟南芥保卫细胞原生质体方法的优化.河北农业大学学报,2014,37(5):12-17.
Liang Y,Sun N,Wei F J.Optimization on large scale isolation of guard cell protoplasts fromArabidopsisthaliana.Journal of Agricultural University of Hebei,2014,37(5):12-17.(in Chinese)
[20] Schnabl H,Hampp R.Vicia guard cell protoplasts lack photosystem Ⅱ activity.The Science of Nature,1980,67(9):465-466.
[21] Ritte G,Raschke K.Rates of sugar uptake by guard cell protoplasts ofPisumsativumL. related to the solute requirement for stomatal opening.Plant Physiology,1999,121(2):647-656.
[22] Ueno K,Kinoshita T,Inoue S.Biochemical characterization of plasma membrane H+ATPase activation in guard cell protoplasts ofArabidopsisthalianain response to blue light.Plant & Cell Physiology,2005,46(6):955-963.
[23] Zhang W,Nilson S E,Assmann S M.Isolation and whole cell patch clamping ofArabidopsisguardcell protoplasts.Cold Spring Harbor Protocols,2008,3(6):1-6.
[24] Schroeder J I,Raschke K,Neher E.Voltage dependence of K channels in guard cell protoplasts.Proceedings of the National Academy of Sciences of the United States of America,1987,84(12):4108-4112.
[25] Leonhardt N,Kwak J M,Robert N,Waner D,Leonhardt G,Schroeder J.Microarray expression analyses ofArabidopsisguard cells and isolation of a recessive abscisic acid hypersensitive protein phosphatase 2C mutant.Plant Cell,2004,16(3):596-615.
[26] Goh C H,Schreiber U,Hedrich R.New approach of monitoring changes in chlorophyll a fluorescence of single guard cells and protoplasts in response to physiological stimuli.Plant,Cell & Environment,2002,22(9):1057-1070.
[27] Weissenböck G,Hedrich R,Sachs G.Secondary phenolic products in isolated guard cell,epidermal cell and mesophyll cell protoplasts from pea (PisumsativumL.) leaves:Distribution and determination.Protoplasma,1986,134(2):141-148.
[28] Donovan N,Gibb E.A comparison of the kinetic properties of phosphoenolpyruvate carboxylase from guard cell and mesophyll cell protoplasts ofCommelinacommunis.Planta,1985,164(1):115-120.
[29] 项燕,武永军,张花,梁宗锁.从蚕豆叶片中提取保卫细胞原生质体方法的改进.西北农业学报,2009,18(6):166-169.
Xiang Y,Wu Y J,Zhang H,Liang Z S.Improved method for preparation of guard cell protoplasts from leaves ofViciafaba.Acta Agriculturae Boreali-occidentalis Sinica,2009,18(6):166-169.(in Chinese)
[30] 杨瑞楠,赵福宽,于涌鲲,秦勇,孙清鹏.两步酶解法制备拟南芥保卫细胞原生质体.北京农学院学报,2008,23(4):67-69.
Yang R N,Zhao F K,Yu Y K,Qin Y,Sun Q P.Two step enzyme digestion ofArabidopsisguardcell protoplasts.Journal of Beijing University of Agriculture,2008,23(4):67-69.(in Chinese)
[31] 李俊林,韩蕾,金曼,张焕朝,苏彦华.蒙古沙冬青气孔及保卫细胞内向钾离子通道特性研究.基因组学与应用生物学,2015,34(11):2502-2507.
Li J L,Han L,Jin M,Zhang H C,Su Y H.Characteristics analysis ofAmmopiptanthusmongolicusstomata and inward potassium channels in guard cell ofAmmopiptanthusmongolicus.Genomics and Applied Biology,2015,34(11):2502-2507.(in Chinese)
[32] 王恒彬,王学臣,陈珈,曹敏,李云荫.蚕豆保卫细胞原生质体质膜ABA结合蛋白的理化特性.植物学报,1997,39(1):43-48.
Wang H B,Wang X C,Chen J,Cao M,Li Y Y.Characteristics of ABA binding proteins on the plasmalemma of guard cells inViciafaba.Acta Botanica Sinica,1997,39(1):43-48.(in Chinese)
PreparationofguardcellprotoplastsfromMedicagosativa
An Jie, You Zang, Cao Yu-Man, Ren Peng-hui, Liu Jin-long, Yang Pei-zhi
(College of Animal Science and Technology, Northwest A&F University, Yangling 712100, Shaanxi, China)
To obtain protoplasts of alfalfa (Medicagosativa) guard cells and lay the foundation for further research into guard cell protoplasts, the utility of a method for extracting guard cells from alfalfa leaves was explored. Epidermal peels were obtained by grinding and using a blender. Two-step enzyme digestion was used to remove mesophyll cells from the epidermal peels and guard cell walls; guard cell protoplasts were obtained through repeated filtration and centrifugation. Finally, the number of protoplasts was counted and their viability was assessed by fluorescein diacetate (FDA) staining. The results showed that this method yielded alfalfa guard cell protoplasts in an efficient manner, with 1 000 protoplasts isolated from samples of five leaves and a rate of viable guard cell protoplasts of more than 90%.
alfalfa; guard cell; protoplasts preparation; two-step enzyme digestion
Yang Pei-zhi E-mail:yangpeizhi@126.com
10.11829/j.issn.1001-0629.2016-0598
安杰,尤章,曹玉曼,任鹏辉,刘金隆,杨培志.紫花苜蓿保卫细胞原生质体的制备.草业科学,2017,34(10):2063-2069.
An J,You Z,Cao Y M,Ren P H,Liu J L,Yang P Z.Preparation of guard cell protoplasts fromMedicagosativa.Pratacultural Science,2017,34(10):2063-2069.
S541+.1;Q944.4
A
1001-0629(2017)10-2063-07
2016-12-03
2017-01-25
国家自然科学基金(31572456);国家牧草产业技术体系(CARS-35-40)
安杰(1992-),男,山西大同人,在读硕士生,研究方向为紫花苜蓿抗逆性研究。E-mail:18700943011@163.com
杨培志(1977-),男,河北衡水人,副教授,博士,研究方向为牧草育种、逆境生理及分子生物学。E-mail:yangpeizhi@126.com
(责任编辑 张瑾)
2017年9月国际市场主要畜产品与饲料价格分析
9月国际饲料价格普遍出现上涨,而畜产品价格普遍持续下跌。
一、除玉米和菜籽价格持续下跌外,其他饲料价格普遍出现上涨
9月份美国玉米和菜籽市场价格分别为136.33和377.32 USD·t-1,环比分别下跌2.60%和2.25%。而大豆、高粱、豆粕、豆粉、棉籽饼和苜蓿粉市场平均价格分别为352.44、137.89、335.64、295.99、231.39和207.94 USD·t-1,环比分别上涨2.00%、6.89%、2.06%、2.92%、2.37%和0.94%,其中涨幅最大为高粱,上涨6.89%;苜蓿粉涨幅最小,为0.94%。
二、除育肥牛、羊肉和羊羔肉市场平均价格持续上涨外,其他畜产品价格持续下跌
9月份美国育肥牛和新西兰羊肉、羊羔肉市场平均价格分别为3.28、3.58和6.05 UDD·kg-1,环比依次上涨3.47%、0.94%和1.20%。而瘦肉猪、牛奶、牛肉和欧盟鸡肉、猪肉市场价格持续下跌,平均价格分别为1.30、0.31、4.57、2.40和1.30 USD·kg-1,其中瘦肉猪价格跌幅最大,环比下降20.00%,其他畜产品环比依次下跌4.53%、2.00%、0.35%和3.90%。

图1 2017年9月国际市场主要饲料与畜产品价格
数据来源:国际市场商品价格网http://price.mofcom.gov.cn/;中国农业信息http://www.agri.gov.cn/;鸡肉http://www.indexmundi.com/;羊肉http://interest.co.nz/rural;牛肉http://www.thebeefsite.com/;猪肉http://www.thepigsite.com/;货币汇率 http://qq.ip138.com/hl.asp。
(兰州大学草地农业科技学院 杨春涛 整理)

