不同光环境下金边百里香的形态和生理可塑性
李金平,任瑞芬,尹大芳,郭 芳,杨秀云
(1.山西潞安矿业集团林业处,山西 长治 047400; 2.山西农业大学林学院,山西 太谷 030800)
不同光环境下金边百里香的形态和生理可塑性
李金平1,任瑞芬2,尹大芳2,郭 芳2,杨秀云2
(1.山西潞安矿业集团林业处,山西 长治 047400; 2.山西农业大学林学院,山西 太谷 030800)
本研究采用1年龄金边百里香(Thymusmongolicus)幼苗为试验材料,以自然光照作为对照处理,设置25%、50%和75%遮光处理梯度,分别于处理0、7、14、24、44 d时测定其叶部、根部的生理和形态指标,以期为芳香地被植物的选育及推广提供基础理论依据。结果表明,1)在处理14 d时干物质分配发生了改变,通过增加叶重比、降低根重比来平衡不同光环境下植株体内的养分累积。2)50%的光照处理显著促进了叶部超氧化物歧化酶(SOD)的活性,增加了根部渗透调节物质可溶性蛋白的含量,抑制了植株内丙二醛(MDA)的积累,表现出较强的生理可塑性。3)金边百里香在50%的光环境较其它光环境处理下的形态和生理可塑性强,且不同光环境下叶部的生理可塑性较根部显著。
芳香地被:金边百里香;光照处理;形态可塑性;生理可塑性
近年来,地被植物因其覆盖力强、易繁殖、适应性强、耐修剪、养护管理粗放以及丰富的群落层次和视觉效果,在城市园林应用中引起了人们的广泛关注[1]。然而,日益加速的城市化进程以及复合式种植结构的盛行造成了大面积的阴蔽小生境[2-3]。地被植物作为自然群落的最下层,对光照条件的适应性决定了不同地被植物在城市绿化中的应用形式[4]。其中,植物的可塑性是由基因型主导,通过生理以及形态上作出相应变化来适应环境条件的改变[5-7]。因此,在不同光环境下探讨地被植物的形态和生理可塑性,对于优化园林植物配置,建立稳定而多样化的园林种植结构模式,提高单位绿地的园林生态效益,具有重要的现实意义[8-9]。
百里香属(Thymus)植物为唇形科优良的观花地被植物[10],兼有较高的食用、药用和化工价值,同时还具有芳香、绿化和环保等多效功能[11-12],是一种开发潜力较大的芳香地被植物[13]。此外,由于其突出的耐寒、耐旱、耐瘠薄、抗病虫能力,以及生长速度快、花量大、花期长等优良特性,已成为现代城市园林绿化中不可多得的优良地被植物[14-15]。目前关于百里香属植物的研究多集中于芳香成分分析、种质资源方面的应用性研究[16-19],对于其在阴蔽环境下的生理可塑性研究较少。因此,本研究以1年龄生金边百里香(Thymusmongolicus)幼苗为材料,探讨不同光环境下金边百里香的形态和生理可塑性,以期为芳香地被植物的选育及推广提供基础的理论依据。
1 材料与方法
1.1试验材料
以长势一致的1年生金边百里香幼苗(株高16~20 cm)为试验材料。其中,幼苗栽植于15 cm×15 cm×20 cm的花盆中,栽培基质为混合土壤(体积比为原土∶砂土∶腐殖质=2∶1∶1)。
1.2试验方法
本研究采用单因素随机区组设计,从2014年8月1日开始采用不同透光率的PVC黑色塑料遮阴网对金边百里香进行不同强度的光照处理。遮阴棚设于远离建筑等障碍物的空旷地带,南北向放置,便于通风透气,东西向遮阴网设于距地面150 cm处。试验共设4个处理梯度,分别为全光照(自然光照CK)、75%光照(75%透光率的遮阴网)、50%光照(50%透光率的遮阴网)、25%光照(25%透光率的遮阴网)[20],每个处理设3次重复,每个重复15株。且各植株间保持一定的距离,避免造成冠层间受光干扰,确保各处理间栽培管理的一致性。
1.3指标测定
每个处理随机取3株,分别于遮阴0、7、14、24和44 d(分别为8月1日、8月8日、8月14日、8月24日、9月14日)测定各部位的生理和形态指标。其中,株高、节间长度、叶长、叶宽采用游标卡尺测定;叶面积采用CAD图像参考法测定;干重采用烘干法测定(105 ℃杀青,80 ℃烘干至恒重),并计算叶重比(叶部生物量/总生物量)和根重比(根部生物量/总生物量);叶绿素采用乙醇研磨比色法测定;丙二醛(MDA)含量采用硫代巴比妥酸(TCA)法测定;超氧化物歧化酶(SOD)活性的采用氮蓝四唑(NBT)还原法测定;可溶性蛋白采用考马斯亮蓝比色法测定[21]。
1.4数据处理
试验数据采用Excel 2003进行初步统计以及图标制作,用SPSS 17.0软件对形态指标进行one-way ANOVA方差分析以及LSD法做多重比较。同时,以处理时间和光照处理梯度两个影响因子对法国百里香各形态和生理指标进行双因素方差分析以及对各指标间进行相关性分析。
2 结果与分析
2.1不同光照条件对金边百里香形态可塑性的影响
2.1.1不同光照条件对金边百里香形态指标的影响 处理时间、光照梯度及二者的互作均极显著影响了金边百里香株高、节间长和单叶面积(P<0.01)(表1)。处理 14 d时,株高、单叶面积各处理间差异显著(P<0.05)(表2);处理24 d时,各处理间的差异变大,株高、节间长及单叶面积增幅达到最大值; 44 d时,75%、50%、25%光照处理下的株高、节间长和单叶面积显著高于全光照,株高分别比全光照高3.38、4.71、2.04 cm,节间长分别长6.51、12.20、4.87 mm,单叶面积分别较全光照处理大7.02、8.85、4.65 mm2。
2.1.2不同光照条件对金边百里香干重及干重比的影响 处理时间、光照梯度及二者的交互作用对金边百里香干重的影响达到显著或极显著水平(表1)(P<0.05,P<0.01)(表1)。在不同光照条件下,随着培养时间的延长,金边百里香干重呈上升趋势(表3)。不同光环境下的金边百里香的干重在处理7和14 d时,各处理间差异不显著(P>0.05)。干重的增幅在处理24 d时达到最大值,且50%和75%光照处理显著高于全光照(P<0.05),75%、50%、25%光照处理下的干重分别较全光照处理大1.05、1.93、0.60 g。44 d时,各处理间的差异显著,且显著大于全光照,75%、50%、25%光环境下的干重分别较全光照大2.02、2.95、0.76 g。

表1 处理时间和光照梯度对金边百里香形态指标的影响Table 1 Interaction effects of treatment time and light gradient on morphological indexes in Thymus mongolicus
注:*表示影响显著(P<0.05);**表示影响极显著(P<0.01)。表4、表5、表6同。
Note:* indicate significant at the 0.05 level;** indicate significant at the 0.01 level; similarly for Table 4, Table 5 and Table 6.

表2 不同光照条件下金边百里香的形态指标Table 2 Morphological indexes in Thymus mongolicus under different light conditions
注:同列相同指标不同小写字母表示不同光照条件间差异显著(P<0.05)。表3同。
Note: Different lowcase letters within the same column for the same parameter indicate significant difference among different light treatments at the 0.05 level; similarly for Table 3.
处理时间及其与光照梯度的交互作用对金边百里香叶重比的影响均不显著(表1)(P>0.05),不同光环境下金边百里香的叶重比随着培养时间的延长呈上升趋势(表3),且各处理下的叶重比均大于全光照。不同光环境下的金边百里香的叶重比在处理7、14以及24 d时,各处理间差异均不显著(P>0.05)。在处理44 d时,各处理间的差异显著,且75%和50%的光照处理分别较全光照处理的叶重比大9.09%、30.30%。其中,25%的光照处理下的叶重比在处理44 d时出现了下降,这可能是由于25%光环境下叶片变薄,且植株底端部分叶片黄化所致。
处理时间和光照梯度对根重比的影响均达到极显著水平(表1)(P<0.01),而二者的互作对根重比的影响不显著(P>0.05)。随着培养时间的延长金边百里香的根重比呈下降趋势,且各处理间的差异逐渐增大(表3)(P<0.05)。不同光照条件下金边百里香的根重比在处理7 d和14 d时,各处理间的差异均不显著。24 d时,各处理间差异显著(P<0.05),且50%和25%光照处理下的根重比分别较全光照处理低20.59%、38.24%。处理44 d时,各处理间差异显著,且50%和25%光照处理下根重比较全光照显著降低。
2.2不同光照条件下金边百里香叶部的生理可塑性
处理时间与光照梯度的交互作用对金边百里香叶部MDA含量的影响显著(表4)(P<0.05)。不同光环境下金边百里香叶部的MDA含量随着培养时间的延长,各处理间的差异变得显著(P<0.05)(图1)。不同光照处理7 d时,50%和25%光照处理下的MDA含量显著高于全光照处理。14 d时,各处理间差异未达到显著水平(P<0.05),75%和25%的光照处理下MDA的含量显著低于CK和50%。24 d时,50%和25%光照处理下促进了MDA含量的合成,且显著高于对照处理。处理44 d时,各处理间差异显著(P<0.05),50%的光照处理MDA显著降低。
处理时间、光照梯度及二者的互作均极显著影响了金边百里香叶部SOD活性(表4)(P<0.01)。金边百里香叶部SOD的活性呈先升后降的变化趋势(图1),且随着处理时间的延长,各处理间差异从处理14 d开始显著(P<0.05)。不同光环境处理14 d时,各处理间差异显著,SOD活性表现为25%>75%>50%;处理24 d和44 d时的变化趋势一致,各处理间差异显著,且与其它各处理相比50%光照处理显著促进了叶部SOD的合成,而75%和25%的光环境抑制了SOD的活性。
处理时间及其与光照梯度互作均极显著影响了金边百里香叶部可溶性蛋白含量(表4)(P<0.01)。不同光照条件下金边百里香叶部的可溶性蛋白含量整体呈下降的变化趋势(图1),且随着处理时间的延长,各处理间的差异变得显著(P<0.05)。对金边百里香进行不同光强处理7 d时, 75%和25%光照处理下的可溶性蛋白含量显著低于全光照处理,而50%光照处理下的含量则显著高于全光照处理。24 d时,不同光照处理间差异不显著,且不同光照处理下的可溶性蛋白含量均低于全光照处理。处理44 d时,各处理间的差异显著,75%和50%的光照处理促进了叶部可溶性蛋白的合成。

表3 不同光照条件下金边百里香的干重Table 3 Dry weights of Thymus mongolicus under different light conditions

表4 处理时间和光照梯度对金边百里香叶部生理指标的影响Table 4 Interaction effects of treatment time and light gradient on the leaf physiological indexes of Thymus mongolicus

图1 不同光照条件对金边百里香叶部生理指标的影响Fig. 1 Effects of different light conditions on leaf physiological index of Thymus mongolicus
注:不同小写字母表示相同处理时间不同光照处理间差异显著(P<0.05)。下同。
Note:Different lowercase letters within the same treatment time indicate significant difference among different light treatments at the 0.05 level; similerly for the following figures.
2.3不同光照条件下金边百里香根部的生理可塑性
处理时间与光照梯度的交互作用以及光照梯度单独作用对金边百里香根部MDA含量的影响均未达到显著水平(表5)(P>0.05)。不同光环境下金边百里香根部MDA的含量随着培养时间的延长呈先降后升的变化趋势(图2)。不同光环境下的金边百里香在处理7 d时,各处理下的MDA含量均低于全光照处理(P<0.05),其中50%的光照处理显著抑制了MDA的合成,显著低于全光照和其他光照处理。14 d不同处理间的差异均不显著(P<0.05),各处理的MDA含量显著高于同期全光照,而24 d时50%和25%各处理的含量显著低于同期全光照。处理44 d时,不同的光照处理显著促进了根部MDA的合成,且各处理下的MDA含量均显著高于全光照。
处理时间与光照梯度的交互作用以及光照梯度单独作用对金边百里香根部SOD活性的影响达到显著(P<0.05)和极显著水平(表5)(P<0.01)。金边百里香根部SOD的活性随着处理时间的延长金边百里香根部SOD活性在各光照处理间开始有差异,并在14 d时达到显著水平(图2)(P<0.05)。不同光环境处理7 d时,50%的光照处理显著高于75%和25%的光照处理,50%的光照处理增强了SOD的活性,而75%和25%的光照处理则抑制了SOD的活性,且显著低于全光照处理。14 d时,各处理间差异显著,SOD的活性表现为75%>25%>50%,且均显著低于全光照处理。处理24 d和44 d时,50%的光照处理显著高于75%和25%的光照处理。
处理时间、光照梯度以及二者的交互作用均极显著影响了金边百里香根部可溶性蛋白含量(表5)(P<0.01)。不同光照条件下金边百里香根部可溶性蛋白含量随着处理时间的延长,各处理间的差异变得显著(图2)(P<0.05)。金边百里香在不同光照强度处理的7 d时,各处理间差异不显著(P>0.05)。处理14和24 d时,根部的可溶性蛋白含量的变化趋势一致,均表现50%处理下的可溶性蛋白含量显著增高,显为著高于全光照处理,75%和25%光照处理的含量与全光照处理间差异不显著。44 d时,各处理间差异显著,其中25%光照处理显著抑制了可溶性蛋白的合成,50%光照处理下的可溶性蛋白含量保持较高的增长量,75%光照处理保持稳定。
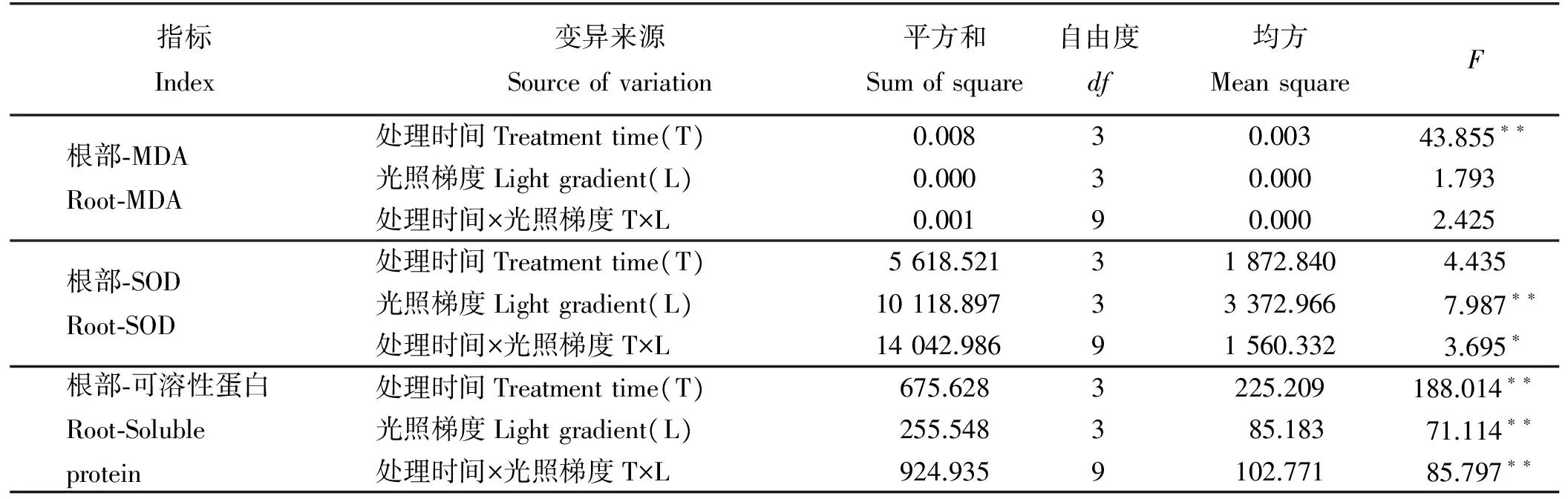
表5 处理时间和光照梯度对金边百里香根部生理指标的影响Table 5 The interaction effects of treatment time and light gradient on the root physiological indexes of Thymus mongolicus

图2 不同光照条件对金边百里香根部生理指标的影响Fig. 2 Effects of different light conditions on root physiological index of Thymus mongolicus
2.4不同光环境下金边百里香各指标的相关性分析
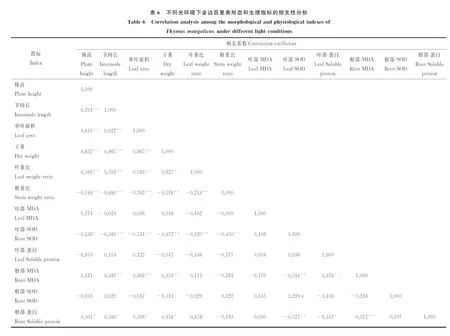
株高、节间长、单叶面积以及叶重比两两间均呈极显著正相关关系(P<0.01)(表6)。而根重比与株高、节间长、单叶面积、干重以及叶重比均呈极显著负相关关系。同时,叶部SOD活性与株高呈显著负相关关系(P<0.05),与节间长、单叶面积、干重、叶重比以及根重比均呈极显著负相关关系(P<0.01),叶部SOD活性与根部SOD活性显著正相关关系(P<0.05)。根部的MDA含量与节间长、单叶面积、干重以及叶部可溶性蛋白呈极显著正相关关系(P<0.01),根部的MDA含量与叶部SOD呈极显著负相关关系。此外,根部的可溶性蛋白含量与株高、节间长、单叶面积、干重以及叶重比显著正相关(P<0.05),根部的可溶性蛋白含量与叶部SOD活性极显著负相关(P<0.01);与叶部可溶性蛋白显著负相关(P<0.05);与根部MDA含量极显著正相关(P<0.01)。
3 讨论
3.1不同光环境下金边百里香的形态可塑性
光作为影响植物生长发育最主要的环境因子之一,是植物生长发育重要的能量源[22]。表型可塑性是植物应对环境变化主要的手段[23],在不同的光照环境下,植物可以通过调整表型可塑性来增强光合作用、增大水分利用率,以维持自身正常的生长和代谢[24]。其中,植株的生长量是适应环境条件最为直观的表现[25],而叶片是对环境条件变化适应性和可塑性最强的器官[26]。本研究中,在不同的光环境下金边百里香通过增加株高、节间长以及单叶面积来调整对光照的适应性,且株高、节间长、单叶面积在不同的光环境下两两之间均极显著正相关(P<0.01)。其中,单叶面积在处理14 d时各处理间差异达到显著水平,而株高和节间长均在24 d时达到显著水平,且50%光照处理下株高、节间长以及单叶面积的可塑性较其他各处理强。
光照强度是影响植株生物量积累的重要环境因子之一[27],随着光照强度的变化,光合作用也产生了一定的变化,导致植株体内有机物的积累以及分配产生了相应的变化。大量研究表明,强光环境下植物的生物量相对较少的用于叶片生长,大量用于根部生长,以捕获足够的水分和养分来维持较高的蒸腾速率后增长率[28-29],而弱光环境下,植物往往通过提高地面生物量的比重(叶和茎)来优化叶片对光能的捕获能力和利用效率以适应弱光环境生存[30-32]。本研究中,不同光环境下金边百里香随着处理时间的延长,干物质积累在不同处理下的差异显著,且干物质含量随着光照强度的减弱而减少。同时,随着处理时间的延长,不同光环境下金边百里香的干物质分配也发生了相应的改变,叶重比增加、根重降低,且两者之间极显著负相关(P<0.01),不同处理间的差异性均在处理24和44 d时达到显著水平,表明不同光照条件下金边百里香可以通过调整生物量的积累与分配比例来适应光环境。
3.2不同光环境下金边百里香根与叶生理属性的关联性
植物地上与地下部分作为一个相互依赖、相互促进的有机整体,根部是植物主要的吸收和合成器官[33],而叶部是植物制造有机养料的主要场所。植物在长期的进化适应过程中形成了多种光防御保护机制[34-35],SOD作为植物体内活性氧清除系统中重要的抗氧化酶类[36],是植物体内防御保护机制的第一道防线,在一定范围内可维持活性氧自由基的产生与清除系统的平衡[37]。本研究中,不同光环境下,金边百里香叶部和根部的SOD活性的变化趋势一致,各处理间差异随着处理时间的延长变的显著,且50%的光照处理显著促进了SOD的合成。其中,叶部SOD活性与株高、节间长、单叶面积、干重、叶重比以及根重比显著或极显著负相关(P<0.05)(P<0.01),且与根部SOD活性显著正相关(P<0.05)。表明在不同的光环境下,金边百里香叶部SOD活性的变化较根部显著。
MDA是脂质过氧化作用的中间产物,当植物受到环境胁迫时,膜脂过氧化作用的增强,生物膜的通透性增大[38],因此,其含量的在一定程度上反映脂膜过氧化水平和膜结构的受害程度[39]。其中,MDA的产生与保护酶的活性有一定的相关性,当保护酶活性较低时,MDA的含量会增加[40]。本研究中,不同光环境下金边百里香根部的MDA含量与节间长、叶面积、干重以及叶部可溶性蛋白极显著正相关(P<0.01),根部的MDA含量与叶部SOD极显著负相关。其中,植株内SOD活性对根部MDA的抑制性较叶部更为明显,在可能是根部作为合成器官优先启动了保护酶对膜系统的防御。
可溶性蛋白也是植物体内重要的渗透调节物质[41],其含量反映了植物体内氮代谢水平和植株生活力的高低,植株内大部分可溶性蛋白的合成均受光的调控[42]。本研究中,金边百里香在不同光照强度处理下,根部可溶性蛋白含量与株高、节间长、单叶面积、叶重比以及根部MDA显著或极显著正相关(P<0.05)(P<0.01),而叶部可溶性蛋白与各形态指标间的相关性均未达到显著水平,说明根部的渗透调节物质可溶性蛋白对于光照较叶部敏感。此外,根部的可溶性蛋白与叶部可溶性蛋白显著负相关(P<0.05),说明根部和叶部的可溶性蛋白含量的变化处于互补型增长,使整个处理期植株内可溶性蛋白保持较高的水平,以防细胞质膜受到损伤[43]。表明金边百里香在不同的光照条件下,可以通过协调不同部位可溶性蛋白含量以保证内环境的稳定。
4 结论
金边百里香通过提高株高、节间长、叶长、叶宽以及叶面积,增加干物质的积累,提高叶重比,降低根重比来适应不同光环境生长。50%的光照条件显著抑制了植株内MDA的合成,降低了细胞膜的透性,提高了可溶性蛋白的含量和SOD的活性,增强了植物的组织防御保护能力。因此,在50%的光环境下金边百里香的形态和生理可塑性较其它光处理下的可塑性高。此外,不同光环境下地上部分酶活性的变化较地下部分显著,而地下部分渗透调节物质的变化较地上部分敏感。
References:
[1] 周潇,毛凯,干友民.我国地被植物耐荫性研究.北方园艺,2007(1):51-53.
Zhou X,Mao K,Gan Y M.Research of cover plant shadow resistance in China.Northern Horticulture,2007(1):51-53.(in Chinese)
[2] 于盈盈,胡聃,郭二辉,肖强,柳敏,张小飞.城市遮阴环境变化对大叶黄杨光合过程的影响.生态学报.2011.31(19):5646-5653.
Yu Y Y,Hu D,Gu E H,Xiao Q,Liu M,Zhang X F.Effects of urban shading on photosynthesis ofEuonymusjaponicas.Acta Ecologica Sinica,2011,31(19):5646-5653.(in Chinese)
[3] 何小燕,马锦林,张日清,叶航.弱光胁迫对植物生长影响的研究进展.经济林研究,2011,29(4):131-136.
He X Y,Ma J L,Zhang R Q,Ye H.Research progress on effects of low-light stress on plant growth.Nonwood Forest Research,2011,29(4):131-136.(in Chinese)
[4] 童开林.10种地被植物的耐阴性与园林适应性比较.西北林学院学报,2012,27(4):234-237.
Tong K L.Comparative studies on shade tolerance and adaptability to garden-environment planting of 10 ground cover plants.Journal of Northwest Forestry University,2012,27(4):234-237.(in Chinese)
[5] FernandoV,José Manuel C,Ismael A,Luis B,Pierre D,Esteban M,Erwin D.The greater seedling high-light tolerance ofQuercusroburoverFagussylvaticais linked to a greater physiological plasticity.Trees,2002,16:395-403.
[6] De Kroons H,Huber H,Stuefer J F,van Groenendael J M.A modular concept of phenotypic plasticity in plants.New Phytologist,2005,166:73-82.
[7] Riis T,Lambertini C,Olesen B,Clayton J S,Brix H,Sorrell B K.Invasion strategies in clonal aquatic plants:Are phenotypic differences caused by phenotypic plasticity or local adaptation.Annals of Botany,2010,106:813-822.
[8] 田福平,武高林,时永杰,杨志强.我国园林地被植物研究现状.草业科学,2006,23(9):111-115.
Tian F P,Wu G L,Shi Y J,Yang Z Q.Review on the research progress of garden lawn plants in China.Pratacultural Science,2006,23(9):111-115.(in Chinese)
[9] 王杰青,祝宁,丁守仓.地被植物研究现状.安徽农业科学,2012,40(1):1-3,12.
Wang J Q,Zhu N,Ding S C.Research status on ground cover plants.Journal of Anhui Agricultural.Science,2012,40(1):1-3,12.(in Chinese)
[10] 穆丹,梁英辉.佳木斯地区百里香的引种栽培及园林应用研究.安徽农学通报,2013,19(16):31-32.
Mu D,Liang Y H.Introduction and landscape application ofThymein Jiamusi region.Anhui Agricultural.Science Bulletin,2013,19(16):31-32.(in Chinese)
[11] Stahl Biskup,Elisabeth,Francisco Sáez.Thyme:The genusThymus.London:Taylor Francis,2002:15-20.
[12] De Lisi A,Tedone L,Montesano V,Sarli G,Negro D.Chemical characterisation ofThymuspopulation belonging from Southern Italy.Food Chemistry,2011,125:1284-1286.
[13] 卞金山,杜广明,赵波.我国百里香属植物研究进展.草原与草坪,2007(1):78-81.
Bian J S,Du G M,Zhao B.Research advances onThymus.Grassland and Turf,2007(1):78-81.(in Chinese)
[14] 权俊萍,吕国华,何树兰,彭峰,聂传胜,夏冰.我国百里香属植物资源调查分析.北方园艺,2012(2):87-91.
Quan J P,Lyu G H,He S L,Peng F,Nie C S,Xia B.Investigation and analysis ofThymuswild resources in China.Northern Horticulture,2012(2):87-91.(in Chinese)
[15] 张颖,贾志斌,杨持.百里香无性系的克隆生长特征.植物生态学报,2007,31(4):630-636.
Zhang Y,Jiang Z B,Yang C.Clonal growth characterstics ofThymusserpyllumvar.asiaticus.Journal of Plant Ecology,2007,31(4):630-636.(in Chinese)
[16] 徐世千,李晓东,张建国.不同方法提取组培百里香精油质量及成分的比较分析.植物科学学报,2013,31(6):609-615.
Xu S Q,Li X D,Zhang J G.Comparative analysis of essential oil quality and composition from tissue culture seedlings ofThymusvulgarisL. using different extraction methods.Plant Science Journal,2013,31(6):609-615.
[17] 裴海闰,韩笑,曹学丽.百里香精油的成分分析及其抗氧化和抑菌活性评价.中国食品学报,2011,11(5):182-188.
Pei H R,Han X,Cao X L.Analysis of the components ofThymusessential oil and its antioxidant and antibacterial activity.Journal of Chinese Institute of Food Science and Technology,2011,11(5):182-188.(in Chinese)
[18] 罗彩霞,田永强,潘彦彪.百里香研究进展.安徽农业科学,2014,42(33):111669-11672.
Luo C X,Tian Y Q,Pan Y B.Research progress ofThymus.Journal of Anhui Agricultural Science,2014,42(33):111669-11672.(in Chinese)
[19] 杨恒,曾凡景,郭甜,卢珊珊,孙健,赵惠恩.百里香研究进展.中国野生植物资源,2012,11(2):4-7.
Yang H,Zeng F J,Guo T,Lu S S,Sun J,Zhao H E.Research advance ofThymus.Chinese Wild Plant Resources,2012,11(2):4-7.(in Chinese)
[20] Seamus K,Kevin B,Conor O,ine N D.The impact of shade on morphology,growth and biomass allocation inPiceasitchensis,Larix×eurolepisandThujaplicata.New Forests,2007,33:139-153.
[21] 李合生,孙群.植物生理生化实验原理和技术.北京:高等教育出版社:2000:164-169.
Li H S,Sun Q.Principle and Technology of Plant Physiological and Biochemical Experiments.Beijing:Higher Education Press,2000,164-169.(in Chinese)
[22] 刘建锋,杨文娟,江泽平,郭泉水,金江群,薛亮.遮荫对濒危植物崖柏光合作用和叶绿素荧光参数的影响.生态学报,2011,31(20):5999-6004.
Liu J F,Yang W J,Jiang Z P,Guo Q S,Jin J Q,Xue L.Effects of shading on photosynthetic characteristics and chlorophyll fluorescence parameters in leaves of the endangered plantThujasutchuenensis.Acta Ecologica Sinica,2011,31(20):5999-6004.(in Chinese)
[23] Valladares F,Gianoli E,Gómez J M.Ecological limits to plant phenotypic plasticity.New Phytologist,2007,176(12):749-763.
[24] 汪越,刘楠,任海,邵玲,陈雄伟,陈刚,王俊.紫背天葵(BegoniafimbristipulaHance)叶片形态和生理生态特征对不同光强的响应.生态环境学报,2015,24(6):957-964.
Wang Y,Liu N,Ren H,Shao L,Chen X W,Chen G,Wang J.Physiological characteristics ofBegoniafimbristipulaHance to light intensity.Ecology and Environmental Sciences,2015,24(6):957-964.(in Chinese)
[25] 招礼军,朱栗琼,谢伟东,刘思祝,欧阳妮,蒋欣,李仁山.红鳞蒲桃幼苗对不同光强的生理生态响应.生态科学,2014,33(6):1177-1181.
Zhao L J,Zhu L Q,Xian W D,Liu S Z,Ouyang N,Jiang X,Li R S.Eco-physiological responses ofSyzygiumhanceiseedlings to different irradiance intensities.Ecological Science,2014,33(6):1177-1181.(in Chinese)
[26] 陈昕,徐宜凤,张振英.干旱胁迫下石灰花楸幼苗叶片的解剖结构和光合生理响应.西北植物学报,2012,32(1):111-116.
Chen X,Xu Y F,Zhang Z Y.Leaf anatomical and phyotosynthetic physiology responses ofSorbusfolgneriseedlings under drought stress.Acta Botanica Boreali-Occidentalia Sinica,2012,32(1):111-116.(in Chinese)
[27] 李金鹏,赵和祥,董然,冯敏.光照强度对两种彩叶玉簪生长及光合特性的影响.南京林业大学学报(自然科学版),2012,36(4):57-61.
Li J P,Zhao H X,Dong R,Feng M.The effect of different light intensity on the growth and photosynthesis characteristics of two kinds of colorfulHosta.Journal of Nanjing Forestry University(Natural Science Edition),2012,36(4):57-61.(in Chinese)
[28] Sims D,Pearcy R.Scaling sun and shade photosynthetic acclimation ofAlocasiamacrorrhizato whole plant performance I.Carbon balance and allocation at different daily photon flux densities.Plant,Cell & Environment,1994,17(6):881-887.
[29] Poorter H,Nagel O.The role of biomass allocation in the growth response of plants to different levels of light,CO2,nutrients and water:A quantitative review.Functional Plant Biology,2000,27(6):1191-1197.
[30] Reich P,Tjoelker M,Walters M,Vanderklein D,Buschena C.Close association of RGR,leaf and root morphology,seed mass and shade tolerance in seedlings of nine boreal tree species grown in high and low light.Functional Ecology,1998,38(12):327-338.
[31] Evans J,Poorter H.Photosynthetic acclimation of plants to growth irradiance:The relative importance of specific leaf area and nitrogen partitioning in maximizing carbon gain.Plant,Cell & Environment,2001,24:755-767.
[32] Gommers C M,Visser E J,Onge K R S,Voesenek L A,Pierik R,Shade tolerance:When growing tall is not an option.Trends Plant Science,2013,18(8):65-71.
[33] 季杨,张新全,彭燕,梁小玉,黄琳凯,陈灵鸷,李州,马迎梅.干旱胁迫对鸭茅幼苗根系生长及光合特性的影响.应用生态学报,2013,24(10):2763-2769.
Ji Y,Zhang X Q,Peng Y,Liang X Y,Huang L K,Chen L Z,Li Z,Ma Y M.Effect of drought stress on the root growth and photosynthetic characters ofDactylisglomerataseedlings.Chinese Journal of Applied Ecology,2013,24(10):2763-2769.(in Chinese)
[34] 李志真,刘东焕,赵世伟,姜闯道,石雷.环境强光诱导玉簪叶片光抑制的机制.植物生态学报,2014,38(10):720-728.
Li Z Z,Liu D H,Zhao S W,Jiang C D,Shi L.Mechanisms of photoinhibition induced by high light inHostagrown outdoors.Chinese Journal of Plant Ecology,2014,38(10):720-728.(in Chinese)
[35] 王博轶,马洪军,苏腾伟,刘涛,王齐.两种热带雨林树苗对环境光强变化的生理响应和适应机制.植物生理学报,2012,48(6):232-240.
Wang B Y,Ma H J,Su T W,Liu T,Wang Q.Physiological response and acclimation to changes in light regimes in two tropical rainforest species.Plant Physiology Journal,2012,48(6):232-240.(in Chinese)
[35] 裴斌,张光灿,张淑勇,吴芹,徐志强,徐萍.土壤干旱胁迫对沙棘叶片光合作用和抗氧化酶活性的影响.生态学报,2013,33(5):1386-1396.
Pei B,Zhang G C,Zhang S Y,Wu Q,Xu Z Q,Xu P.Effects of soil drought stress on photosynthetic characteristics and antioxidant enzyme activities inHippophaerhamnoidesLinn. seedings.Acta Ecologica Sinica,2013,33(5):1386-1396.(in Chinese)
[36] Maruta T,Tanouchi A,Tamoi M,Yabuta Y,Yoshimura K,Ishikawa T,Shigeoka S.Arabidopsischloroplastic ascorbate peroxidase isoenzymes play a dual role in photoprotection and gene regulation under photooxidative stress.Plant and Cell Physiology,2010,51(2):190-200.
[37] 唐钢梁,李向义,林丽莎,李磊,鲁建荣.骆驼刺在不同遮阴下的水分状况变化及其生理响应.植物生态学报,2013,37(4):354-364.
Tang G L,Li X Y,Lin L S,Li L,Lu J R.Change of different shading on moisture conditions and the physiological response inAlhagisparsifolia.Chinese Journal of Plant Ecology,2013,37(4):354-364.(in Chinese)
[38] Wang Z L,Huang B R.Physiological recovery of Kentucky bluegrass from simultaneous drought and heat stress.Crop Science,2004,44:1729-1736.
[39] 王飒,周琦,祝遵凌.干旱胁迫对欧洲鹅耳枥幼苗生理生化特征的影响.西北植物学报,2013,33(12):2459-2466.
Wang S,Zhou Q,Zhu Z L.Physiological and biochenical characteristics ofCarpinusbetulusseedling under drought stress.Acta Botanica Boreali-Occidentalia Sinica.,2013,33(12):2459-2466.(in Chinese)
[40] 靳素娟.遮荫和高温胁迫对几种香草植物生理与生长发育的影响.重庆:西南大学硕士学位论文,2010.
Jin S J.Shading,high temperature stress on six herbs’ growth and plant physiology.Master Thesis.Chongqing:Southwest University,2010.(in Chinese)
[41] 位杰,吴翠云,王合理,蒋媛,刘小梅.不同光照强度对灰枣叶片生理特性的影响.河南农业科学,2014,43(12):112-116.
Wei J,Wu C Y,Wang H L,Jiang Y,Liu X M.Effect of different light intensity on physiological characteristics in leaves ofZiziphusjujubacv.Huizao.Journal of Henan Agricultural Sciences,2014,43(12):112-116.(in Chinese)
[42] 孙继亮,李六林,陶书田,张绍铃.干旱胁迫和复水对梨幼树生理特性的影响.应用与环境生物学报,2012,18(2):218-223.
Sun J L,Li L L,Tao S T,Zhang S L.Effects of drought stress and rewatering on physiological characteristics of pear seedling.China Journal of Applied Environmental Biology,2012,18(2):218-223.(in Chinese)
MorphologicalandphysiologicalplasticityofThymusmongolicusunderdifferentlightconditions
Li Jin-ping1, Ren Rui-fen2, Yin Da-fang2, Guo Fang2, Yang Xiu-yun2
(1.Forestry Division of Shanxi Luan Mining Group, Changzhi 047400, Shanxi, China; 2.College of Forestry of Shanxi Agriculture University, Taigu 030801, Shanxi, China)
One-year-oldThymusmongolicusseedlings were used as the test material. They were grown under either natural light (control, CK), or 25, 50 and 75% shading; physiological and morphological indexes of leaves and roots were measured at 0, 7, 14, 24, and 44 d. The study aimed to identify tissue plasticity inT.mongolicusunder different illumination conditions so as to provide a theoretical basis for the selection and promotion of aromatic ground cover plants. The results showed that 1) changes in the distribution of dry matter content at 14 d was due to an increase in leaf weight ratio and a reduction in root weight ratio under different light conditions. 2) The 50% light treatment significantly promoted the activity of leaf SOD, increased the content of soluble protein in the root osmotic adjustment substances, inhibited the accumulation of malondialdehyde, and showed strong physiological plasticity. 3)T.mongolicusshowed greater morphological and physiological plasticity under 50% light, and significantly different physiological plasticity in leaves and roots in response to environmental changes.
aromatic ground-cover plant;Thymusmongolicus; light treatment; morphological plasticity; physiological plasticity
Yang Xiu-yun E-mail:xyyang2002@yeah.net
10.11829/j.issn.1001-0629.2017-0189
李金平,任瑞芬,尹大芳,郭芳,杨秀云.不同光环境下金边百里香的形态和生理可塑性.草业科学,2017,34(10):2130-2140.
Li J P,Ren R F,Yi D F,Guo F,Yang X Y.Morphological and physiological plasticity ofThymusmongolicusunder different light conditions.Pratacultural Science,2017,34(10):2130-2140.
S573.9
A
1001-0629(2017)10-2130-11
2017-04-14
2017-06-22
山西省农业科技攻关项目——山西优势草种驯化培育及产业化开发——山西乡土芳香地被植物选优及扩繁体系构建(20140311013-4);山西省科技成果转化引导专项——绢毛匍匐委陵菜新品种示范及推广(201604D131054)
李金平(1976-),男,山西屯留人,助理工程师,本科,主要从事林业方面的研究。E-mail:715872085@qq.com
杨秀云(1976-),女,山西洪洞人,教授,博士,主要从事园林植物育种研究。E-mail:xyyang2002@yeah.net
(责任编辑 张瑾)

