低分子肝素及乌司他丁单用及联合治疗急性胰腺炎的效果及对肠道损伤保护分析
柳建华,李翔
(1.大连市中心医院,大连 116000;2.湖南师范大学医学院,长沙 410013)
低分子肝素及乌司他丁单用及联合治疗急性胰腺炎的效果及对肠道损伤保护分析
柳建华1,李翔2
(1.大连市中心医院,大连 116000;2.湖南师范大学医学院,长沙 410013)
目的:研究低分子肝素和乌司他丁单用及联合治疗急性胰腺炎的疗效。方法:135例急性胰腺炎患者随机平均分为A、B、C三组,均行常规治疗,A组加服低分子肝素,B组加服乌司他丁,C组联合应用两药,对比三组症状治愈时间、转归、肠道黏膜屏障功能和炎症因子变化。结果:C组腹痛、呕吐、进食、体温、白细胞和血尿淀粉酶改善时间显著高于A、B两组,B组腹痛、呕吐、体温和血尿淀粉酶改善显著高于A组;A组缓解率80%,重症化13.33%,手术6.67%,B组分别为82.22%、11.11%和6.67%,C组分别为95.56%、2.22%和2.22%,C组缓解率显著高于A、B两组;治疗后三组DAO、D-乳酸和尿L/M值显著降低,且降低幅度由高至低依次为C、B和A组;治疗后三组TNF-α和IL-1含量显著降低,IL-10含量显著升高,C组降低或升高幅度显著高于A、B两组,A、B两组TNF-α、IL-1差异显著。结论:低分子肝素联合乌司他丁治疗急性胰腺炎疗效较单用两药效果显著,可显著改善患者肠道黏膜屏障功能,降低炎症反应,值得临床推广。
低分子肝素;乌司他丁;急性胰腺炎;肠道损伤保护
急性胰腺炎(acute pancreatitis,AP)属于消化内科多见急腹症,病发迅猛,累及多个器官,病发原因不一,轻者可自行愈合,重者可诱发重症胰腺炎、多器官功能障碍甚至死亡,约4/5的患者经保守治疗可治愈,但仍有1/5以上患者可发生死亡[1-3]。低分子肝素属于抗凝剂的一种,临床用于AP治疗,具有促进胰腺血液微循环作用,可避免因微循环血栓所致的胰腺缺血、坏死现象[4]。乌司他丁为广谱胰蛋白酶抑制剂,可有效抑制脂肪酶、淀粉酶、胰蛋白酶等分泌,抑制炎性因子分泌,抗炎、抗氧化应激、抗休克,治疗多器官障碍综合征,为AP常用治疗药物[5,6]。本研究旨在探讨低分子肝素联合乌司他丁治疗急性胰腺炎疗效,为急性胰腺炎治疗提供指导。具体报道如下。
1 资料与方法
1.1 一般资料 选取2013年5月~2016年5月于我院诊治的135例急性胰腺炎患者纳入研究。诊断和分型标准:临床检测结果符合《急性胰腺炎诊治指南》诊断标准和分型标准[7],患者具有腹痛、恶性、呕吐等症状,具有胰腺局部炎症反应,伴或不伴有其他器官功能病变;不同程度AP均具有临床表现和生物化学改变,其中轻度AP不伴有器官功能衰竭和全身或局部并发症;中度AP伴有全身或局部并发症,不伴有持续性器官功能衰竭(48h不能恢复),或伴有一过性器官功能衰竭(48h可自行恢复);重度AP伴有持续性器官功能衰竭(时间持续48h以上,不可自行恢复,累计一个及以上器官)。纳入标准:符合AP诊断标准,确诊为急性胰腺炎者;病程<48h者;血清淀粉酶高出正常者;对本研究用药无禁忌症者;本研究经我院伦理委员会批准,所有患者均签署知情同意书,愿意配合本治疗方案者。排除标准:既往有严重器官类功能障碍者;合并糖尿病等慢性类疾病者;合并病毒性、酒精性、代谢性、自身免疫性等肝病者;胰腺脓肿、胰腺坏死急需手术治疗者;妊娠及哺乳期妇女。所有患者入院后进行编号,依据随机数字表法和单盲试验法,将患者随机分为A、B、C三组(各45例)进行治疗,三组均在常规治疗基础上,A组加服低分子肝素,B组加服乌司他丁,C组联合应用两药。A组男23例,女22例,平均年龄(47.36±6.28)岁,平均病程(18.65±4.25)h,其中酒精性胰腺炎12例,胆囊性胰腺炎23例,其他(包括高血脂症性、外伤性、感染性、自身免疫性胰腺炎)10例,AP重度11例,中度21例,轻度13例;B组男24例,女21例,平均年龄(48.05±5.94)岁,平均病程(19.02±4.68)h,其中酒精性胰腺炎13例,胆囊性胰腺炎24例,其他8例,AP重度11例,中度20例,轻度14例;C组男22例,女23例,平均年龄(48.58±6.25)岁,平均病程(19.16±5.08)h,其中酒精性胰腺炎12例,胆囊性胰腺炎24例,其他9例,AP重度12例,中度21例,轻度12例。三组患者一般资料比较无显著性差异,具体见表1(P>0.05)。
1.2 治疗方法 三组患者入院后均给予常规急性胰腺炎治疗,具体为保持胃肠道减压,采用西米替丁(陕西渭南华仁制药有限责任公司,国药准字H20054965)抑制胃酸分泌,采用奥曲肽(上海丽珠制药有限公司,国药准字H20090272)抑制胰液分泌,给予抗生素抗炎、止痛解挛、补液等治疗;A组在常规治疗基础上加用低分子量肝素钙注射液(广东天普生化医药股份有限公司,国药准字H19990079)治疗,剂量5000IU皮下注射,每12h注射1次;B组加用乌司他丁注射液(广东天普生化医药股份有限公司,国药准字H20040506)治疗,剂量10万单位/次,溶于250ml 5%的葡萄糖溶液中静脉滴注,每8h注射一次,症状改善后改为1日2次。两组治疗8d后评估疗效。C组在常规治疗基础上,给予低分子肝素钙5000IU皮下注射,12h/次;乌斯他丁10万单位溶于250ml 5%的葡萄糖溶液中静脉滴注,8h/次,治疗8d。
1.3 观察指标 ①临床症状、体征、实验室指标改善时间:三组患者每1~3d检测一次白细胞、血尿淀粉酶、体温、血气分析等情况,比较三组患者治疗过程腹痛、呕吐、进食、体温、白细胞、血淀粉酶明显改善时间,其中以腹痛、呕吐症状消失,开始进食流质食物、体温≤37.5℃、白细胞处于4~10×109个/L,血淀粉酶<125 IU/L为明显改善;②转归情况:包括缓解、重症化和死亡三类,治愈:患者腹痛、呕吐、进食、体温、白细胞、血尿淀粉酶等有所改善或恢复正常,低脂饮食无不适症;重症化:患者治疗过程症状、体征加重,并且出现下述6项症状中>2项者视为重症化,1)体温>39℃;2)心率>110次/min;3)动脉血氧分压<60mmHg;4)收缩压 <90mmHg,收缩压、舒张压差值 <22.5mmHg;5)尿量<500ml/d;6)患者腹水变多,行穿刺检验,可抽取浑浊或血性脓液;其中因重症化接受胰腺引流或胰腺坏死清创术的患者为手术病例;③肠道黏膜屏障功能:检测指标包括血清二胺氧化酶(DAO)、血浆D-乳酸水平和尿乳果糖/甘露醇(L/M)值变化;DAO和D-乳酸采取患者治疗前后清晨空腹静脉血检测,DAO采用分光光度法检测,D-乳酸采用酶联免疫吸附法检测;乳果糖/甘露醇(L/M)值于患者治疗前和治疗第7d,清晨给予患者口服10ml乳果糖/甘露醇溶液,收集患者6h尿液,采用高效液相色谱法检测乳果糖和甘露醇浓度;④血清细胞因子:于治疗前和治疗第7d,取三组患者清晨空腹静脉血,离心分离血清检测其肿瘤坏死因子-α(TNF-α)、白介素-1(IL-1)和白介素-10(IL-10)水平,均采用酶联免疫吸附法检测。
1.4 数据分析 数据分析采用SPSS19.0软件,计数资料以例(n)或百分比(%)表示,采用χ2检验,计量资料以(± s)表示,采用t检验,将P< 0.05定义为显著有统计学意义。
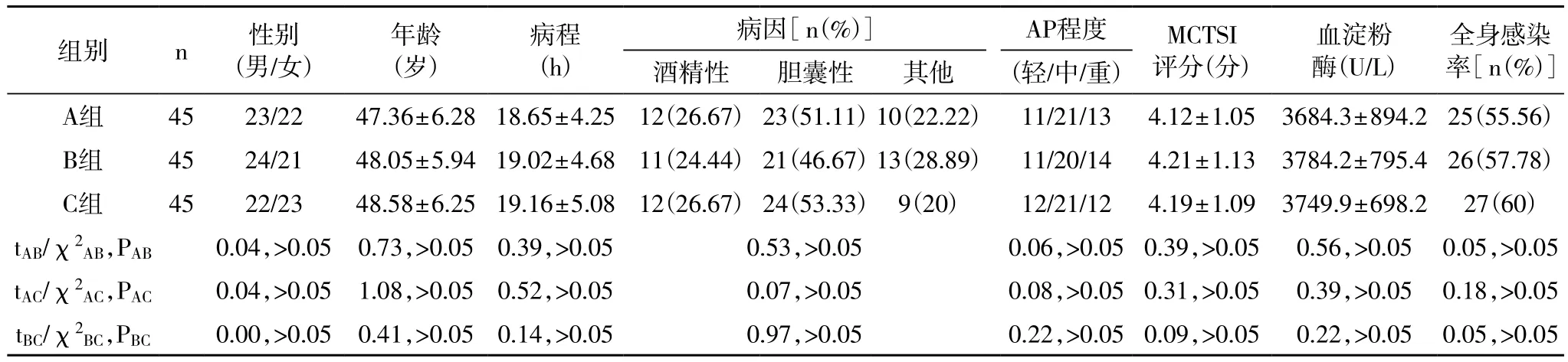
表1 三组患者一般资料比较
2 结果
2.1 三组临床症状、体征和实验室指标改善时间比较
结果如表1中,三组患者临床症状、体征和实验室指标均明显改善,C组腹痛、呕吐、进食、体温、白细胞和血尿淀粉酶改善时间显著高于A、B两组,而B组腹痛、呕吐、体温和血尿淀粉酶改善显著高于A组,差异具有统计学意义(P< 0.05)。
2.2 三组转归情况比较 A组缓解率80%,重症化13.33%,手术6.67%,B组分别为82.22%、11.11%和6.67%,C组分别为95.56%、2.22%和2.22%,C组缓解率显著高于A、B两组,差异具有统计学意义(P<0.05)。
2.3 三组肠道黏膜屏障功能比较 治疗后三组DAO、D-乳酸和尿L/M值显著降低,且降低幅度由高至低依次为C组、B组和A组,差异具有统计学意义(P<0.05)。
2.4 三组血清TNF-α、IL-1和IL-10水平变化比较
治疗后,三组TNF-α和IL-1水平显著降低,IL-10水平显著升高,C组降低或升高幅度显著高于A、B两组,差异具有统计学意义(P<0.05),A、B两组治疗后TNF-α和IL-1水平差异具有统计学意义(P<0.05)。
表1 三组临床症状、体征和实验室指标改善时间比较(d,±s)
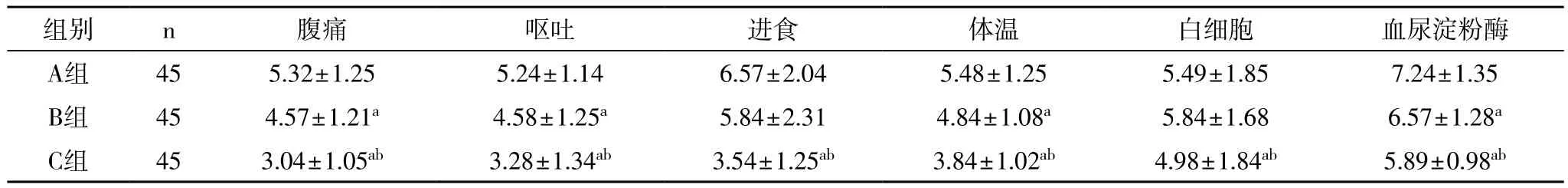
表1 三组临床症状、体征和实验室指标改善时间比较(d,±s)
aP< 0.05,与A组比较;bP< 0.05,与B组比较
组别 n 腹痛 呕吐 进食 体温 白细胞 血尿淀粉酶A组 45 5.32±1.25 5.24±1.14 6.57±2.04 5.48±1.25 5.49±1.85 7.24±1.35 B组 45 4.57±1.21a 4.58±1.25a 5.84±2.31 4.84±1.08a 5.84±1.68 6.57±1.28a C组 45 3.04±1.05ab 3.28±1.34ab 3.54±1.25ab 3.84±1.02ab 4.98±1.84ab 5.89±0.98ab
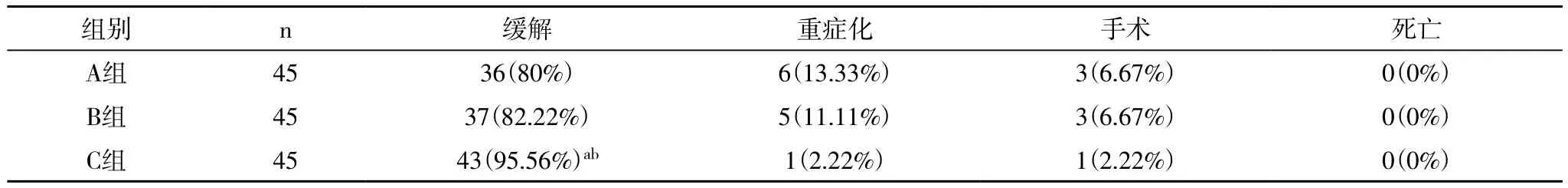
表2 三组转归情况比较 [n(%)]

表3 三组肠道黏膜屏障功能比较
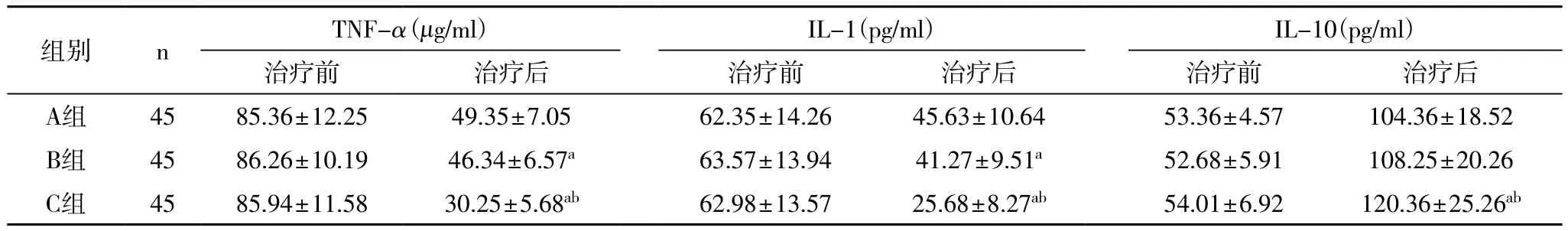
表4 三组血清TNF-α、IL-1和IL-10水平变化比较
3 讨论
急性胰腺炎病因复杂多样,除胰酶被激活所致的胰腺组织自身消化机制外,还与胰腺小叶动脉血管痉挛所致的微循环障碍有关,胰腺缺血不仅可导致缺血再灌注损伤,还可累及全身各个器官,诱发多器官功能障碍[1-3]。胰腺微循环障碍为抗凝剂低分子量肝素钙的使用提供依据,低分子量肝素钙具有促进胰腺血液微循环和溶栓作用,可有效避免胰腺因微循环血栓所致的胰腺缺血、坏死现象[8]。乌司他丁为AP常用抑制胰蛋白酶分泌类药物,可抑制炎性因子分泌,抗炎、抗氧化应激、抗休克,治疗多器官障碍综合征[5,6]。本研究针对我院135例急性胰腺炎患者,研究低分子肝素和乌司他丁单用及联合治疗急性胰腺炎的疗效,发现两药连用具有显著疗效。
腹痛、呕吐、进食、高温、白细胞升高和血尿淀粉酶升高等属于急性胰腺炎常见病理变化,与AP发作时机体炎症反应、氧化应激反应、胰腺微循环障碍、胰酶自身消化、肠道菌群异位等多种病发机制相关[9]。本研究中,三组患者经过治疗后,其症状、体征、实验室指标均得到显著改善,且低分子肝素联合乌司他丁用药组改善效果更加显著,说明联合用药的有效性,与窦文琴[10]研究结果类似。胰腺微循环障碍,主要包括以下几个方面,一、AP发生后,胆汁反流、一氧化氮水平下降和活性氧自由基的升高可诱发胰腺小叶动脉括约肌痉挛,导致胰腺微循环障碍;二、胰腺缺血后快速补液可导致缺血再灌注损伤;三、AP所致的胰腺蛋白酶高表达可加重缺血再灌注损伤;四、AP发生后血小板活性增强,粘附于静脉和毛细血管,引起血栓素升高,加重微循环障碍;五、内皮细胞和白细胞相互反应,增加内皮细胞通透性,引发水肿 ;六、血液动力学改变[8,9,11]。低分子量肝素钙具有抑制凝血酶、凝血活性因子分泌作用,可通过抑制血小板活性来改善血液微循环,此外,Hochart等[12]研究显示,低分子肝素钙还可抑制内毒素所致的炎症反应,下调炎性介质表达。乌司他丁提取自健康成年男性尿液,属于胰蛋白酶抑制剂的一种,具有抑制脂肪酶、淀粉酶、胰蛋白酶等分泌作用,伊宏伟等[13]研究显示,乌司他丁改善急性胰腺炎临床疗效显著。本研究中,低分子肝素与乌司他丁联用,可从改善胰腺微循环、抑制胰蛋白酶分泌两个主要方面改善患者病情,故临床疗效较各自单用两药组显著,缓解率高。本研究中,经过治疗后,三组患者DAO、D-乳酸和尿L/M值显著降低,且联合用药组下降幅度更显著,说明三组肠道黏膜屏障功能得到显著改善,且联合用药改善效果更显著。二胺氧化酶(DAO)为小肠标志酶,可反映肠道完整性和损伤程度,文献报道,AP患者会出现不同程度肠道黏膜屏障功能损伤,其标志性物质为DAO含量显著升高[14]。D-乳酸由肠道黏膜分泌,其他组织不生产D-乳酸,当肠道黏膜受损时,D-乳酸可经肠道黏膜流入血液[15],故本研究中AP患者会出现D-乳酸升高现象。尿乳果糖/甘露醇(L/M)值是评估肠道黏膜屏障损伤标志性指标,乳果糖通透性反应肠道黏膜屏障功能,甘露醇反应肠道吸收功能,生理状态下,尿液乳果糖、甘露醇含量极低,L/M值低,当机体出现肠道黏膜屏障功能损伤后,L/M值升高[16]。研究中,联合应用低分子肝素和乌司他丁治疗后,患者DAO、D-乳酸和尿L/M值显著提示,说明患者肠道屏障功能得到显著改善。文献报道,AP患者肠道黏膜屏障破坏,主要与微循环障碍、缺血再灌注损伤、炎性因子介导的炎症反应等相关[9],本研究中,通过检测血清TNF-α、IL-1和IL-10水平发现,治疗前,患者TNF-α、IL-1显著增高,IL-10显著降低,说明患者体内炎症反应剧烈。Fink等[17]研究显示,血清TNF-α含量上升与多器官功能不全发生具有显著正相关性,可激活白介素-6诱导炎性反应;IL-1由胰腺巨噬细胞分泌,可诱导动物类休克状态;治疗后TNF-α和IL-1含量下降,说明机体炎症反应和类休克反应得到显著缓解。IL-10属于抗炎因子,可抑制巨噬细胞、单核细胞分泌促炎因子[18],治疗后患者IL-10含量上升,说明机体抗炎反应明显,炎症反应得到有效抑制。低分子肝素和乌司他丁均有降低机体内毒素,下调炎症因子表达,促进抗炎作用[4,5],本研究显示,两药联合抗炎、保护肠道黏膜屏障、改善血液循环功能更佳,与窦文琴[10]研究结果一致。
综上所述,低分子肝素联合乌司他丁治疗急性胰腺炎疗效较单用两药治疗效果好,改善肠道黏膜屏障功能、降低炎症反应效果显著,提高治疗有效率,临床推广意义显著。
[1] 李英, 韩丽, 崔利锋, 等. 降钙素原和C反应蛋白在急性胰腺炎病情及预后评估中的应用价值[J]. 医学临床研究, 2015, 32(4): 715-718.
[2] 陈兴旺, 周华锋, 姚志军, 等. Ghrelin和BMI对急性胰腺炎患者的预测价值[J]. 湖南师范大学学报 (医学版), 2014, 11(1): 53-55.
[3] 叶本功.73例急性胰腺炎的螺旋CT诊断分析[J]. 中国CT和MRI杂志,2016, 14(4): 101-103.
[4] 田时静, 周发春. 低分子肝素治疗重症急性胰腺炎研究进展[J]. 重庆医学, 2014, 43(5): 625-627.
[5] 连红霞, 李秀刚, 闫建平. 乌司他丁联合生长抑素治疗重症胰腺炎疗效评价[J]. 西部医学, 2016, 28(7): 960-963.
[6] 冯筑生, 范颖楠, 尹文. 乌司他丁治疗急性百草枯中毒的系统评价与meta分析[J]. 临床误诊误治, 2016, 29(6): 68-72.
[7] 中华医学会消化病学分会胰腺疾病学组. 中国急性胰腺炎诊治指南 (2013年, 上海) [J]. 中华消化杂志, 2013, 33(4): 530-535.
[8] 李云, 李慧敏. 重症急性胰腺炎患者早期胰腺感染的危险因素分析[J]. 国际医药卫生导报, 2016, 22(7): 953-956.
[9] 赵燕, 徐桂芳, 邹晓平. 急性胰腺炎中肠道屏障功能障碍发生机制和治疗[J]. 国际消化病杂志, 2012, 32(5): 276-279.
[10] 窦文琴. 乌司他丁、低分子肝素联合治疗急性胰腺炎的疗效观察[J]. 实用临床医药杂志, 2012, 16(21): 102-104.
[11] 侯斐, 刘瑞霞, 阴赪宏. 急性胰腺炎微循环障碍的发生机制及其治疗进展[J]. 临床肝胆病杂志, 2014, 30(8): 817-820.
[12] Hochart H, Jenkins PV, Smith OP, et al. Low-molecular weight and unfractionated heparins induce a downregulation of inflammation: decreased levels of proinflammatory cytokines and nuclear factor-kappaB in LPS-stimulated human monocytes[J]. British Journal of Haematology, 2006, 133(1): 62-7.
[13] 尹宏伟, 周慧芬. 乌司他丁治疗急性胰腺炎患者的临床观察[J]. 中国药房, 2016, 27(8): 1125-1127.
[14] 崔艳丽, 余杨. 重症急性胰腺炎患者二胺氧化酶检测的临床意义[J]. 中国临床研究, 2012, 25(1): 20-21.
[15] 陈渝萍, 王文文. 血清肿瘤坏死因子-α、内毒素和D-乳酸动态变化在急性胰腺炎转归及治疗选择中的意义[J]. 临床内科杂志,2014, 31(10): 687-689.
[16] 余杨梓, 傅强, 华鹂鹂. 重症急性胰腺炎血行感染患者肠屏障功能障碍的研究[J]. 中国中西医结合急救杂志, 2012, 19(4): 196-199.
[17] Fink GW, Norman JG. Specific changes in the pancreatic expression of the interleukin 1 family of genes during experimental acute pancreatitis[J]. Cytokine, 1997, 9(12): 1023-1027.
[18] 张静. BISAP评分联合促炎/抗炎细胞因子检测对重症急性胰腺炎预后的评估价值[J]. 解放军医药杂志, 2016, 28(2): 62-65.
Effects of low molecular weight heparin and ulinastatin alone and combined use in the treatment of acute pancreatitis and the protection effect in intestinal injury
Liu Jian-hua1,Li Xiang2
(1.Department of Gastrointestinal Surgery Dalian Municipal Central Hospital Affilliated of Dalian Medical University, Dalian 116000, China;2.Medical College,Hunan Normal University,Changsha 410013,China)
ObjectiveTo study the effects of low molecular weight heparin and ulinastatin alone and combined use in the treatment of acute pancreatitis.Methods135 patients with acute pancreatitis were randomly divided into group A, B and C, and all the patients were given routine treatment. Group A was additionally treated with low molecular weight heparin, while group B was treated with ulinastatin, and group C was treated with the combination of the two. The cure time of symptoms, outcome, intestinal mucosal barrier function and inflammatory factors were compared between groups.ResultsThe relief of abdominal pain and vomiting, improvement of feeding, body temperature, white blood cell and urine amylase in group C were more significant than those in group A and group B, and the relief of abdominal pain, vomiting, fever and urine amylase in group B was more significant than that in group A; The remission rate, aggravation rate and operation rate in group A were 80%, 13.33% and 6.67%,respectively while those in group B were 82.22%, 11.11% and 6.67% respectively, and in group C were 95.56%, 2.22% and 2.22%, respectively. Theremission rate in group C was significantly higher than that in group A and that in group B; After treatment, DAO, D-lactic acid and urinary L/M were significantly decreased, and the reduction range from high to low was group C, group B and group A; The contents of TNF-α and IL-2 decreased significantly after treatment, while the content of IL-10 increased significantly. The decrease and increase in group C were more significant than those in group A and group B. TNF-α and IL-2 showed significant differences between group A and group B.ConclusionCompared with single drug, the effect of low molecular weight heparin combined with ulinastatin is significant in the treatment of acute pancreatitis. It can significantly improve the intestinal mucosal barrier function, and reduce inflammation in patients.
low molecular weight heparin; ulinastatin; acute pancreatitis; intestinal injury
R735
A
1673-016X(2017)06-0091-05
2017-09-05
李翔,E-mail:12923063@qq.com

