三种用药方案在糖尿病周围神经病变患者中临床疗效对比
黄海波
(连云港市第一人民医院,连云港 222002)
三种用药方案在糖尿病周围神经病变患者中临床疗效对比
黄海波
(连云港市第一人民医院,连云港 222002)
目的:对比分析甲钴胺+前列地尔、依帕司他+前列地尔、甲钴胺+依帕司他+前列地尔在糖尿病周围神经病变(DPN)患者中的临床疗效及安全性。方法:分析2014年4月~2017年4月在我院接受治疗的108例DPN患者的临床资料。随机将入选者分成A组(甲钴胺+前列地尔)、B组(依帕司他+前列地尔)和C组(甲钴胺+依帕司他+前列地尔)三组,每组36例。比较三组患者的一般资料、治疗前后感觉神经传导速度(SCV)及运动神经传导速度(MCV)与临床体征及症状评分、治疗后的临床疗效及不良反应。结果:三组患者的一般资料无明显统计学差异。三组患者治疗后的SCV及MCV速度均快于治疗前,临床体征及症状评分均明显低于治疗前;治疗前,三组患者的SCV及MCV、临床体征及症状评分无明显统计学差异;治疗后,C组患者的SCV及MCV速度均快于A、B组,临床体征及症状评分均明显低于A、B组。A、B组患者的临床总有效率(83.3%,77.8%)明显低于C组(100.0%)。三组患者治疗后的不良反应发生率无明显统计学差异。结论:甲钴胺+依帕司他+前列地尔在DPN患者中的联合应用临床疗效突出,且安全性良好,值得推广
甲钴胺;前列地尔;依帕司他;糖尿病周围神经病
随着生活水平及饮食结构的变化,我国糖尿病患者人数呈逐年递增趋势,其不但严重影响了人们的生活质量,而且加重了社会负担[1]。糖尿病慢性并发症中糖尿病周围神经病变(DPN)属于常见疾病之一,发病率较高,其主要是肌力萎缩或减退、感觉障碍及腱反射减弱等任意组合或单独形成的一种综合征,好发于下肢,会累及周边多条神经,引起感觉异常或对称性疼痛等各种病症,对患者的生存质量造成了不良影响[2],故如何有效治疗DPN患者是目前广大学者所关注的焦点,也是临床上迫切需要解决的问题。本研究旨在通过采用甲钴胺+前列地尔、依帕司他+前列地尔、甲钴胺+依帕司他+前列地尔三种方式治疗DPN患者,探析上述三种用药方案的临床疗效,以期为DPN患者提供最佳治疗思路。
1 资料与方法
1.1 研究对象 分析2014年4月~2017年4月在我院接受治疗的108例DPN患者的临床资料。本研究经我院医学伦理委员会批准,患者或患者家属知情同意此次研究并签署相关知情同意书。入选标准:(1)年龄不低于18周岁;(2)根据糖尿病的临床诊断标准予以确诊,诊断期间可能会出现糖尿病远端对称性多发性神经病变(DSPN)临床表现,震动感觉阈值、压力觉、温度觉、针刺痛觉及踝反射检查只有有一项异常即可进行诊断。经肌电图检查及神经传导功能检查结果显示异常,且传导速度降低,可确诊为DPN患者;(3)临床信息资料完整者。排除标准:(1)不愿配合此次研究者;(2)最近有抗氧化应激药物(如前列地尔、胡萝卜素及谷胱甘肽等)服用史者;(3)存在感染、心肝肾功能不全及自身免疫性疾病等糖尿病并发症者;(4)其它因素导致的动静脉血管性病变及脑梗死等周围神经病变患者。随机将入选者分成A组(甲钴胺+前列地尔)、B组(依帕司他+前列地尔)和C组(甲钴胺+依帕司他+前列地尔)三组,每组36例。
1.2 研究方法 治疗方法:对入选者普及糖尿病相关医学知识,严格控制饮食,以低脂、低盐为主,并加强锻炼。维持血压<130/80mmHg,接受胰岛素或降糖药治疗,控制空腹血糖<7.0mmol/L,餐后2h血糖<11.1mmol/L,且糖化血红蛋白控制在8%一下。A组:肌肉注射或静脉注射甲钴胺注射液(日本卫材株式会社,商品名:弥可保,国药准字J20040024,规格:1ml×10安瓶),500μg/次(每次混合50ml生理盐水稀释),qd,3次/w;静脉滴注前列地尔注射液(北京泰德制药股份有限公司,商品名:凯时,国药准字H10980023,规格:1ml:5μg),qd,10μg/次。B组:口服依帕司他片(南京海陵药业有限公司,商品名:唐林,国药准字H20040012,规格:50mg×10片/盒),餐前口服,50mg/次,tid,连续服用;前列地尔具体用药量及其方法与A组相同。C组:在A组基础上添加依帕司他片(具体用药量及方法参考B组)。
观察指标及方法:(1)详细询问并记录三组患者的年龄、性别及体质指数(BMI)等一般资料信息。(2)感觉神经传导速度(SCV)及运动神经传导速度(MCV):通过KEY-POINT4C电位仪检测DPN患者的胫神经、足底神经及腓总神经传导速度,刺激频率设定为2Hz,电流强度51~99mA,时间控制在40ms左右,分别检测患者的SCV和MCV。(3)临床体征及症状评分:根据患者的临床表现及检查评分量表予以评估,其中临床体征主要指患者的踝反射及膝反射情况与痛觉及触觉感知,采用尼龙单丝检查患者的痛觉及触觉感知:无异常感觉,0分;疼痛或者感知仅出现在尼龙单丝所刮过的地方;疼痛或者感知出现在尼龙单丝所刮过地方附近10~15cm范围内以外区域,2分;疼痛或者感知出现在尼龙单丝所刮过地方附近15~20cm范围内以外区域,3分;疼痛或者感知出现在尼龙单丝所刮过地方附近20~30cm范围内以外区域,4分;疼痛或者感知出现在尼龙单丝所刮过地方附近30~40cm以外区域,5分。临床症状主要是指患者的烧灼感、刀割样痛或针刺痛样及异常性冷热感等,总分值2分:无上述症状,0分;有上述症状;1分;患者夜间疼痛感加重,2分。
疗效评判标准:显效:DPN患者下肢发冷、疼痛及麻木等一系列异常感觉症状完全消失,跟腱反射及膝关节反射降低,有明显改善或恢复至正常,SCV及MCV增加至5m/s以上;有效:DPN患者下肢发冷、疼痛及麻木等症状有所缓解,肢体感觉灵敏度有所增强,SCV及MCV有所增加,5m/s以下;无效:DPN患者异常感觉症状及跟腱反射、膝关节反射均未好转甚至加重,SCV及MCV增加不足2m/s或者进一步阻滞,无效。总有效=显效+有效。
1.3 统计学方法 本研究采用SPSS19.0软件分析处理相关数据。计数资料以百分数(%)表示,比较采用卡方(χ2)检验;计量资料以均数±标准差(± s)形式表示,比较采用t检验。我们定义P<0.05为差异具有统计学意义。
2 结果
2.1 一般资料 本研究共纳入108例DPN患者,其中A组(甲钴胺+前列地尔)、B组(依帕司他+前列地尔)和C组(甲钴胺+依帕司他+前列地尔)三组各36例。三组患者的一般资料无明显统计学差异(P>0.05)。
表1 三组患者的一般资料比较
2.2 治疗前后SCV及MCV情况 三组患者治疗后的SCV及MCV速度均快于治疗前(P<0.05);治疗前,三组患者的SCV及MCV速度均无明显统计学差异(P>0.05);治疗后,C组患者的SCV及MCV速度均快于A、B组(P<0.05),详见表2。
2.3 治疗前后临床体征及症状评分情况 三组患者治疗后的临床体征及症状评分均明显低于治疗前(P<0.05);治疗前,三组患者的临床体征及症状评分无明显统计学差异(P>0.05);治疗后,C组患者的临床体征及症状评分均明显低于A、B组(P<0.05),详见表3。
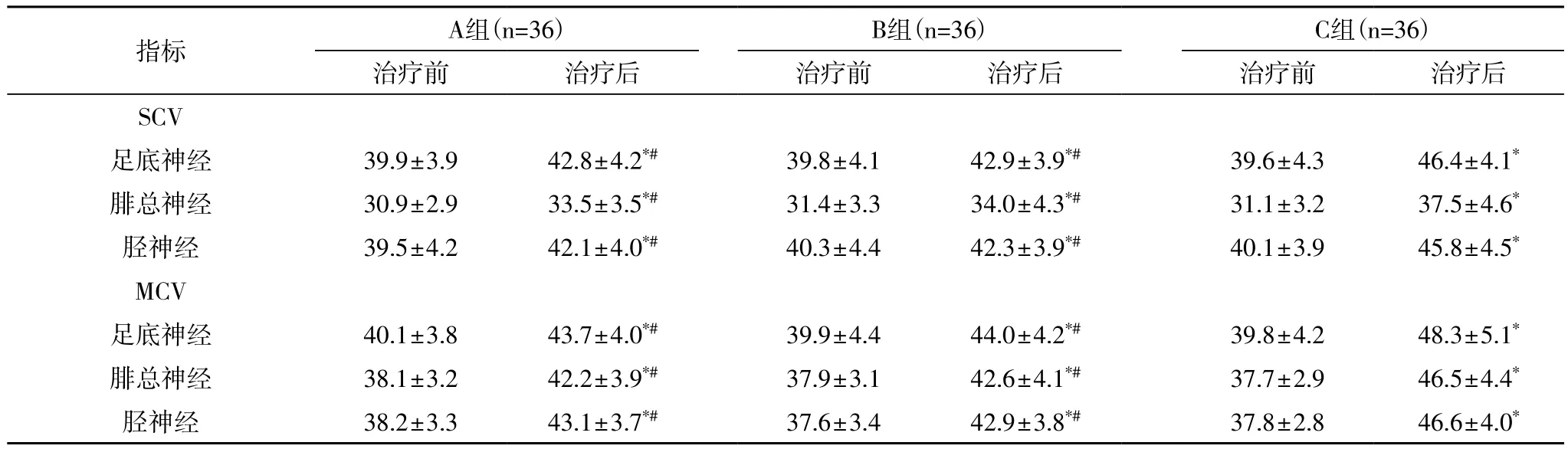
表2 三组患者治疗前后的SCV及MCV情况比较(m/s)

表3 三组患者治疗前后的临床体征及症状评分情况比较(分)
2.4 临床疗效 A、B组患者的临床总有效率(83.3%,77.8%)明显低于C组(100.0%)(χ2=6.545,P=0.01;χ2=9.000,P=0.003)。
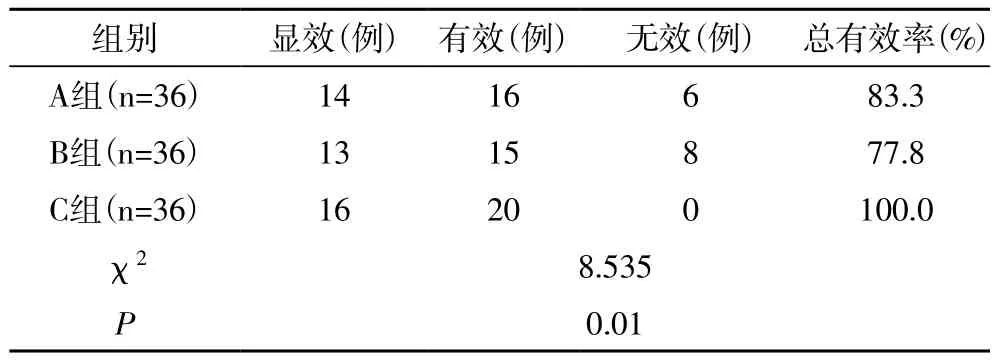
表4 三组患者治疗后的临床疗效比较
2.5 不良反应 A、B、C组患者治疗期间各有2例、2例、3例患者有头晕及头痛症状,均可耐受,调慢滴注速度后上述症状均明显缓解,三组患者治疗后的不良反应发生率无明显统计学差异(P>0.05)。
3 讨论
DPN是糖尿病患者最常见的一种慢性并发症,其一般起病较为隐匿,病情进展缓慢,且临床症状较为复杂,与长期高血糖导致的血管性缺血缺氧及代谢紊乱等因素关系密切,具体发病机制及其原因目前尚未完全明确[3,4]。据报道,我国DPN患者发病率正呈逐年递增趋势,严重影响了我国人们的生活质量,给家庭及社会均造成了沉重负担[5]。
B族维生素可以治疗多发性神经炎,其与醛糖还原酶抑制类药物或钙离子通道阻滞剂等联合应用于临床可有效治疗末梢神经障碍及改善外周循环,是目前DPN患者主要治疗手段[6]。甲钴胺是维生素B12衍生物,其能有效治疗DPN患者的自觉症状,加快感觉及运动神经的传导速度,治疗效果突出[7]。依帕司他是醛糖还原酶抑制类药物之一,其对在糖尿病并发症的发病机制中有着重要作用的多元醇有着直接有效作用,可以降低周围神经组织内山梨醇与果糖的聚集,改善运动、感觉外周神经的病变症状[8]。前列地尔属于血小板聚集抑制类药物之一,可以有效恢复心脑血管微循环功能。
本研究结果显示,三组患者治疗后的SCV及MCV速度均快于治疗前;治疗前,三组患者的SCV及MCV速度均无明显统计学差异;治疗后,C组患者的SCV及MCV速度均快于A、B组,提示甲钴胺+依帕司他+前列地尔联合可以有效治疗DPN患者的神经纤维缺血症状,使SCV及MCV提高。此外,三组患者治疗后的临床体征及症状评分均明显低于治疗前;治疗前,三组患者的临床体征及症状评分无明显统计学差异;治疗后,C组患者的临床体征及症状评分均明显低于A、B组,提示甲钴胺+依帕司他+前列地尔联合可以有效缓解DON患者的微血管内血栓的形成,改善血液循环,减少多元醇旁路中过多山梨醇沉积,缓解神经损伤症状,从而减轻患者临床体征及症状[10]。本研究还发现,三组患者治疗后的不良反应发生率无明显统计学差异,且A、B组患者的临床总有效率(83.3%,77.8%)明显低于C组(100.0%),提示三药联合使用在DPN患者治疗中有着良好的协同作用,其临床疗效较佳,有效改善了患者的神经功能,安全可靠。
总之,甲钴胺+依帕司他+前列地尔在DPN患者中的联合应用临床疗效突出,且安全性良好,值得推广。
[1] 崔影, 陈静, 吴波. 前列地尔注射液联合硫辛酸治疗糖尿病周围神经病变及神经电生理变化研究[J]. 湖南师范大学学报 (医学版),2017, 14(1): 31-33.
[2] Pruitt J, Moracho-Vilrriales C, Threatt T, et al. Identification, prevalence, and treatment of painful diabetic neuropathy in patients from a rural area in South Carolina[J]. J Pain Res, 2017, 10: 833-843.
[3] Games G, Hutchison A. Tapentadol-ER for the treatment of diabetic peripheral neuropathy[J]. Consult Pharm, 2013, 28(10): 672-5.
[4] Cho YW, Na GY, Lim JG, et al. Prevalence and clinical characteristics of restless legs syndrome in diabetic peripheral neuropathy: comparison with chronic osteoarthritis[J]. Sleep Med, 2013, 14(12): 1387-92.
[5] 张文, 重远. 腺苷钴胺对糖尿病周围神经病变患者血清同型半胱氨酸水平的影响研究[J]. 湖南师范大学学报 (医学版), 2016, 13(3):52-55.
[6] Stavniichuk R, Obrosov AA, Drel VR, et al.12/15-Lipoxygenase inhibition counteracts MAPK phosphorylation in mouse and cell culture models of diabetic peripheral neuropathy[J]. J Diabetes Mellitus, 2013,3(3).
[7] Dulipsingh L, Zailskas S, Goldsby T, et al. Assessment of pain and treatment satisfaction in patients with painful diabetic peripheral neuropathy[J]. Conn Med, 2013, 77(9): 523-7.
[8] Hansen CS, Jensen TM, Jensen JS, et al. The role of serum methylglyoxal on diabetic peripheral and cardiovascular autonomic neuropathy:the ADDITION Denmark study[J]. Diabet Med, 2015, 32(6): 778-85.
[9] Yoo M, D'Silva LJ, Martin K, et al. Pilot Study of Exercise Therapy on Painful Diabetic Peripheral Neuropathy[J]. Pain Med, 2015, 16(8):1482-9.
[10] Bartkoski S, Day M. Alpha-Lipoic Acid for Treatment of Diabetic Peripheral Neuropathy[J]. Am Fam Physician, 2016, 93(9): 786.
Comparison of the efficacy of three kinds of treatment regimen in patients with diabetic peripheral neuropathy
Huang Hai-bo
(Department of Endocrinology, The First People’s Hospital of Lianyungang, Lianyungang 222002, China)
ObjectiveOur retrospective study was aimed toanalyze and compare the efficacy and safety of mecobalamine +alprostadil, epalrestat + alprostadil and mecobalamine + epalrestat + alprostadil in treating the patients with diabetic peripheral neuropathy (DPN).MethodsClinical data of 108 patients with DPN
treatment at our hospitalfrom April, 2014 to April,2017 was retrospectivelyanalyzed. Patients included were divided into two groups at random, group A (mecobalamine + alprostadil), group B (epalrestat + alprostadil) and group C (mecobalamine + epalrestat + alprostadil). The general information, the SCV, MCV, clinical signs and symptoms scores before and after treatment, the clinical effects and the adverse recreation in three groups were compared.ResultsThe general information in three groups had no statistical difference . The values of SCV and MCV in three groups after treatment were all obviously faster than those before treatment, and the clinical signs and symptoms scores were obviously lower than those before treatment . The SCV, MCV, clinical signs and symptoms scores before treatment in three groups had no statistical difference. After treatment, the SCV and MCV in groups C were obviously faster than those in group A, B, and the clinical signs and symptoms scores in group C were obviously lower than those in group A, B. The clinical effect in group C (100.0%) was obviously higher than those in group A (83.3%), B (77.8%). The adverse recreation in three groups had no statistical difference.ConclusionThe efficacy and safety of mecobalamine + epalrestat + alprostadil in treating the DPN patients is obvious, which is worth promoting.
mecobalamine; alprostadil; epalrestat; diabetic peripheral neuropathy (DPN)
R587
A
1673-016X(2017)06-0072-04
2017-08-04
黄海波,E-mail:bates_huang@163.com

