阿魏酸对戊四氮致癫痫大鼠海马组织中Bax和Bcl-2蛋白表达的影响
邢玉凤, 刘东海, 张淑红, 张玉萍, 朱金玲
阿魏酸对戊四氮致癫痫大鼠海马组织中Bax和Bcl-2蛋白表达的影响
邢玉凤, 刘东海, 张淑红, 张玉萍, 朱金玲
目的探讨阿魏酸(Ferulic acid,FA)对戊四氮致癫痫大鼠海马组织中Bax和Bcl-2蛋白表达的影响,近而讨论FA对戊四氮致癫痫鼠海马神经元的保护作用。方法将60只雄性健康的Wister大鼠随机分为生理盐水组、模型组(PTZ 35 mg/kg)和阿魏酸干预组(50 mg/kg),均采用腹腔注射的方式,连续注射28 d,停止给药1 d后处死实验大鼠、取材。应用免疫组织化学技术和Western blot方法来检测Bax和Bcl-2的表达情况,用来判断癫痫所导致的细胞凋亡情况。结果阿魏酸干预组大鼠的海马组织Bax的表达量明显低于模型组,差异有显著性(P<0.01),Bcl-2的表达量高于模型组,差异有显著性(P<0.01);生理盐水组大鼠的海马组织内Bax的表达量明显低于模型组,差异有显著性(P<0.01),Bcl-2表达量明显高于模型组,差异有显著性(P<0.01)。结论阿魏酸对戊四氮致癫痫大鼠海马神经元损伤具有保护作用,其保护作用机制可能与其抑制鼠脑细胞凋亡有关。
阿魏酸; 癫痫; 戊四氮; Bax; Bcl-2
癫痫是一种常见的神经系统疾病,我国癫痫发病率在3.5%~4.8%[1]。其病理表现为大脑神经元反复异常放电导致的大脑功能失调。癫痫的发生与神经元的凋亡、神经元的兴奋性增加及突触的异常等相关[2]。癫痫异常放电导致神经细胞毒性损伤可能导致神经元的凋亡。阿魏酸对脂多糖损伤大鼠海马神经元细胞的保护作用已被证实[3],阿魏酸在治疗心脑血管疾病中具有很好的耐药性,但目前没有人去探讨其对癫痫的影响,因此我们选择阿魏酸来探讨其对戊四氮致癫痫大鼠神经元的保护作用。
1 材料与方法
1.1 试剂 Rabbit Anti Bax,Rabbit Anti Bcl-2,Mouse Anti β-actin,Goat Anti-Mouse IgG,Goat Anti-Rabbit IgG,考马斯亮蓝染色液,考马斯亮蓝脱色液,5×SDS-PAGE蛋白上样缓冲液,枸橼酸盐缓冲液(pH=6.0),SDS(武汉博士德生物工程有限公司)。彩虹245广谱蛋白Marker,PMSF(100 mmol),10×电泳液,10×转膜液,20×TBS(北京索莱宝科技有限公司)。BCA试剂盒,ECL化学发光液(上海碧云天生物技术有限公司)。兔SP检测试剂盒,DAB 试剂盒(北京中衫金桥生物技术有限公司)。戊四氮(Sigma公司),阿魏酸(上海源叶生物科技有限公司)其他试剂均由分子实验室提供。
1.2 分组和模型的建立 选择30只体重在(200±20)g之间健康雄性Wistar大鼠(佳木斯大学动物实验中心提供),采用随机数字表法将其平均分为3组:生理盐水组、模型组(PTZ)、阿魏酸(PTZ+FA)干预组,每组10只。每天12点将戊四氮(35 mg/kg)和生理盐水腹腔注射大鼠体内,在注射PTZ前20 min注射阿魏酸(50 mg/kg),连续注射28 d,最后一次给药24 h后,用10%的水合氯醛(400 mg/kg)麻醉大鼠,用随机数字表法将每组大鼠随机分为两组,一组采用心脏灌注固定取脑,左右大脑半球置于10%甲醛中固定,待用于免疫组化检测;另一组断头取海马区置于液氮中保存,待用于Western blot法检测Bax和Bcl-2蛋白。
1.3 免疫组化SP法检测大鼠海马内Bax和Bcl-2蛋白的表达 从10%的中性甲醛中取出固定好的脑组织,取视交叉后4~5 mm即海马平面。石蜡脱水,石蜡包埋,切片(5 μm),烤片(56 ℃,24 h),石蜡切片经二甲苯及梯度酒精脱蜡后用枸橼酸盐缓冲液(pH=6.0)水浴97 ℃20 min。PBS冲洗,每次5 min,冲洗3次。37 ℃3%H2O2去离子水孵育15 min。PBS冲洗,每次5 min,冲洗3次。37 ℃山羊血清封闭20 min,吸去封闭液滴加一抗(Bax、Bcl-2 1∶200)37 ℃孵育2 h。PBS冲洗,每次5 min,冲洗3次。滴加生物素化山羊抗兔二抗工作液37 ℃孵育20 min。PBS冲洗,每次5 min,冲洗3次。滴加辣根酶标记链霉素卵白素工作液,37 ℃孵育15 min。PBS冲洗,每次5 min,冲洗3次。DAB显色,显微镜下控制时间。PBS冲洗,每次5 min,冲洗3次。苏木精复染30 s、返蓝10 min。常规脱水透明,中性树脂封片,显微镜拍照并观察海马CA1区阳性细胞。用图像分析软件Image-Pro Plus 6.0对图片进行平均光密度分析。
1.4 Western blot方法检测Bax和Bcl-2蛋白的表达 从液氮中取出海马组织,放入2 ml的EP管中倒入磁珠和Western细胞裂解液,用组织研磨机将组织碾碎致匀浆,4 ℃静置30 min后,4 ℃ 12000 rpm 离心10 min,取上清液。用BCA试剂盒测蛋白的浓度,加入5×SDS-PAGE蛋白上样缓冲液55 ℃水浴10 min,恢复室温。凝胶:下层胶采用15%的分离胶(10 ml);上层胶采用5%的压缩胶(3 ml)。电泳:上层压缩胶恒压70 V;下层分离胶恒压120 V,至胶板最下端1 cm处停止。并按照Marker和目的蛋白的分子量来切胶。转膜:将PVDF膜裁剪合适的大小,甲醇浸润20 s,用电转液将纤维层和滤纸浸湿。按照阴极-纤维层-滤纸-胶-PVDF膜-滤纸-纤维层-阳极顺序制作“三明治”,用电压100 V、电流200 mA进行电转。37 ℃ 5%脱脂奶粉(TBS溶解)封闭1.5 h。一抗孵育4 ℃过夜(β-actin 1∶1000,Bax 1∶200,Bcl-2 1∶200)。TBST 5 min/遍,洗3遍。二抗室温孵育1 h(HRP标记山羊抗小鼠IgG 1∶1000)。TBST 5 min/遍,洗3遍,ECL曝光。使用天能GLS拍照并进行图像分析,计算目的条带与内参条带的光密度值比。

2 结 果
2.1 免疫组化SP法检测的大鼠海马内Bax和Bcl-2蛋白的表达水平 Bax、Bcl-2蛋白免疫反应表现为棕色或棕黄色定位于细胞胞浆内,结果(见图1、图2)。阿魏酸干预组大鼠的海马组织Bax的表达量明显低于模型组(P<0.01),生理盐水组Bax的表达量明显低于模型组(P<0.01)(见图1);阿魏酸干预组大鼠的海马组织bcl-2的表达量明显高于模型组(P<0.01),生理盐水组大鼠的海马组织内Bcl-2明显高于模型组(P<0.01)(见图2)。
2.2 Western blot方法检测的Bax和Bcl-2蛋白的表达水平 阿魏酸干预组大鼠的海马组织Bax的表达量明显低于模型组(P<0.01),生理盐水组Bax的表达量明显低于模型组(P<0.01);阿魏酸干预组大鼠的海马组织Bcl-2的表达量明显高于模型组(P<0.01),生理盐水组大鼠的海马组织内Bcl-2明显高于模型组(P<0.01)(见图3)。

图1A 是生理盐水组(NS),模型组(PTZ),阿魏酸干预组(PTZ+FA)海马CA1区免疫组化图片(×200);图1B 各组大鼠海马CA1区神经元细胞Bax平均光密度(生理盐水组、阿魏酸干预组分别和模型组相比P<0.01)
图1 大鼠海马CA1区细胞Bax蛋白的表达
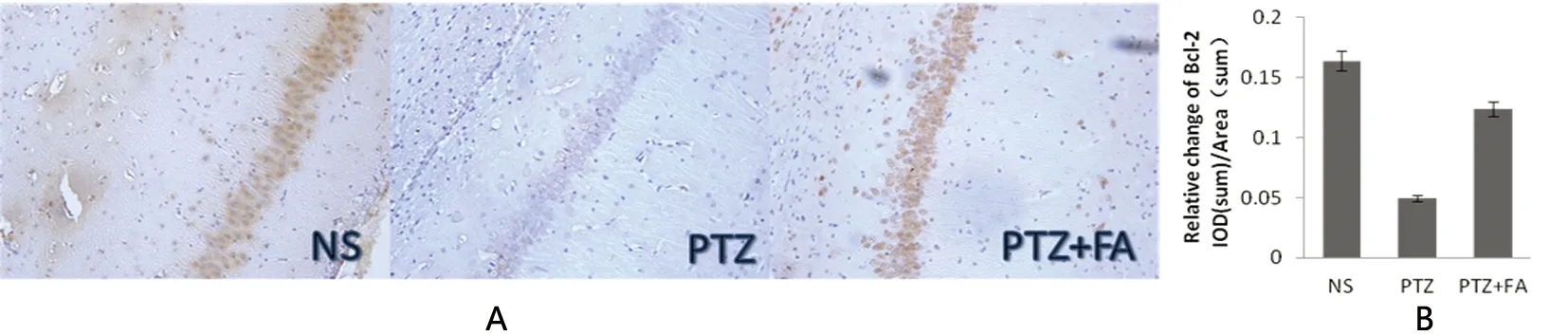
图2A 是生理盐水组(NS),模型组(PTZ),阿魏酸干预组(PTZ+FA)海马CA1区免疫组化图片(×200);图2B 各组大鼠海马CA1区神经元细胞Bcl-2平均光密度(生理盐水组、阿魏酸干预组分别和模型组相比P<0.01)
图2 大鼠海马CA1区细胞内Bcl-2蛋白的表达
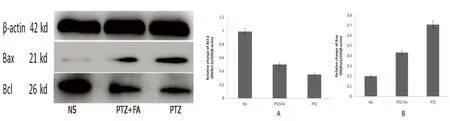
图3 Western blot方法检测的大鼠海马CA1区细胞内Bax和Bcl-2蛋白表达水平
3 讨 论
癫痫是慢性反复发作性短暂脑功能失调综合征,以脑神经元异常放电引起反复痫性发作为特征。癫痫是神经系统常见疾病之一,在我国的发病率在3.5%~4.8%,严重影响了人类健康。目前苯巴比妥、苯妥英钠、卡马西平、丙戊酸钠是广泛应用的一线抗癫痫药,但30%患者出现耐药性,为此寻找新的抗癫痫药物,研究癫痫的发病机制成为人们研究的热点。
戊四氮点燃大鼠慢性癫痫模型与人类癫痫发作十分相似,有病理反应的局灶部位的确定性、病理反应的渐进性、效应的稳定性和持久性等优点;且戊四氮本身不具有神经毒性,不会直接造成神经元的凋亡[4]。是理想的癫痫动物模型。目前广泛应用于抗癫痫新药的实验研究中。为此我们选用戊四氮诱导的癫痫模型鼠,研究阿魏酸对癫痫大鼠的脑的保护作用,及其可能的发生机制。
阿魏酸(FA)是广泛使用的药材的重要组成部分,属于羟基肉桂酸家族。FA在许多植物的叶子和种子中高度丰富,特别是在糙米、全麦和燕麦等谷物中,已被认为具有许多药理学性质,包括神经元祖细胞增殖、抗炎、抗氧化和神经保护活性[5,6]。许多实验研究报道了FA的神经保护作用,包括脑损伤、脊髓缺血和阿尔茨海默氏病[7~9],但目前没有人应用阿魏酸对癫痫进行研究脑保护作用及机制进行研究,目前已有研究证实阿魏酸具有抗细胞凋亡作用[10~12],而癫痫导致的神经元损伤会引起细胞凋亡,我们推测阿魏酸可以抑制细胞凋亡保护癫痫导致的神经元损伤。因此我们选择阿魏酸来探讨其对戊四氮致癫痫大鼠脑海马区的神经元细胞内凋亡相关蛋白Bax和Bcl-2的表达的影响。
B淋巴细胞瘤-2基因简称Bcl-2,是细胞凋亡研究中最受重视的癌基因之一。Bcl-2蛋白家族是一个特别的家族,其成员中有些促进凋亡,如Bad、Bid、Bax,有些成员阻止细胞凋亡,如Bcl-2、 Bcl-x、Bcl-w。其中Bcl-2可与促凋亡Bax形成二聚体,如果Bax相对量高于Bcl-2,则Bax同二聚体的数量增多,从而促进细胞死亡;而如果Bcl-2相对量高于Bax,则促进形成Bcl-2/Bax异二聚体,并使Bcl-2同二聚体的量增多,从而抑制细胞凋亡。我们的研究结果显示:阿魏酸干预组大鼠的海马组织CA1区的Bax蛋白的表达量明显低于模型组;相反Bcl-2的表达量高于模型组;生理盐水组大鼠的海马组织内Bcl-2明显高于模型组;Bax的表达量明显低于模型组,说明阿魏酸可促进Bcl-表达,降低Bax表达,从而抑制细胞凋亡。阿魏酸可减少戊四氮致癫痫鼠的癫痫发作强度和频率以及癫痫发作时间。阿魏酸对大鼠海马神经元具有保护作用,抗凋亡可能是其作用的机制之一。
[1]张晓莉,张晓莉,曾 皎,等.5种抗癫痫药物单药治疗初诊癫痫患儿2a单药保留率比较[J].新乡医学院学报,2016,33(4):297-301.
[2]Kai K,Ruusuvuori E,Seja P,et al.GABA actions and Ionicplasticity in epilepsy[J].Curr Opin Neurobiol,2014,26(5):34-41.
[3]黄 浩,马增春,王宇光,等.阿魏酸对脂多糖损伤的PC12细胞和大鼠海马神经元细胞的保护作用[J].中国药理学与毒理学杂志,2016,4:330-337.
[4]Hurgel M,Ivy GO.Astrocytes in kindling:relevance to epileptogenesis[J].Epilepsy Res,1996,26(1):163-175.
[5]Yabe T,Hirahara H,Harada N,et al.Ferulic acid induces neural progenitor cell proliferation in vitro and in viv[J].Neuroscience,2010,165(2):515-524.
[6]Kim BW,Koppula S,Park SY,et al.Attenuation of neuroinflammatory responses and behavioral deficits by Ligusticum officinale (Makino) Kitag in stimulated microglia and MPTP-induced mouse model of Parkinson’s disease[J].J Ethnopharmacol,2015,164:388-397.
[7]Mori T,Koyama N,Guillot-Sestier MV,et al.Ferulic acid is a nutraceutical β-secretase modulator that improves behavioral impairment and alzheimer-like pathology in transgenic mice[J].PLoS One,2013,8(2):e55774.
[8]Sultana R,Ravagna A,Mohmmad-Abdul H,et al.Ferulic acid ethyl ester protects neurons against amyloid beta-peptide (1-42)-induced oxidative stress and neurotoxicity: relationship to antioxidant activity[J].J Neurochem,2005,92(4):749-758.
[9]Koh PO.Ferulic acid prevents cerebral ischemic injury-induced reduction of hippocalcin expression[J].Synapse,2013,67(7):390-398.
[10]林秉奖,闵 玮,骆 丹.中波紫外线对HaCaT细胞凋亡、细胞周期变化及p16、c-myc蛋白表达的影响及阿魏酸干预作用研究[J].中国中西医结合皮肤性病学杂志,2010,1:8-11.
[11]张立才.脊髓损伤大鼠细胞凋亡、自噬程度的评估及阿魏酸的干预作用研究[J].海南医学院学报,2017,10:1308-1311.
[12]Katarzyna Kotulska,Wieslaw Magdalena,Larysz-Brysz,et al.Impaired regeneration of bcl-2 lacking peripheral nerves[J].Neurological Research,2005,27(12):843-849.
EffectsofferulicacidontheexpressionofBaxandBcl-2proteininhippocampusofpentylenetetrazole-inducedepilepsyrats
XINGYufeng,LIUDonghai,ZHANGShuhong,etal.
(SchoolofBasicMedicalSciencesofJiamusiUniversity,Jiamusi154007,China)
ObjectiveTo investigate the effect of ferulic acid (FA) on the expression of Bax and Bcl-2 protein in hippocampus of pentylenetetrazole (PTZ)-induced epilepsy rats,and to discuss the protective effect of FA on hippocampal neurons in pentylenetetrazol-induced epilepsy effect.Methods60 male healthy wister rats were randomly divided into saline group,model group (PTZ 35 mg/kg) and ferulic acid intervention group (50 mg/kg).The rats were injected intraperitoneally with continuous 28 days,the rats were sacrificed after one day.Immunohistochemistry and Western blot were used to detect the expression of Bax and Bcl-2,which were used to determine the apoptosis induced by epilepsy.ResultsThe expression of Bax in the hippocampus was significantly lower than that in the model group (P<0.01).The expression of Bcl-2 was significantly higher than that of the model group (P<0.01).ConclusionFerulic acid has protective effect on hippocampal neuronal injury induced by pentylenetetrazole in epilepsy rats,and its protective mechanism may be related to its inhibition of brain cell apoptosis.
Ferulic acid; Epilepsy; Pentylenetetrazole; Bax; Bcl-2
R742.1
A
1003-2754(2017)10-0919-03
2017-08-20;
2017-10-04
佳木斯大学创新团队项目资助(No.CXTDPY-201602)
(佳木斯大学基础医学院,黑龙江 佳木斯 154007)
通迅作者:朱金玲,E-mail:370786436@qq.com

