慢性阻塞性肺疾病患者外周血核苷酸结合寡聚化结构域2、核苷酸结合寡聚化结构域样受体蛋白3及下游炎性因子表达情况及其关系研究
宋 珊,贾钦尧,陈绍平,毛 建,韩美玲,廖俊蕾
·论著·
慢性阻塞性肺疾病患者外周血核苷酸结合寡聚化结构域2、核苷酸结合寡聚化结构域样受体蛋白3及下游炎性因子表达情况及其关系研究
宋 珊,贾钦尧,陈绍平,毛 建,韩美玲,廖俊蕾
目的探讨慢性阻塞性肺疾病(COPD)患者外周血核苷酸结合寡聚化结构域2(NOD2)、核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)及下游炎性因子表达情况及其关系。方法选取2015年1月—2017年1月川北医学院附属医院收治的COPD患者200例,其中慢性阻塞性肺疾病急性发作期(AECOPD)患者100例作为A组,COPD缓解期患者100例作为B组,并根据肺功能分级及1年内急性发作次数将B组患者分为低风险组与高风险组,每组50例;另选取同期体检健康者100例作为对照组。比较A组、B组、对照组和低风险组、高风险组、对照组受试者NOD2 mRNA表达量、NLRP3 mRNA表达量、血清白介素1β(IL-1β)和白介素18(IL-18)水平,NOD2 mRNA表达量、NLRP3 mRNA表达量与COPD患者血清IL-1β水平、血清IL-18水平、第1秒用力呼气容积与用力肺活量比值(FEV1/FVC)、第1秒用力呼气容积占预计值百分比(FEV1%)的相关性分析采用Pearson相关性分析。结果A组、B组患者NOD2 mRNA表达量、NLRP3 mRNA表达量、血清IL-1β和IL-18水平高于对照组(P<0.05);A组患者NOD2 mRNA表达量、NLRP3 mRNA表达量、血清IL-1β和IL-18水平高于B组(P<0.05)。低风险组、高风险组患者NOD2 mRNA表达量、NLRP3 mRNA表达量、血清IL-1β和IL-18水平高于对照组(P<0.05);高风险组患者NOD2 mRNA表达量、NLRP3 mRNA表达量、血清IL-1β和IL-18水平高于低风险组(P<0.05)。Pearson相关性分析结果显示,NOD2 mRNA表达量、NLRP3 mRNA表达量与COPD患者血清IL-1β水平(r值分别为0.625、0.656)、血清IL-18水平(r值分别为0.701、0.723)呈正相关,与FEV1/FVC(r值分别为-0.389、-0.415)、FEV1%(r值分别为-0.513、-0.558)呈负相关(P<0.05)。结论COPD患者外周血NOD2、NLRP3表达水平及血清IL-1β、IL-18水平较高,且NOD2 mRNA表达量、NLRP3 mRNA表达量与COPD患者血清IL-1β、IL-18水平及肺功能有关。
肺疾病,慢性阻塞性;核苷酸结合寡聚化结构域2;核苷酸结合寡聚化结构域样受体蛋白3;炎性因子
宋珊,贾钦尧,陈绍平,等.慢性阻塞性肺疾病患者外周血核苷酸结合寡聚化结构域2、核苷酸结合寡聚化结构域样受体蛋白3及下游炎性因子表达情况及其关系研究[J].实用心脑肺血管病杂志,2017,25(9):42-46.[www.syxnf.net]
SONG S,JIA Q R,CHEN S P,et al.Peripheral blood expressions of NOD2,NLRP3 and downstream inflammatory cytokines in patients with COPD and their correlations[J].Practical Journal of Cardiac Cerebral Pneumal and Vascular Disease,2017,25(9):42-46.
慢性阻塞性肺疾病(COPD)是一种慢性炎性疾病,主要特征为持续性气流受限,存在不同程度的气道损伤、肺功能下降及免疫功能异常[1]。COPD的发病机制较为复杂,目前尚无确切发病机制。研究表明,固有免疫与慢性阻塞性肺疾病急性发作期(AECOPD)有关[2]。
核苷酸结合寡聚化结构域2(NOD2)和核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)均属于细胞内模式识别受体-NOD样受体(NLRs)家族,在机体固有免疫中发挥着重要作用。研究表明,NOD2通过激活核因子κB(NF-κB)而启动炎性反应,NLRP3激活后形成NLRP3炎性小体能活化促炎蛋白酶,两者均通过介导下游炎性因子〔白介素1β(IL-1β)、白介素18(IL-18)〕而参与炎性反应过程[3];NOD2和NLRP3作为机体固有免疫系统的重要防御成分,可参与多种疾病的发生发展过程[4]。本研究旨在探讨NOD2、NLRP3及下游炎性因子在COPD患者外周血中的表达及关系,现报道如下。
1 资料与方法
1.1 一般资料 选取2015年1月—2017年1月川北医学院附属医院收治的COPD患者200例,均符合中华医学会呼吸病学分会制定的COPD诊断标准。纳入标准:(1)沙丁胺醇支气管扩张试验阴性;(2)未使用影响白三烯代谢药物;(3)能配合肺功能检查。排除标准:(1)合并支气管哮喘、肺纤维化、支气管扩张、肺结核等肺部疾病者;(2)合并气胸、大咯血及胸腔积液者;(3)近期(4周内)行胸腹手术者;(4)合并心力衰竭者;(5)不宜行肺功能检查及长期接受糖皮质激素治疗者。其中AECOPD患者100例作为A组,COPD缓解期患者100例作为B组。A组患者中男56例,女44例;年龄52~80岁,平均年龄(68.3±5.2)岁。B组患者中男59例,女41例;年龄54~79岁,平均年龄(69.1±5.5)岁。根据病情将B组患者分为低风险组(肺功能分级Ⅰ~Ⅱ级,1年内急性发作≤1次)与高风险组(肺功能分级Ⅲ~Ⅳ级,1年内急性发作≥2次),每组50例。低风险组中男28例,女22例;年龄56~82岁,平均年龄(70.3±5.2)岁。高风险组中男27例,女23例;年龄55~84岁,平均年龄(70.6±5.8)岁。另选取同期于川北医学院附属医院体检健康者100例作为对照组,其中男55例,女45例;年龄52~82岁,平均年龄(69.4±5.8)岁;肺功能正常;无吸烟史;近期(4周内)无呼吸系统疾病症状。A组、B组和对照组受试者性别(χ2=0.35)、年龄(F=1.07)比较,差异无统计学意义(P>0.05),具有可比性。本研究经川北医学院附属医院医学伦理委员会审核批准,受试者及其家属均签署知情同意书。
1.2 方法
1.2.1 仪器与试剂 低温高速离心机(德国Legend RT公司生产),Elx 800酶标仪(美国BioTek公司生产),ABI 7300型荧光定量PCR仪(美国Applied Biosystems公司生产),HP-Deskjet 3748肺功能仪(德国耶格公司生产)。磷酸盐缓冲液(PBS)(北京中杉金桥生物技术有限公司生产),人淋巴细胞分离液(天津灏洋生物公司生产),Trizol(美国Invitrogen公司生产),三氯甲烷(上海迈瑞尔化学技术有限公司生产),异丙醇(上海迈瑞尔化学技术有限公司生产),无水乙醇(上海迈瑞尔化学技术有限公司生产),焦碳酸二乙酯(DEPC)(Gibco公司生产),反转录-聚合酶链反应(RT-PCR)试剂盒购自日本Taka Ra公司(由上海生工生物公司合成所需引物),聚合酶链反应(PCR)所需试剂由美国Invitrogen公司提供,酶联免疫吸附试验(ELISA)试剂盒购自欣博盛生物科技有限公司。
1.2.2 标本采集与外周血单个核细胞(PBMCs)分离 采集所有受试者清晨空腹外周血5 ml,置于含有乙二胺四乙酸(EDTA)的真空采血管中,于4 ℃保存;后以3 000 r/min离心10 min,取上清,置于-80 ℃保存;使用吸管吸取血清1 ml置于加入0.01M PBS 1 ml离心管,反复吹打,混匀;将混悬液转移至15 ml离心管,加入人淋巴细胞分离液2 ml,2 000 r/min离心15 min,分4层,取第2层(即PBMCs)置于1.5 ml去酶EP管中,后继续加入一定量的0.01M PBS,3 000 r/min离心10 min,弃上清,经2次洗涤后留沉淀备用,再继续加入Trizol 1 ml,反复吹打后于室温下静置5 min,于-80 ℃超低温冰箱保存。
1.2.3 RNA提取及RT-PCR (1)RNA提取采用Trizol法,取PBMCs,加入三氯甲烷200 μl(按Trizol∶三氯甲烷=1∶5),剧烈振荡后静置5 min,于4 ℃环境下以12 000 r/min离心10 min,取上层水相400 μl,置于1.5 ml EP管中;加入异丙醇400 μl,轻轻振荡后静置5 min,于4 ℃下以12 000 r/min离心15 min,弃上清;加入75%乙醇1 ml进行洗涤,于4 ℃下以12 000 r/min离心15 min,弃上清,洗涤2次,后将EP管风干,加入0.1% DEPC 20 μl,反复吹打,溶解沉淀,将提取的RNA置于-80 ℃超低温冰箱保存。(2)RT-PCR采用SYBR Premix Ex TaqTM试剂盒(日本Taka Ra公司生产),反应体系为20 μl/孔,包括SYBR Green Premix Ex Taq 10 μl、ROX Reference Dyell(50x)0.4 μl、PCR Reverse Primer(10 μM)0.3 μl、PCR Forward Primer(10 μM)0.3 μl 、DNA模板2 μl、灭菌蒸馏水7 μl;反应条件:94 ℃预变性4 min进入主循环,其中94 ℃预变性30 s,56 ℃变性60 s,72 ℃延伸40 s,经40个循环;记录循环次数(CT值),并计算NOD2 mRNA和NLRP3 mRNA表达量。NOD2正向引物序列为5'-CACCCTGACCGTGTCCTGT-3',反向引物序列为5'-CACCTTGCGGGCATTCTT-3',扩增长度为159 bp;NLRP3正向引物序列为5'-CTTCCTTTCCAGTTTGCTGC-3',反向引物序列为5'-TCTCGCAGTCCACTTCCTTT-3',扩增长度为212 bp。
1.2.4 血清IL-1β、IL-18水平 采集所有受试者清晨空腹外周血5 ml,3 000 r/min离心10 min,取上清,置于-80 ℃环境下保存待测,严格按照ELISA试剂盒说明书进行操作,显色后在Elx 800酶标仪下进行光密度(OD)值测定,波长为450 nm,根据OD值作出标准曲线,并计算样本浓度。
1.2.5 肺功能指标 检查前24 h停用长效支气管扩张剂,检查前12 h停用短效β2-受体激动剂,吸入沙丁胺醇200 μg,15 min后采用HP-Deskjet 3748肺功能仪检查肺功能指标〔第1秒用力呼气容积(FEV1)、用力肺活量(FVC)、第1秒用力呼气容积与用力肺活量比值(FEV1/FVC)、第1秒用力呼气容积占预计值百分比(FEV1%)〕,测量3次取平均值。
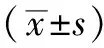
2 结果
2.1 对照组、A组、B组受试者NOD2 mRNA表达量、NLRP3 mRNA表达量、血清IL-1β和IL-18水平比较 3组受试者NOD2 mRNA表达量、NLRP3 mRNA表达量、血清IL-1β和IL-18水平比较,差异有统计学意义(P<0.05);A组、B组患者NOD2 mRNA表达量、NLRP3 mRNA表达量、血清IL-1β和IL-18水平高于对照组,差异有统计学意义(P<0.05);A组患者NOD2 mRNA表达量、NLRP3 mRNA表达量、血清IL-1β和IL-18水平高于B组,差异有统计学意义(P<0.05,见表1)。
Table1 Comparison of expressions of NOD2 mRNA and NLRP3 mRNA,serum levels of IL-1β and IL-18 among control group,A group and B group
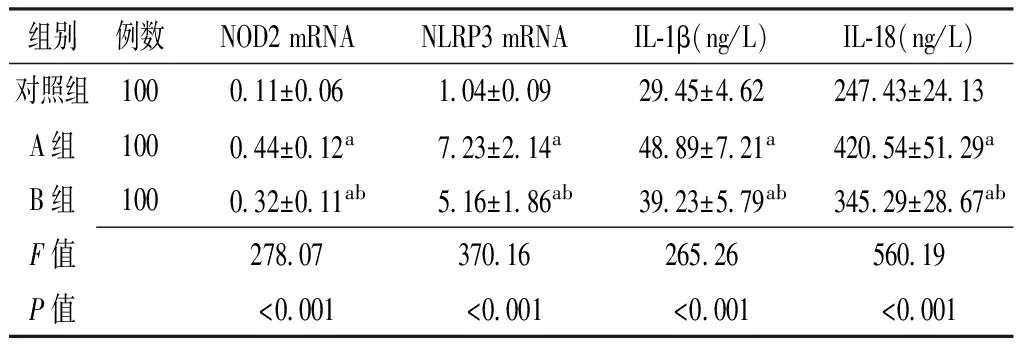
组别例数NOD2mRNANLRP3mRNAIL⁃1β(ng/L)IL⁃18(ng/L)对照组1000 11±0 061 04±0 0929 45±4 62247 43±24 13A组1000 44±0 12a7 23±2 14a48 89±7 21a420 54±51 29aB组1000 32±0 11ab5 16±1 86ab39 23±5 79ab345 29±28 67abF值278 07370 16265 26560 19P值<0 001<0 001<0 001<0 001
注:NOD2=核苷酸结合寡聚化结构域2,NLRP3=核苷酸结合寡聚化结构域样受体蛋白3,IL-1β=白介素1β,IL-18=白介素18;与对照组比较,aP<0.05;与A组比较,bP<0.05
2.2 对照组、低风险组、高风险组受试者NOD2 mRNA表达量、NLRP3 mRNA表达量、血清IL-1β和IL-18水平比较 3组受试者NOD2 mRNA表达量、NLRP3 mRNA表达量、血清IL-1β和IL-18水平比较,差异有统计学意义(P<0.05);低风险组、高风险组患者NOD2 mRNA表达量、NLRP3 mRNA表达量、血清IL-1β和IL-18水平高于对照组,差异有统计学意义(P<0.05);高风险组患者NOD2 mRNA表达量、NLRP3 mRNA表达量、血清IL-1β和IL-18水平高于低风险组,差异有统计学意义(P<0.05,见表2)。
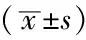
Table2 Comparison of expressions of NOD2 mRNA and NLRP3 mRNA,serum levels of IL-1β and IL-18 among control group,low-risk group,and high-risk group

组别例数NOD2mRNANLRP3mRNAIL⁃1β(ng/L)IL⁃18(ng/L)对照组1000 11±0 061 04±0 0929 45±4 62247 43±24 13低风险组500 30±0 10a5 08±1 14a37 78±6 98a330 78±23 62a高风险组500 49±0 18ab9 32±2 07ab57 31±10 54ab445 71±40 83abF值200 88842 26256 62781 10P值<0 001<0 001<0 001<0 001
注:与对照组比较,aP<0.05;与低风险组比较,bP<0.05
2.3 NOD2 mRNA表达量、NLRP3 mRNA表达量与血清IL-1β水平、血清IL-18水平、FEV1/FVC、FEV1%的相关性 Pearson相关性分析结果显示,NOD2 mRNA表达量、NLRP3 mRNA表达量与COPD患者血清IL-1β水平(r值分别为0.625、0.656)、血清IL-18水平(r值分别为0.701、0.723)呈正相关,与FEV1/FVC(r值分别为-0.389、-0.415)、FEV1%(r值分别为-0.513、-0.558)呈负相关(P<0.05)。
3 讨论
COPD发病机制复杂,炎症是其中心环节,临床常表现为气道、肺实质的慢性炎性反应,且炎性反应反复发生可损伤气道,导致气道重塑[5]。吸烟、烟雾、有害气体和病原微生物感染可导致气道炎症和损伤的发生,是COPD发生发展的影响因素[6]。
固有免疫能有效清除病原体及外源性有害物质,其中病原体的保守结构〔即病原体相关分子模式(PAMPs)〕识别可通过模式识别受体(PRRs)实现,PRRs和PAMPs相互作用可激活下游信号通路,介导多种炎性因子分泌和释放,从而引发炎性反应及免疫应答[7]。PRRs包括Toll样受体、NLRs等,目前研究较多的NLRs家族成员主要包括NOD2、NLRP3等[8]。NOD2与其特异性配体结合后可激活NF-κB经典信号通路和丝裂原激活蛋白激酶(MAPK)信号通路,产生大量促炎因子,导致炎性反应;同时激活NF-κB可增强NOD2 mRNA表达,促进促炎因子前体转录,使促炎因子分泌,具有调控炎性反应的作用[9]。NLRP3经PAMPs激活后耦联酶和相关蛋白形成NLRP3炎性小体,可参与机体固有免疫过程,在多种炎性反应中发挥了重要作用;同时,NLRP3炎性小体可在多种危险信号下被激活,调控IL-1β和IL-18 前体分泌,从而介导下游炎性反应发生。
本研究结果显示,A组、B组患者NOD2 mRNA表达量、NLRP3 mRNA表达量、血清IL-1β和IL-18水平高于对照组,A组患者NOD2 mRNA表达量、NLRP3 mRNA表达量、血清IL-1β和IL-18水平高于B组,与既往研究结果一致[10-12],提示COPD患者NOD2 mRNA表达量、NLRP3 mRNA表达量、血清IL-1β和IL-18水平较高,且AECOPD患者NOD2 mRNA表达量、NLRP3 mRNA表达量、血清IL-1β和IL-18水平更高;低风险组、高风险组患者NOD2 mRNA表达量、NLRP3 mRNA表达量、血清IL-1β和IL-18水平高于对照组,高风险组患者NOD2 mRNA表达量、NLRP3 mRNA表达量、血清IL-1β和IL-18水平高于低风险组,与既往研究结果一致[13]。研究表明,COPD患者由于感染、烟雾及有害气体等刺激而导致NOD2 mRNA表达量、NLRP3 mRNA表达量、血清IL-1β和IL-18水平升高,引发炎性反应,造成患者病情进展[14-15]。Pearson相关性分析结果显示,NOD2 mRNA表达量、NLRP3 mRNA表达量与COPD患者血清IL-1β、IL-18水平呈正相关,与FEV1/FVC、FEV1%呈负相关,提示NOD2、NLRP3可参与COPD患者炎性反应过程,可影响患者肺功能。
综上所述,COPD患者外周血NOD2、NLRP3表达水平及血清IL-1β、IL-18水平较高,且NOD2 mRNA表达量、NLRP3 mRNA表达量与COPD患者血清IL-1β、IL-18水平及肺功能有关。但本研究样本量较小,且研究对象多为中老年人,结果结论存在一定局限性,而NOD2、NLRP3影响COPD患者肺功能的具体机制仍有待扩大样本量进一步深入研究。
作者贡献:宋珊进行文章的构思与设计,撰写论文;陈绍平进行研究的实施与可行性分析,负责文章的质量控制及审校,对文章整体负责,监督管理;毛建、韩美玲、廖俊蕾进行数据收集、整理、分析;贾钦尧进行结果分析与解释;贾钦尧、韩美玲进行论文的修订;廖俊蕾进行英文的修订。
本文无利益冲突。
[1]杨其彬,周京国,青玉凤,等.痛风性关节炎患者外周血单个核细胞NLRP3炎性体mRNA表达的研究[J].中华风湿病学杂志,2010,14(10):686-689.DOI:10.3760/cma.j.issn.1007-7480.2010.10.008.
[2]毛建,宋珊,贾钦尧,等.慢性阻塞性肺疾病患者外周血淋巴细胞NLRP3 mRNA的表达及血清IL-1β、IL-18检测的意义[J].临床肺科杂志,2017,22(6):1060-1063.DOI:10.3969/j.issn.1009-6663.2017.06.026.
[3]黄巧玲,覃聪,黄广群,等.NLRP3炎症小体及其下游炎症因子在动脉粥样硬化炎症反应中的作用[J].海南医学,2017,28(1):86-88.DOI:10.3969/j.issn.1003-6350.2017.01.026.
[4]丁焕发,徐晓辰,王尚云,等.急性痛风性关节炎患者治疗前后外周血单核细胞NLRP3炎性体mRNA表达及血清IL-18水平的研究[J].中国医药指南,2016,14(14):1-3.
[5]孙志芬,张媚霞,曲桂红,等. 噻托溴铵治疗慢性阻塞性肺疾病稳定期的临床疗效及对血清白介素18、肿瘤坏死因子α、基质金属蛋白酶9水平的影响研究[J]. 实用心脑肺血管病杂志,2016,24(8):50-53.
[6]陈愉生,陈小燕,陈正伟,等.单纯烟雾暴露建立慢性阻塞性肺疾病大鼠模型的方法学研究[J].实用心脑肺血管病杂志,2016,24(10):58-62.DOI:10.3969/j.issn.1008-5971.2016.10.016.
[7]王国强,牟佳,李元,等.NLRP3、AIM2和CASP1基因在慢性阻塞性肺疾病急性加重发病中的作用[J].吉林大学学报(医学版),2016,42(1):130-133.DOI:10.13481/j.1671-587x.20160126.
[8]田岚.痛风性关节炎患者外周血单个核细胞中TRF1、TRF2及NLRP3炎性体的变化[J].中国医药导报,2015,12(34):82-85.
[9]韩浩贤,王虹艳,曲鹏,等.NLRP3与NOD2受体激活对下游炎症因子表达的影响[J].重庆医学,2016,45(23):3182-3184.DOI:10.3969/j.issn.1671-8348.2016.23.005.
[10]王金凤.NOD1、NOD2及NLRP3炎症小体在肺部疾病中的研究进展[D].兰州:兰州大学,2013.
[11]贾钦尧,陈绍平,李新胜,等.慢性阻塞性肺疾病患者外周血单个核细胞NOD2 mRNA表达及白细胞介素-6的水平及意义[J].中国老年学杂志,2017,37(14):3529-3531.
[12]杨其彬.NLRP3炎性体信号通路在急性痛风性关节炎患者中变化的研究[D].南充:川北医学院,2011.
[13]王师,王华英,翁跃颂,等.NLRP3炎症小体通路在慢性阻塞性肺病发展中的作用研究[J].浙江医学,2017,39(1):32-36.
[14]HAMMAD D R,ELGAZZAR A G,ESSAWY T S,et al.Evaluation of serum interleukin-1 beta as an inflammatory marker in COPD patients[J].Egyptian Journal of Chest Diseases and Tuberculosis,2015,64(2):347-352.DOI:10.1016/j.ejcdt.2015.01.005.
[15]王莉莉.NLRP3炎症小体及其下游炎症因子在动脉粥样硬化炎症反应中的作用[D].大连:大连医科大学,2013.
PeripheralBloodExpressionsofNOD2,NLRP3andDownstreamInflammatoryCytokinesinPatientswithCOPDandTheirCorrelations
SONGShan,JIAQin-rao,CHENShao-ping,MAOJian,HANMei-ling,LIAOJun-lei
DepartmentofRespiratoryMedicine,theAffiliatedHospitalofNorthSichuanMedicalCollege,Nanchong637000,China
CHENShao-ping,E-mail:chenshaoping836@163.com
ObjectiveTo investigate the peripheral blood expressions of NOD2,NLRP3 and downstream inflammatory cytokines in patients with COPD and their correlations.MethodsA total of 200 patients with COPD were selected in the Affiliated Hospital of North Sichuan Medical College from January 2015 to January 2017,thereinto 100 patients with acute exacerbation of COPD were served as A group,other 100 patients with stable COPD were served as B group,and then patients of B group were divided into low-risk group and high-risk group according to the pulmonary function grading and acute exacerbation frequency within 1 year,each of 50 cases;meanwhile 100 healthy people admitted to this hospital for physical examination were selected as control group.Expressions of NOD2 mRNA and NLRP3 mRNA,serum levels of IL-1β and IL-18 were compared among A group,B group and control group,among low-risk group,high-risk group and control group;Pearson correlation analysis was used to analyze the correlations of expressions of NOD2 mRNA and NLRP3 mRNA with serum levels of IL-1β and IL-18,FEV1/FVC and FEV1% in patients with COPD.ResultsExpressions of NOD2 mRNA and NLRP3 mRNA,serum levels of IL-1β and IL-18 of A group and B group were statistically significantly higher than those of control group,meanwhile expressions of NOD2 mRNA and NLRP3 mRNA,serum levels of IL-1β and IL-18 of A group were statistically significantly higher than those of B group(P<0.05).Expressions of NOD2 mRNA and NLRP3 mRNA,serum levels of IL-1β and IL-18 of low-risk group and high-risk group were statistically significantly higher than those of control group,meanwhile expressions of NOD2 mRNA and NLRP3 mRNA,serum levels of IL-1β and IL-18 of high-risk group were statistically significantly higher than those of low-risk group(P<0.05).Pearson correlation analysis results showed that,NOD2 mRNA expression and NLRP3 mRNA expression was positively correlated with serum levels of IL-1β(r=0.625;r=0.656)and IL-18(r=0.701;r=0.723),respectively,was negatively correlated with FEV1/FVC(r=-0.389;r=-0.415)and FEV1%(r=-0.513;r=-0.558),respectively(P<0.05).ConclusionPeripheral blood expressions of NOD2,NLRP3,serum levels of IL-1β and IL-18 are significantly elevated in patients with COPD;expressions of NOD2 mRNA and NLRP3 mRNA are significantly correlated with serum levels of IL-1β and IL-18,pulmonary function of patients with COPD.
Pulmonary disease,chronic obstructive;Nucleotide binding oligomerization domain containing 2;Nucleotide binding oligomerization domain like receptor protein 3;Inflammatory factors
四川省教育厅基金资助项目(16ZB0230)
637000四川省南充市,川北医学院附属医院呼吸内科
陈绍平,E-mail:chenshaoping836@163.com
R 563.9
A
10.3969/j.issn.1008-5971.2017.09.010
2017-06-01;
2017-08-29)
(本文编辑:李洁晨)

