巴氏法联合高渗盐水对骨与软组织恶性肿瘤体外灭活研究
高兴,顾庆陟,陶开亮,樊雪鹏,李承铎,李宝剑,李冬,田征*
(1.新疆医科大学,新疆 乌鲁木齐 830054;2.新疆医科大学第一附属医院骨科,新疆 乌鲁木齐 830054;3.佳木斯大学,黑龙江 佳木斯 154000)
实验研究
巴氏法联合高渗盐水对骨与软组织恶性肿瘤体外灭活研究
高兴1,2,顾庆陟1,2,陶开亮1,2,樊雪鹏1,2,李承铎1,2,李宝剑1,李冬3,田征1,2*
(1.新疆医科大学,新疆 乌鲁木齐 830054;2.新疆医科大学第一附属医院骨科,新疆 乌鲁木齐 830054;3.佳木斯大学,黑龙江 佳木斯 154000)
目的探讨20%高渗盐水对体外肿瘤细胞的灭活作用及温度、时间效应关系,为临床骨与软组织恶性肿瘤进行自体骨灭活再植保肢手术提供指导。方法选取四肢及骨盆术前活检确诊为骨与软组织恶性肿瘤患者24例,去除4例不符合条件病例,分三组分别在0.9%盐水、20%高渗盐水、巴氏法联合高渗盐水处理(15 min、30 min、45 min),采用光镜、透射电镜观察并计算肿瘤细胞灭活率。结果20%高渗盐水及巴氏法联合法各时间点肿瘤细胞灭活较0.9%等渗盐水存在明显差异,差异有统计学意义(P<0.01);巴氏联合法15 min优于20%高渗盐水组(P<0.01)。结论20%高渗盐水灭瘤作用确切,联合巴氏法或增加灭瘤时间能明显增加肿瘤细胞坏死率,增加灭瘤时间至30min以上灭瘤效果达到最佳。
高渗盐水;恶性骨肿瘤;灭活;凋亡;骨肉瘤
1 资料与方法
1.1 材料
1.1.1 标本 收集2016年1月至2017年5月我科手术患者离体肿瘤标本24份,骨肉瘤12例,软骨肉瘤5例,转移癌6例,黏液炎性纤维母细胞肉瘤1例,女13例,男11例;年龄6~78岁。术前均经病理确诊,12例骨肉瘤8例术前行新辅助化疗治疗,4例患者化疗后切除肿瘤后测得肿瘤坏死率大于5%,予以剔除,其余病例纳入实验,1例软骨肉瘤行术前化疗,余术前未接受化疗。
1.1.2 仪器与制剂 JEM-1230透射电镜(日本电子株式会社),莱卡显微镜、莱卡病理组织脱水机、莱卡石蜡包埋机、莱卡切片机、病理图像采集系统(徕卡微系统有限公司),水浴箱(上海跃进医疗器械厂),伊红染液、苏木素染液(北京索莱宝科技有限公司),EDTA(武汉市盖云天生物技术有限公司)20%高渗盐水(新疆医科大学第一附属医院药剂科)等。
1.2 方法
1.2.1 标记 每实验病例准备10个标本盒,标注未处理空白参照一个;常温0.9%等渗生理盐水15 min、30 min、45 min时间段各一个标记;常温20%高渗盐水15 min、30 min、45 min时间段各一个标记;65℃ 20%高渗盐水15 min、30 min、45 min时间段各一个标记。
1.2.2 采集处理组织 在肿瘤组织离体后将肿瘤沿最大纵径抛开,结合影像学及肉眼观察,选取无坏死组织层面,沿肿瘤同一层面将组织块分成大小约1 cm×1 cm×1 cm 10份,冲洗组织块,将1块组织立即固定,其余9块分3份分别放入常温0.9%生理盐水、常温20%高渗盐水、65℃ 20%高渗盐水恒温箱内分别计时至15 min、30 min、45 min,处理后分别放入4%中性甲醛溶液内固定,0.9%生理盐水各时间点为空白对照组,甲醛立即固定组织作为生理盐水组的参考标本。
1.2.3 制作病理切片 将不同处理因素下肿瘤组织充分固定后,骨组织经EDTA脱钙液脱钙[7]分别将组织脱水、石蜡包埋、切片、脱蜡、HE染色等制成病理切片。
1.2.4 判断标准 依据细胞坏死的形态学特征[8],细胞膜破裂,核浓缩、核碎裂、核溶解、胞浆嗜酸性染色加深的细胞表明已坏死,不纳入计数;形态正常、细胞核和细胞膜完整的细胞纳入计数。每张玻片随机观察10个高倍视野(放大400倍),取其平均值。
1.2.5 灭活率计算方法[9]单个标本各时间点灭活率=(每高倍视野下生理盐水对照中的肿瘤细胞数一每高倍视野下不同温度下高渗盐水各时间点的肿瘤细胞数)/每高倍视野下生理盐水对照中的肿瘤细胞数×100%。
1.3 统计学方法 将20例肿瘤标本镜下观察数据输入SPSS 24.0统计软件包处理,用中位数、百分位数进行统计描述。实验设计类型为成组设计,各时间点灭活率组间比较采用Kruskal Wallis秩和经验,两两比较用Bonferroni校正法,P<0.05为差异有统计学意义。
2 结 果
2.1 灭活骨及软组织肿瘤HE染色光镜下观察 纳入标本满视野细胞坏死率小于等于2%,生理盐水各时间点对照组坏死率无明显增多,常温20%高渗盐15 min,细胞体积缩小,外围常见一围绕细胞环状空白区,细胞核及染色质浓聚,以核浓缩及裸核为主。30 min,肿瘤坏死为胞核浓缩,胞浆嗜酸性变内部胞核浓缩进一步增强,核碎裂及核溶解细胞占比增多。45 min,细胞坏死仍以核浓缩为主,胞浆嗜酸性进一步增强,常可见小于3%片状无法辨别的伊红样嗜酸性染色结构。巴氏法联合15 min,肿瘤细胞仍以核浓缩坏死为主,核染色质嗜碱性增强,可见5%肿瘤坏死呈片状嗜酸性红染样溶解。30 min,细胞坏死以核浓缩及核碎裂为主,核碎裂及核溶解较15 min时进一步增多。胞浆呈强嗜酸性改变并出现空泡样改变,片状无结构坏死进一步增多,45 min,细胞坏死以核浓缩及核碎裂为主,核碎裂及核溶解较30 min时增多,部分细胞于核浓缩细胞内可见白色空泡样变化(见图1)。
2.2 电镜下表现 灭活骨及软组织肿瘤电镜下表现:常温下生理盐水组30 min细胞膜结构完整,细胞核染色质均匀分布,未见明显溶解破坏,肿瘤细胞未见明显坏死。常温下20%高渗盐水30 min细胞基质水肿明显,可见空泡样变,线粒体明显肿胀、峭溶解明显,肿瘤细胞坏死彻底。65℃ 20%高渗盐30 min细胞核染色质明显溶解,细胞核异染色质增生,分布在核膜周围和核中央区域,肿瘤细胞坏死彻底(见图2)。
2.3 各组肿瘤坏死率 20份肿瘤标本0.9%生理盐水15 min、30 min、45 min灭活率小于2%,常温下20%高渗盐15 min灭活率82.77%,30 min、45 min灭活率100%,巴氏法联合组,15 min灭活率92.03%,30 min、45 min灭活率100%(见表1)。
3 讨 论
高渗盐灭活机制是使肿瘤细胞极度脱水,造成肿瘤细胞内环境紊乱、代谢障碍,使肿瘤细胞不可逆性损害而死亡。对于灭活骨而言,20%的高渗盐水不会使灭活骨深部骨基质中的蛋白质发生化学变性,盐离子在溶液中是高度移动的。根据霍夫迈斯特效应,高浓度的盐可能会保护静电相互作用的蛋白质,从而进一步改变蛋白质的空间构象和它们的热稳定性[10-11]。高渗盐水被广泛地用作蛋白质稳定剂和沉淀剂在生物化学与分子生物学;所以我们选择使用高渗盐水代替生理盐水作为失活剂在灭瘤同时更好地保护蛋白质活性。20%的高渗盐水是临床使用最佳浓度。高浓度的氯化钠是一种蛋白质稳定剂而不是蛋白变性剂[10],这样灭活骨内参与骨骼重建的细胞因子及骨诱导蛋白得以保留,断端骨愈合不仅依靠骨传导作用,而且还需要骨诱导作用。灭活骨作为“支架”,可激活间充质细胞和成骨细胞对骨形态发生蛋白基因的表达,合成并分泌内源性骨形态发生蛋白,且呈现出一定阶段性,诱导灭活骨周围肌肉及间充质细胞形成外生骨痂,促进修复愈合,随着骨传导不断进行,宿主骨与灭活骨连接界面愈合,逐渐向骨段中间发展,最终完成骨性连接。
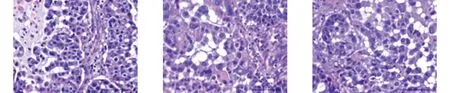
a 0.9%生理盐水15 min b 0.9%生理盐水30 min c 0.9%生理盐水45 min
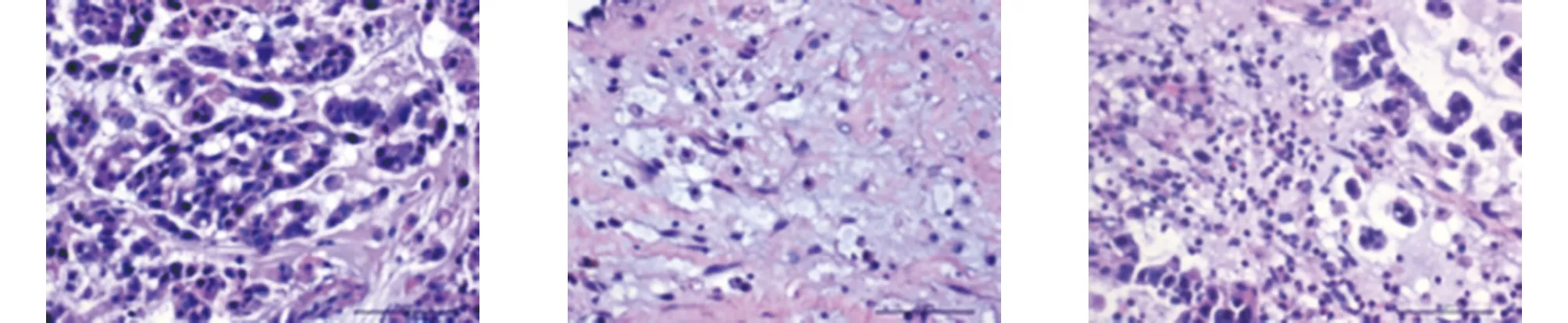
d 常温20%高渗盐15 min e 常温20%高渗盐30 min f 常温20%高渗盐45 min
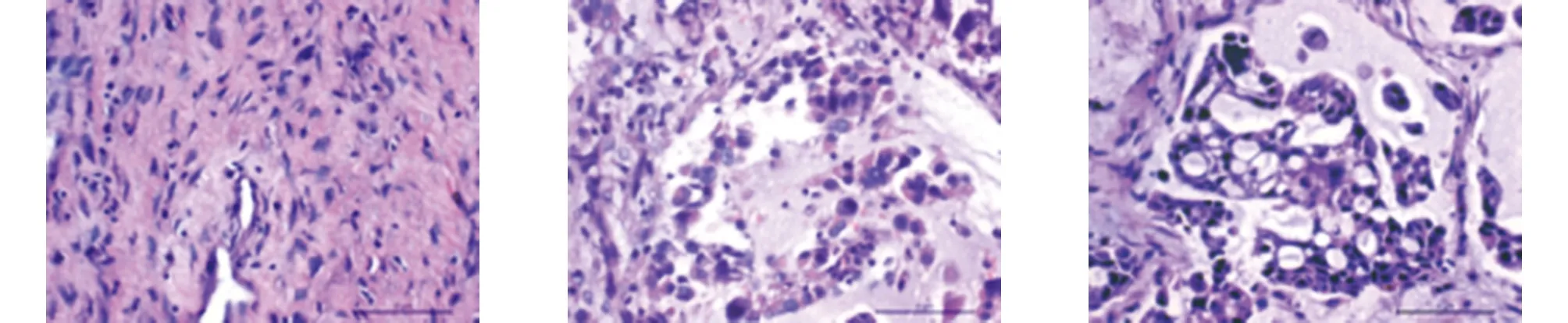
g 巴氏联合法15 min h 巴氏联合法30 min i 巴氏联合法45 min
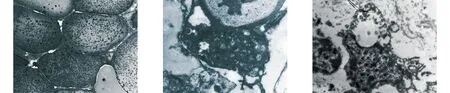
a 常温等渗盐水30 min b 常温20%高渗盐30 min c 65℃ 20%高渗盐30 min

图2 各组处理后电镜下形态改变(电镜,×15 000)
高渗盐水灭活再植的断端愈合及力学强度研究,彭长亮等[4]在动物模型上,用20%高渗盐水浸泡离体兔尺骨20 min进行回植后,行X线、三点弯曲负荷实验,再植后3周即可见其近段有骨痂形成,骨外膜侧有直接骨形成;6周时HE染色显示骨基质内可见成堆的幼稚软骨细胞增生,骨化而逐渐成骨,即为软骨化骨。24周已接近正常骨;三点弯曲负荷实验力学测试结果发现,6、12周生理盐水对照侧三点弯曲载荷明显高于灭活骨,24周两者差异无统计学意义。
灭活再植是一种理想的解决肿瘤切除后大段骨缺损的方法,瘤骨灭活再植的生物重建具有价格低廉、断端骨愈合能力良好、恢复解剖重建等优点,但灭活技术必须在彻底杀灭骨内肿瘤细胞的同时,尽可能保留残存骨力学强度、再生活性。术后复发及灭活骨出现骨折是亟需解决的问题。国内外学者报道液氮冷冻[8]、高温蒸气[12]、无水乙醇[13]、辐照灭活、巴氏法[3,6]等,均保证了足够的肿瘤坏死率,但上述灭活方法中液氮、高温等方法在灭瘤的同时严重破坏了骨的力学强度,术后骨折发生率高达20%~50%。我国常用的乙醇在骨的灭活中往往不易彻底杀灭肿瘤细胞,回植后局部复发率高,应用于骨肉瘤患者局部复发率可达20%以上,因而近年来已较少使用。实验证明,骨组织用95%的乙醇浸泡20 min,只有薄层外侧和髓腔皮层被侵及而被灭活,深部的肿瘤细胞只是被一层死骨壳紧紧包裹,与外界隔绝。乙醇灭活的缺点是渗透性差,灭活不彻底,局部复发率高达20%以上。与乙醇相比,高渗盐水对骨的渗透性极强,能够渗透到肿瘤的深部,从而保证杀死全部肿瘤细胞,且可以保留灭活骨骨基质中的骨形态发生蛋白及其他成骨诱导细胞因子,这些成骨诱导因子就能发挥作用诱导成骨,这为以后骨骼重建创造了比较有利的条件。高渗盐水也广泛应用于肝癌、包虫病、淋巴瘤等治疗,王俊江等[14]报道应用10%~20%高渗盐联合0.125%冰醋酸对肺包虫囊内原头蚴作用5 min即有损害作用,10 min损害更加严重,伊红染色100%坏死,Sun等[15]从病理HE染色证实射频联合高渗盐水对兔子肝脏肿瘤灭活效果确切,Bikowski等[16]应用23.4%的高渗盐水于局限性淋巴瘤患者,注射后患者症状明显缓解,以局部色素沉着为最小副作用为代价,Gennar等[17-18]报道应用20%高渗盐水于脊柱骨包虫的辅助治疗取得了满意的效果,高渗盐水广泛应用于各种疾病的治疗且获得满意效果,文献中对高渗盐水的浓度、时间、温度报道不尽相同,郭卫等[2-4]报道应用10%~20%高渗盐水浸泡20 min、30 min、45 min灭瘤均取得满意的结果,文献报道对灭活时间多在30 min,在较为广泛临床应用的同时文献中鲜有对肿瘤灭活时间相关的基础形态学研究报道,在我们的研究中常温20%高渗盐水15 min时不能完全对肿瘤细胞完全灭活,达到30 min后才可彻底灭活瘤骨,有学者也报道当高渗盐水成为肿瘤单一灭活因素时肿瘤坏死不彻底容易复发[5],国内外文献报道高渗盐联合20%巴氏法灭活效果更彻底[2,6],且巴氏法具有对骨力学性能达到最少灭活影响。
巴氏法对骨相关恶性肿瘤的灭活是一种行之有效的方法。在此基础上,一些研究已经完成对这些骨愈合相关蛋白在灭活骨的活动。人骨形态发生蛋白在骨的成骨活性可以得到一定的保留在巴氏法中[19],这可能会促进骨折愈合时的成骨。临床和实验研究表明,加热是一种有效的杀灭肿瘤细胞的方法。Qu等[6]学者研究65℃ 20%高渗盐应用于27例骨恶性肿瘤30 min后平均随访时间62.8个月数据对比单纯巴氏法、放射、高温、同种异体骨在骨断端不愈合率、平均骨愈合时间、深部感染率、骨折发生率均优于其他灭瘤方法,此灭瘤方法正是巴氏法联合高渗盐的灭瘤方法。
为获得高渗盐水最佳灭瘤时间和效果,做了上述实验研究,认为20%高渗盐水15 min时不能完全对肿瘤细胞完全灭活,联合巴氏法对肿瘤细胞灭活明显增强,但仍然不能达到最佳灭瘤效果,30 min及以上时灭活均可以达到满意灭瘤效果,但联合巴氏法灭瘤效果更加确切,对肿瘤细胞的杀伤更加彻底,联合巴氏法15 min,肿瘤细胞仍以核浓缩坏死为主,核染色质嗜碱性增强,可见5%肿瘤坏死呈片状嗜酸性红染样溶解。30 min、45 min,细胞坏死以核浓缩及核碎裂为主,核碎裂及核溶解较15 min时明显增多。胞浆内可见大量气泡样变性,且无结构样片状坏死明显增多,进一步在电镜下对细胞坏死进行验证,细胞核染色质明显溶解,细胞质明显肿胀,线粒体肿胀呈气球样变,得出肿瘤细胞坏死彻底。
本研究也存在一些不足之处:a)标本纳入量较少,由于骨与软组织肿瘤发病率较低,百万基数中可能病发几例患者,发病率低给实验造成了困难。b)纳入疾病种类不一,在对骨与软组织肿瘤高渗盐水研究过程中,发病率低致使很难收集单一肿瘤进行研究,各种肿瘤细胞可能对高渗盐水的生存抵抗存在着差异,对这种差异在混合病种研究中不能发现。c)研究时间跨度较大,考虑到巴氏法灭菌是60~65℃加热30 min才能达到联合作用,实验设计了时间15 min、30 min、45 min 3个时间段,实验得出30 min即可达到理想效果,在缩短灭活时间至20 min时可能也会达到相同效果,今后我们会针对上述不足继续改进收集较多病理标本,精准实验时间继续探索研究。
灭活瘤骨移植具有廉价、解剖重建、力学性能稳定等优点可以作为一个良好的选择,20%高渗盐30 min及以上对离体骨与软组织恶性肿瘤可以完全灭活,联合巴氏法可使瘤细胞灭活更彻底,20%高渗盐是一种良好及有效的灭活再植方法。良好的灭瘤结果和可接受的并发症发生率使它成为一个合适的替代金属假体修复节段性骨缺损的方法。未来随着高渗盐水的研究更加深入,高渗盐水可能广范应用于骨与软组织恶性肿瘤灭活再植治疗中,同时也可用于骨巨细胞瘤等良性肿瘤的辅助治疗,高渗盐水安全、易得、价廉,在各层次医院均较易获得,为我国广大基层医院治疗骨与软组织良恶性肿瘤提供更多的治疗选择。
[1]康晓征,闫万璞,杨永波,等.骨与软组织肉瘤肺转移的单中心大样本外科治疗结果及预后分析[J].中国肺癌杂志,2016,19(5):299-306.
[2]郭卫,杨荣利,汤小东,等.复合移植重建恶性骨肿瘤切除后骨缺损[J].中华骨科杂志,2003,23(4):13-16.
[3]杨毅,郭卫,杨荣利,等.肿瘤骨灭活再植重建骨盆肿瘤切除后骨缺损的临床研究[J].中华外科杂志,2014,52(10):754-759.
[4]彭长亮,杨毅,孙馨,等.高渗盐水灭活自体骨再植的动物实验[J].北京大学学报(医学版),2012,44(6):950-953.
[5]彭秋平,汪森明,张积仁.高渗盐水注射提高对小鼠肝癌冷冻疗效的实验研究[J].现代诊断与治疗,2002,1(1):14-16.
[6]Qu H,Guo W,Yang R,et al.Reconstruction of segmental bone defect of long bones after tumor resection by devitalized tumor-bearing bone[J].World J Surg Oncol,2015,13(1):282.
[7]赵雨坤,郑康,郭晴晴,等.一种基于EDTA脱钙法的改良骨组织脱钙方法[J].中国实验方剂学杂志,2016,22(11):17-19.
[8]刘斌.深低温冷冻灭活技术在骨肉瘤保肢治疗中的应用及进展[J].中国癌症防治杂志,2016,8(1):66-68.
[9]张剑英,周滋霞,顾则娟,等.无水乙醇灭活体外肿瘤细胞的时间效应研究[J].中华护理杂志,2012,47(4):339-340.
[10]MT Record,Jr W Zhang,CF Anderson.Analysis of effects of salts and uncharged solutes on protein and nucleic acid equilibria and processes:a practical guide to recognizing and interpreting polyelectrolyte effects,hofmeister effects,and osmotic effects of salts[J].Adv Protein Chem,1998(51):281-353.
[11]DL Beauchamp,M Khajehpour.Studying salt effects on protein stability using ribonuclease T1as a model system[J].Biophys Chem,2012(161):29-38.
[12]陈秉耀,韦兴,李南,等.微波消融治疗下肢长骨骨肉瘤15例随访报告[J].中国骨与关节杂志,2014,12(4):272-276.
[13]许宋锋,刘江,聂鑫,等.酒精灭活瘤段骨在重建恶性骨肿瘤骨缺损中的应用[J].中国骨与关节杂志,2015,4(5):354-360.
[14]王俊江,田征.高渗盐水在恶性骨肿瘤治疗中的应用[J].中华医学杂志,2016,96(11):910-912.
[15]Sun YX,Cheng W,Han X,et al.In vivo experimental study on the effects of fluid in increasing the efficiency of radiofrequency ablation[J].Asian Pac J Cancer Prev,2014,15(14):5799-5804.
[16]Bikowski JB,Dumont AM.Lymphangioma circumscriptum:treatment with hypertonic saline sclerotherapy[J].J Am Acad Dermatol,2005,53(3):442-444.
[17]Gennari A,Almairac F,Litrico S,et al.Spinal cord compression due to a primary vertebral hydatid disease:a rare case report in metropolitan france and a literature review[J].Neurochirurgie,2016,62(4):226-228.
[18]Togral G,Arikan SM,Ekiz T,et al.Musculoskeletal hydatid cysts resembling tumors:a report of five cases[J].Orthop Surg,2016,8(2):246-252.
[19]Takata M,Sugimoto N,Yamamoto N,et al.Activity of bone morphogenetic protein-7 after treatment at varioustemperatures:freezing vs.pasteurization vs.allograft[J].Cryobiology,2011,63(3):235-239.
InVitroInactivationoftheMalignantTumorsofBoneandSoftTissuebyPasteurizationCombinedwithHypertonicSaline
Gao Xing1,2,Gu Qingzhi1,2,Tao Kailiang1,2,et al
(1.Xinjiang Medical University,Urumqi 830054,China;2.The First Affiliated Hospital of Xinjiang Medical University,Urumqi 830054,China)
ObjectiveTo study the effect of 20% hypertonic saline on the in vitro inactivation of tumor cells and its relationships with temperature and time,and to provide guidance for the inactivation of autologous bone and limb salvage operation in the treatment of clinical malignant tumors of bone and soft tissue.Methods24 patients who were diagnosed with malignant tumors of bone and soft tissue according to the biopsy of limbs and pelvis before operation were chosen,and 4 patients who didn’t meet the requirement were removed.The samples were treated with 0.9% saline,20% hypertonic saline,and pasteurization treatment combined with hypertonic saline (15,30,45 min) and were observed by optical microscope,transmission electron microscope.The inactivation rate of the tumor cells were calculated.ResultsInactivated tumor cells at 20% hypertonic saline and pasteurization combined with hypertonic saline at each time were obviously different compared with 0.9% isotonic saline,and the difference was statistically significant (P<0.01).The effect of inactivating of 15 min pasteurization combined with hypertonic saline was better than 20% hypertonic saline group (P<0.01).ConclusionThe effect of 20% hypertonic saline on tumor elimination is reliable,and combining with pasteurization or increasing the time of killing tumor cells can obviously increase the necrosis rate of tumor cells.The time of killing tumor cells is more than 30 min,and the effect of killing tumor will be best.
hypertonic saline;malignant bone tumor;inactivation;apoptosis;osteosarcoma
1008-5572(2017)10-0899-05
R738.6
A
新疆维吾尔自治区自然科学基金资助项目(2014211C034);*本文通讯作者:田征
高兴,顾庆陟,陶开亮,等.巴氏法联合高渗盐水对骨与软组织恶性肿瘤体外灭活研究[J].实用骨科杂志,2017,23(10):899-903.
2017-07-17
高兴(1990- ),男,研究生在读,新疆医科大学,新疆医科大学第一附属医院骨科,830054。
骨与软组织肉瘤属于罕见疾病[1],仅占成人所有癌种的0.2%,以儿童及青少年发病居多,新辅助化疗及Enneking外科分期概念的推广,保肢手术已成为治疗恶性骨与软组织肿瘤的经典术式。保肢手术有人工假体置换、同种异体骨移植、自体骨灭活再植等方法,人工假体价格昂贵,同种异体骨因我国缺乏大型骨库且供体较少,常不能实现,自体骨灭活再植相对廉价、且无免疫排斥等问题,是一种重要的重建术式,灭瘤方法主要有:高压蒸气、液氮、辐照或无水乙醇、高渗盐水化学灭活后植回原位,然后辅助内固定装置达到解剖上的重建,高渗盐水有着操作方便、使用安全、灭活后对移植骨的力学强度影响较小等特点。
目前国内外对高渗盐水的临床应用研究较为广泛,多数研究集中在包虫病的辅助灭活,肝、肾、淋巴等实体肿瘤的注射灭瘤,均取得了较为满意效果。高渗盐水在骨与软组织恶性肿瘤治疗中应用较少,国内学者对高渗盐的研究自2000年起主要以北京大学人民医院骨与软组织肿瘤治疗中心郭卫等[2-4]报道10%~20%高渗盐浸泡离体负瘤骨行灭活再植,高渗盐水应用时间在10~30 min之间灭瘤均取得满意的效果,国外学者对高渗盐水在骨与软组织恶性肿瘤鲜有报道,目前研究者对高渗盐水在骨与软组织灭瘤再植的灭活时间尚没有定论,临床应用多集中在30 min,尚缺乏高渗盐水灭瘤后时间因素肿瘤坏死率的基础研究,为获得高渗盐水最佳灭活时间及对细胞坏死形态学的基础研究,本研究针对不同时间20%高渗盐水进行分组实验,希望为临床骨与软组织肿瘤离体灭活再植缩短手术时间,避免因长时间手术增加相关并发症发生率,提供有力理论依据,同时有学者报道当高渗盐水成为肿瘤单一的灭活因素时肿瘤坏死不彻底容易复发[5],有学者提出增加温度至65℃成为联合巴氏法灭瘤方法,效果将进一步增强[3,6],但两种方法均缺少基础研究的报道,为探究20%高渗盐水是否灭瘤效果确切且联合巴氏法进一步增强灭瘤效果,特进行如下实验。

