红景天苷通过抑制补体C3的表达对MCAO大鼠缺血侧NeuN、Egr4影响的研究
宋百颖,赖文芳,苏燕青,林 昱,许 文,洪桂祝
(福建中医药大学药学院,福建 福州 350122)
红景天苷通过抑制补体C3的表达对MCAO大鼠缺血侧NeuN、Egr4影响的研究
宋百颖,赖文芳,苏燕青,林 昱,许 文,洪桂祝
(福建中医药大学药学院,福建 福州 350122)
目的探讨红景天苷(Sal)通过抑制补体C3对MCAO大鼠缺血侧NeuN、Egr4的影响。方法♂成年SD大鼠45只随机分成假手术组(sham)、模型组(MCAO)以及给药组(MCAO+Sal),采用线栓法制备大鼠大脑中动脉闭塞模型(middle cerebral artery occlusion,MCAO)。连续给药1、2 d,免疫荧光及Western blot技术检测NeuN、Egr4、C3和C1的表达情况。健康成年♂ SD大鼠60只,随机分为6组,即人工脑脊液+sham、C3aR抑制剂+sham、人工脑脊液+MCAO、C3aR抑制剂+MCAO、人工脑脊液+MCAO+Sal、C3aR抑制剂+MCAO+Sal,Western blot技术检测缺血侧脑组织NeuN、Egr4、C3的表达水平。结果与MCAO组相比较,经红景天苷分别作用1、2 d能使C3的表达明显下降,NeuN表达明显上升;红景天苷给药1 d对Egr4和C1没有明显影响,但能使2 d的Egr4表达明显升高, C1的表达明显降低;经连续2 d侧脑室注射C3aR抑制剂或给予红景天苷后,均能够降低P50的表达,增加Egr4的表达。结论红景天苷对脑缺血/再灌注亚急性期的神经保护功能可能与抑制补体经典途径的激活,调控Egrs,从而减少细胞凋亡有关。
红景天苷;脑缺血/再灌注;补体C3;C3aR抑制剂;Egrs;神经保护
脑卒中的致死率在西方工业国家位列第3,仅次于恶性肿瘤和心血管疾病。在我国的致死性疾病中位居第2,且发病率正在逐年上升。补体系统是人体免疫系统重要的组成部分,广泛参与机体的微生物防御的免疫反应。补体系统介导的炎症反应,使得脑损伤加重[1-2]。因此,适当抑制补体系统有利于减轻脑损伤的炎症反应,促进神经修复。
红景天(RhodiolaroseaL.)为景天科植物,其药用历史悠久,红景天苷(salidroside, Sal)是红景天有效成分之一,也是红景天的药用基础,具有保护神经、清除自由基、调节中枢神经系统的神经递质、促进神经修复等功效[3]。研究表明[4],红景天苷能有效减少缺血性脑损伤大鼠的大脑梗死体积以及改善神经损伤[5]。因此,本实验在红景天苷对脑缺血/再灌注大鼠保护作用的基础上,着重分析红景天苷在脑缺血/再灌注大鼠模型中对补体系统C3的作用。
1 材料
1.1药品与试剂红景天苷(由福建中医药大学提供,纯度≥98%);DAPI染色液(碧云天生物技术有限公司,货号:C1005);神经元特异性核蛋白(neuron specific nuclear protein, NeuN)抗体(Abcam,货号:ab104224);C3抗体(生工生物工程上海有限公司,货号:AB51005);C3a抗体(Abcam,货号:ab48581);PCNA(F-2)抗体(Santa Cruz,货号:sc-2528);C3aR抑制剂(Santa Cruz,货号:sc-222291);早期生长反应转录因子-4(early growth response transcription factor 4, Egr4)抗体(Santa Cruz,货号:sc-133540);β-actin抗体(碧云天生物技术有限公司,货号:H015)。
1.2实验动物健康成年♂大鼠105只,SPF级,购于上海斯莱克实验动物有限公司,合格证号:2015000509563,许可证号:SCXK(沪)2012-0002,由福建中医药大学实验动物中心饲养,许可证号:SYXK(闽)2014-0005。
1.3仪器凝胶成像分析系统 (Bio-Rad,型号:ChemiDoc XRS+);PCR 仪(Bio-Rad,型号:C1000);高速台式冷冻离心机(Thermo Fisher,型号:PrimoR);电热恒温培养箱(上海一恒,型号DHP-9052);快速混匀器(常州国华电器,型号SK-1)。
2 方法
2.1动物分组及给药方法第1批:大鼠随机分为假手术组(sham)、模型组(MCAO)、红景天苷给药组(MCAO+Sal),每组15只。造模成功后,分别腹腔注射生理盐水或红景天苷(100 mg·kg-1),给药2 d。取缺血侧的脑组织,用于实验。第2批:大鼠随机分成溶剂假手术组(sham)、C3aR抑制剂假手术组(C3aR+sham)、模型组(MCAO)、C3aR抑制剂模型组(C3aR+MCAO)、给药组(MCAO+Sal)、C3aR抑制剂给药组(C3aR+MCAO+Sal),共6组,每组10只。侧脑室注射C3aR抑制剂或空白溶剂后30 min内,除假手术组外,其余均进行MCAO造模。造模后,连续腹腔注射生理盐水或红景天苷(100 mg·kg-1)2 d,取缺血侧脑组织用于实验。
2.2大鼠脑缺血/再灌注模型的制备♂健康的SD大鼠经适应性喂养至体质量达280 g左右,禁食后,用2%戊巴比妥钠(2 mL·kg-1)腹腔注射麻醉。仰卧固定于手术台上,沿颈部正中剪开皮肤,并且钝性分离皮下组织,找到颈总动脉、颈外动脉以及颈内动脉。结扎颈外动脉,并用动脉夹封住颈内动脉。用眼科剪在颈总动脉距血管分叉5 mm处的管壁上剪一个小口,插入线栓,使线栓由颈总动脉经过分叉进入颈内动脉约18~20 mm,结扎颈总动脉。栓塞2 h后,将线栓从颈内动脉抽出,实现再灌注。而假手术组不插入线栓,其余步骤与模型组相同。整个手术过程保持温度在37℃,以维持大鼠的体温[6]。
2.3侧脑室注射C3aR抑制剂大鼠麻醉后固定于脑立体定位仪上,剪开大鼠的头皮,用定位仪定位:前卤旁开2.0 mm,后下1.5 mm。用颅骨钻在此位置打孔后,用微量进样器经由此孔定位于脑膜下方3.5 mm。静置适应5 min后,以0.5 mL·min-1的速率注射C3aR抑制剂或溶剂,C3aR抑制剂注射量为1 mg·kg-1。侧脑室注射后30 min内进行MCAO造模[7]。
2.4神经功能评分Zea-longa评分标准如下:0分为正常,无脑损伤;1分为不能完全伸展侧前肢;2分为行走时向一侧转圈;3分向一侧转圈行走时摔倒;4分为不能行走,意识丧失。MCAO造模后2 h时进行神经功能评分,≥2分模型成功[8]。
2.5脑组织中C1、C3、Egr4和NeuN蛋白的表达水平检测提取缺血侧大脑总蛋白以及核蛋白,用SDS-PAGE电泳将蛋白分离后,将凝胶上的蛋白转移至PVDF膜上。 5% BSA封闭2 h后,用稀释后的一抗4℃孵育过夜。用TBST洗涤3次,每次10 min。加入稀释1 000倍的二抗稀释液室温孵育2 h,再用TBST洗涤3次,每次10 min。加ECL试剂,用凝胶成像系统显影,得到目标蛋白的灰度值,计算各组之间的差异。
2.6脑组织中Egr4、C1qa、NeuNmRNA表达水平的检测用RNeasy®MiNi Kit提取脑组织总RNA,再用逆转录试剂盒逆转录成cDNA,以cDNA为模板,通过荧光定量PCR检测Egr4、C1qa基因的表达量。反应条件为50℃ 2 min,95 ℃预变性15 s,退火60℃ 30 s,40个循环。以GAPDH为内参,计算2-△△Ct值。参照GenBank中大鼠的Egr4、C1qa的引物序列,Egr4的上游引物5′-AAGCTGGAGCAGGAAGAGGTTG-3′,下游引物5′-GCAGGGAGGAGGTTTTGGATAG-3′,PCR扩增片段长度为161 bp。C1qa的上游引物5′-AACGACTACAACGGCATGGTG-3′,下游引物5′-TGAGTGAGGATGGGGAAAGCA-3′,PCR扩增片段长度为141 bp。GAPDH的上游引物5′-CAACGGGAAACCCATCACCA-3′,下游引物5′-ACGCCAGTAGACTCCACGACAT -3′,PCR扩增片段长度为96 bp。
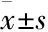
3 结果
3.1红景天苷对MCAO模型大鼠缺血侧C3、NeuN表达的影响MCAO造模1、2 d后,模型组C3均有明显上升,NeuN表达明显下降。红景天苷给药后,可使C3的表达明显下降,NeuN的表达上升,且差异具有显著性(P<0.05)。对C3以及NeuN的蛋白表达量进行检测,发现大鼠造模1、2 d后,与假手术组相比,模型组的C3表达明显上升,而NeuN的表达明显下降,经由红景天苷处理之后,可逆转C3以及NeuN的蛋白量表达,差异具有显著性(P<0.01),见Fig 1、2。
3.2红景天苷对MCAO模型大鼠缺血侧Egr4、C1qa表达的影响为了确定最佳的时间点,分析1 d以及2 d的Egr4和C1qa mRNA的表达量。结果表明,给予红景天苷1 d对Egr4和 C1qa的表达并没有明显的影响,但给药2 d能明显升高Egr4,降低C1qa的mRNA表达,且差异均具有显著性(P<0.01),见Fig 3。
3.32d侧脑室注射C3aR抑制剂和给予红景天苷对C3a、Egr4、NeuN表达的影响由“3.2”结果得出,红景天苷对经典途径的抑制作用在2 d后,因此,该实验选用2 d的MCAO大鼠模型,给予红景天苷以及C3aR抑制剂。结果表明,与MCAO组大鼠相比,经过2 d的红景天苷以及C3aR抑制剂的分别作用,明显降低了C3a的表达,并明显增加NeuN、Egr4的表达,且差异均具有显著性(P<0.01),见Fig 4。

Fig 1 Salidroside reduced C3 and increased NeuN in peri-infarcted area (×400) #P<0.05, ##P<0.01 vs sham; *P<0.05 vs MCAO

Fig 2 Salidroside inhibited protein expression of C3(A,C) and enhanced protein expression of NeuN(B, D)(n=3)
##P<0.01vssham;**P<0.01vsMCAO

Fig 3 Differential effects of salidroside on Egr4(A) andC1qa(B) mRNA after 1d and 2d ischemic/reperfusion injury (n=3)
##P<0.05vssham;**P<0.01vsMCAO
4 讨论
补体C3是补体系统的核心,也是经典途径、旁路途径以及凝集素途径的中枢分子,C3的活化是放大补体级联反应的关键步骤。而C1是激活经典途径的启动子[8],当C1被激活后,经过一系列变化生成C3转化酶,所形成的C3转化酶将补体C3裂解为C3a、C3b,从而产生炎症。Egrs为早期生长反应基因,包含Egr1、Egr2、Egr3、Egr4。该家族都具有1个高度保守的结构域,可与DNA中的启动子特异性结合,从而调控转录,在细胞的增殖、分化、凋亡中起到重要的作用[9-10]。Ludwig等[11]研究发现,K-Cl协调转运蛋白的近侧启动子区域携带Egr4结合位点,当神经营养因子激活MAPK/ERK通路,诱导Egr4表达时,会刺激K-Cl协调转运蛋白上调,从而影响未成熟神经元。Mengozzi等[9]的研究表明,通过上调Egr1、Egr2或Egr4的表达,可减轻炎症和神经细胞凋亡,治疗脑缺血大鼠。NeuN是成熟神经元的特异性标志物,仅神经元成熟后表达,且直接参与神经元的调节。随着神经元的成熟,NeuN的表达量逐渐增加,故其表达量可以反映神经元的成熟程度[12]。本实验结果提示,红景天苷对Egr4的升高作用是在成功抑制C3以后,并且红景天苷对经典途径的抑制是在2 d之后。也证明了红景天苷在MCAO急性期不是通过抑制经典途径和升高Egr的表达而发挥神经保护作用的。有研究表明[13],脑缺血/再灌注24 h后,可通过抑制凝集素途径起到神经保护的作用,该实验的结果恰好与之相吻合。因此,为探索红景天苷对经典途径的作用,分别连续2 d给予红景天苷或侧脑室注射C3aR抑制剂,使得C3a明显下降,进一步测得Egr4和NeuN均明显上升,表明了红景天苷和C3aR抑制剂的作用相一致。同时,该结果提示了Egrs的表达与红景天苷在亚急性期抑制经典途径的激活有关。

Fig 4 Salidroside inhibited protein expression ofC3a(A) and enhanced mRNA expression of Egr4 (B) andprotein expression of NeuN(C)
##P<0.01vssham;**P<0.01vsMCAO
综上所述,红景天苷对脑缺血/再灌注亚急性期的神经保护作用可能与抑制补体经典途径的激活,调控Egrs,从而减少细胞凋亡有关。
(致谢: 本实验在福建省中医药大学药理实验室完成,感谢各位老师和同学的帮助与支持。)
[1] Morrison H, Frye J, Davis-Gorman G, et al. The contribution of mannose binding lectin to reperfusion injury after ischemic stroke[J].CurrNeurovascRes, 2011,8(1): 52-63.
[2] Arumugam T V, Woodruff T M, Lathia J D, et al. Neuroprotection in stroke by complement inhibition and immunoglobulin therapy[J].Neuroscience, 2009,158(3): 1074-89.
[3] 谢 卉, 朱大会. 红景天苷对神经系统疾病药理作用的研究进展[J]. 中国中药杂志, 2012,37(17): 2505-9.
[3] Xie H, Zhu D H. Advance in studies on pharmacological effect of salidroside on nervous system diseases[J].ChinaJChinMaterMed, 2012,37(17): 2505-9.
[4] Qu Z Q, Zhou Y, Zeng Y S, et al. Protective effects of a Rhodiola crenulata extract and salidroside on hippocampal neurogenesis against streptozotocin-induced neural injury in the rat[J].PLoSOne, 2012,7(1): e29641.
[5] 赖文芳, 张小琴, 洪海棉, 等. 红景天苷对大鼠局灶性脑缺血/再灌注损伤的神经保护作用[J]. 中国药理学通报, 2015,31(6): 775-9.
[5] Lai W F, Zhang X Q, Hong H M, et al. Neuroprotective effects of salidroside against focal celebral ischemia/reperfusion injury in rats[J].ChinPharmacolBull,2015,31(6):775-9.
[6] Longa E Z, Weinstein P R, Carlson S, Cummins R. Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke, 1989,20(1): 84-91.
[7] Ducruet A F, Hassid B G, Mack W J, et al. C3a receptor modulation of granulocyte infiltration after murine focal cerebral ischemia is reperfusion dependent[J].JCerebBloodFlowMetab, 2008,28(5): 1048-58.
[8] Noris M, Remuzzi G. Overview of complement activation and regulation[J].SeminNephrol, 2013,33(6): 479-92.
[9] Mengozzi M, Cervellini I, Villa P, et al. Erythropoietin-induced changes in brain gene expression reveal induction of synaptic plasticity genes in experimental stroke[J].ProcNatlAcadSciUSA, 2012,109(24): 9617-22.
[10] Gomez-Martin D, Diaz-Zamudio M, Galindo-Campos M, Alcocer-Varela J. Early growth response transcription factors and the modulation of immune response: implications towards autoimmunity[J].AutoimmunRev, 2010,9(6): 454-8.
[11] Ludwig A, Uvarov P, Pellegrino C, et al. Neurturin evokes MAPK-dependent upregulation of Egr4 and KCC2 in developing neurons[J].NeuralPlast, 2011,2011:1-8.
[12] Mullen R J, Buck C R, Smith A M. NeuN, a neuronal specific nuclear protein in vertebrates[J].Development, 1992,116(1): 201-11.
[13] Ducruet A F, Sosunov S A, Zacharia B E, et al. The neuroprotective effect of genetic mannose-binding lectin deficiency is not sustained in the sub-acute phase of stroke[J].TranslStrokeRes, 2011,2(4): 588-99.
EffectsofsalidrosideonexpressionofNeuNandEgr4inischemicsideofMCAOratsbyinhibitingexpressionofC3
SONG Bai-ying, LAI Wen-fang, SU Yan-qing, LIN Yu, XU Wen, HONG Gui-zhu
(CollegeofPharmacy,FujianUniversityofTraditionalChineseMedicine,Fuzhou350122,China)
AimTo investigate the effects of salidroside on NeuN and Egrs in the ischemic side of middle cerebral artery occlusion (MCAO) rats by inhibiting complement C3.MethodsThe rats were subjected to MCAO with suture-occluded method, and the neurologic injury was evaluated. The rats underwent 1h ischemia/reperfusion with 1d and 2d salidroside treatment, and the expressions of NeuN, Egr4, C3 and C1 were tested. Male Sprague Dawley rats were separately injected ventricle C3aR inhibitor and artificial cerebrospinal fluid with the help of ventricle stereotaxic apparatus. Thirty min later, the models of MCAO were finished with 1h reperfusion, drug administration and intracerebroventricular injection for 2d. The expressions of NeuN, Egr4, C3 were detected.ResultsCom-pared with models of MCAO, the expression of C3 in MCAO rats treated with salidroside 1d and 2d decreased significantly, and the expression of NeuN increased markedly. Salidroside had no apparent effect on Egr4 and C1 of administration of 1d, but it could significantly enhance the expression of Egr4 after 2d, and reduce the expression of C1 significantly after 2d. The rats administrated with C3aR inhibitor into cerebral ventricle continueously showed the same result in accordance with the treatment of salidroside. And the treatment of salidroside and C3aR inhibitor did not show remarkable additive effects.ConclusionThe neuroprotective effect of salidroside on acute cerebral ischemia/reperfusion injury may be related to the inhibition of the activation of the classical pathway of complement, the regulation of Egrs and the reduction of apoptosis.
salidroside; cerebral ischemia-reperfusion; complement C3; C3aR inhibitor; Egrs; neuroprotection
A
1001-1978(2017)11-1579-06
R-332;R284.1;R322.81;R392.11;R743.310.22
时间:2017-10-10 10:05 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20171010.1005.040.html
10.3969/j.issn.1001-1978.2017.11.020
2017-07-20,
2017-08-17
国家自然科学基金资助项目(No 81603323,81473382)
宋百颖( 1990-),女,硕士,研究方向:心脑血管药理学,E-mail:422039332@qq.com; 洪桂祝( 1966-),女,博士,教授,研究方向:心脑血管药理学,通讯作者,E-mail: laiwenfang08@ 163.com
——题《圣山系-金巅》

