巢式-实时PCR检测梅毒初诊患者不同样本中梅毒螺旋体靶DNA
叶兴东 高方铭 曹文苓 林宏达 任泽舫
510095广州市皮肤病防治所(叶兴东、高方铭、曹文苓);中山大学公共卫生学院(林宏达、任泽舫)
巢式-实时PCR检测梅毒初诊患者不同样本中梅毒螺旋体靶DNA
叶兴东 高方铭 曹文苓 林宏达 任泽舫
510095广州市皮肤病防治所(叶兴东、高方铭、曹文苓);中山大学公共卫生学院(林宏达、任泽舫)
目的探讨巢式-实时PCR(NR-PCR)检测初诊梅毒患者不同样本中梅毒螺旋体(Tp)靶DNA的可行性及应用前景。方法以Tp polA为靶基因,用NR-PCR检测梅毒患者初诊时皮损拭子、血清、全血、脑脊液、末梢耳垂血等样本中的靶DNA,用统计软件SPSS.13分析结果。结果NRPCR检测Tp polA靶DNA的极限为2个Tp/ml,总体阳性率为71.7%,检测不同类样本的阳性率从高到低依次为:耳垂血92.0%>脑脊液90.2%>拭子74.3%>血清66.9%>全血64.2%。NR-PCR结果与血清学检查结果的一致性为76.0%(152/200)。进一步分析显示:一期、二期梅毒拭子DNA阳性率(63.2%比87.5%)差异无统计学意义(χ2=2.62,P>0.05);血清样本中,二期梅毒DNA阳性率高于一期梅毒(χ2=3.6,P=0.06);全血样本中,二期梅毒DNA阳性率高于其他各类型梅毒;神经梅毒耳垂末梢血阳性率与脑脊液比较,P=0.06。隐性梅毒血清(RPR)滴度≥1∶8组的Tp DNA阳性率高于RPR≤1∶4组。结论NR-PCR方法检测梅毒患者不同样本中Tp DNA是可行的,不同类型梅毒、不同类型样本以及其血清RPR滴度水平都影响Tp DNA阳性率。
梅毒;苍白密螺旋体;临床实验室技术;实时聚合酶链反应;巢式聚合酶链反应
梅毒是梅毒苍白螺旋体(Treponema palladium,Tp)感染引起的慢性系统性疾病。Tp还不能在体外培养[1],采用荧光抗体或暗视野显微镜直接镜检发现,Tp和(或)血液梅毒抗体检测是目前诊断梅毒的主要方法,常规PCR检测Tp DNA诊断梅毒主要适用于疑似梅毒患者的拭子样本,而检测血液样本的敏感性低[2],Tp早期感染及神经梅毒的诊断面临挑战,以Tp polA,tpp47为靶基因的巢式PCR是较理想的分子生物学检测手段[3]。结合巢式PCR和实时PCR的巢式-实时PCR(NR-PCR)检测梅毒患者体液中Tp DNA在临床的应用尚未见报道。我们于2012—2015年间收集临床诊断为各类型梅毒的体液(血浆、血清、耳垂血、脑脊液、拭子)样本进行了NR-PCR检测,取得较理想的效果,报道如下。
资料与方法
1.病例来源:2012年7月至2015年6月,取得患者知情同意后,收集在广州市皮肤病防治所、番禺区中心医院、广东省第二人民医院、番禺区慢性病防治站、广州市第一人民医院、广州市脑科医院等医院初诊且血清梅毒螺旋体明胶颗粒凝集试验(TPPA)和快速血浆反应素环状卡片试验(RPR)双阳性的患者血液/血清、皮损/组织液拭子、脑脊液。一期梅毒、二期梅毒、三期梅毒、隐性梅毒以及神经梅毒的诊断参照文献[4]。按照性病诊疗指南[4]梅毒诊疗方案治疗首诊后梅毒患者200例,男121例,女79例;年龄21~65岁,平均36岁。一期梅毒19例均有硬下疳;23例二期梅毒(11例表现为躯干丘疹、掌部铜红色脱屑性红斑,5例为外阴、肛周扁平湿疣,7例为脱发,色素减退斑、砺壳样痂屑);三期梅毒10例及隐性梅毒106例、神经梅毒42例。本研究通过广州市皮肤病防治所医学伦理委员会批准。
2.样本采集:①皮损拭子或组织液:治疗前用生理氯化钠溶液清洁皮损后,左手拇、食指捏紧皮损,右手用棉拭子擦拭或钝刀刮取溃疡或斑疹或扁平湿疣皮损,直至肉眼可见组织液,将拭子或钝刀置标记好的试管内来回搅拌数次,将洗脱的样本置-80℃保存备用;②血液和血清:治疗前取干燥试管采集梅毒患者静脉血3 ml,200 μl分装5份全血,其余2 ml离心收集血清,按200 μl分装于1 ml离心管,-80℃保存备用。在获得患者知情同意后同时采集患者耳垂血和脑脊液检查,耳垂血采集50~100 μl,加氯化钠生理溶液至200 μl保存;选择无禁忌证患者常规腰穿收集2 ml脑脊液-80℃保存备用。
3.试剂:TIANA mp Micro DNA试剂盒购自北京天根生化科技有限公司,兔睾丸培养后纯化的Tp阳性标准品(Nichol株)由中国医学科学院皮肤病研究所性病参比实验室尹跃平教授馈赠。所有引物及探针序列参照文献[5]由美国Invitrogen公司合成。常规PCR polA基因引物:引物对F1/R1,序列F1:5′-TGCGCGTGTGCGAATGGTGTGGTC-3′,R1:5′-CAC AGTGCTCAAAAACGCCTGCACG-3′,产物长度为377 bp。实时PCR引物及探针序列参照文献[6]合成 SyphTF:5′-AGGATCCGGCATATGTCCAA-3′,SyphTR:5′-GTGAGCGTCTCATCATTCCAAA-3′,MGB探针SyphTP的序列:ATGCACCAGCTT CGA。
4.检测方法:参照说明书,用TIANA mp Micro DNA试剂盒提取Tp基因组DNA,紫外分光光度计测定DNA浓度后-80℃冻存备用。外引物PCR反应体系包括:Plantium PCR Super MIX 20 μl,正反向引物各1 μl(终浓度为0.4 μmol/L),DNA模板为3 μl,总体积25 μl。参数设置:预变性94℃5 min,变性94 ℃ 30s,退火65℃ 30s,延伸72 ℃ 1min,循环30次,72℃延伸7 min。常规PCR外扩增产物1∶2稀释后取4 μl为模板DNA,预先加入384孔PCR板中,于干净的培养箱中65℃30 min烘干水分。各孔中加入下列反应组分:TaqMan®Master Mix 2.5 μl,引物终浓度为0.3 μmol/L,加无菌水补充体系至5 μl。反应参数:孵化50℃ 2 min,预变性95℃ 15 min,变性95℃15 s,退火延伸60℃1 min,循环40次。PCR扩增每个样本设置复孔,每板设阴性(无菌水)及阳性对照(标准品)。Ct值由美国ABI公司计算,阈值设置于扩增曲线对数增长期,样本扩增曲线清晰、平滑,Ct值<40判为阳性。
5.统计分析:Excel软件建立数据库,SPSS 13.0软件统计分析,用描述性统计指标(%)统计各类样本的Tp DNA阳性率,χ2检验统计不同临床样本Tp DNA阳性率,P<0.05为差异有统计学意义。
结 果
一、样本采集结果
200例梅毒患者采集到368份各类样本,其中91例患者只采集了1份样本(5例一期梅毒只有拭子,7例二期梅毒只有全血,7例三期梅毒只有血清,53例隐性梅毒只有血清,19例神经梅毒只有脑脊液),其余109例患者分别有多份样本合计277份。各类型梅毒样本分布见表1。
二、NR-PCR方法学的建立
用阳性标准品稀释后一式三份对NR-PCR检测Tp DNA的检测能力进行观察,显示检测Tp DNA最大极限为2个Tp/ml(图1),随着初始DNA模板量的减少,Ct值随之增大,两者之间呈线性趋势,以初始模板浓度取10为底的对数作横轴,检测Ct值作纵轴,构建标准曲线为y=-3.3209x+37.743(纵轴y为Ct值,横轴x为初始模板DNA浓度取10为底的对数),R2=0.991,表明两者之间相关性较强(图2)。
三、NR-PCR检测梅毒感染者初诊时各类样本中Tp DNA阳性率

表1 200例初诊梅毒患者各类生物样本分布情况[例(%)]

图1 阳性标准品各梯度巢式-实时PCR扩增曲线 从左至右,换算Tp浓度分别为:2 × 105个Tp/μl、2 × 104个Tp/μl、2 × 103个Tp/μl、200 个 Tp/μl、20 个 Tp/μl、2 个 Tp/μl、200 个 Tp/ml、20 个 Tp/ml、2 个Tp/ml
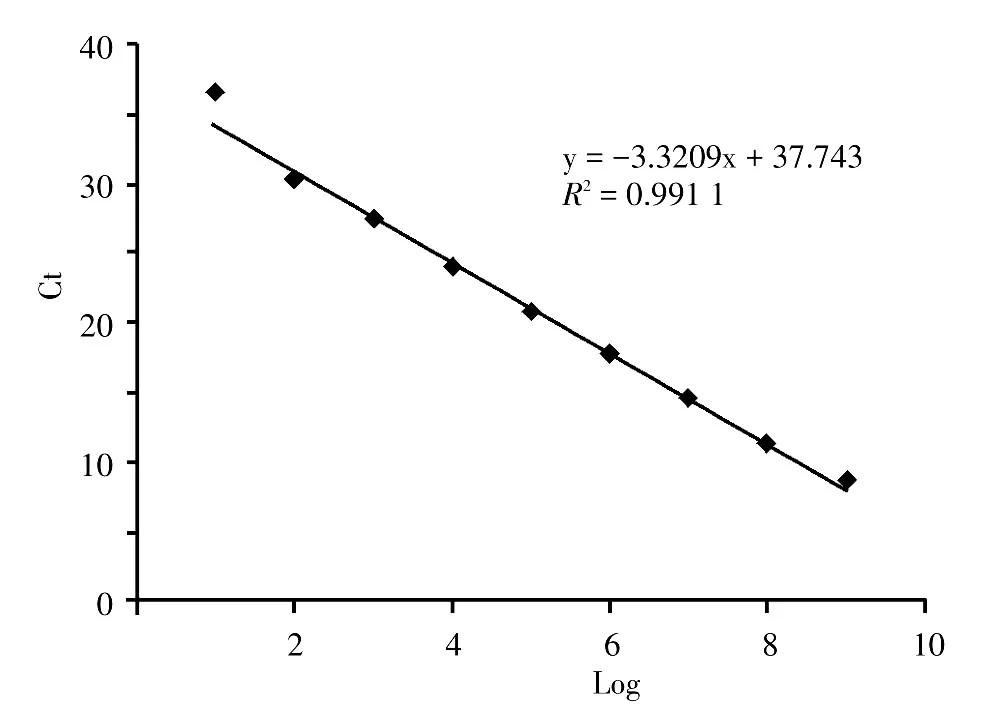
图2 阳性标准品巢式-实时PCR标准曲线
所检测的368份样本中,Tp DNA总阳性率为71.7%(264/368),NR-PCR结果与血清学检查结果的一致性为76.0%(152/200,1例患者有多种标本阳性,只计算1次阳性)。各类型样本阳性率从高到低依次为:耳垂血92.0%(23/25)、脑脊液90.2%(46/51)、拭子74.3%(26/35)、血清66.9%(99/148)、全血64.2%(70/109),各类样本阳性率间比较,差异有统计学意义(χ2=18.55,P< 0.01),但进一步分析显示:血清和全血比较,差异无统计学意义(χ2=0.20,P=0.66);耳垂血和脑脊液比较,差异无统计学意义(校正χ2=0.03,P=0.87)。
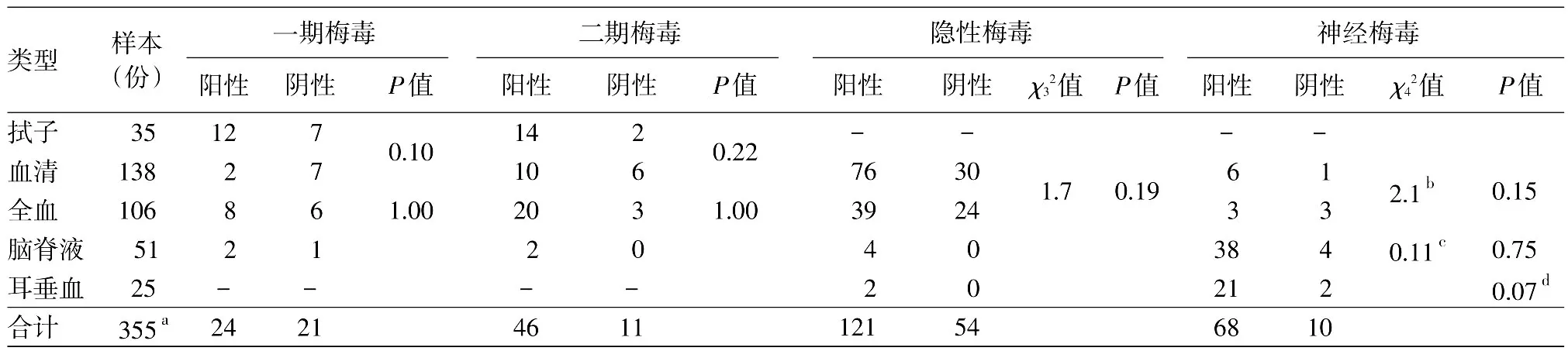
表2 不同类型梅毒的不同样本Tp DNA阳性率组间比较
四、各类型梅毒中不同类型样本间Tp DNA阳性率比较
一期梅毒中,拭子、血清、全血三者比较,Tp DNA阳性率差异无统计学意义(χ2=4.29,P=0.12);二期梅毒中,拭子、血清、全血三者比较,Tp DNA阳性率差异无统计学意义(χ2=4.32,P=0.12)。全血与血清阳性率比较(精确概率P=0.12);隐性梅毒中,四类型样本比较,差异无统计学意义(χ2=4.55,P=0.21);神经梅毒中,四类型样本阳性率比较,差异有统计学意义(χ2=8.20,P=0.04);将耳垂血、血清、全血样本合并,再与脑脊液比较,显示脑脊液阳性与血液阳性率之间差异无统计学意义(χ2=0.36,P=0.54),各类型梅毒不同类型样本组间阳性率比较结果见表2。
五、不同类型梅毒、不同RPR滴度水平血清Tp DNA阳性率比较
依据RPR滴度水平,以1∶8滴度为界分为两组,为排除血清和全血样本重复检测的影响,我们仅对148份血清Tp DNA阳性率进行单独分析,由于二期梅毒和三期梅毒两组RPR≤1∶4样本数为0,二期梅毒16例均RPR≥1∶8,阳性率62.5%;三期梅毒10例均RPR≥1∶8,阳性率50%。一期、神经梅毒未见不同滴度水平对Tp DNA阳性率有关,可能与样本量小有关。隐性梅毒血清Tp DNA阳性率与RPR滴度水平有关,滴度越高,阳性率越高。一期、隐性梅毒、神经梅毒不同血清RPR滴度水平的Tp DNA阳性率比较见表3。

表3 不同类型梅毒初诊患者血RPR滴度水平与Tp DNA阳性率比较
讨 论
本研究是国内首次报道的NR-PCR法用于检测梅毒临床患者各种生物样本中的Tp DNA,总体阳性率达到71.7%,表明该方法可行。需要注意的是,为避免DNA交叉污染,每次实验前用70%乙醇擦拭移液器,并置于紫外线消毒30 min。在DNA提取、试剂配置及模板加样都在生物安全柜进行操作。
本研究提示,NR-PCR检测Tp Nichol标准株DNA的极限为2个Tp/ml,高于既往报道的其他PCR法,如Marra等[7]用改良RT-PCR法检测脑脊液中的Tp DNA的极限可达1~10个Tp/ml。曾铁兵等[8]报道,常规及巢式PCR检测Tp DNA极限分别为400 个/ml及 10 个/ml,而 Grange等[9]以 Nichol标准株DNA为参照,报道了巢式PCR检测极限为20个Tp/ml。由于检测系统封闭且污染少,实时PCR也成功用于多种体液样本中的Tp DNA的检测[10],文献报道,其检测Tp的极限为10 × 103/ml[11]。NR-PCR检测极限较高的原因可能与其通过外引物扩增增加了Tp靶DNA模板量和高度敏感且特异的检测探针有关。
polA基因是目前PCR方法诊断Tp感染常用的引物候选基因[3]。Sutton等[12]首次以polA为靶基因,PCR法成功检测Tp DNA诊断Tp感染,阳性率介于27%~93%,全血样本检测的阳性率最低,皮损阳性最高。本研究显示,polA为靶基因NR-PCR法检测Tp DNA总阳性率71.7%,各类型样本阳性率介于64.2%~92.0%,且肘静脉全血Tp DNA阳性率最低,但皮损/组织液Tp DNA阳性率不及耳垂血和脑脊液的阳性率高,可能与本研究中不同单位技术人员样本采集方法技术差异和皮损因素影响有关,但总体高于Castro等[13]报道的polA为靶基因PCR检测结果(总阳性31.1%,血液样本各成分Tp DNA阳性率介于25%~56%之间)。类似的,也高于Flasarova等[14]用巢式PCR检测临床样本中Tp DNA阳性率(不同类型梅毒血液阳性率介于8.8~64.8%)。本研究还发现,血清RPR滴度水平与Tp DNA阳性率有关,一期、神经梅毒由于样本量少,差异无统计学意义,在隐性梅毒患者中,血清RPR滴度≥1∶8者Tp DNA阳性率显著高于RPR≤1∶4者,二期梅毒和三期梅毒中,RPR滴度 ≥1∶8者,Tp DNA均阳性,1∶8通常被认为是梅毒活动的指征[15-16]。
本研究初步显示,NR PCR在Tp DNA检测中有应用价值,但也存在一些不足:一是标准品中可能含有一定的兔体细胞DNA,Tp DNA阳性只具有诊断价值,并不说明传染性问题。且未在本研究中与定量PCR进行平行对照;二是研究中各类型梅毒及其不同样品数量不均衡,因此结果可能有所偏倚;三是限于篇幅,未就同一患者不同样本的检出一致率进行分析。作为一种新的PCR结合技术,仍需扩大样本量进行深入研究,以期临床能够应用。
[1]Zobanikova,M,Mikolka,P,Cejkova,D,et al.Complete genome sequence ofTreponema pallidumstrain DAL-1[J].Stand Genomic Sci,2012,7(1):12-21.DOI:10.4056/sigs.2615838.
[2]李军,郑和义.梅毒检测研究进展[J].中国医学科学院学报,2012,34(1):95-98.DOI:10.3881/j.issn.1000-503X.2012.01.018.
[3]叶兴东,林宏达,戴向农,等.聚合酶链反应检测梅毒螺旋体的应用进展[J].国际皮肤性病学杂志,2016,42(1):15-18.DOI:10.3760/cma.j.issn.1673-4173.2016.01.006.
[4]中国疾病预防控制中心性病艾滋病预防控制中心.梅毒、淋病、生殖器疱疹、生殖道沙眼衣原体感染诊疗指南(2014)[J].中华皮肤科杂志,2014,47(5):365-372.DOI:10.3760/cma.j.issn.0412-4010.2014.05.022.
[5]Liu,H,Rodes,B,Chen,CY,et al.New tests for syphilis:rational design of a PCR method for detection ofTreponema pallidumin clinical specimens using unique regions of the DNA polymerase I gene[J].J Clin Microbiol,2001,39(5):1941-1946.DOI:10.1128/JCM.39.5.1941-1946.2001.
[6]Leslie DE,Azzato F,Karapanagiotidis T,et al.Development of a real-time PCR assay to detectTreponema pallidumin clinical specimens and assessment of the assay′s performance by comparison with serological testing[J].J Clin Microbiol,2007,45(1):93-96.DOI:10.1128/JCM.01578-06.
[7]Marra CM,Maxwell CL,Smith SL,et al.Cerebrospinal fluid abnormalities in patients with syphilis:association with clinical and laboratory features[J].J Infect Dis,2004,189(3):369-376.DOI:10.1086/381227.
[8]曾铁兵,吴移谋,黄澍杰,等.巢式PCR扩增梅毒螺旋体polA及其临床应用的研究[J].中国皮肤性病学杂志,2004,18(2):15-17.DOI:1001-7089(2004)02-0074-03.
[9]Grange PA,Gressier L,Dion,PL,et al.Evaluation of a PCR test for detection of treponema pallidum in swabs and blood[J].J Clin Microbiol,2012,50(3):546-552.DOI:10.1128/JCM.00702-11.
[10]Chi KH,Danavall D,Taleo F,et al.Molecular Differentiation ofTreponema pallidumsubspecies in skin ulceration clinically suspected as yaws in vanuatu using real-time multiplex PCR and serological methods[J].Am J Trop Med Hyg,2015,92(1):134-138.DOI:10.4269/ajtmh.14-0459.
[11]Gayet-Ageron A,Ninet B,Toutous-Trellu L,et al.Assessment of a real-time PCR test to diagnose syphilis from diverse biological samples[J].Sex Transm Infect,2009,85(4):264-269.DOI:10.1136/sti.2008.034314.
[12]Sutton MY,Liu H,Steiner B,et al.Molecular subtyping ofTreponema pallidumin an Arizona County with increasing syphilis morbidity:use of specimens from ulcers and blood[J].J Infect Dis,2001,183(11):1601-1606.DOI:10.1086/320698.
[13]Castro R,Prieto E,Aguas MJ,et al.Detection ofTreponema pallidumsp pallidum DNA in latent syphilis[J].Int J STD AIDS,2007,18(12):842-845.DOI:10.1258/095646207782716901.
[14]Flasarova M,Pospisilova P,Mikalova L,et al.Sequencing-based molecular typing of treponema pallidum strains in the Czech Republic:all identified genotypes are related to the sequence of the SS14 strain[J].Acta Derm Venereol,2012,92(6):669-674.DOI:10.2340/00015555-1335.
[15]Gupte S,Daly C,Agarwal V,et al.Introduction of rapid tests for large-scale syphilis screening among female,male,and transgender sex workers in Mumbai,India[J].Sex Transm Dis,2011,38(6):499-502.DOI:10.1097/OLQ.0b013e318205e45d.
[16]De Santis M,De Luca C,Mappa I,et al.Syphilis infection during pregnancy:fetal risks and clinical management[J].Infect Dis Obstet Gynecol,2012,2012:430585.DOI:10.1155/2012/430585.
第三届全国银屑病学术会议征文通知
为了让皮肤科医师了解国内外关于银屑病研究的最新动向,分享知名专家的临床诊治经验,中国中西医结合学会皮肤性病专业委员会定于2018年9月21-23日在上海召开“第三届全国银屑病学术会议”。会议将邀请国内外知名专家报告他们在银屑病基础与临床的最新研究进展,演讲者报告形式多样、内容丰富。欢迎从事银屑病基础及临床研究的皮肤科医师和相关人员踊跃投稿和参会。
一、投稿要求:①投稿内容:银屑病基础研究论文、银屑病临床诊断和治疗等方面的论文、典型与疑难病例等;②投稿方式:中文全文和400字以内的中文摘要,请通过电子邮件投稿,Email:pfkxh@126.com。来稿请注明第三届全国银屑病学术会议征文,截稿日期:2018年8月1日;③会议交流形式:特邀演讲、大会发言、分会发言、书面交流。
二、联系方式:上海市黄浦区成都北路500号峻岭广场19楼1908室,上海长征医院《中国真菌学杂志》编辑部,邮编200003,Email:pfkxh@126.com,联系人:施慧,021-81885497,手机13764560811。
Application of nested real-time PCR in detecting Treponema palladium DNA in various clinical samples from patients preliminarily diagnosed as syphilis
Ye Xingdong,Gao Fangming,Cao Wenling,Lin Hongda,Ren Zefang
Guangzhou Institute of Dermatology,Guangzhou 510095,China(Ye XD,Gao FM,Cao WL);School of Public Health,Sun Yat-sen University,Guangzhou 510080,China(Lin HD,Ren ZF)
Ye Xingdong,Email:yxingdong@qq.com
ObjectiveTo investigate the feasibility and prospects of nested real-time PCR(NRPCR)technique forTreponema palladium(Tp)detection in various samples of different stages of syphilis from patients preliminarily diagnosed as syphilis.MethodsTargeting the Tp polA gene,NR-PCR was performed to detect Tp DNA in various samples from the patients with various stages of syphilis at the first clinic visit,including skin tissue fluid swabs,serum,whole blood,cerebrospinal fluid(CSF)and earlobe blood.Data were analyzed with SPSS software version 13.ResultsA total of 368 clinical samples were collected from 200 patients with syphilis.With a detection limit of 2 Tp/ml,NR-PCR showed that the total positiverateforTpDNAwas 71.7%(264/368).TheTpDNApositiveratewashighestinearlobebloodsamples(92.0%,23/25),followed by CSF samples(90.2%,46/51),skin tissue fluid swabs(74.3%,26/35),serum samples(66.9%,99/148)and whole blood samples(64.2%,70/109).There was good agreement between NR-PCR results and serologic test results,with a consistency rate of 76.0%(152/200).Furthermore,the Tp DNA positive rate did not differ between patients with primary(12/19)and secondary syphilis(14/16)in skin tissue fluid swabs(χ2=2.62,P> 0.05),and was slightly but insignificantly higher in patients with secondary syphilis than those with primary syphilis in the serum samples(χ2=3.6,P=0.06).The Tp DNA positive rate of whole blood samples was also higher in patients with secondary syphilis than those with any other types of syphilis.Among patients with neurosyphilis,no significant difference was observed in the Tp DNA positive rate between earlobe blood samples and CSF samples(P=0.06).Among patients with latent syphilis,the Tp DNA positive rate was significantly higher in serum samples with an RPR titer of≥ 1∶8 than those with an RPR titer of≤ 1∶4.ConclusionNR-PCR is feasible for detecting Tp DNA in various kinds of samples,and the Tp DNA positive rate is influenced by stages of syphilis and types of samples,as well as RPR titers.
Syphilis;Treponema pallidum;Clinical laboratory techniques;Real-time polymerase chain reaction;Nested polymerase chain reaction
叶兴东,Email:yxingdong@qq.com
10.3760/cma.j.issn.0412-4030.2017.05.008
广东省科技计划项目(2012B031800014);广州市科技攻关项目(201300000166);广州市医药卫生科技项目(2012A031001)
Fund programs:Science and Technology Planning Project of Guangdong Province of China(2012B031800014);Guangzhou Programs forScience and Technology DevelopmentofChina(201300000166);Guangzhou Medical and Health Science and Technology Plan Project(2012A031001)
2017-02-10)
(本文编辑:吴晓初)

