球形红细菌降解2,4-二硝基甲苯的途径及酶学性质
白红娟,王寿艳,梁芳楠,赵婷婷,康鹏洲
(中北大学环境与安全工程学院, 山西 太原 030051)
球形红细菌降解2,4-二硝基甲苯的途径及酶学性质
白红娟,王寿艳,梁芳楠,赵婷婷,康鹏洲
(中北大学环境与安全工程学院, 山西 太原 030051)
采用气相色谱-质谱联用仪(GC-MS)分析了球形红细菌降解2,4-二硝基甲苯(2,4-DNT)的中间代谢产物,分析了可能的降解途径,讨论了培养基中2,4-DNT的初始质量浓度、溶液pH值及反应温度对3种酶的酶比活力影响。结果表明,当2,4-DNT的初始质量浓度为40 mg/L时,培养72h后,可以检测到5种物质:2,4-二硝基甲苯、4-氨基-2硝基甲苯、2-氨基-4硝基甲苯、4-硝基-1,2-二(三甲基硅烷)苯、1,2,4-三(三甲基硅烷)苯,其可能的降解途径为2,4-DNT首先还原为4-氨基-2-硝基甲苯和2-氨基4-硝基甲苯,再进一步转化为4-硝基-1,2-羟基苯,然后氧化为1,2,4-三羟基苯,之后开环生成β-酮己二酸,最终降解为小分子物质。硝基还原酶、邻苯二酚2,3-双加氧酶和邻苯二酚1,2-双加氧酶的酶比活力最适宜温度分别为35、30、35℃,最适宜pH值分别为7.0、8.0、7.0,最适宜培养基初始2,4-DNT质量浓度均为40mg/L。
球形红细菌;2,4-二硝基甲苯;2,4-DNT;硝基还原酶;邻苯二酚1,2-双加氧酶;邻苯二酚2,3-双加氧酶
引 言
2,4-二硝基甲苯(2,4-DNT)是2,4,6-三硝基甲苯(TNT)生产过程中的主要副产物[1],不仅广泛应用于国防、医药、造漆、橡胶等过程中,同时,它也是甲苯二胺、农药、聚氨酯和染料等生产过程中的中间体[2-4]。因其具有较大的毒性,美国环保署已将其列为优先控制污染物名单[5]。
国内外对微生物降解2,4-DNT进行了深入研究,然而其代谢途径有所差异[6-11]。微生物在不同条件下降解2,4-DNT时,可能生成不同产物。 厌氧还原2,4-DNT时,通常生成2-氨基-4-硝基甲苯、4-氨基-2-硝基甲苯、2,4-二氨基甲苯等[4,6];好氧氧化2,4-DNT时,苯环上引入羟基、羰基,最后开环、矿化[7-8];也可能生成毒性较大的肼类化合物,且肼类化合物的生成与羟胺硝基甲苯相关[9-10]。同时,微生物转化2,4-DNT的过程中涉及酶促反应,如:硝基还原酶还原硝基,加氧酶在苯环引入羟基、羰基等。研究降解2,4-DNT的微生物主要是在严格的厌氧菌和好氧菌条件下。厌氧转化产物需要好氧菌后续处理,2,4-DNT在化学结构上的特点,导致其很难直接发生氧化反应;而兼性细菌首先缺氧还原2,4-DNT,然后再好氧氧化开环、矿化;有关兼性细菌较少报道。球形红细菌(Rhodobactersphaeroides)是兼性细菌,也是益生菌。它既能在厌氧条件下利用光照进行生长,也能在好氧条件下利用有机物生长[11]。前期研究表明[12],球形红细菌能在72h完全转化2,4-DNT,120h彻底矿化,但是对降解途径及酶学性质还需要进行深入研究。因此,本研究采用球形红细菌对2,4-DNT进行降解,并利用GC-MS方法对球形红细菌降解2,4-DNT的中间产物进行鉴定,同时研究了降解过程中关键酶的酶活力,为硝基苯类化合物的废水治理提供参考。
1 实 验
1.1 试剂和仪器
球形红细菌(Rhodobactersphaeroides)H菌株系紫色非硫菌群红细菌属光合细菌,由山西大学光合细菌研究室分离、鉴定并保存[13];2,4-二硝基甲苯(2,4-DNT,纯度99%),阿拉丁公司;牛血清白蛋白和邻苯二酚,生工生物工程(上海)股份有限公司;其余试剂均为分析纯;水为二次去离子水。
高效液相色谱仪(HPLC),美国Waters公司。色谱柱为C18反相柱(250mm×4.6mm×5μm),20 ℃下测量,流动相为甲醇/水(体积比70∶30),流速为0.9mL/min,探测波长254nm,进样体积20μL;HP5973型气相色谱-质谱联用仪(GC-MS),美国惠普公司;SCIENIZ-ⅡD型超声破碎仪,宁波新芝科学器材研究所。
1.2 实验方法
1.2.1 培养基的配制
基础培养基参照文献[13]进行配置。
液体驯化培养基:将2,4-DNT作为唯一有机碳源配制培养基,使其溶于甲醇溶液中,待甲醇挥发后直接加入除苹果酸以外的基础培养基。
1.2.2 质谱分析
球形红细菌在以2,4-DNT为唯一有机碳源的培养液中生长72 h后,经过8000r/min高速离心机离心10min后取上清液,经0.45μm的微孔滤膜过滤,用GC-MS进行分析。
1.2.3 粗酶液的制备[14]及蛋白含量测定
取培养好的菌液,用8000r/min高速离心机离心10min,收集菌体,用33μmol/L、pH 值为7.5的Tris-HCl缓冲液洗涤2次,悬浮于1mL的缓冲液中。将其在冰水浴下用超声波细胞粉碎仪破碎细胞,破碎20min(每间隔3s破碎1s)。然后在10000r/min的高速冷冻离心机中离心10min,弃沉淀,上清液即细胞粗酶液,于-20℃保存备用。
以牛血清白蛋白作为标准蛋白[15],采用考马斯亮蓝比色法测定粗酶液中的蛋白质含量。
1.2.4 酶比活力测定
硝基还原酶比活力测定参考文献[16],略作修改。反应体系中含有110μmol/L 2,4-DNT、1.5mmol/L NADH、50mmol/L Tris-HCl缓冲液(pH值为7),200μL粗酶液,终体积为1mL。反应从加入NADH后开始,在30℃下反应60min,之后在90 ℃下加热10min终止反应。将样品在1000g的离心力下离心3min,之后在254nm处通过高效液相色谱仪测定2,4-DNT的吸光度。
邻苯二酚-2,3-双加氧酶和邻苯二酚-1,2-双加氧酶比活力测定参照文献[17]。
酶活力(U)定义为反应条件下每分钟催化生成1mmol 产物(或转化1mmol底物)所需的酶量;酶比活力定义为每毫克可溶性蛋白质所含酶活力单位数(U/mg)。
1.2.5 相对酶比活力的计算
配制不同2,4-DNT质量浓度分别为0、20、40、60、80mg/L的液体驯化培养基,制得粗酶液,在30℃,pH值为7的条件下分别测定酶比活力。以40mg/L的2,4-DNT条件下的酶比活力为100%,计算相对酶比活力。
将40mg/L的2,4-DNT作为唯一有机碳源的培养基制得粗酶液,在30℃下设置5个反应体系,pH值分别调为5.0、6.0、7.0、8.0、9.0。在不同pH值条件下测定酶比活力。以pH值为7条件下的酶比活力为100%,计算相对酶比活力。
将40mg/L的2,4-DNT作为唯一有机碳源的培养基制得粗酶液,在pH值为7时,设置为5个反应体系,为25、30、35、40、45℃。在不同温度条件下分别测定酶比活力。以温度为35℃下的酶比活力为100%,计算相对酶比活力。
2 结果与分析
2.1 球形红细菌降解2,4-DNT的中间产物
为了测定球形红细菌降解2,4-DNT的中间产物,在降解反应完成后采用GC-MS进行检测分析,结果如图1所示。
从图1中可以看出,在未降解时,可检测到物质A,其出峰时间为10.58min,当被降解72h后,物质A的峰已经消失,同时出现了4个较大的峰,得到了中间产物B(出峰时间10.76min)、C(出峰时间11.87min)、D(出峰时间17.98min)和E(出峰时间18.50min)。表明被降解72 h后,物质A已经被完全降解,并得到了4种主要的中间产物。
通过与数据库谱图对比A及其中间代谢产物B、C、D和E的质谱图,其对应的相对分子质量、保留时间和质核比(m/z)如表1所示。在检测过程中出现的物质有2,4-二硝基甲苯(2,4-DNT)、2-氨基-4-硝基甲苯(2-A-4-NT)、4-氨基-2-硝基甲苯(4-A-2-NT),1,2,4-三(三甲基硅烷)苯和4-硝基-1,2-二(三甲基硅烷)苯。与Valli[18]所报道的一致。
由此可判断,球形红细菌降解2,4-DNT的主要途径是:先将硝基还原为氨基,生成中间产物4-A-2-NT和2-A-4-NT,随后将4-A-2-NT氧化为4-硝基-1,2-羟基苯,再进一步还原为1,2,4-三羟基苯。据推测[18-19]1,2,4-三羟基苯在双加氧酶的作用下完成开环,生成β-酮己二酸,进一步矿化为小分子物质CO2、H2O(见图2)。
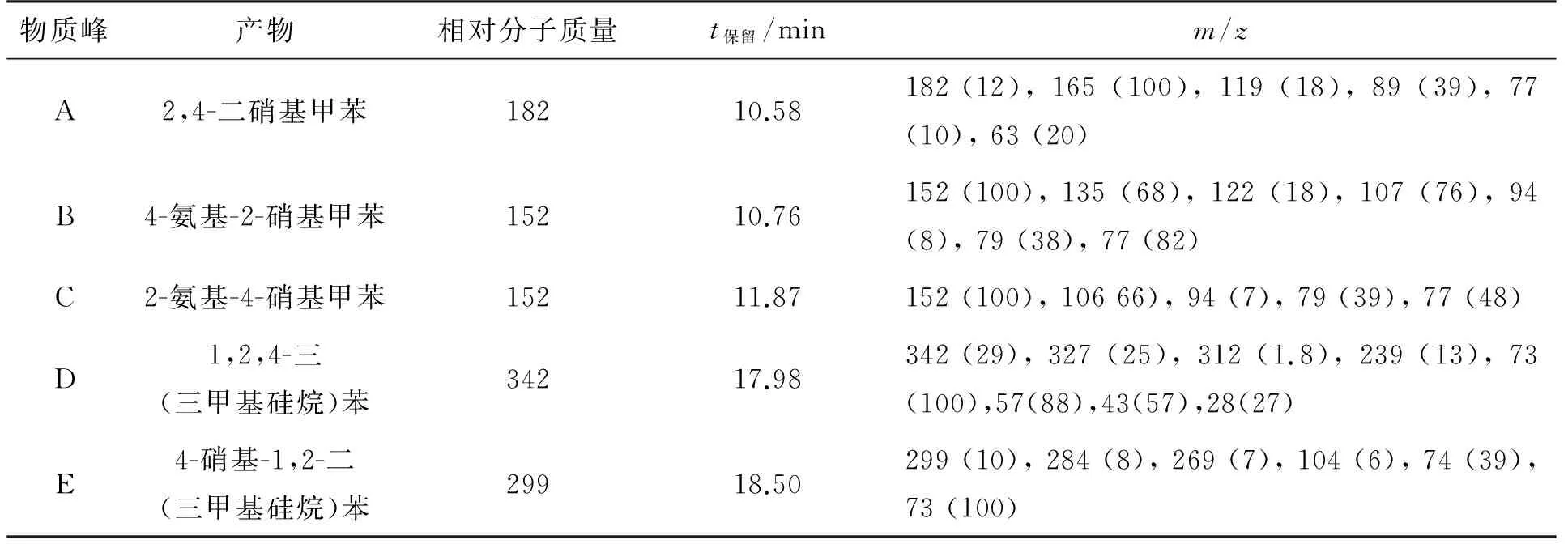
表1 球形红细菌降解2,4-DNT代谢过程中的代谢产物和衍生物
2.2 不同条件对3种酶的酶比活力的影响
2.2.1 2,4-DNT初始浓度的影响
培养基中不同2,4-DNT的初始浓度对酶比活力有重要的影响,结果见表2。
根据表1中的酶比活力值计算得到相对酶比活力,图3为不同初始浓度培养条件下2,4-DNT对硝基还原酶、邻苯二酚2,3-双加氧酶、邻苯二酚1,2-双加氧酶的相对酶活力大小的影响。
从图3可以看出,当2,4-DNT初始质量浓度达到40mg/L时,3种酶的相对酶比活力都达到最佳,之后随着2,4-DNT初始浓度的逐渐加大,3种酶的酶比活力逐渐降低。表明在一定范围内,球形红细菌中3种酶的相对酶比活力会随着2,4-DNT初始质量浓度的增大而升高,当2,4-DNT达到一定浓度后,则会对相对酶比活力起抑止作用;因此,当培养基中2,4-DNT质量浓度达到40mg/L时,3种关键酶的相对酶比活力达到最佳。这是由于当2,4-DNT的质量浓度较低时,酶的活性中心未达到饱和,酶的活力会随着2,4-DNT质量浓度的增加而增大。随着2,4-DNT质量浓度达到40mg/L时,酶的活性中心趋于饱和,酶的活性达到一个极限[20];2,4-DNT质量浓度过大时,降低了分子的扩散性,降低酶解反应速率,酶的活力降低。

表2 培养基中不同初始浓度2,4-DNT处理下细胞中酶比活力
2.2.2 pH值的影响
分别研究了pH值为5、6、7、8、9的不同缓冲体系对硝基还原酶、邻苯二酚1,2-双加氧酶、邻苯二酚2,3-双加氧酶的相对酶比活力影响。分别以110μmol/L的2,4-DNT或20μmol/L邻苯二酚为底物,30℃下,在pH值为5~9的Tris-HCl缓冲液中反应,测定3种酶的酶比活力,结果见表3。根据表3酶比活力值计算得到相对酶比活力,pH值对相对酶比活力的影响见图4。
图4表明,硝基还原酶的最适宜反应pH值为7;当pH为 8时,邻苯二酚2,3-双加氧酶的相对酶比活力达到最大,之后随着pH值的逐渐加大,邻苯二酚2,3-双加氧酶的相对酶比活力逐渐降低;当pH值为7时,邻苯二酚1,2-双加氧酶的相对酶比活力达到最大,之后随着pH值过高而导致邻苯二酚1,2-双加氧酶的相对酶比活力降低甚至失活。
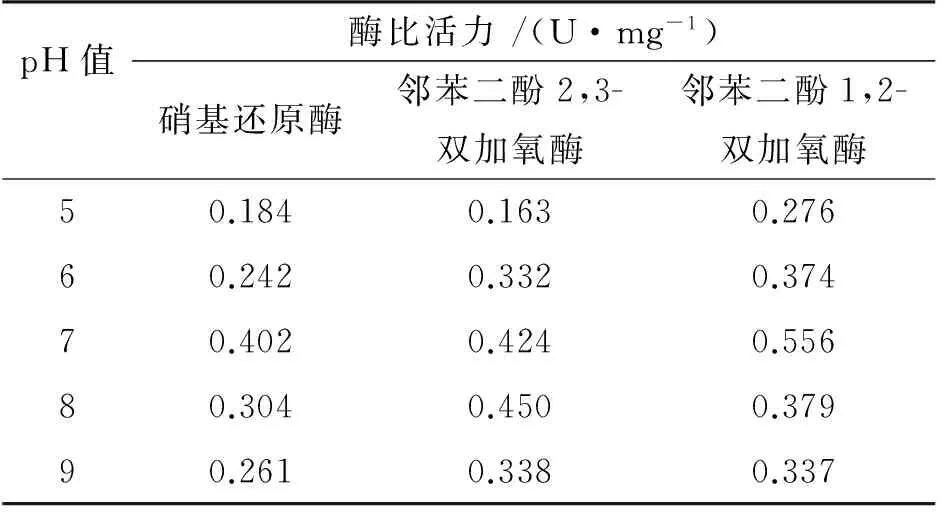
表3 不同pH值反应条件下细胞中的酶比活力
2.2.3 温度的影响
考察了温度为25、30、35、40、45℃对硝基还原酶、邻苯二酚2,3-双加氧酶和邻苯二酚1,2-双加氧酶的酶比活力的影响,结果见表4。根据表4的酶比活力值计算得到相对酶比活力随温度变化结果,见图5。
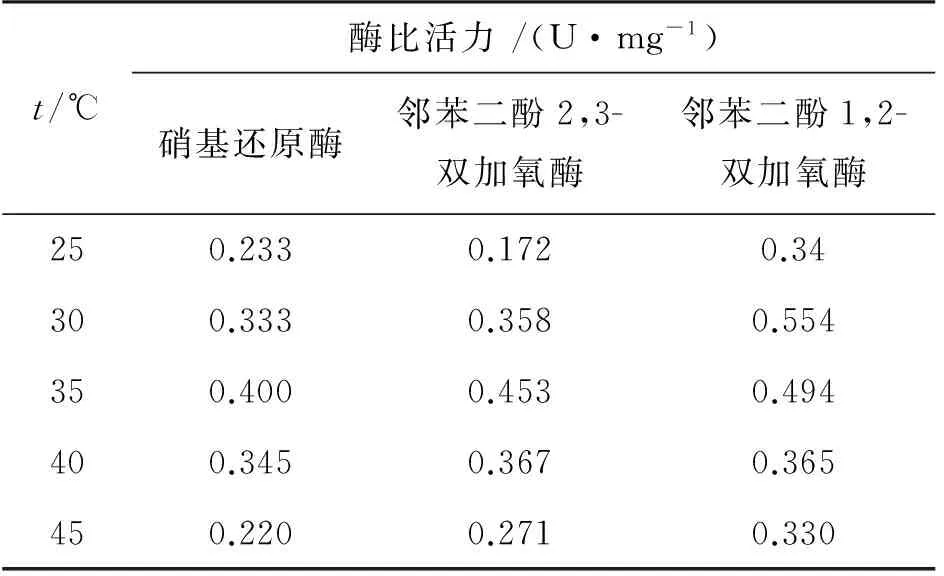
表4 不同温度反应条件下细胞中的酶比活力
由图5可知,在30~40℃时,硝基还原酶和邻苯二酚2,3-双加氧酶均具有较高的相对酶比活力,35℃时,其相对酶比活力均达到最大,之后随着温度的逐渐升高,相对酶比活力均逐渐降低。在25~30℃时,随着温度的升高,邻苯二酚1,2-双加氧酶的酶比活力增加,30℃时,其相对酶比活力达到最佳,而随着温度的继续升高,其相对酶比活力降低。
3 结 论
(1)在球形红细菌降解2,4-DNT的过程中,出现了4种中间产物,分别为2-氨基-4-硝基甲苯、4-氨基-2硝基甲苯、4-硝基-1,2-二羟基苯和1,2,4-三羟基苯。推测其可能的降解途径为:2,4-二硝基甲苯首先还原为4-氨基-2-硝基甲苯和2-氨基-4-硝基甲苯,继而氧化为4-硝基-1,2-二羟基苯,而后转化为1,2,4-三羟基苯,然后开环生成β-酮己二酸,最终降解为小分子物质。
(2)硝基还原酶、邻苯二酚2,3-双加氧酶和邻苯二酚1,2-双加氧酶是球形红细菌降解2,4-DNT过程中的关键酶。在2,4-DNT质量浓度为40mg/L的培养液中,培养72h时,硝基还原酶、邻苯二酚2,3-双加氧酶和邻苯二酚1,2-双加氧酶酶比活性达到最大。硝基还原酶、邻苯二酚2,3-双加氧酶和邻苯二酚1,2-双加氧酶的最适宜反应温度分别为35、30、35℃,最适pH值分别为7.0、8.0、7.0。
[1] Christopher H J, Boardman G D, Freedman D L. Aerobic biological treatment of 2,4-dinitrotoluene in munitions plant wastewater[J]. Water Research, 2000, 34(5): 595-1603.
[2] Gong P, Kuperman R G, Sunahara G I. Genotoxicity of 2,4-and 2,6-dinitrotuluene as measured by the Tradescantia micronucleus(Trad-MCN) Bioassay[J]. Mutation Research/Genetic Toxicology and Environmental Mutagenesis, 2003, 538(1): 13-18.
[3] 王倩. 高效降解菌的筛选与固定化方法处理DNT废水的研究[D].南京:南京理工大学,2010.
[4] Huang J, Ning G, Li F, et al. Biotransformation of 2,4-dinitrotoluene by obligate marine shewanella marisflavi EP1 under anaerobic conditions[J]. Bioresource Technology, 2015, 180:200-206.
[5] Spanggord R J, Spain J C, Nishino S F, et al. Biodegradation of 2,4-dinitrotoluene by a pseudomonas sp.[J]. Applied & Environmental Microbiology, 1991, 57(11):3200-3205.
[6] 黄杰勋, 陈星, 李非里, 等. 厌氧条件下Shewanella oneidensis MR-1 对2,4-二硝基甲苯的还原转化[J]. 微生物学通报, 2013, 40(9): 1734-1741.
HANG Jie-xun, CHEN Xing, LI Fei-li, et al. Reductive biotransformation of 2,4-dinitrotoluene by Shewanella oneidensis MR-1 under anaerobic conditions[J]. Microbiology China, 2013, 40(9): 1734-1741.
[7] Nishino S F, Paoli G C, Spain J C. Aerobic degradation of dinitrotoluenes and pathway for bacterial degradation of 2,6-dinitrotoluene [J]. Appilied and Environmental Microbiology, 2000, 66(5): 2139-2147.
[8] Smets B F, Mueller R J. Metabolism of 2,4-dinitrotoluene (2,4-DNT) by Alcaligenes sp. JS867 under oxygen limited conditions [J]. Biodegradation, 2001, 12(4):209-217.
[9] Shin K H, Lim Y, Ahn J H, et al. Anaerobic biotransformation of dinitrotoluene isomers by Lactococcus lactis subsp. lactis strain 27 isolated from earthworm intestine [J]. Chemosphere, 2005, 61: 30-39.
[10] Yang H, Halasz A, Zhao J S, et al. Experimental evidence for in situ natural attenuation of 2,4- and 2,6-dinitrotoluene in marine sediment [J]. Chemosphere, 2008,70: 791-799.
[11] 龙思思, 谢数涛, 段舜山, 等. 光合细菌及其应用现状[J]. 生态科学,2002,21(1):91-94.
LONG Si-si, XIE Shu-tao, DUAN Shun-shan, et al. Photosynthetic bacteria and their applied actualities[J]. Ecological Science, 2002, 21(1):91-94.
[12] LIANG Fang-nan, BAI Hong-juan, CHAI Chun-jing, et al. Anaerobic biodegradation of 2,4-dinitrotoluene by Rhodobacter sphaeroides[J]. Microbiology China, 2016, 42(2):279-284.
[13] 姚竹云, 张肇铭.几株光合细菌的表型特征及 DNA-DNA 同源性分析[J]. 应用与环境生物学报, 1996, 2(1): 84-89.
YAO Zhu-yun, ZANG Zhao-ming. Phenotypic features and DNA-DNA homologyanalyses of some photosynthetic bacteria[J].Chinese Journal of Applied and Environmental Biology, 1996,2(1): 84-89.
[14] 白红娟,张肇铭,杨官娥, 等. 球形红细菌转化去除重金属镉及其机理研究[J]. 环境科学学报,2006,26(11):1809-1814.
BAI Hong-juan, ZHANG Zhao-ming, YANG Guan-e, et al. Study on transformation and removal of the heavy metal cadmium by Rhodobacter sphaeroides[J]. Acta Scientiae Circumstantiae, 2006, 26(11):1809-1814.
[15] 陈钧辉, 陶力, 李俊, 等. 生物化学实验[M ] . 第6版. 北京: 科学出版社, 2006:63-64
[16] Oh B T, Sarath G, Shea P J. TNT nitroreductase from a Pseudomonas aeruginosa strain isolated from TNT-contaminated soil [J]. Soil Biology and Biochemistry, 2001,33: 875-881.
[17] 谢青,董迎松,易薇,等. 一株苯胺降解菌的分离及其苯胺降解特性的研究[J].生物技术, 2009,19(1):55-58.
XIE Qing, DONG Ying-song, YI Wei, et al. Isolation and characterization of an aniline-degrading bacterium [J]. Biotechnology, 2009,19(1):55-58.
[18] Valli K, Brock B J, Joshi D K, et al. Degradation of 2,4-dinitrotoluene by the lignin-degrading fungus Phanerochaete chrysosporium[J]. Applied and Environmental Microbiology, 1992, 58(1):221-228.
[19] Buswell J A, Eriksson K E. Aromatic ring cleavage by the white-rot fungus sporotrichum pulverulentum [J]. Febs Letters, 1979, 104(2): 258-260.
[20] 王静, 夏芳芳, 王闻伟, 等. 土壤甲烷单加氧酶活性测定的研究 [J]. 土壤通报, 2011,42(3):589-592.
WANG Jing, XIA Fang-fang, WANG Wen-wei, et al. Study on the determination of soil mathane monooxygenase activity [J]. Chinese Journal of Soil Science, 2011,42(3):589-592.
DegradationPathwayandPropertiesofEnzymeof2,4-DinitrotoluenebyRhodobacterSphaeroides
BAI Hong-juan, WANG Shou-yan, LIANG Fang-nan, ZHAO Ting-ting, KANG Peng-zhou
(School of Environment and Safe Engineering, North University of China, Taiyuan 030051, China)
The intermediates of 2,4-dinitrotoluene (2,4-DNT) metabolized byrhodobactersphaeroideswere analyzed by the gas chromatograph-mass spectrometer (GC-MS), the possible degradation pathway was analyzed, and the effect of initial mass concentration of 2,4-DNT in culture medium, pH value of solution and reaction temperature on the enzyme specific activity of three kinds of enzymes was discussed. The results show that five intermediates including 2,4-dinitrotoluene, 4-amino-2-nitrotoluene, 2-amino-4-nitrotoluene, 4-nitro-1,2-di(TMS)benzene and 1,2,4-tri(TMS)benzene were detected when initial mass concentration of 2,4-DNT is 40mg/L after cultivating for 72h. The possible degradation pathway is that 2,4-DNT is first reduced to 4-amino-2-nitrotoluene and 2-amino-4-nitrotoluene and further transformed into 4-nitro-1,2-hydroquinone, then is oxidized to 1,2,4-trihydroxybenzene, finally 1,2,4-trihydroxybenzene ring is cleaved to form β-ketoadipic acid, which was finally degraded to smaller molecular compounds. For enzyme specific actiyity of nitroreductase, catechol 2,3-dioxygenase and catechol 1,2-dioxygenase , the optimal temperature is 35, 30 and 35℃, respectively, the optimal pH value is 7.0, 8.0 and 7.0, respectively and the optimal initial mass concentration of 2,4-DNT in culture medium is 40mg/L.
Rhodobactersphaeroides; 2,4-dinitrotoluene; 2,4-DNT; nitroreductase; catechol 1,2-dioxygenase; catechol 2,3-dioxygenase
TJ55;TQ464.8
1007-7812(2017)05-0082-06
10.14077/j.issn.1007-7812.2017.05.016
2017-03-27;
2017-07-23
山西省回国留学人员科研资助项目(No. 2016-084)
白红娟(1969-),女,博士,教授,从事环境微生物技术研究。E-mail: bhj44871@163.com

