肝脏影像报告及数据系统(LI-RADS)的更新
——2017版解读
邹显伦, 沈亚琪, 胡道予
·本刊特稿·
肝脏影像报告及数据系统(LI-RADS)的更新
——2017版解读
邹显伦, 沈亚琪, 胡道予
肝脏影像报告及数据系统(LI-RADS)由美国放射学院(ACR)发布,是一个旨在规范肝脏影像图像采集、征象解释、报告及数据收集的综合系统。自2011年第一版LI-RADS发布以来,ACR分别在2013及2014年对LI-RADS进行了更新。随着新的证据出现以及实践反馈,为更好地满足临床、教育和研究需求,ACR在2017年进行了更新。本文特对CT/MRI LI-RADS v2017的更新内容进行介绍和解读。
肝脏影像报告及数据系统(LI-RADS); 更新; 解读
肝细胞肝癌(hepatocellular carcinoma,HCC)是世界第五大常见肿瘤,在肿瘤性致死原因中排列世界第二[1]。与大多数其他恶性肿瘤不同,HCC的诊断可在不活检的情况下,通过非侵入性方法建立,进而指导治疗[1]。动态增强CT或MRI检查是美国肝病研究组织(AASLD)推荐无创诊断HCC的方法[1]。然而,不同的影像医师之间以及不同医疗中心之间,对动态增强CT或MRI图像的解释和报告可能不同,从而造成放射科医师之间、放射科医师与临床医师之间沟通困难。为了规范肝脏影像图像采集、影像解释、报告及数据收集,美国放射学院(ACR)制定和发布了肝脏影像报告及数据系统(The Liver Imaging Reporting And Data System,LI-RADS)。
LI-RADS具有以下特点:①是一个规范肝脏影像图像采集、解释、报告及数据收集的综合系统;②是一个随着知识积累及实践反馈而不断扩充和完善的动态文件;③旨在改善沟通、患者护理、教育和研究;④由美国放射学院支持、认可;⑤由包括影像诊断与介入放射学医师、肝胆外科医师、肝脏病医师和肝病理学医师等多学科组成的国际联合组织制定(参与人员来源既有学术机构,也有社区医师及受训医师人员)。2014版(LI-RADSLI-RADS v2014)发布以来,许多国内外学者对LI-RADS v2014进行了临床检验研究[2-7],针对实践反馈及新证据的出现,为更好地满足临床、教育和研究需求,ACR在2017年发布了2017版CT/MRI LI-RADS,对2014版中的一些内容进行了修改[8]。
本文特从LI-RADS适用人群、治疗前诊断、扫描技术、治疗后反应评估等方面对CT/MRI LI-RADS v2017进行介绍和解读。
CT/MRI LI-RADS v2017适用人群的修改
在LI-RADS v2014中,LI-RADS的适用人群为HCC高危患者,即任何原因引起的肝硬化及慢性乙型病毒性肝炎患者。CT/MRI LI-RADS v2017对LI-RADS适用人群进行了修改及补充,适用人群包括:①肝硬化患者;②慢性乙型病毒性肝炎患者;③目前或曾诊断为HCC的患者。对于适合肝移植的成人及肝移植后的患者,CT/MRI LI-RADS v2017同样适用。CT/MRI LI-RADS v2017不适用于以下人群:①无HCC高危因素;②年龄<18岁;③因先天性肝纤维化引起的肝硬化,由于血管疾病引起的肝硬化,如遗传性出血性毛细血管扩张症、Budd-Chiari综合征、慢性门静脉闭塞、心脏充血或弥漫性结节性增生等。可以看出,CT/MRI LI-RADS v2017的适用人群已非任何原因引起的肝硬化患者。由于血管疾病引起的肝硬化常与良性再生结节形成相关,在影像上有时与HCC表现类似,从而造成假阳性的诊断,因此,CT/MRI LI-RADS v2017不适用于这类肝硬化患者。
CT/MRI LI-RADS v2017诊断部分的修改
1.诊断思路图的修改
与LI-RADS v2014(图1)相比,CT/MRI LI-RADS v2017(图2)的诊断思路图将判断条件及LI-RADS类别按诊断顺序纵向排列,使用者只需按判断条件逐步判断直至找到符合类别为止。新版的诊断思路图结构清晰,思路明确,更符合诊断医生的思维模式,方便诊断医生使用。因CT/MRI LI-RADS v2017新增了治疗反应评估分级,故诊断思路图只适用于HCC高危人群中未经治疗且未经病理证实的患者,LI-RADS v2014中的LR-Treated(经治疗后发现)类别在治疗反应评估中进一步描述和分类。在CT/MRI LI-RADS v2017中,辅助特征的使用是可选的,而破局规则只在不确定LI-RADS分类时才使用,因此CT/MRI LI-RADS v2017诊断思路图删除了LI-RADS v2014中“应用辅助特征,再使用破局规则对分级进行调整”这句话。此外,CT/MRI LI-RADS v2017在诊断思路图的下面加上了“如果不确定是否有某个主要征象,则认为无该主要征象”这句话。
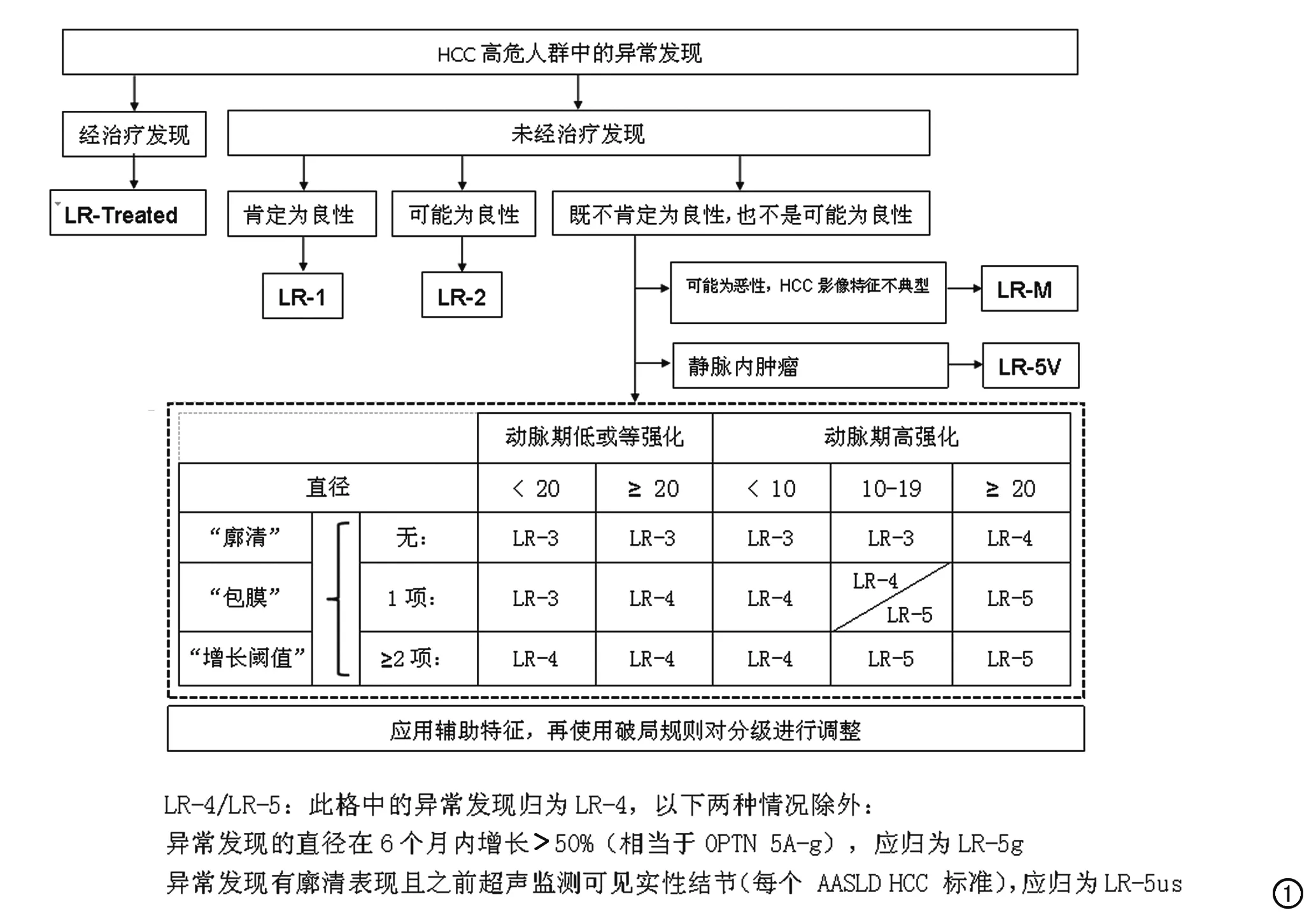
图1 LI-RADS v2014诊断思路图
2.LI-RADS类别的增加与修改
新增LR-NC,修改LR-5V为LR-TIV。与LI-RADS v2014相比,CT/MRI LI-RADS v2017新增LR-NC(无法分类的发现)类别,即因图像质量不佳或不完整而不能分类的发现。另外,原LR-5V类别即静脉内肿瘤(tumor in vein,TIV)更改为LR-TIV。虽然导致静脉内肿瘤的最常见原因是HCC,但HCC以外的其他肿瘤,如肝内胆管细胞癌、混合性肝细胞胆管细胞癌等,也可侵犯静脉,所以,将TIV的发现由LR-5V更改为LR-TIV更符合实际情况。如果发现TIV,还应报告导致TIV的可能原因,参照标准如下:若与LR-5相邻,则报告TIV肯定由HCC导致;若与LR-4相邻,则报告TIV可能由HCC导致;若与浸润性肿块相关,则报告TIV可能由HCC导致;若与靶环状肿块相邻,则报告TIV可能由HCC以外的恶性肿瘤导致;若以上均不是,则报告TIV原因不明。
3.术语的修改
涉及动脉期高强化(非环状)、廓清(非周边)、强化包膜、阈值增长等术语。
LI-RADS v2014中对病灶进行分类的依据是动脉期强化特点(高强化、低/等强化)和主要征象(廓清、包膜、阈值增长)的数目。文献报道不同观察者对动脉期高强化和廓清的诊断一致性为中等至良好,对包膜的诊断一致性为一般至中等[9,10]。
CT/MRI LI-RADS v2017对动脉期强化作了两点更改:一是在动脉期高强化(arterial phase hyperenhancement,APHE)的基础上括号说明了非环形高强化 (not rim),二是不再使用动脉期低/等强化这一词,而改为无动脉期高强化(No APHE)。对LI-RADS v2014中的主要征象,即廓清(washout)、包膜(capsule)和阈值增长(threshold growth),CT/MRI LI-RADS v2017均做了修改,主要征象中的廓清,CT/MRI LI-RADS v2017括号说明了非周边廓清[“Washout” (not peripheral)];对包膜,强调是“强化包膜”(enhancing “capsule,”非强化包膜见辅助征象);对阈值增长的定义CT/MRI LI-RADS v2017进行了部分修改,直径增长不<5 mm,且符合以下3个条件之一者,即符合阈值增长:①6个月内直径增长≥50%;②6个月以上直径增长≥100%;③两年时间内(LI-RADS v2014中未限制此时间),前次CT或MRI检查未发现,此次直径≥10 mm。

图2 CT/MRI LI-RADS v2017诊断思路图
动脉期环形高强化和周边廓清是胆管细胞癌、混合性肝细胞胆管细胞癌等恶性肿瘤的特异性征象,因此,CT/MRI LI-RADS v2017将动脉期高强化区分为环形高强化(LR-M特征)与非环形高强化(HCC特征),将廓清区分为周边廓清(LR-M特征)与非周边廓清(HCC特征),可能将会提高LI-RADS诊断分类的一致性,降低LR-M被错误分类的可能性。
4.LR-M标准的修改
CT/MRI LI-RADS v2017明确说明了对LR-M的诊断标准,靶样肿块;或非靶样肿块但具有下列中的一项或多项者(不符合LR-5标准,且非静脉内肿瘤者),即诊断为LR-M:①浸润表现;②明显扩散受限;③坏死或严重缺血;④由影像医生判断支持非HCC恶性病变的其他征象。靶样肿块在影像上形状似靶环状,内部成分呈同心圆排列(靶征),这可能反映周边密集的细胞和中央的纤维基质及缺血[11,12]。在动态增强图像上,靶征可表现为环状动脉期高强化、周边廓清以及延迟中央强化。在过渡期或肝胆期,靶征表现为周边中等至明显低信号,而中央区域呈轻度低信号;在DWI上,靶征表现为周边扩散受限,而中央区域扩散受限程度减轻。靶征是胆管细胞癌、混合性肝细胞胆管细胞癌及其他非HCC恶性肿瘤的特征,但也可见于不典型肝癌[13,14],因此,靶征提示HCC以外的恶性肿瘤,但不能完全除外HCC。
5.辅助征象的修改
CT/MRI LI-RADS v2017对辅助征象进行了部分修改。在支持恶性病变(不特指HCC)的辅助征象中,增加了超声可见性(ultrasound visibility)这一特征;在支持HCC的辅助征象中,将“明显的环(distinctive rim)”修改为“非强化包膜”(nonenhancing capsule)。在支持良性病变的辅助征象中,去除了LI-RADS v2014中“明显均匀的T2或T2*低信号”这一特征。辅助征象的使用是可选的,影像医师可选择是否应用辅助征象来调整LI-RADS分级。此外,如果不确定是否有某个辅助征象,则认为无该辅助征象;当支持良性和恶性的特征同时存在时,则不调整LI-RADS分级。需特别注意的是,LI-RADS v2014中,包膜是HCC的主要征象,而在CT/MRI LI-RADS v2017中,强化包膜是HCC的主要征象,而非强化包膜是支持HCC的辅助征象,在应用LI-RADS时需注意区别。强化包膜的特点是光滑、均匀、边界锐利,比背景结节周边的纤维化组织更厚、更明显,在门脉期、延迟期或过渡期表现为环状强化影,包绕“病变”的大部分或全部区域;而非强化包膜虽可见包膜表现,但无环形强化。
CT/MRI LI-RADS v2017扫描技术的修改
LI-RADS v2014新加入了肝脏特异性对比增强MRI检查及相关征象的定义和推荐扫描技术。CT/MRI LI-RADS v2017对肝脏特异性对比增强MRI检查进行了进一步详细说明,并指出了必须采集的图像及推荐采集的图像。
1.细胞外对比剂或钆贝葡胺(莫迪司)
必须采集的图像:增强前T1加权同/反相位图像;T2加权图像;多期T1加权增强图像[注射对比剂前图像及动脉期(强烈首选动脉晚期)、门脉期及延迟期图像]。
推荐或可选采集的图像:扩散加权图像;减影图像;多平面采集图像;使用钆贝葡胺时,1~3h的肝胆期图像。
2.钆塞酸二钠(普美显)
必须采集的图像:增强前T1加权同/反相位图像;T2加权图像;多期T1加权增强图像[注射对比剂前图像及动脉期(强烈首选动脉晚期)、门脉期、过渡期(注射对比剂后2~5 min内)及肝胆期图像]。
推荐或可选采集的图像:扩散加权图像;减影图像;多平面采集图像。
多项研究表明,钆塞酸二钠对比增强MRI检查因其独特的肝胆期图像,可以提高HCC的检出率及LI-RADS分级的准确性[15-17]。在CT/MRI LI-RADS v2017中,肝胆期被列为钆塞酸二钠对比增强MRI检查时必须采集的期相。
CT/MRI LI-RADS v2017新增治疗反应评估内容
HCC经局部治疗(如射频消融、经皮无水乙醇消融、冷冻消融、微波消融、动脉栓塞或化疗栓塞等)后的疗效评估对患者的后续管理具有重要意义。CT或MR增强广泛应用于疗效的评估,并显示了其价值[18-20]。LI-RADS v2014中将肝脏局部治疗后的发现归为LR-Treated,但并未对治疗后的发现进行具体描述及进一步分类。CT/MRI LI-RADS v2017新增了基于增强CT或MR检查的肝脏病变局部治疗后的反应评估思路图,对LR-Treated进行了细分,并对相关征象进行了如下说明。
无法评估治疗反应(LR-TR Nonevaluable):指治疗后的改变,因图像不全或质量差而不能评估治疗反应。
治疗后无肿瘤存活(LR-TR Nonviable):指经治疗后,可能或肯定无肿瘤存活,其判断标准为无病灶强化或治疗-特异性增强模式。
治疗反应不确定(LR-TR Equivocal):指经治疗后,不确定肿瘤是否存活,其判断标准为预期治疗相关-特异性增强模式不典型,并且不满足有肿瘤可能或肯定存活的标准。
治疗后肿瘤存活(LR-TR Viable):指经治疗后,可能或肯定肿瘤存活,其判断标准为在治疗后的病灶内或周边出现结节状、肿块样、厚的不规则组织,具有动脉期高强化、廓清表现、强化表现与治疗前类似等3种征象中的任意一个即可诊断。
治疗后的发现必须在结果和影像中报告,对LR-TR Nonevaluable应提供造成影像图像技术限制或伪影的原因及后续建议。对LR-TR Nonviable、LR-TR Equivocal及LR-TR Viable,报告中应提供治疗前的LI-RADS类别、病灶直径大小以及当前治疗反应类别,如LR-TR Nonviable(治疗前,LR-5,22 mm)。此外,对于LR-TR Equivocal及LR-TR Viable,报告中还应包括存活肿瘤的直径大小(或直径范围),判断存活的标准与较前次检查的变化情况,如LR-TR Viable 20 mm (治疗前,LR-5,32 mm)。
对治疗后发现的管理,CT/MRI LI-RADS v2017建议如下:对LR-TR Nonevaluable、LR-TR Nonviable及LR-TR Equivocal, 推荐3个月内用与前次检查相同的检查方式继续监测,也可选择3个月内用替代检查方式继续监测;而对于LR-TR Viable,需要多学科讨论形成管理共识,通常包括再次治疗。
肝脏病变局部治疗后的反应评估为2017版新增内容,其实用性、准确性、观察者间的一致性等有待临床实践的进一步检验。
目前,CT/MRI LI-RADS v2017的核心内容已在官网发布,而使用手册尚未发布,有关列表视图、示意图、时间强度曲线等更新内容将在手册中详细介绍。LI-RADS是一个随着知识积累及实践反馈而不断扩充和完善的动态系统,其不断更新并被越来越多的影像医生和临床医生所接受和使用。CT/MRI LI-RADS v2017需要大量的临床实践反馈以不断完善,进而更好地满足临床、教育和研究需求。
[1] Heimbach J,Kulik LM,Finn R,et al.Aasld guidelines for the treatment of hepatocellular carcinoma[J].Hepatology,2017 Jan 28.Doi:10.1002/hep.29086.[Epub ahead of print]
[2] Tanabe M,Kanki A,Wolfson T,et al.Imaging outcomes of liver imaging reporting and data system version 2014 category 2,3 and 4 observations detected at CT and MR imaging[J].Radiology,2016,281(1):129-139.
[3] Choi SH,Byun JH,Kim SY,et al.Liver imaging reporting and data system v2014 with gadoxetate disodium-enhanced magnetic resonance imaging[J].Invest Radiol,2016,51(8):483-490.
[4] Cha DI,Jang KM,Kim SH,et al.Liver imaging reporting and data system on CT and gadoxetic acid-enhanced MRI with diffusion-weighted imaging[J].Eur Radiol,2017.Doi:10.1007/s00330-017-4804-1. [Epub ahead of print]
[5] Joo I,Lee JM,Lee SM,et al.Diagnostic accuracy of liver imaging reporting and data system (LI-RADS) v2014 for intrahepatic mass-forming cholangiocarcinomas in patients with chronic liver disease on gadoxetic acid-enhanced MRI[J].J Magn Reson Imaging,2016,44(5):1330-1338.
[6] 王可,郭小超,王鹤,等.CT和MRI对乙肝肝硬化背景下肝细胞癌诊断评分的一致性:基于LI-RADS的多中心、个体内对照研究[J].放射学实践,2016,31(4):291-295.
[7] 赵伟,李文政,易小平,等.LI-RADS分级标准对原发性肝癌诊断价值的初步探讨[J].临床放射学杂志,2016,35(3):384-388.
[8] American College of Radiology.CT/MR liver imaging reporting and data system version 2017[EB/OL].http://www.acr.org/Quality-Safety/Resources/LIRADS,2017-08-05
[9] Zhang YD,Zhu FP,Xu X,et al.Classifying CT/MR findings in patients with suspicion of hepatocellular carcinoma:comparison of liver imaging reporting and data system and criteria-free likert scale reporting models[J].J Magn Reson Imaging,2016,43(2):373-383.
[10] Barth BK,Donati OF,Fischer MA,et al.Reliability,validity,and reader acceptance of LI-RADS-an in-depth analysis[J].Acad Radiol,2016,23(9):1145-1153.
[11] Park HJ,Kim YK,Park MJ,et al.Small intrahepatic mass-forming cholangiocarcinoma:target sign on diffusion-weighted imaging for differentiation from hepatocellular carcinoma[J].Abdom Imaging,2013,38(4):793-801.
[12] Kang Y,Lee JM,Kim SH,et al.Intrahepatic mass-forming cholangiocarcinoma:enhancement patterns on gadoxetic acid-enhanced MR images[J].Radiology,2012,264(3):751-760.
[13] Park MJ,Kim YK,Park HJ,et al.Scirrhous hepatocellular carcinoma on gadoxetic acid-enhanced magnetic resonance imaging and diffusion-weighted imaging:emphasis on the differentiation of intrahepatic cholangiocarcinoma[J].J Comput Assist Tomogr,2013,37(6):872-881.
[14] Choi SH,Lee SS,Kim SY,et al.Intrahepatic cholangiocarcinoma in patients with cirrhosis:differentiation from hepatocellular carcinoma by using gadoxetic acid-enhanced MR imaging and dynamic CT[J].Radiology,2017,282(3):771-781.
[15] Hope TA,Aslam R,Weinstein S,et al.Change in liver imaging reporting and data system characterization of focal liver lesions using gadoxetate disodium magnetic resonance imaging compared with contrast-enhanced computed tomography[J].J Comput Assist Tomogr,2017,41(3):376-381.
[16] Kim BR,Lee JM,Lee DH,et al.Diagnostic performance of gadoxetic acid-enhanced liver MR imaging versus multidetector CT in the detection of dysplastic nodules and early hepatocellular carcinoma[J].Radiology,2017:162080.Doi:10.1148/radiol.2017162080. [Epub ahead of print].
[17] An C,Rhee H,Han K,et al.Added value of smooth hypointense rim in the hepatobiliary phase of gadoxetic acid-enhanced MRI in identifying tumour capsule and diagnosing hepatocellular carcinoma[J].Eur Radiol,2017,27(6):2610-2618.
[18] Gordic S,Corcuera-Solano I,Stueck A,et al.Evaluation of HCC response to locoregional therapy:validation of MRI-based response criteria versus explant pathology[J].J Hepatol,2017.pii:S0168-8278(17)32208-0.Doi:10.1016/j.jhep.2017.07.030.[Epub ahead of print].
[19] Corona-Villalobos CP,Halappa VG,Geschwind JH,et al.Volumetric assessment of tumour response using functional MR imaging in patients with hepatocellular carcinoma treated with a combination of doxorubicin-eluting beads and sorafenib[J].Eur Radiol,2015,25(2):380-390.
[20] Ippolito D,Fior D,Bonaffini PA,et al.Quantitative evaluation of CT-perfusion map as indicator of tumor response to transarterial chemoembolization and radiofrequency ablation in HCC patients[J].Eur J Radiol,2014,83(9):1665-1671.
R574; R05; R445.2
A
1000-0313(2017)10-0998-05
2017-08-20)
430030 武汉,华中科技大学同济医学院附属同济医院放射科
邹显伦(1991-),男,江西赣州人,硕士研究生,主要从事腹部影像学研究工作。
沈亚琪,E-mail:yqshen@hust.edu.cn
10.13609/j.cnki.1000-0313.2017.10.001

